Лазерная проточная цитометрия в лабораторном иммунологическом мониторинге эндопротезирования коленного и тазобедренного суставов
Автор: Волокитина Елена Александровна, Чепелева Марина Владимировна
Журнал: Гений ортопедии @geniy-ortopedii
Рубрика: Оригинальные статьи
Статья в выпуске: 3, 2011 года.
Бесплатный доступ
Представлен впервые разработанный алгоритм обследования больных с остеоартрозом III стадии методом лазерной проточной цитометрии (типирование лимфоцитов периферической крови) на различных этапах эндопротезирования коленного или тазобедренного суставов (до имплантации, через 5-7, 18-21 сутки, 4-7, 10-14, 22-24 месяца после опе- рации). Исследование показателей клеточного иммунитета (CD3+, CD3+CD4+, CD3+CD8+, CD3-CD19+, CD3-CD16+CD56+, CD3+CD16+CD56+, CD3+CD25+, CD3+HLA-DR) в эти сроки позволяет прогнозировать течение послеоперационного периода, а также выявлять больных из группы риска по развитию вялотекущего гнойно-воспалительного процесса в зоне имплан- тации нестабильного искусственного сустава.
Иммунофенотипирование, остеоартроз, эндопротезирование
Короткий адрес: https://sciup.org/142121447
IDR: 142121447 | УДК: 617.581/583-089.819.843-77-073
Текст научной статьи Лазерная проточная цитометрия в лабораторном иммунологическом мониторинге эндопротезирования коленного и тазобедренного суставов
Несмотря на значительные успехи современной ортопедии, повреждения и заболевания крупных суставов до настоящего времени остаются одной из наиболее значимых проблем медицины и общества. Методом выбора при лечении поздних стадий коксартроза и го-нартроза является эндопротезирование, относящееся к числу высокоэффективных лечебно-реабилитационных технологий. Имплантацией искусственных суставов занимаются сотни клиник и исследовательских центров. В России потребность в эндопротезировании только тазобедренного сустава по предварительным расчетам составляет до 300 000 хирургических вмешательств в год. В то же время, операции по имплантации искусственного сустава по-прежнему относятся к высокой категории сложности и требуют длительной реабилитации. При остеоартрозе крупных суставов существует определенный порочный круг. С одной стороны, стойкий иммунологический дисбаланс способствует дальнейшему развитию дегенеративно-дистрофических изменений в тканях пораженного сустава и поддержанию вторичного синовита, с другой — прогрессирование патологии и нарастание в связи с этим компенсаторных реакций истощают метаболический фон и адаптационные механизмы [4]. Операционная травма способна провоци- ровать патологические иммунные реакции в организме, усугубляя уже имеющиеся нарушения, что, в свою очередь, способствует развитию послеоперационных осложнений, поэтому при подготовке больного к операции необходимо учитывать состояние системы иммунитета [1, 3]. При современном оснащении лабораторий большинства крупных больниц, в которых выполняется эндопротезирование, иммунологическое обследование пациентов вполне осуществимо, а прогностическая значимость полностью оправдывает все расходы и трудозатраты на его проведение [2, 5, 6]. Исследование показателей клеточного иммунитета на различных этапах реабилитационного периода после эндопротезирования крупных суставов позволяет прогнозировать как благоприятное течение послеоперационного периода, так и развитие послеоперационных осложнений [7, 8].
Стрессовое ремоделирование («stress shielding») — реакция костной ткани на имплантат, проявляющаяся усилением интенсивности процессов резорбции и костеобразования, рассматривается как процесс адаптации к новым условиям. Это изменение интенсивности ремоделирования с одной стороны имеет своей целью увеличение массы кости для создания тесного контакта с имплантатом, с другой — становится причиной развития нестабильности и ограничивает «срок жизни» эндопротеза. Некоторые авторы указывают на связь асептической нестабильности эндопротеза с наличием персистирующей микрофлоры в зоне имплантации. В частности, методом полимеразной цепной реакции доказано, что % протезов, удаленных при ревизии, инфицированы, тогда как традиционными методами выявляют менее 10 % инфицированных имплантатов. Определение среди больных с нестабильными эндопротезами группы риска в плане развития вялотекущего гнойно — воспалительного процесса в зоне имплантации искус- ственного сустава позволяет изменить тактику хирургического лечения: вместо одноэтапного ревизионного эндопротезирования выполнять двухэтапное ревизионное эндопротезирование с санацией зоны имплантации и установкой цементного спейсера с антибиотиком.
Цель исследования — разработка алгоритма иммунологического обследования пациентов с гонартрозом и коксартрозом до и после имплантации искусственного сустава, позволяющая сократить сроки реабилитации тяжелой группы больных путем снижения возможных ошибок в выборе тактики хирургического лечения.
МАТЕРИАЛЫ И МЕТОДЫ
Основу исследования составил анализ показателей иммунного статуса 109 больных остеоартрозом коленного и тазобедренного суставов III стадии в возрасте от 40 до 73 лет. Длительность заболевания варьировала от 5 до 35 лет. Для имплантации цементных протезов использовался костный цемент марки «Pоlacos-R».
Распределение больных по видам имплантированных цементных и бесцементных эндопротезов представлено в таблице 1.
Состояние клеточного иммунитета изучали посредством типирования лимфоцитов периферической крови методом лазерной проточной цитометрии на цитометре «BECKMAN COULTER EPICS XL» (США). Для идентификации лимфоцитов и определения их субпопуляционного состава применялся набор моноклональных антител (МКАТ) компании «Immunotech» (Франция). Т-лимфоциты (CD3+),
Т-хелперы (CD3+CD4+), цитотоксические Т-лимфоциты (CD3 + CD8 + ), В-лимфоциты (CD3 - CD19 + ), естественные киллеры (CD3 - CD16 + CD56 + ), естественные киллеры / Т-лимфоциты (CD3+CD16+CD56+), CD3+CD25+, несущие маркеры ранней активации Т-лимфоцитов, CD3+HLA-DR, несущие маркеры поздней активации Т-лимфоцитов, идентифицировали с помощью МКАТ, меченых фикоэритрином (РЕ) и флуоресцинизотиоци-анатом (FITC). Забор крови для исследования производится в количестве 6 мл из локтевой вены, натощак.
Полученные данные обрабатывались с помощью методов непараметрической статистики с использованием U-критерия Вилкоксона с применением программного обеспечения AtteStat 1.0, выполненного как надстройка к «Microsoft Exсel» программного продукта «Microsoft Office». Результаты исследования были представлены в виде медиан и интерквартильных размахов.
РЕЗУЛЬТАТЫ ИССЛЕДОВАНИЯ
Первичное обследование больного проводилось до хирургического вмешательства. Полученные данные на последующих этапах исследования использовались в качестве контрольных.
Через 5-7 суток после имплантации выявлялись изменения, обусловленные массивным повреждением суставных и околосуставных тканей, внедрением инородных тел (имплантат, костный цемент). Для благоприятного течения послеоперационного периода было характерно умеренное снижение абсолютного количества лимфоцитов, повышение относительного и абсолютного числа В-лимфоцитов (CD3 - CD19 + ), уменьшение относительного количества естественных киллеров (CD3-CD56+CD16+) и естественных киллеров / Т-лимфоцитов (CD3+CD56+CD16+) (не более чем на 30 %).
При отсутствии осложнений инфекционного характера исследуемые показатели через 18-21 сутки после эндопротезирования возвращались к исходным значениям, что позволило использовать их в качестве диагностического теста для оценки течения послеоперационного периода.
Этап перехода оперированной конечности на полную нагрузку (4-7 месяцев после имплантации) характеризовался умеренным снижением относительного содержания Т-хелперов (CD3+CD4+) (не более чем на 15 %). Остальные показатели клеточного иммунитета в эти сроки не отличались от дооперационных значений.
Влияние имплантата на показатели клеточного иммунитета через 10-14 месяцев после имплантации (период начала активного функционирования эндопротеза) проявлялся снижением количества лимфоцитов (не более чем на 15 %), абсолютного числа Т-лимфоцитов (CD3 + ) (не более чем на 20%), относительного и абсолютного содержания Т-хелперов (CD3+CD4+) (не более чем на 15 %). Данные изменения были характерны для неосложненного течения послеоперационного периода.
Таблица 1
Распределение больных по виду имплантированных протезов
|
Виды бесцементных эндопротезов |
Кол-во больных |
Виды эндопротезов с цементной фиксацией |
Кол-во больных |
|
SLPS ЗАО «Altimed» (Белоруссия) |
64 |
«Smith & Nephew» (США) (тазобедренные) |
10 |
|
«Keramed» (Германия) |
2 |
«Genesis-1» (США) (коленные) |
29 |
|
«Ceraver» (Франция) |
3 |
«De Peu» (США) |
1 |
До операции (лимфоциты, моноциты, гранулоциты, CD3 , CD3*CD4 , СОЗ CDS*, СОЗ CD19 , CD3CD16+CD56+, CD3+CD16+CD56+,CD3+CD25+, CD3+HLA-DR).
5-7суток после имплантации
НЕОСЛОЖНЕННОЕ ТЕЧЕНИЕ ПОСЛ ЕОП ЕРА ПИОЧНОГО П ЕРИОДА
1 лимфоциты '
ТСОЗ СО19+ не более чем на 30 %
1CD3CD16CD56 от дооперационных 1CD3+CD16*CD56J значений
РИСК РАЗВИТИЯ
ИНФЕКЦИОННЫХ ОСЛОЖНЕНИЙ
1 лимфоциты (< 0,8х 10 /л)
Т СОЗ СО19+ (> 16 %; 0,Зх 10%)
1 CD3 CD16+CD56+ (< 6 %)
I CD3+CD16*CD56+ (< 3,3 %; 0.04х 10%)
18-21 суток после имплантации показатели возвращаются к дооперационным значениям
। лимфоциты (<0,8хЮ%)
Т СD3 CD 19+ (> 16 %; 0,3х 10%)
4-7 месяцев после имплантации
я д
1 СОЗ*СО4* (не более чем на 15% от TCD3CD19* (>16 %; 0,Зх|0%)
дооперационных значений)
Я
10-14 месяцев после имплантации
Т лимфоциты (нс более чем на 15 %)
Т СОЗ* (не более чем на 20 %)
Т CD3+CD4+ (не более чем на 15 % от дооперационных значений)
РИСК РАЗВИТИЯ ГНОЙНО-ВОСПАЛИТЕЛЬНОГО ПРОЦЕССА В ЗОНЕ НЕСТАБИЛЬНОГО ИМПЛАНТАТА
4 о гранулоциты (>4,0x10 /л)
Т CD3CD19+(>16 %; 0,3 х 10%)
TCD3*HLA-DR (>8 %; 1,0x10%)
TCD3+CD25+(>26 %; 1,3x10%)
22-24 .месяца после имплантации
д
-
1 лимфоциты (нс более чем на 40 %)
-
1 CD3* (не более чем на 40 %)
-
1 CD3+CD4+ (не более чем на 17 %)
-
* CD3 CD16+CD56 (не более чем на 25 %)
Т CD3*CD 16 CD56* (не более чем на 13 % от дооперационных значений)
Д
Т гранулоциты (>4,0х 10%) TCD3CD19* (>16 %; О,3х 10%) TCD3 HLA-DR (>8 %; 1,0хЮ%) TCD3+CD25+(>26%; 1,3x10%)
Рис. 1. Алгоритм иммунологического обследования пациентов с остеоартрозом после эндопротезирования крупных суставов
Снижение абсолютного количества лимфоцитов (не более чем на 40 %), относительного содержания Т-лимфоцитов (CD3+) (не более чем на 15 %), абсолютного содержания Т-лимфоцитов (CD3+) (не более чем на 40 %), относительного и абсолютного содержания Т-хелперов (CD3+CD4+) (не более чем на 17 %), повышение относительного количества естественных киллеров (CD3-CD56+CD16+) (не более чем на 40 %) и естественных киллеров / Т-лимфоцитов (CD3+CD56+CD16+) (не более чем на 50 %) было характерно для благоприятного течения послеопера ционного периода. Относительное и абсолютное количество исходно повышенных клеток, экспрессирующих маркеры ранней активации Т-лимфоцитов (CD25+), в эти сроки снижалось, достигая нормальных значений. Значения показателей, превышающие 4,0×109/л для гранулоцитов, 16 % (0,35 × 109/л) для В-лимфоцитов (CD3-CD19+), 8 % (1,0 х 109/л) для CD3+HLA-DR, 26 % (0,4 х 109/л) для CD3+CD25+ свидетельствуют о вероятном развитии вялотекущего воспалительного процесса в области нестабильного имплантата (рис. 1).
ЗАКЛЮЧЕНИЕ
Данный алгоритм используется в стационаре ФГУ «РНЦ «ВТО» им. акад. Г. А. Илизарова» Минздравсоцразвития РФ во время подготовки к первичному и ревизионному эндопротезированию тазобедренных и коленных суставов и в послеоперационном периоде. Эффективность новой технологии подтверждена наблюдением на протяжении двух лет за группой из 109 больных в возрасте от 28 лет до 71 года, проле -ченных методом эндопротезирования. У 93 пациентов (85,3 %) получены хорошие функциональные результаты, признаков нестабильности эндопротеза на протяжении 2 лет наблюдения не выявлено, ближайший и отдаленный послеоперационные периоды протекали без осложнений, что было подтверждено результатами иммунологического обследования. Динамика иммунологических показателей в этой группе представлена в таблицах 2–4.
У 16 больных (14,7 %) в течение первого года после имплантации искусственного сустава были выявлены признаки нестабильности эндопротеза (тотальной или одного из компонентов). В этой группе с признаками нестабильности эндопротеза у 10 пациентов (0,09 %) с помощью иммунологических тестов был выявлен клинически не проявляющийся, вялотекущий воспалительный процесс в зоне имплантации (рис. 2), что позволило внести существенные изменения в тактику лечения: пациентам было выполнено двухэтапное реви- зионное эндопротезирование. На первом этапе удалялся нестабильный эндопротез и устанавливался цементный спейсер с антибиотиком. После регресса воспалительного процесса в зоне имплантации, подтвержденного результатами иммунологического тестирования (спустя 2-4 месяца после первого вмешательства), выполнялся второй этап лечения (удаление спейсера и реимплантация эндопротеза). Все результаты двухэтапной реимплантации хорошие. Повторного воспалительного процесса, а также признаков нестабильности реимплан-тированного протеза не выявлено, что позволяет рекомендовать данную медицинскую технологию для применения в лечебных учреждениях.
Таблица 2
Абсолютное содержание лимфоцитов, моноцитов и нейтрофилов после эндопротезирования крупных суставов при неосложненном течении послеоперационного периода (медианы значений показателей и интерквартильные размахи)
|
Лимфоциты (109/л) |
Моноциты (109/л) |
Гранулоциты (109/л) |
|
До операции |
||
|
1,56 (1,25÷2,02) |
↓ 0,16+ (0,1÷0,27) |
3,08 (2,55÷4,01) |
|
5-7 суток после эндопротезирования |
||
|
Д,29 * (0,9:1,4) |
0,2 (0,13÷0,25) |
Т 4,4 * (3,8:4,93) |
|
18-21 сутки после эндопротезирования |
||
|
1,64 (1,35÷1,95) |
0,16 (0,11÷0,24) |
3,3 (2,25÷4,28) |
|
4-7 месяцев после эндопротезирования |
||
|
1,56 (1,35÷1,83) |
0,18 (0,14÷0,26) |
3,31 (2,64÷3,87) |
|
10-14 месяцев после эндопротезирования |
||
|
| 1,24 * (1,06:1,47) |
0,16 (0,12÷0,27) |
2,91 (2,6÷3,27) |
|
22-24 месяца после эндопротезирования |
||
|
| 0,9 ** (0,71:1,43) |
0,16 (0,11÷0,29) |
3,29 (2,74÷3,58) |
|
Норма |
||
|
1,0 - 2,5 |
0,12 - 0,6 |
1,7 - 4,0 |
Примечание: * — p < 0,05, ** — p < 0,01 относительно дооперационных значений.
Таблица 3
Показатели клеточного иммунитета после эндопротезирования крупных суставов у пациентов с остеоартрозом при неосложненном течении послеоперационного периода (медианы значений показателей и интерквартильные размахи)
|
СD3+ |
CD3 - CD19 + |
CD3+CD4+ |
CD3+CD8+ |
CD3 - CD16 + CD56 + |
CD3+CD16+CD56+ |
|
|
До операции |
||||||
|
% |
73,4 (67,2÷77,5) |
9,6 (5,9÷11,8) |
45,3 (41,3÷51,8) |
26,2 (18,6÷31,2) |
13,6 (8,3÷17,9) |
6,7 (5,3÷8,8) |
|
109/л |
1,1(0,9÷1,41) |
0,16 (0,08÷0,19) |
0,72 (0,56÷0,88) |
0,37 (0,28÷0,48) |
0,21(0,11÷0,29) |
0,1 (0,08÷0,23) |
|
5 - 7 суток после эндопротезирования |
||||||
|
% |
72,8 (69,3÷78,1) |
Т 12,3 * (10,0:15,3) |
48,0 (43,4÷52,5) |
24,1(18,6÷29,0) |
1 9,3 ** (6,0:10,9) |
, 4,9 * (3,3:6,0) |
|
109/л |
1,0 (0,77÷1,27) |
Т 0,18 * (0,19:0,25) |
0,65 (0,53÷0,87) |
0,33 (0,22÷0,41) |
0,16 (0,13÷0,22) |
1 0,08 ** (0,04:0,11) |
|
18 - 21 сутки после эндопротезирования |
||||||
|
% |
75,6 (69,8÷79,7) |
8,5 (6,52÷10,2) |
47,7 (43,9÷54,4) |
24,7 (16,9÷29,1) |
12,1 (7,8÷15,8) |
6,1(4,6÷7,4) |
|
109/л |
1,16 (1,01÷1,52) |
0,13 (0,09÷0,17) |
0,76 (0,61÷0,96) |
0,39 (0,28÷0,53) |
0,19 (0,12÷0,29) |
0,08 (0,06÷0,12) |
|
4 - 7 месяцев после эндопротезирования |
||||||
|
% |
71,4 (59,6÷74,7) |
9,7 (7,2÷11,5) |
1 38,7 * (35,3:43,4) |
26,1 (18,6÷36,4) |
16,6 (13,2÷17,4) |
6,8 (4,2÷11,2) |
|
109/л |
1,04 (0,68÷1,26) |
0,14 (0,09÷0,2) |
0,6 (0,47÷0,67) |
0,38 (0,25÷0,51) |
0,21 (0,16÷0,27) |
0,11 (0,05÷0,14) |
|
10 - 14 месяцев после эндопротезирования |
||||||
|
% |
68,2 (62,7÷71,4) |
9,7 (7,2÷11,1) |
1 38,5 ** (35,5:41,8) |
30,4 (19,6÷35,8) |
17,6 (11,7÷18,8) |
7,4 (3,6÷9,5) |
|
109/л |
1 0,92 * (0,7:1,1) |
0,13 (0,1÷0,16) |
1 0,5 * (0,4:0,59) |
0,38 (0,24÷0,54) |
0,21 (0,15÷0,31) |
0,09 (0,05÷0,13) |
|
22 - 24 месяца после эндопротезирования |
||||||
|
% |
1 62,2 * (57,8:68,9) |
8,3 (5,6÷9,6) |
1 35,3 ** (34,1:38,5) |
23,1 (18,1÷26,1) |
Т 24,8 ** (21,6÷25,3) |
Т 11,9 * (8,7:13,1) |
|
109/л |
1 0,59 ** (0,47:1,01) |
1 0,08 * (0,07:0,14) |
1 0,43 ** (0,35:0,53) |
^ 0,21 * (0,16:0,39) |
0,21 (0,18÷0,29) |
0,11 (0,08÷0,14) |
|
Норма |
||||||
|
% |
60-83 |
6-16 |
37-53 |
20-34 |
8-18 |
0-6 |
|
109/л |
0,79-2,5 |
0,06-0,51 |
0,5-1,6 |
0,23-1,06 |
0,05-0,66 |
0-0,16 |
Примечание: * — p < 0,05, ** — p < 0,01 относительно дооперационных значений.
Таблица 4
|
CD3+HLA-DR (%) |
CD3+HLA-DR (10 9/л) |
CD3+CD25+ (%) |
CD3+CD25+ (109/л) |
|
До операции |
|||
|
4,11 (3,21÷6,37) |
0,06(0,04÷0,11) |
29,8 (26,0÷31,9) |
0,44(0,37÷0,52) |
|
5 – 7 суток после эндопротезирования |
|||
|
4,31 (2,42÷6,78) |
0,06 (0,03÷0,11) |
27,9 (23,1÷29,6) |
0,41(0,23÷0,45) |
|
18 – 21 сутки после эндопротезирования |
|||
|
3,9 (2,92÷6,37) |
0,07 (0,05÷0,09) |
31,8 (28,7÷33,9) |
0,63 (0,5÷0,83) |
|
4 – 7 месяцев после эндопротезирования |
|||
|
5,3 (4,2÷6,3) |
0,07 (0,06÷0,12) |
26,3 (25,7÷34,2) |
0,33 (0,29÷0,35) |
|
10 – 14 месяцев после эндопротезирования |
|||
|
5,1 (3,2÷7,6) |
0,08 (0,05÷0,1) |
↓ 20,6 * (18,2÷24,8) |
↓ 0,23 * (0,19÷0,34) |
|
22 – 24 месяца после эндопротезирования |
|||
|
5,6 (5,0÷6,4) |
0,07 (0,04÷0,12) |
↓ 18,0 ** (15,4÷22,1) |
↓ 0,18 ** (0,13÷0,23) |
|
Норма |
|||
|
0–6 |
0–0,16 |
7–18 |
0,06–0,4 |
Примечание: * — p < 0,05, ** — p < 0,01 относительно дооперационных значений.
CD3+(%)
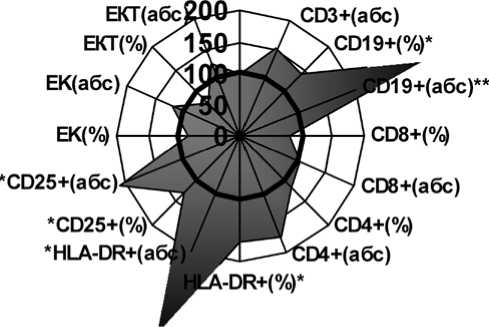
Рис. 2. Иммунологический профиль у пациентов с нестабильностью эндопротеза с выявленными во время ревизионного вмешательства признаками гнойно — воспалительного процесса в зоне имплантации; за 100 % приняты медианы показателей пациентов со стабильными имплантатами; * — p < 0,05; ** — p < 0,01 относительно значений показателя в группе со стабильными имплантатами
Динамика CD3+ HLA-DR и CD3+ CD25+ после эндопротезирования крупных суставов при неосложненном течении послеоперационного периода (медианы значений показателей и интерквартильные размахи)


