Лечение атрофических ложных суставов ключицы с применением биогеля
Автор: Давыдов Д.В., Аль-ханих М.А., Брижань Л.К.
Журнал: Кафедра травматологии и ортопедии @jkto
Рубрика: Оригинальное исследование
Статья в выпуске: 2 (48), 2022 года.
Бесплатный доступ
Цель исследования - улучшить результаты лечения атрофических ложных суставов ключицы путем применения коллагенового биогеля.Материалы и методыПроведено двухэтапное последовательное ретроспективно-проспективное контролируемое одноцентровое исследование с 2015 по 2021 годы. На первом этапе проведен анализ лечения 15 пациентов с атрофическими ложными суставами ключицы, которое заключалось в остеосинтезе и костной пластике. Изучали сроки сращения, функциональные результаты и осложнения. На втором этапе (12 пациентов) проводилось проспективное исследование: пациентам с атрофическими ложными суставами ключицы, при хирургическом лечении применяли биогель. Всего включено 27 пациентов, все мужского пола, средний возраст 29,6±7,5 лет. Средняя продолжительность лечения от момента травмы до госпитализации составил 357,1±78,1 суток. Низкоэнергетические травмы имели место у 18 (66,6%) пациентов: бытовые 12 (44,4%) и спортивные 6(22,2 %); высокоэнергетические 9 (33,3%): ДТП - 7 (25,9%), кататравма 2 (7,4%). Все переломы были закрытые по классификации АО тип: В (70,5%) и С (29,5%). Результаты лечения оценивали по клинические признаки сращения (боль и физиологическая осевая нагрузка); рентгенологические и КТ признаки сращения, функциональный результат лечения (клинический и тестирование по шкалам DASH и SF-36.Результаты. Сращение ложного сустава (по клиническим и рентгенологическим признакам) при применении биогеля было быстрее (239,4±55,3 суток) чем при стандартной костной аутопластике (299,74±67,9 суток) статистически значимо (р=0,0023). При тестировании по шкале DASH в первой группе результаты на сроках в 1 и 3 месяца были статистически значимо лучше (1 месяц: DASHгруппаI=77,6±3,3 и DASHгруппаII=80,4±4,2 (р=0.0065), 3 месяца DASHгруппаI=63,6±4,3 и DASHгруппаII=70,4±4,5 (р=0.0336), на более поздних сроках достоверной разницы между группами отмечено не было. По шкале SF-36 cтатистически значимые значения были через 3 месяца после операции, в группе I (ФФ) = 44,6±4,4, в группе II (ФФ) = 37,2±3,3 (разница 16,6% р=0,0065).Вывод: применение коллагенового гидрогеля в сочетании с губчатым костным аутотрансплантатом позволяет улучшить результаты лечения атрофических ложных суставов ключицы сократить срок сращения на 20% (р=0,0023) с высоким функциональным результатом.
Ложный сустав ключицы, коллагеновый биогель
Короткий адрес: https://sciup.org/142236564
IDR: 142236564 | УДК: 617.3 | DOI: 10.17238/2226-2016-2022-2-26-33
Текст научной статьи Лечение атрофических ложных суставов ключицы с применением биогеля
Образования ложного сустава обусловлено нарушением репаративной регенерации, которая по механизму качественно отличается от физиологической, в основе которой лежат процессы ангио и остеогенеза [1, 2, 3, 4]. Атрофические ложные суставы костей верхних конечностей являются серьезным осложнением переломов, возникающим примерно в 5% случаев. Ложные суставы диагностируются, когда при рентгенографии через 6 месяцев с момента травмы (два срока нормального сращения) отсутствуют признаки сращения кости [5, 6, 7, 8, 9].
Частота переломов ключицы составляет от 2,6 до 10% всех переломов, при этом 80% из них в средней трети, а ложные суставы ключицы — достаточно редко, и в основном при консервативном лечении [10]. В случаях многооскольчатых и открытых переломов, требующих открытой репозиции и фиксации, частота ложных суставов составляет около 3% [11, 12]. В метаанализе, представленном Zlowodzki M. и соавт. (2005), частота ложных суставов ключицы достигала 2,2%, в случае открытой и накостной фиксации в средней трети по сравнению с 5,9% при консервативном лечении и 15,1% при переломах со смещением [13].
Анализируя научную литературу мы не нашли единого тактического алгоритма для хирургической коррекции ложных суставов костей верхних конечностей атрофического характера [6, 14, 15, 16]. Снижение регенераторной способность кости ведет к большому проценту неудачных исходов операций, поэтому необходимы новые методы воздействия на репаративную регенерацию кости с помощью различных биопрепаратов. Многочисленные исследования в разных странах говорят о высокой актуальности данных исследований, что ставит задачу лечения атрофических ложных суставов костей конечностей в ряд наиболее важных в травматологии и ортопедии повреждений, потому что связана с инвалидизацией молодых пациентов [17, 18] .
Искусственные биорезорбируемые гидрогелевые матриксы, полученные из компонентов природного внеклеточного матрикса (ВКМ), представляют большой научно-практический интерес, потому что несут несколько компонентов из коллагена, желатина, гиалуроновой кислоты, что позволяет им выступать в роли биомиметиков [19]. Отечественный биополимерный микрогетерогенный коллагенсодержащий гидрогель (БМКГ) отвечает требованиям, предъявляемым к данному классу по-ликомпонентных биогидрогелевых тканевых биомиметиков [20]. Биополимерные микрогетерогенные коллагенсодержащие гидрогели данного класса способны создавать клеточным культурам соответствующий матрикс, который позволяет эффективную адгезию с последующей пролиферацией, необходимой для дифференцировки и синтеза специфической биоткани. Оригинальная технология создания инъекционной формы биогелевого препарата обеспечивает стабильную структурную биологически активную ксеногенную ткань, состоящую из частиц коллагена животного происхождения и гидрогеля, несущие в своем составе необходимые активные элементы ВКМ [21-27].
Множество экспериментальных работ показывает перспективы биоинженерного подхода к решению данной проблемы, но отсутствуют данные о клиническом применении биопрепаратов. Наша работа направлена на достижение этой цели путем применения биогеля для улучшения регенерации костной ткани у пациентов с атрофическими ложными суставами ключицы.
Цель исследования - улучшить результаты лечения атрофических ложных суставов ключицы путем применения коллагенового биогеля.
Материалы и методы
Проведено двухэтапное последовательное ретроспективнопроспективное контролируемое одноцентровое исследование с 2015 по 2021 годы. На первом этапе проведен анализ лечения 15 пациентов с атрофическими ложными суставами ключицы, которое заключалось в остеосинтезе и костной пластике. Изучали сроки сращения, функциональные результаты и осложнения. На втором этапе (12 пациентов) проводилось проспективное исследование пациентов с атрофическими ложными суставами ключицы, которым хирургическом лечении применяли биогель с целью повышения регенераторных свойств кости. Всего в исследование включено 27 пациентов с ложными суставами ключицы, все пациенты мужского пола, средний возраст 29,6±7,5 лет, без серьезной сопутствующей патологии по шкале ASA (Американского общества анестезиологов I–II). Ложные суставы были атрофического типа, без потери костной массы. Средняя продолжительность лечения от момента травмы до госпитализации составил 357,1±78,1 суток гендерные показатели представлены в таблице №1.
Таблица №1
Распределение пациентов по группам
|
Показатели |
Группы пациентов |
Всего n=27 |
Р** |
|
|
Основная n=12 |
Сравнения n=15 |
|||
|
Средний возраст (лет) |
28,9±8,3* |
29,9±7,7 |
29,6±7,5 |
0,725 |
|
ASA I: II |
9:3 |
10:5 |
19:8 |
0,163 |
|
Сегмент ключицы (n, %): |
||||
|
Латеральная треть |
3 (11,1%) |
3(11,1%) |
6 (22,2%) |
сзро*** |
|
Средняя треть |
6 (22,2%) |
8(29,7%) |
14(51,9%) |
сзро*** |
|
Медиальная треть |
3 (11,1%) |
4 (14,8%) |
7 (25,9%) |
сзро*** |
|
Средняя длительность предшествующего лечения (сут.) |
355,4±76,2 |
359,1±80,5 |
357,7±78,1 |
0,065 |
* - среднее значение ±среднеквадратичное отклонение;
** - р<0.05
***сзро - статистически значимая разница отсутствует
Критерии включения: пациенты с атрофическими ложными суставами ключицы, после закрытого перелома (срок давности травмы не менее 6 месяцев). Критерии невключения: открытые, внутрисуставные переломы, гипертрофические и инфицированные ложные суставы, циркулярные дефекты кости и/или мягких тканей, наличие сопутствующих заболеваний (ASA III и выше), повреждение нервов, отказ от участия в исследовании. Критерии исключения: инфекционные осложнения, недоступность пациента или отказ от участия в исследовании.
Низкоэнергетические травмы имели место у 18 (66,6%) пациентов: бытовые 12 (44,4%) и спортивные 6 (22,2 %); высокоэнергетические 9 (33,3%): ДТП – 7 (25,9%), кататравма 2 (7,4%). Все переломы были закрытые по классификации АО тип: В (19–70,5%) и С (29,5%), при этом дефектов мягких тканей области травмы не было, переломы ключицы при политравме были у 9 (33,3%) пострадавших. До поступления в госпиталь все пациенты проходили лечение в других лечебных учреждениях, при том консервативное лечение было у 8 (29,7%), остальные пациенты (19–70,5%) были оперированы ранее: накостный остеосинтез пластиной - 17 (63,1%) пациентов, интрамедуллярный 2 (7,4%). Повторные операции были у 12 (44,4%) пациентов: удаление металлоконструкций – 7 (25,9%), повторный остеосинтез – 2 (7,4%), костно-пластические операции – 3 (11,1%).
Первый этап проводился ретроспективно (группа сравнения), второй этап проспективно, при отборе пациентов по критериям включения и невключения, предлагалась операция накостного остеосинтеза с костной аутопластикой (фрагмент крыла подвздошной кости) с применением гидрогеля. У всех пациентов до включения в проводимое исследование было получено информированное согласие, одобренное локальным этическим комитетом ГВКГ им. Н. Н. Бурденко (протоколы № 193 от 29.04.2017 г. и № 219 от 18.09.2019 г.).
В обеих подгруппах применяли внутренний накостный остеосинтез и пластику области ложного сустава аутотрансплантатом из гребня крыла подвздошной кости, в основной группе применяли коллагеновый гидрогель «КОЛЛОСТ®» производства ООО «БиоФАРМАХОЛДИНГ», в качестве биомиметика внеклеточного матрикса. В ходе операции удаляли рубцовые ткани в межотломковой зоне (резекция ложного сустава) с одновременным удалением склерозированных участков раневой поверхности костных отломков. При необходимости усиления прочностных качеств трансплантата сохраняли кортикальную пластинку подвздошной кости, по ходу операций особое внимание уделяли сохранению (или восстановлению) длины, оси и ротации сегмента. Аутотрансплантаты укладывали в область ложного сустава, перекрывая отломки, при этом добиваясь плотного контакта между ними и реципиентным ложем, в некоторых случаях укрепляли винтами. При этом вокруг зоны ложного сустава и аутотрансплантата в мягких тканях формировали карман, на участки губчатой аутокости, дистальный и проксимальный отломки, равномерным слоем наносили коллагеновый гидрогель, после чего «карман» ушивали. В послеоперационном периоде пациентам обеих групп конечности иммобилизировали косыночной повязкой. Функциональную нагрузку на верхнюю конечность разрешали в ранние сроки в дозированном режиме. Протокол послеоперационного ведения пациентов в обеих группах был одинаковым.
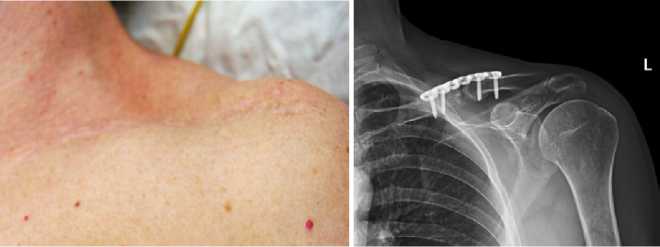
Клинический пример пациентка К., 47 лет, получила бытовую травму — закрытый перелом левой ключицы в средней трети со смещением отломков. По месту жительства выполнен остеосинтез пластиной, через 12 месяцев при обследовании выявлен атрофический ложный сустав левой ключицы в средней трети (рис. 1), боли в области левой ключицы, деформацию и травмы отрицает.
б
а
Рисунок 1. Пациентка К. А — вид послеоперационного рубца и деформация в области ключицы; б — рентгенограмма левой ключицы, атрофический ложный сустав
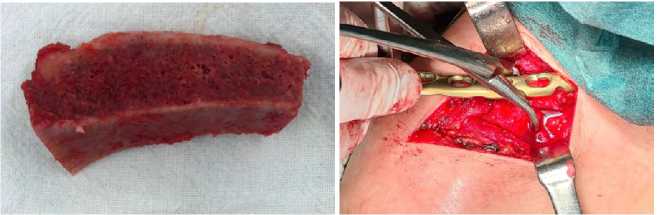
При госпитализации пациентки в ГВКГ им. Н. Н. Бурденко решено было выполнить реостеосинтез и свободную неваскуляризированную костную аутопластику левой ключицы трансплантатом фрагмента гребня крыла подвздошной кости с применением биогеля. Этапы операции представлены на рисунке 2. Костный аутотрансплантат фиксирован винтами к месту контакта отломков ключицы ниже пластины для создания плотного контакта отломками ключицы.
а б
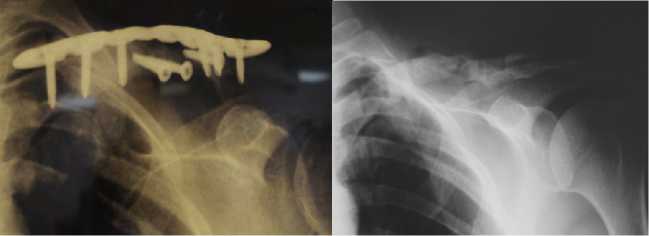
Послеоперационная рана зажила первично, перелом сросся через 24 месяца после операции и пластина удалена (через 36 месяцев) (рис. 3), функция конечности восстановлена в полном объеме (рис. 4).
б
а
Рисунок 3. Пациентка К. А — рентгенограмма левой ключицы через 24 месяца после пластики с применением БМКГ; б — рентгенограмма левой ключицы через 36 месяцев, ложный сустав сросся, но тень трансплантата видна
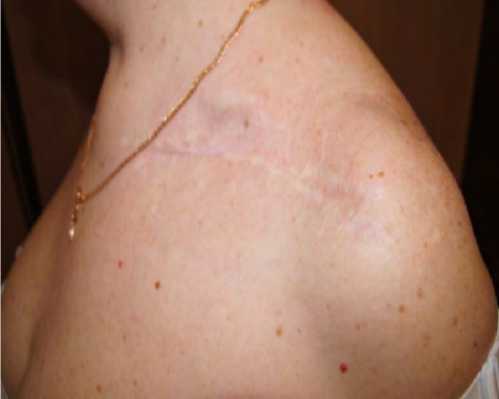
Пациентка продолжает амбулаторное наблюдения, в настоящее время срок наблюдения 40 месяцев после удаления пластины, жалоб нет, работает по прежней специальности.
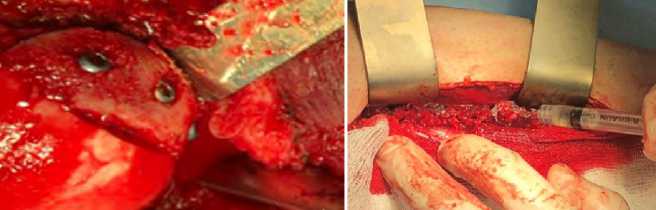
в г
Рисунок 2. Пациентка К. Интраоперационная картина:
а — вид кортикально-губчатого трансплантата из крыла подвздошной кости; б — этап остеосинтеза ключицы; в — вид фиксированного 3 винтами трансплантата; г — сформирован мышечный «карман» в области ключицы и этап введения биополимерного микрогетерогенного коллагенсодержащего геля в область кортикально-губчатого трансплантата
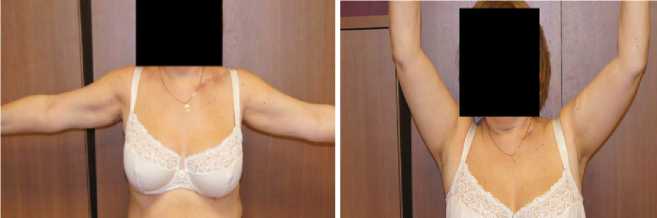
б
в
Рисунок 11. Пациентка К. А — вид рубцов области левой ключицы; б, в — вид пациентки и функция верхних конечностей через 12 месяцев после удаления пластины
Результаты лечения оценивали по трем критериям: клинические признаки сращения (боль и физиологическая осевая нагрузка); рентгенологические и КТ признаки сращения
(оценка костной мозоли и щели между отломками), функциональный результат лечения (клинический и тестирование по шкалам).
Для всех пациентов применяли опросник SF-36 (максимальная положительная оценка 100 баллов за 10 пунктов) и по двум разделам опросника «Оценка исходов при нарушении функции руки, плеча, кисти (DASH Outcome Measure, USA Institute for a Work&Health). Максимальная сумма баллов в первом разделе 150, во втором –20; минимальная – 30 и 4 соответственно. Результаты данного теста интерпретировали согласно инструкции: отличные и хорошие –от 30 до 49 баллов, удовлетворительные – от 50 до 74 баллов, неудовлетворительные – от 75 до 100 баллов.
Статистическая обработка.
Для описания количественных переменных использовали средние значения и стандартные отклонения в виде M ± S. Сопоставление двух групп по числовым переменным проводили при помощи непараметрического метода Манна–Уитни. Статистическую значимость различий групп для бинарных и номинальных показателей определяли при помощи критерия Хи-квадрат Пирсона в случае независимых выборок и при помощи непараметрической ранговой корреляции по Спирмену. Анализ динамики показателей для сопоставления двух периодов осуществляли на основе непараметрического метода Уилкоксона. Для исследования влияния сразу нескольких независимых показателей на зависимую использовали многофакторный дисперсионный анализ (MANOVA). Уровень статистической значимости был зафиксирован на уровне 0,05. Статистическую обработку данных выполняли при помощи пакета прикладных программ IBM SPSS Statistics 22.
Результаты
Сращение ложного сустава (по клиническим и рентгенологическим признакам) при применении биогеля было быстрее (239,4±55,3 суток) чем при стандартной костной аутопластике (299,74±67,9 суток) статистически значимо (р=0,0023).
При тестировании по шкале DASH в первой группе результаты на сроках в 1 и 3 месяца были статистически значимо лучше (1 месяц: DASHгруппаI=77,6±3,3 и DASHгруппаII=80,4±4,2 (р=0.0065), 3 месяца DASHгруппаI=63,6±4,3 и DASHгруппаII=70,4±4,5 (р=0.0336) , на более поздних сроках достоверной разницы между группами отмечено не было, диаграмма № 1.
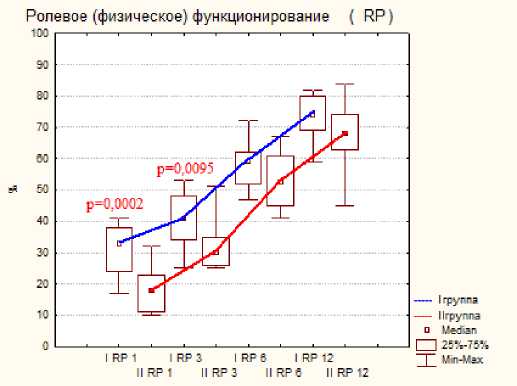
Тестирование по шкале SF-36 показало меньше различий показателей, но статистическая разница была отмечена на ранних сроках исследования при следующих критериях: это боль, физическое, ролевое и социальное функционирование, на поздних сроках статистической разницы отмечено не было, результаты представлены на диаграмме №2.
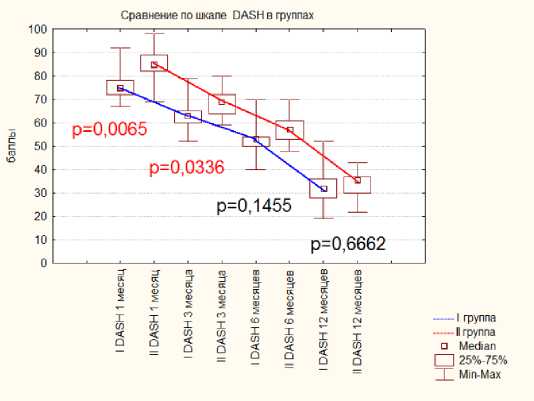
Диаграмма 1. Динамика результатов по шкале DASH в группах после операции.
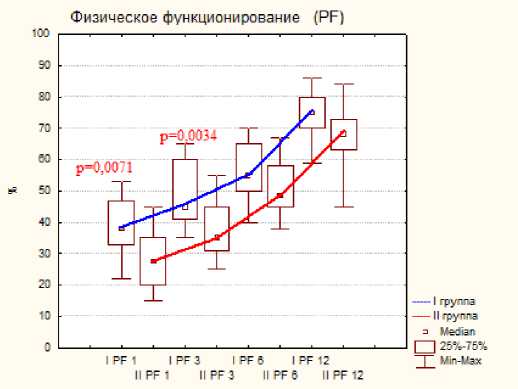
а
б
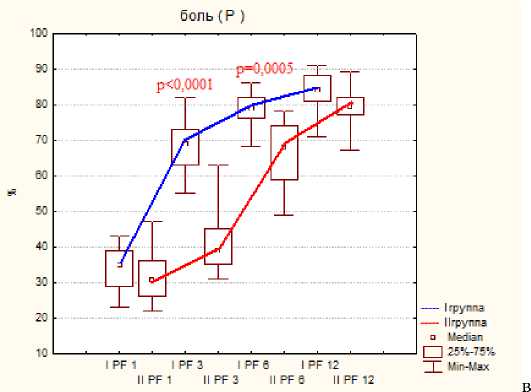
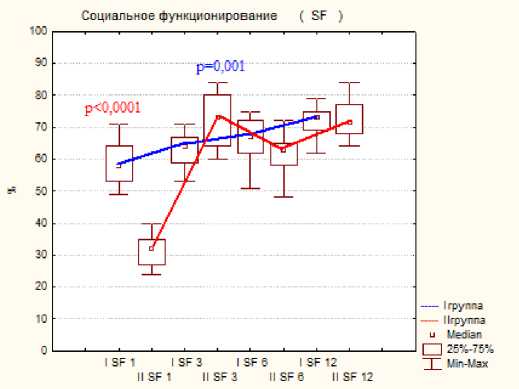
Диаграмма 2. Динамика показателей по шкале SF-36 по группам пациентов после операции: а- физическое функционирование, б- ролевое функционирование, в- боль, г социальное функционирование.
г
Обсуждение
Исследование посвящено хирургическому лечению ложных суставов ключицы атрофического характера. Многочисленные исследования, проведенные в разных странах, характеризуют проблему образования ложных суставов костей верхних конечностей как актуальную в связи с частотой и высоким процентом инвалидности, особенно среди лиц трудоспособного возраста.
Большое количество научных работ рекомендует применять стабильный остеосинтез с использованием костных аутотрансплантатов — это уже устоявшееся мнение, но новые биомиметики и остеопластические материалы показывают неплохие экспериментальные и клинические результаты.
Органические имплантаты интегрируются в кость и замещают дефект ткани за счет прорастания сосудов вглубь ткани имплантата. Такой механизм интеграции, основанный на постепенном замещении имплантата нативной тканью, является наиболее предпочтительным, поэтому использование тканеинженерных конструкций на основе природных полимеров (биомиметиков) является перспективным направлением биоинженерии [22, 29].
Органический компонент костной ткани составляет 45 % от всего объема кости и состоит из коллагена (85–90 %), поэтому наличие коллагена в матрице тканеинженерной конструкции будет стимулировать остеорепарацию. Коллаген полимеризуясь образует белковые сферические тела, которые вступают во взаимодействие между собой и образуют прочную полимерную матрицу с 3D-объемной формой. Такая матрица способна менять свою консистенцию от жидкой до желеобразной без нарушения решетчатой структуры, что стимулирует прорастание сосудов, при этом в нормальном состоянии имеет гелеобразную, удобную для использования форму [30, 31, 32, 33].
Применение предлагаемой в исследовании модели тканеинженерной конструкции, состоящей из скаффолда (коллагеновый гидрогель), остеогенной клеточной колонии (губчатая аутокость) с биологически активными веществами (фибриллярные белки, гликозаминогликаны, многочисленные растворимые факторы в области операционной раны), доказывает свою способность к оптимизации репаративной остеорегенерации, что проявилось в ускорении сращения ложного сустава [34]. Однако ввиду особенностей данного исследования (малой выборки, отсутствие рандомизации) факты успешного функционирование тканеинженерной конструкции с матрицей из коллагенового гидрогеля требуют дальнейшего исследования.
Вывод: применение коллагенового гидрогеля в сочетании с губчатым костным аутотрансплантатом позволяет улучшить результаты лечения атрофических ложных суставов ключицы сократить срок сращения на 20% (р=0,0023) с высоким функциональным результатом.
Список литературы Лечение атрофических ложных суставов ключицы с применением биогеля
- Быков, В.Л. Общая гистология: Учебник для мед. ВУЗов / В. Л. Быков. — СПб.: СОТИС, 2001. — 519 с. [Bykov, V.L. Obshchaya gistologiya: Uchebnik dlya med. VUZov / V. L. Bykov. — SPb.: SOTIS, 2001. — 519 s]
- Гайворонский, И.В. Нормальная анатомия человека: Учебник для медицинских ВУЗов. Т. 1 / И.В. Гайворонский. — СПб.: СпецЛит, 2000. [Gaivoronskii, I.V. Normal’naya anatomiya cheloveka: Uchebnik dlya meditsinskikh VUZov. T. 1 / I.V. Gaivoronskii. — SPb.: SpetsLit, 2000]
- Гистология: Учебник / Под ред. Э. Г. Улумбекова, Ю. А. Челышева; 2-е изд., перераб. и доп. — М.: ГЭОТАР-Мед, 2001. — 694 с. [Gistologiya: Uchebnik / Pod red. E. G. Ulumbekova, Yu. A. Chelysheva; 2-e izd., pererab. i dop. — M.: GEOTAR-Med, 2001. — 694 s]
- Лаврищева, Г.И. Морфологические и клинические аспекты репаративной регенерации опорных органов и тканей / Г. И. Лаврищева, Г. А. Оноприенко. — М.: Медицина, 1996. — 206 с. [Lavrishcheva, G.I. Morfologicheskie i klinicheskie aspekty reparativnoi regeneratsii opornykh organov i tkanei / G. I. Lavrishcheva, G. A. Onoprienko. — M.: Meditsina, 1996. — 206 s]
- Мюллер, М.Е. Руководство по внутреннему остеосинтезу / М. Е. Мюллер, М. Альговер, Р. Шнайдер. — Гейдельберг; Нью-Йорк: Springer-Verlag, 1996. — 750 с. [Myuller, M.E. Rukovodstvo po vnutrennemu osteosintezu / M. E. Myuller, M. Al’gover, R. Shnaider. — Geidel’berg; N’yu-Iork: Springer-Verlag, 1996. — 750 s]
- Шевцов, В.И. Псевдоартрозы, дефекты длинных костей верхней конечности и контрактуры локтевого сустава / В. И. Шевцов, В.Д. Макушин, Л.М. Куфтырев, Ю. П. Солдатов. — Курган, 2001. — 398 с. [Shevtsov, V.I. Psevdoartrozy, defekty dlinnykh kostei verkhnei konechnosti i kontraktury loktevogo sustava / V. I. Shevtsov, V.D. Makushin, L.M. Kuftyrev, Yu. P. Soldatov. — Kurgan, 2001. — 398 s]
- Abarca, J. Clavicular reconstruction with free fibula flap: a report of four cases and review of the literature / J. Abarca, P. Valle, P. Valenti // Injury. — 2013. — Vol. 44, N 3. — P. 283–7. doi: 10.1016/j.injury.2013.01.026
- Bostman, O. Complications of plate fixation in fresh displaced midclavicular fractures / O. Bostman, M. Manninen, H. Pihlajamaki // J. Trauma. — 1997. — Vol. 43, N 5. — P. 778–783. doi: 10.1097/00005373-199711000-00008
- Jaloux, C. Free vascularized medial femoral condyle corticoperiosteal flap with non-vascularized iliac crest graft for the treatment of recalcitrant clavicle non-union / C. Jaloux, Q. Bettex, M. Levadoux [et al.] // J. Plast. Reconstr. Aesthet. Surg. — 2020. — Vol. 73, N 7. — P. 1232–1238. doi: 10.1016/j.bjps.2020.03.018
- O’Neill, B.J. Clavicle fractures: a comparison of five classification systems and their relationship to treatment outcomes / B.J. O’Neill, K.M. Hirpara, D. O’Briain, C. McGarr, T.K. Kaar // Int. Orthop. — 2011. — Vol. 35, N 6. — P. 909–14. doi: 10.1007/s00264-010-1151-0
- Werner, C.M.L. Pedicled vascularized rib transfer for reconstruction of clavicle nonunions with bony defects: anatomical and biomechanical considerations / C.M.L. Werner, P. Favre, H.G. van Lenthe, C.E. Dumont // Plast. Reconstr. Surg. — 2007. — Vol. 120, N 1. — P. 173–80. doi: 10.1097/01.prs.0000263537.57701.8b
- Wessel, R.N. Outcome of total claviculectomy in six cases / R.N. Wessel, G.R. Schaap // J. Shoulder Elbow Surg. — 2007. — Vol. 16, N 3. — P. 312–15. doi: 10.1016/j.jse.2006.07.007
- Zlowodzki, M. Evidence-Based Orthopaedic Trauma Working Group. Treatment of acute midshaft clavicle fractures: systematic review of 2144 fractures: on behalf of the Evidence-Based Orthopaedic Trauma Working Group / M. Zlowodzki, B.A. Zelle, P.A. Cole, K. Jeray, M.D. McKee // J. Orthop. Trauma. — 2005. — Vol. 19, N 7. — P. 504–7. doi: 10.1097/01.bot.0000172287.44278.ef
- Rosen H (1988) Treatment of nonunion: General principles. In: Chapman WM, editor. Operative Orthopaedics. Philadelphia: Lippincott-Raven: 489–509.
- Schenk RK, Müller ME, Willenegger H (1968) [Experimental histological contribution to the development and treatment of pseudarthrosis]. Hefte Unfallheilkd; 94:15–24 .
- Guttentag IJ, Rechtine GR (1988) Fractures of the scapula. A review of the literature. Orthop Rev; 17 (2):147–158.
- Jupiter JB, Leffert RD (1987) Non-union of the clavicle. Associated complications and surgical management. J Bone Joint Surg [Am]; 69 (5):753–760.
- Echtermeyer V, Zwipp H, Oestern HJ (1984) [Errors and dangers in the treatment of fractures and pseudarthroses of the clavicle]. Langenbecks Arch Chir; 364:351–354.
- Popp, J.R. In vitro evaluation of osteoblastic differentiation on amorphous calcium phosphate decorated poly (lactic-co-glycolic acid) scaffolds / J.R. Popp, K.E. Laflin, B.J. Love [et al.] // J. Tissue Eng. Regen. Med. — 2011. — Vol. 5. — P. 780–789. doi: 10.1002/term.376
- Fisher, S.A. Tissue mimetics: engineered hydrogel matrices provide biomimetic environments for cell growth / S.A. Fisher, R.Y. Tam, M.S. Shoichet // Tissue Engineering. — 2014. — Part A. — Vol. 20, N 5–6. — P. 895–898. doi: 10.1089/ten.tea.2013.0765
- Севастьянов, В.И. Технологии тканевой инженерии и регенеративной медицины / В. И. Севастьянов // Вестник трансплантологии и искусственных органов. — 2014. — Т. 16. — № 3. — С. 93–108. [Sevast’yanov, V.I. Tekhnologii tkanevoi inzhenerii i regenerativnoi meditsiny / V. I. Sevast’yanov // Vestnik transplantologii i iskusstvennykh organov. — 2014. — T. 16. — № 3. — S. 93–108]
- Севастьянов, В.И. Клеточно-инженерные конструкции в тканевой инженерии и регенеративной медицине / В. И. Севастьянов // Вестник трансплантологии и искусственных органов. — 2015. — Т. 17. — № 2. — С. 127–130. [Sevast’yanov, V.I. Kletochno-inzhenernye konstruktsii v tkanevoi inzhenerii i regenerativnoi meditsine / V.I. Sevast’yanov // Vestnik transplantologii i iskusstvennykh organov. — 2015. — T. 17. — № 2. — S. 127–130]
- Севастьянов, В.И. Формирование тканеинженерной конструкции хрящевой ткани человека в проточном биореакторе / В.И. Севастьянов, Ю.Б. Басок, А. М. Григорьев, Л. А. Кирсанова, В.Н. Василец // Клеточные технологии в биологии и медицине. — 2017. — № 3. — С. 178–183. [Sevast’yanov, V.I. Formirovanie tkaneinzhenernoi konstruktsii khryashchevoi tkani cheloveka v protochnom bioreaktore / V. I. Sevast’yanov, Yu.B. Basok, A. M. Grigor’ev, L. A. Kirsanova, V.N. Vasilets // Kletochnye tekhnologii v biologii i meditsine. — 2017. — № 3. — S. 178–183]
- Севастьянов, В.И. Применение технологии тканевой инженерии для формирования хрящевой ткани человека в проточном биореакторе / В. И. Севастьянов, Ю.Б. Басок, А. М. Григорьев, Л. А. Кирсанова, В.Н. Василец // Вестник трансплантологии и искусственных органов. — 2017. — Т. 19. — № 3. — С. 81–92. [Sevast’yanov, V.I. Primenenie tekhnologii tkanevoi inzhenerii dlya formirovaniya khryashchevoi tkani cheloveka v protochnom bioreaktore / V. I. Sevast’yanov, Yu.B. Basok, A. M. Grigor’ev, L. A. Kirsanova, V.N. Vasilets // Vestnik transplantologii I iskusstvennykh organov. — 2017. — T. 19. — № 3. — S. 81–92]
- Севастьянов, В.И. Функциональная эффективность биомедицинского клеточного продукта для регенерации суставного хряща (экспериментальная модель остеоартроза) / В. И. Севастьянов, Г.А. Духина, А. М. Григорьев [и др.] // Вестник трансплантологии и искусственных органов. — 2015. — Т. 17. — № 1. — С. 86–96. [Sevast’yanov, V.I. Funktsional’naya effektivnost’ biomeditsinskogo kletochnogo produkta dlya regeneratsii sustavnogo khryashcha (eksperimental’naya model’ osteoartroza) / V. I. Sevast’yanov, G.A. Dukhina, A. M. Grigor’ev [i dr.] // Vestnik transplantologii i iskusstvennykh organov. — 2015. — T. 17. — № 1. — S. 86–96]
- Севастьянов, В.И. Биополимерный гетерогенный гидрогель Сферо®ГЕЛЬ — инъекционный биодеградируемый имплантат для заместительной и регенеративной медицины / В. И. Севастьянов, Н.В. Перова // Практическая медицина. — 2014. — Т. 8. — № 84. — С. 120–126. [Sevast’yanov, V.I. Biopolimernyi geterogennyi gidrogel’ Sfero®GEL’’ — in»ektsionnyi biodegradiruemyi implantat dlya zamestitel’noi i regenerativnoi meditsiny / V. I. Sevast’yanov, N. V. Perova // Prakticheskaya meditsina. — 2014. — T. 8. — № 84. — S. 120–126]
- Севастьянов В. И., Перова Н. В. Инъекционный гетерогенный биополимерный гидрогель для заместительной и регенеративной хирургии и способ его получения. Патент РФ на изобретение № 2433828 (2010). [Sevast’yanov V. I., Perova N. V. In”ektsionnyi geterogennyi biopolimernyi gidrogel’ dlya zamestitel’noi i regenerativnoi khirurgii i sposob ego polucheniya. Patent RF na izobretenie № 2433828 (2010)]
- Севастьянов, В.И. Доклинические исследования безопасности и эффективности БМКП для регенерации суставного хряща, печени и поджелудочной железы. В кн.: Методические рекомендации по проведению доклинических исследований биомедицинских клеточных продуктов / Под ред. акад. В. А. Ткачука / В. И. Севастьянов, М.Ю. Шагидулин, Н.Н. Скалецкий, Н. В. Перова, И.А. Довжик, С.В. Готье. — М.: МГУ, 2017. — С. 110–132. [Sevast’yanov, V.I. Doklinicheskie issledovaniya bezopasnosti i effektivnosti BMKP dlya regeneratsii sustavnogo khryashcha, pecheni i podzheludochnoi zhelezy. V kn.: Metodicheskie rekomendatsii po provedeniyu doklinicheskikh issledovanii biomeditsinskikh kletochnykh produktov / Pod red. akad. V. A. Tkachuka/ V. I. Sevast’yanov, M.Yu. Shagidulin, N.N. Skaletskii, N. V. Perova, I.A. Dovzhik, S.V. Got’e. — M.: MGU, 2017. — S. 110–132.]
- Остеоинтеграция биоактивных имплантов при лечении переломов длинных трубчатых костей: учебное пособие /под ред. Попкова А. В.; Томский политехнический университет. Томск: Изд-во Томского политехнического университета, 2017. 304 с. [Osteointegratsiya bioaktivnykh implantov pri lechenii perelomov dlinnykh trubchatykh kostei: uchebnoe posobie /pod red. Popkova A. V.; Tomskii politekhnicheskii universitet. Tomsk: Izd-vo Tomskogo politekhnicheskogo universiteta, 2017. 304 s.]
- Wong SW, Lenzini S, Bargi R, Feng Z, Macaraniag C, Lee JC, et al. Controlled deposition of 3D matrices to direct single cell functions. Adv Sci (Weinh). 2020; 7(20): 2001066. DOI: 10.1002/advs.202001066.
- Кузнецова Д. С., Тимашев П. С., Баграташвили В.Н., Загайнова Е.В. Костные имплантаты на основе скаффолдов и клеточных систем в тканевой инженерии (обзор) //Современные технологии в медицине. 2014. Т. 6, № 4. С. 201–212.) [Kuznetsova D. S., Timashev P. S., Bagratashvili V.N., Zagainova E. V. Kostnye implantaty na osnove skaffoldov i kletochnykh sistem v tkanevoi inzhenerii (obzor) //Sovremennye tekhnologii v meditsine. 2014. T. 6, № 4. S. 201–212.)]
- Balasubramanian P, Prabhakaran MP, Sireesha M, Ramakrishna S. Collagen in human tissues: structure, function, and biomedical implications from a tissue engineering perspective. Advances in Polymer Science. 2013; 251: 173-206. doi: 10.1021/acsnano.7b06826
- Lenzini S, Bargi R, Chung G, Shin JW. Matrix mechanics and water permeation regulate extracellular vesicle transport. Nat Nanotechnol. 2020; 15(3): 217-223. DOI: 10.1038/s41565-020-0636-2.
- Давыдов Д. В., Чирва Ю.В., Брижань Л.К., Бабич М. И., Федуличев П.Н., Аль-Ханих М.А. Перспективный метод восстановления костной ткани у пострадавших с тяжелыми нарушениями остеорегенерации (опыт клинического применения скаффолд-технологий) //ПОЛИТРАВМА / POLYTRAUMA. 2021. № 1, С. 41–50. DOI: 10.24411/1819–1495-2020-10005. [Davydov D. V., Chirva Yu.V., Brizhan’ L.K., Babich M. I., Fedulichev P.N., Al’-Khanikh M.A. Perspektivnyi metod vosstanovleniya kostnoi tkani u postradavshikh s tyazhelymi narusheniyami osteoregeneratsii (opyt klinicheskogo primeneniya skaffold-tekhnologii)//POLITRAVMA / POLYTRAUMA. 2021. № 1, S. 41–50. DOI: 10.24411/1819–1495-2020-10005.]


