Лечение больной раком молочной железы с метастазами в контралатеральные подмышечные лимфатические узлы. Клинический случай и обзор литературы
Автор: Амосова Виктория Андреевна, Петровский Александр Валерьевич, Черных Марина Васильевна, Коваленко Елена Игоревна, Фролова Мона Александровна, Валиев Рамиз Камраддинович, Нечушкин Михаил Иванович, Кирсанов Владислав Юрьевич, Высоцкая Ирина Викторовна, Автомонов Дмитрий Евгеньевич
Журнал: Сибирский онкологический журнал @siboncoj
Рубрика: Клинические исследования
Статья в выпуске: 6 т.18, 2019 года.
Бесплатный доступ
Актуальность. В настоящее время в обзорах литературы, касающихся метастатического рака молочной железы (РМЖ), практически отсутствуют данные, освещающие вопросы лечебной тактики при метастатически пораженных контралатеральных подмышечнымх лимфатических узлах (КПЛУ). Традиционно принято считать, что поражение лимфатических узлов при РМЖ происходит ипсилатерально. Однако описано достаточно много случаев, при которых метастазы обнаруживаются в КПЛУ Описание клинического случая. Представлен клинический случай больной с поражением КПЛУ При комплексном обследовании установлен диагноз: рак правой молочной железы Т2ЖМ1 (метастаз в контралатеральный подмышечный лимфоузел). По данным гистологического исследования образования правой молочной железы и подмышечного лимфатического узла слева верифицирован протоковый инфильтративный рак II степени злокачественности с признаками ангиолимфатической инвазии. Мутации в генах BRCA1, BRCA2, CHEK2, NBS1 не выявлены. Пациентка получила комплексное лечение. Обзор литературы. Проведен поиск литературы, касающейся лечения пациенток с метастазом в КПЛУ. Анализ литературы показал, что поражение КПЛУ особенно после проведенного хирургического и лучевого лечения, следует рассматривать как гематогенное распространение и учитывать особенности лимфодренажного оттока. При этом выживаемость таких пациенток больше сопоставима с результатами при местнораспространенных формах заболевания, а не при наличии отдаленных метастазов. Заключение. Продолжается дискуссия о ранней диагностике и дальнейшей тактике лечения. До сих пор не определены факторы, влияющие на прогноз заболевания. Открытым остается вопрос стадирования пораженного КПЛУ.
Рак молочной железы, контралатеральный подмышечный лимфатический узел, гематогенное распространение, лимфодренажный отток
Короткий адрес: https://sciup.org/140254301
IDR: 140254301 | УДК: 618.19-006.6-033.2-08:61018.98 | DOI: 10.21294/1814-4861-2019-18-6-31-38
Текст научной статьи Лечение больной раком молочной железы с метастазами в контралатеральные подмышечные лимфатические узлы. Клинический случай и обзор литературы
До настоящего времени вопрос о выборе метода лечения при метастатическом раке молочной железы, а также критериях подбора пациентов для выполнения того или иного способа хирургического вмешательства остается открытым. Многочисленные ретроспективные исследования указывают на пользу от проведения хирургического лечения и увеличение показателей выживаемости. Наиболее эффективно оперативное вмешательство при метастатическом поражении костей, 1–2 метастазах в пределах одного органа, наличии ответа на системное лечение, высокой экспрессии РЭ/РП, достижении «чистых» краев резекции. Однако в обзорах литературы, касающихся метастатического РМЖ, практически отсутствуют данные, освещающие вопросы лечебной тактики при поражении контрлатерального подмышечного лимфатического узла.
Клинический случай
Представляем клинический случай больной раком молочной железы с метастатическим поражением КПЛУ. В ноябре 2011 г. пациентка Б., 35 лет, самостоятельно обнаружила образо- вание в правой молочной железе, однако к врачу не обращалась. Спустя год отметила появление увеличенного подмышечного лимфатического узла слева. При обследовании по месту жительства по данным ММГ, УЗИ и патоморфологического исследования диагностирован рак. В августе 2013 г. пациентка обратилась в ФГБУ «НМИЦ онкологии им. Н.Н. Блохина» Минздрава России. При осмотре молочные железы развиты и сформированы правильно; кожа, соски, ареолы не изменены; выделений из сосков нет (рис. 1). В верхне-наружном квадранте правой молочной железы пальпируется участок уплотнения, без четких границ, около 2,5 см в диаметре. В левой молочной железе узловые образования не пальпируются. В правой и левой подмышечных областях пальпируются плотные лимфоузлы.
По данным ММГ+УЗИ молочных желез, регионарных зон: в верхне-наружном квадранте правой молочной железы визуализируется гиперденсное образование неправильной формы с лучистым контуром размерами 2,6×1,8 см, с зоной микрокальцинатов. В левой аксиллярной области определяется лимфоузел до 1,1×0,7 см, в правой аксиллярной области – лимфоузлы от 0,9 см до 1,6 см. При выполнении core-биопсии узлового образования правой молочной железы и лимфатического узла слева по данным гистологического исследования верифицирован протоковый инфильтративный рак II степени злокачественности с признаками ангиолимфатической инвазии. При выполнении тонкоигольной аспирационной биопсии лимфатического узла справа цитологически верифицирован рак. В материале из над- и подключичных л/у справа найденные изменения соответствуют лимфоидной гиперплазии. По данным иммуногистохимического исследования рецепторы эстрогена и прогестерона соответствуют 7 баллам, гиперэкспрессии Her2/neu не было (1+), Ki67 – 70 %. Мутации в генах BRCA1, BRCA2, CHEK2, NBS1 не выявлены. Таким образом, установлен диагноз: рак правой молочной железы Т2N1М1 (метастаз в контралатеральный подмышечный лимфоузел). Сопутствующие заболевания: сифилис, гепатит С.
На первом этапе с 26.02.13 по 23.07.13 проведено 4 курса химиотерапии по схеме АС, 4 курса доцетаксела с положительной динамикой, лечение перенесла удовлетворительно, без выраженных побочных реакций. При контрольной ММГ + УЗИ молочных желез, регионарных зон от 15.08.13: в сравнении с исследованием от 07.05.13, в верхненаружном квадранте правой молочной железы визуализируется зона неоднородной структуры, пониженной эхогенности, размерами 2,1×1,0 см, узловые образования четко не определяются, зона микрокальцинатов без динамики. В ткани левой молочной железы без узловых образований. В левой
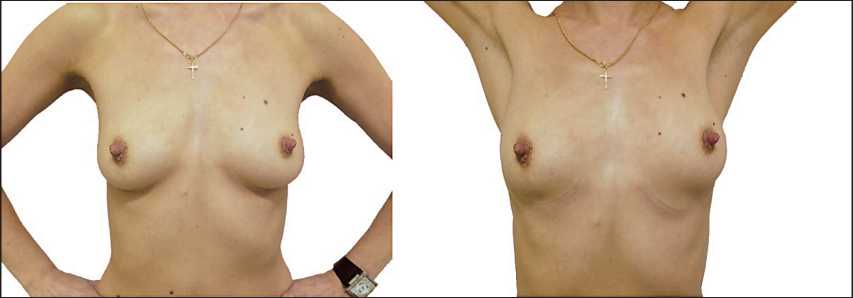
Рис. 1. Пациентка при первом обращении в ФГБУ НМИЦ онкологии им. Н.Н. Блохина МЗ РФ (август 2013 г.)
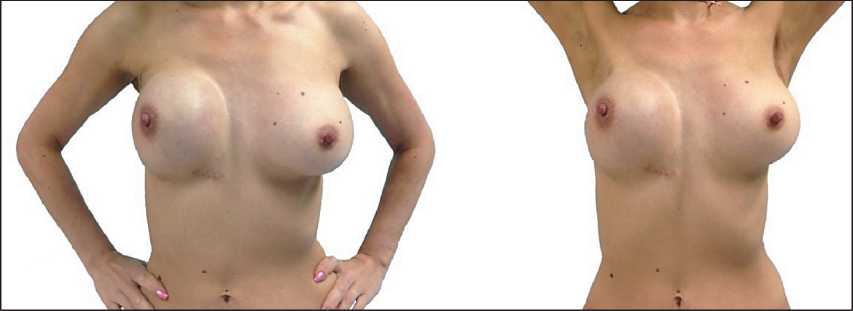
Рис. 2. Состояние после 1 этапа реконструкции правой молочной железы, аугментационной маммопластики слева, проведения ДЛТ (июль 2014 г.)
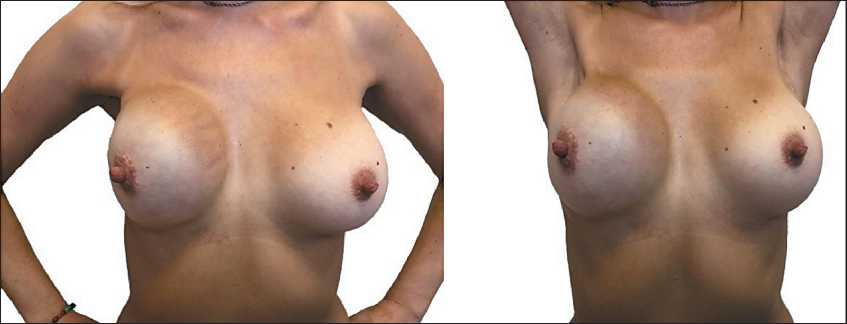
Рис. 3. Пациентка в настоящее время (ноябрь 2018 г.)
аксиллярной области лимфоузел до 1,0×0,7 см – без динамики. В правой аксиллярной области лимфоузлы от 0,9 см до 1,6 см – без динамики. В других регионарных зонах патологически измененных лимфоузлов не выявлено.
В порядке оперативного лечения 6.09.13 выполнена радикальная подкожная мастэктомия справа с одномоментной реконструкцией эспандером, подмышечная лимфаденэктомия слева, аугмента-ционная маммопластика слева (рис. 2). По данным гистологического исследования операционного материала опухолевый узел в молочной железе не обнаружен, что расценено как лечебный пато-морфоз IV степени. В 12 лимфоузлах регионарной клетчатки справа и в 7 лимфоузлах регионарной клетчатки слева – аналогичные изменения.
В послеоперационном периоде с 5.11.13 по 6.12.13 проведена конформная лучевая терапия. Объем лучевой терапии был выбран с учетом проведенного радикального хирургического вмешательства для достижения высокого уровня локального контроля. В зоны облучения вошли правая половина грудной стенки, правая подмышечная, над-подключичные, парастернальная зоны, а также зона контрлатерального метастазирования – левая подмышечная область. Лечение проводилось на линейном ускорителе электронов, энергия фотонов 18 микроэлектрон-Вольт (МэВ). Разметка проводилась на специальном фиксирующем приспособлении – маммоборде. План лечения составлен на основании разметочной компьютерной томографии, с применением трехмерного планирования (тангенциальные поля). Верификация положения пациентки во время лечения осуществлялась под контролем визуализации с помощью CB-CT (cone beam computed tomography) 1 раз в нед. Во время дистационной лучевой терапии (ДЛТ) применялась технология защиты пациента LaserGuard. Выбран стандартный режим фракционирования (разовая доза – 2 Гр, суммарная доза – 50 Гр). Затем была назначена эндокринотерапия тамоксифеном 20 мг 1 раз в сут, которая продолжается в настоящее время.
Второй этап реконструкции правой молочной железы (замена эспандера на эндопротез) выполнен 20.06.14.
При контрольном обследовании в сентябре 2018 г. данных за прогрессирование заболевания не получено (рис. 3). Оценку качества жизни, общего состояния здоровья, эстетического результата и удовлетворённости пациентки выполненной реконструкцией проводили с применением опросников BREAST-Q, QLQ – C30/BR23. При математической обработке результатов опроса использовались счетные руководства «EORTC QLQ-C30 Scoring Manual» для QLQ – C30/BR23. Результаты подсчетов продемонстрировали, что снижение качества жизни в основном было связано с наличием болей в области послеоперационной раны. Кроме того, отмечены высокие результаты, касающиеся самовосприятия образа тела, эмоциональной, сексуальной и социальной функции.
Обзор литературы
В последнее время возрос интерес к изучению вопроса поражения КПЛУ, что связано с накоплением клинических и экспериментальных данных об особенностях возникновения и течения заболевания, а также результатов выживаемости. Продолжается дискуссия о ранней диагностике пораженного КПЛУ и определении дальнейшей тактики лечения, до сих пор не определены факторы, влияющие на прогноз заболевания.
Согласно современной классификации TNM рака молочной железы, метастатически пораженный КПЛУ характерен для IV стадии, т.е. является отдаленным метастазом (М1) и встречается примерно у 3,6–6 % от общего числа больных РМЖ [1]. Однако экспериментальное изучение лимфодренажной системы у больных раком молочной железы после выполнения хирургического вмеша-тетельства, лучевого или химиотерапевтического лечения позволило выявить ряд особенностей и причин, связанных с поражением КПЛУ. Многие авторы подчеркивают, что наибольшие трудности в данном случае вызывал поиск первичного очага, который на первом этапе зачастую был удален. Кроме того, большое практическое значение имела одновременность возникновения опухоли в обеих молочных железах, т.е. метахронность или синхронность процесса, а также гистологический тип опухоли.
Еще в 1874 г. французский анатом Sappey [2] впервые высказал предположение о том, что дренаж от лимфатических сосудов молочной железы поступает в ипсилатеральные подмышечные лимфатические узлы. Совершенствование методов диагностики показало, что отток вне этой зоны осуществляется примерно в 20–57 % случаев. Такой диапазон зависел от способов идентификации сигнального лимфатического узла – места инъекции, количества и типа индикатора, способов и методов обнаружения. Дренаж в контралатеральную молочную железу диагностируется гораздо реже, примерно в 0–2 % случаев [3–4].
В исследовании, проведенном в 1972 г. Haagens-en, были использованы различные индикаторы для обнаружения возможных путей лимфатического оттока при раке молочной железы [5]. Было выдвинуто предположение, что опухолевые клетки могут распространяться на КПЛУ через лимфатическое сплетение грудной клетки, так как стандартный путь поврежден при хирургическом вмешательстве или лучевой терапии [6–8]. Аналогичные данные продемонстрировали и другие авторы [9–10].
Поражение КПЛУ, характерное для пациентов после хирургического или химиотерапевтического вмешательства, получило название «кроссоверного метастаза» или «кроссоверной болезни». При сравнении результатов выживаемости этих пациентов и пациентов с отдаленными метастазами прогноз на тот момент оказался значительно лучше в первой группе и больше сопоставим с результатами при РМЖ III стадии [11].
В дальнейшем это было подтверждено в исследовании Morcos et al., по данным которого у 5 пациентов с РМЖ не был поражен КПЛУ за период наблюдения от 4 до 45 мес [12]. Аналогичные данные были ранее получены Huston, при наблюдении в сроки от 29 до 35 мес [13]. Согласно одному из последних обзоров [14], после тщательного изучения результатов диагностических и патомор-фологических исследований, поражение КПЛУ не следует классифицировать как РМЖ IV стадии. Из этого следует, что, несмотря на ограниченность и небольшое количество исследуемых групп, поражение КЛПУ является региональным процессом, потенциально поддающимся лечению.
В 2015 г. M. Moossdorff et al. [15] опубликовали обзор, включивший 24 статьи, отобранные в PubMed за период с января 1995 г. по июль 2014 г. Проанализированы результаты выживаемости 48 женщин, имеющих поражение КПЛУ. При выявлении первичного опухолевого очага 26 пациенткам провели органосохраняющее лечение; пятерым выполнялась мастэктомия, из которых – 2 с дальнейшим облучением половины грудной клетки. При этом подмышечная лимфодиссекция выполнялась 29 пациенткам. Данные об оперативном вмешательстве у остальных пациенток остались неизвестными. Адъювантное лечение получили 27 женщин, 12 (77,8 %) из которых – химиотерапию, остальные – гормонотерапию. При исследовании всех пациенток разделили на три группы: в первую вошли 26 женщин с изолированно пораженным КПЛУ; во вторую – 7 с двухсторонним поражением лимфатических узлов, обнаруженных клинически (при физическальном осмотре или во время диагностики); в третьей группе поражение КПЛУ было верифицировано при исследовании сигнальных лимфоузлов (СЛУ). Регионарная лимфодиссекция выполнялась 34 пациенткам, в некоторых случаях (6,3 %) в комбинации с региональной лучевой терапией. Далее 21 (43,8 %) больная получила химиотерапевтическое лечение, 7 (14,6 %) – эндокринотерапию, у 43,8 % адъювантное лечение не описывалось. Данные о последующей выживаемости были доступны только относительно 23 (47,9 %) пациенток. Общая выживаемость составила 82,6 % (95 % ДИ 67,1–98,1), безрецидивная – 65,2 % (95 % ДИ 45,7–84,7). У пациенток первой группы общая выживаемость – 76,9 % (95 % ДИ 54–99,8), при среднем сроке наблюдения 69,2 мес, безрецидивная выживаемость несколько ниже – 46,1 % (95 % ДИ 19–73,2). Во второй группе (n=4) безрецидивная выживаемость составила 100 %. В третьей группе общая выжи- ваемость – 83,4 % (95 % ДИ 53,5–100), при этом данных за рецидив заболевания не получено.
В данном обзоре также отмечено, что части больных после хирургического лечения выполнялась лимфосцинтиграфия. С учетом полученных данных, а также результатов исследования СЛУ предполагается, что помимо стандартного пути лимфооттока в подмышечную и периклавикуляр-ную области дренаж возможен по внутренним грудным сосудам. Это позволяет сделать вывод о том, что поражение КПЛУ – регионарное событие, а не системное заболевание.
Вместе с тем за исследуемый период наблюдения у 18 из 20 пациенток описано одновременное поражение ИПЛУ и КПЛУ, что также подтверждает гипотезу о регионарном метастазировании. Интересен тот факт, что выявление изолированно пораженного КПЛУ происходит значительно раньше (34 мес), чем синхронного ИПЛУ и КПЛУ (по клиническим данным – через 108 мес, при исследовании СЛУ – через 138 мес). Это позволяет думать о том, что КПЛУ может быть скрытым очагом миграции рака in situ, оставшегося во время лечения первичной опухоли.
Несмотря на то, что выживаемость в этот временной период прослежена лишь у небольшого количества пациенток, сравнение с группой метастатического РМЖ показало, что результаты выживаемости при поражении КПЛУ оказывались гораздо лучше и сопоставимы с выживаемостью при локорегионарном рецидиве в ипсилатеральных лимфоузлах (56–84 %) [16]. Для примера, средняя 5-летняя выживаемость у пациенток с метастазами в кости составляла около 23 %, с висцеральными метастазами – 13 % [17]. В связи с этим возникает вопрос о правильности стадирования поражения КПЛУ как отдаленного метастаза.
Аналогичные данные были получены в другом ретроспективном обзоре [18]. В исследование были включены 13 пациенток с поражением КПЛУ (синхронным или метахронным). У 11 женщин определялась инвазивная протоковая карцинома, у 2 – инвазивная дольковая карцинома. Рецептор-положительными оказались 8 пациенток, у 2 наблюдалась гиперэкспрессия Her2/neu, у 4 – трип-лнегативный РМЖ. Поражение КПЛУ происходило синхронно с первичным опухолевым очагом у 5 (38 %) больных, у 5 (38 %) – одновременно с локальным рецидивом, у 1 (8 %) – метахронно с первичным раком, у 2 (15 %) – метахронно с локальным рецидивом. Кроме того, у 3 (23 %) женщин были выявлены отдаленные метастазы (легкие, кости). Диссекция КПЛУ выполнялась в 10 (77 %) случаях, среднее количество удаленных лимфоузлов – 16. Кроме этого, все пациентки получили системную терапию, 5 (38,4 %) – дополнительно гормональную терапию. Впоследствии у 7 женщин – при среднем наблюдении 3,6 года (диапазон 0,3–7,6 года) – появились отдаленные метастазы, 3 – без признаков прогрессирования (медиана наблюдения – 5,8 года).
В исследовании, проведенном W. Wang et al. [19], были изучены истории болезни пациенток, получавших лечение в клиниках Китая с 1999 по 2012 г. Были выделены 28 женщин с поражением КПЛУ, средний возраст – 47 лет. Примерно в половине случаев первичный очаг располагался в центральном и внутренних квадрантах молочной железы. После 29 мес наблюдения у 25 пациенток отмечено прогрессирование заболевания со средней выживаемостью без прогрессирования в течение 10 мес. Помимо КПЛУ, метастатически измененные грудные лимфатические узлы были у 11 (44 %) пациенток. Медианная выживаемость без прогрессирования была больше у пациенток, получавших также лучевую терапию (10 против 22 мес). За период наблюдения 13 пациенток умерли от прогрессирования заболевания. Поражение КПЛУ чаще всего ассоциировалось с агрессивными опухолями (в частности, с триплнегативным РМЖ).
В исследовании B. Morcos et al. [12] при оценке выживаемости 21 пациентки с поражением КПЛУ оказалось, что большинство первичных опухолей – инвазивные протоковые (95 %), низкой степени дифференцировки G3 (81 %) и с лимфо-сосудистой инвазией (81 %). В 90 % их выявление происходило у пациенток с местнораспространенным раком, а также ассоциировалось с триплнегативном типом РМЖ (около 50 %).
Необходимо отметить, что совсем недавно был поставлен вопрос об обязательности выполнения биопсии сторожевого контралатерального подмышечного лимфоузла для оценки поражения при первичном раке молочной железы. Исследование I.M. Lizarraga et al. [3] включило данные о двух
Список литературы Лечение больной раком молочной железы с метастазами в контралатеральные подмышечные лимфатические узлы. Клинический случай и обзор литературы
- Huston T.L., Pressman P.I., Moore A., Vahdat L., Hoda S.A., Kato M., Weinstein D., Tousimis E. The presentation of contralateral axillary lymph node metastases from breast carcinoma: a clinical management dilemma. Breast J. 2007; 13: 158-64. DOI: 10.1111/j.1524-4741.2007.00390.x
- Suami H., Pan W.R., Taylor G.I. Historical review of breast lymphatic. Clin Anatomy. 2009; 22: 531-6. DOI: 10.1002/ca.20812
- Lizarraga I.M., Scott Conner C.E., Muzahir S., Weigel R.J., Graham M.M., Sugg S.L. Management of contralateral axillary sentinel lymph nodes detected on lymphoscintigraphy for breast cancer. Ann Surg Oncol. 2013 Oct; 20(10): 3317-22. DOI: 10.1245/s10434-013-3151-y
- Trifiro G., Ravasi L., Paganelli G. Contralateral or bilateral lymph drainage revealed by breast lymphoscintigraphy. Eur J Nucl Med Mol Imaging. 2008 Feb; 35(2): 225-9. DOI: 10.1007/s00259-007-0595-y
- Haagensen C. The Lymphatics in Cancer. Saunders, USA. 1972. 583.


