Лечение и реабилитация карпального туннельного синдрома у спортсменов и пациентов
Автор: Купитман О.В., Кинзерский С.А., Сумная Д.Б., Кинзерский А.А., Быков Е.В., Григорьева Н.М.
Журнал: Человек. Спорт. Медицина @hsm-susu
Рубрика: Восстановительная и спортивная медицина
Статья в выпуске: 3 т.24, 2024 года.
Бесплатный доступ
Цель: сравнить результаты комплексных биохимических, клинических и инструментальных исследований при различных способах лечения и реабилитации карпального туннельного синдрома (КТС), разработать и внедрить в клиническую практику новый способ неинвазивного лечения КТС у пациентов и спортсменов. Материалы и методы. На базе кафедры спортивной медицины и физической реабилитации НИИ Олимпийского спорта УралГУФК, ГБУЗ ЧОКБ № 1, ООО «СОНАР», ООО «Центр нейромышечной стабилизации» проходили лечение и реабилитацию 115 человек с идиопатическим КТС. Группа здоровых идентичного возраста для контроля биохимических анализов и эластометрических параметров структур карпального канала и срединного нерва состояла из 25 человек. Обследуемые с КТС были поделены на 4 группы: группа А – 25 человек получали медикаментозную терапию; группа Б – 30 человек, в реабилитации которых использовался способ аппаратного лечения; группа В – 30 человек получали УЗИ-контролируемые блокады срединного нерва с ГКС; группа Г – 30 человек, получавших ударно-волновую терапию (УВТ). У всех обследуемых в сыворотке крови определялось содержание продуктов перекисного окисления липидов (ПОЛ) спектрофотометрическим методом. Результаты. Обследование показало, что все методы лечения, кроме медикаментозной терапии, привели к значительному улучшению функциональных показателей. При более значительном исходном повышении (в 1,68–1,75 раза по сравнению с нормой) содержания продуктов ПОЛ в сыворотке крови и наличии отека срединного нерва по данным эластометрии наиболее эффективным является проведение периневрального введения ГКС; при наличии противопоказаний к проведению блокад методом оптимального выбора является проведение УВТ. На ранних стадиях заболевания, при отсутствии выраженного отека срединного нерва и значительного повышения активности ПОЛ эффективно применение аппаратного лечения. Заключение. Определение содержания в сыворотке крови продуктов ПОЛ и проведение УЗИ карпального канала с эластометрией срединного нерва у пациентов с КТС целесообразно использовать при составлении программы реабилитации пациентов с данной патологией. Прогностически неблагоприятными факторами для успешного консервативного лечения и реабилитации являются значительный отек (по данным эластометрии) и сдавление нерва в туннеле, что коррелирует с повышением в сыворотке крови продуктов липопероксидации (r = 0,873–0,905). Длительность ремиссии у обследуемых группы с аппаратным лечением (Патент на изобретение № 2739277) достаточно продолжительна – в среднем 26,73 месяца, максимально – 44 месяца.
Карпальный туннельный синдром (ктс), лечение, реабилитация, неинвазивное устройство, пол (перекисное окисление липидов), эластометрия срединного нерва, узи-контролируемые блокады, ударно-волновая терапия (увт)
Короткий адрес: https://sciup.org/147247660
IDR: 147247660 | УДК: 616.833.35: | DOI: 10.14529/hsm240321
Текст научной статьи Лечение и реабилитация карпального туннельного синдрома у спортсменов и пациентов
О.В. Купитман1,2, , С.А. Кинзерский3, , Д.Б. Сумная1,4, , А.А. Кинзерский1,4, , Е.В. Быков1, ,
Н.М. Григорьева1, , 1 Уральский государственный университет физической культуры, Челябинск, Россия 2 Челябинская областная клиническая больница № 1, Челябинск, Россия 3 Клиника профессора А.Ю. Кинзерского, Челябинск, Россия 4 Центр нейромышечной стабилизации, Челябинск, Россия
Введение. В настоящее время синдром карпального канала или карпальный туннельный синдром (КТС) занимает лидирующее место среди компрессионных невропатий [5, 13]. Минимум раз в неделю в ленте кибер-спортивных новостей появляются сообщения о том, что игроки вынуждены обращаться к врачам или брать перерыв в карьере из-за специфических заболеваний. Большинство из них страдает от синдрома запястного канала – одной из самый распространённых травм среди геймеров [12] (рис. 1).
Синдром запястного канала, или карпальный туннельный синдром, – неврологическое
Рис. 1. Синдром запястного канала [12]
Fig. 1. Carpal tunnel syndrome
заболевание, которое считается профессиональным. В группу риска входят гитаристы, барабанщики, художники, программисты и спортсмены, чей труд связан с монотонной нагрузкой на кисти рук. У программистов такая нагрузка связана с длительным использованием клавиатуры и компьютерной мышью.
Терапевтические подходы к лечению КТС на сегодняшний день четко разработаны, но предметом дискуссий является предпочтительность конкретного метода [14]. К консервативным методам лечения и реабилитации с доказанной эффективностью относятся: лечебная гимнастика, ограничение нагрузки на сустав, ношение ортеза в ночное время, пара-невральное введение глюкокортикостероидов в карпальный канал [8, 14].
Метод УВТ достаточно эффективно стал использоваться при дегенеративно-дистрофических заболеваниях мягких околосуставных тканей и связочного аппарата, периферической нервной системы [10].
В действующих клинических рекомендациях «Мононевропатии» от 2022 г. иммобилизация лучезапястного сустава рекомендуется как лечение первой линии при КТС легкой и средней степени тяжести (уровень убедительности рекомендаций А, уровень достоверности доказательств – 1). Тем не менее преимущества какого-то дизайна иммобилизирующих устройств не доказано. Однако ношение фиксирующего ортеза на запястье не приводит к декомпрессии карпального канала. В большинстве случаев шинирование рекомендуется в ночное время, преимущество постоянного ношения ортеза перед ночным шинирование не доказано [17, 20]. Четких указаний на продолжительность ношения ортеза в исследованиях нет, в Кокрановском обзоре за 2012 год есть указания на ношение в течение 3 месяцев. Понятно, что ношение ортеза длительный период времени вызывает дискомфорт у пациентов и снижает приверженность к терапии. Частично решить проблему предлагают индивидуально изготовленным ортезом [16, 18].
Относительно новым методом лечения карпального туннельного синдрома является кинезиологическое тейпирование [15]. Кине-зиотейп стимулирует механорецепторы кожи, изменяет конфигурацию межфасциальных пространств и может уменьшать внутритканевое давление и мягко фиксировать лучезапястный сустав [2, 6]. Тем не менее кинезиотей-пирование оказывает декомпрессирующее воздействие на фасциальные структуры всей поверхности предплечья, но не позволяет создать локальную декомпрессию срединного нерва. У пациентов с начальной стадией КТС при минимальных клинических проявлениях и отсутствии изменений по ЭНМГ показана эффективность кинейзиотейпирования в монотерапии [9].
Считается, что консервативная терапия КТС может быть эффективной в 75 % случаев, ее применение необходимо в том числе и перед тем как принять решение об оперативном лечении [1, 4, 19].
Преимущество хирургического лечения над ортезированием при лечении КТС было выявлено в Кокрановском обзоре, опубликованном еще в 2008 г., но нет доказательства о большей эффективности хирургического метода над ортезированием при более легкой степени заболевания [14].
Учитывая вышесказанное, становится по- нятно, что консервативные методы лечения занимают значительное место в терапии КТС.
На сегодняшний день среди специалистов, занимающихся туннельными невропатиями, не разработан четкий алгоритм выбора эффективной реабилитационной программы для той или иной группы пациентов с КТС, а также пока нет консенсуса в отношении сроков и объема оперативного лечения, показаний к нему, планов послеоперационных реабилитационных мероприятий [3, 7, 13].
Цель исследования: сравнить результаты комплексных биохимических, клинических и инструментальных исследований при различных способах лечения и реабилитации карпального туннельного синдрома, разработать и внедрить в клиническую практику новый способ неинвазивного лечения карпального туннельного синдрома (КТС) у пациентов и спортсменов.
Материалы и методы. Настоящее исследование выполнено на базе НИИ Олимпийского спорта Уральского государственного университета физической культуры, ГБУЗ ЧОКБ № 1, ООО «СОНАР», ООО «Центр нейромышечной стабилизации». Наблюдение и лечение спортсменов и пациентов осуществлялось с 2015 по 2024 г. В исследование включались 115 человек с односторонним или двусторонним идиопатическим КТС, со 2-й стадией заболевания (умеренным поражением срединного нерва) в соответствии с международной классификацией Mackinnon, Dellon, 1988, с дополнениями А.И. Крупаткина и 25 человек здоровых идентичного возраста для контроля биохимических анализов и эласто-метрических параметров структур карпального канала и срединного нерва. Всем обследуемым проводился забор крови для оценки системы ПОЛ-АОС. Определение продуктов перекисного окисления липидов производилось спектрофотометрическим методом.
Обследуемые были подразделены на группы.
Группа контроля – 25 человек здоровых, не принимавших участия в реабилитации, обследовалась для определения параметров нормы биохимических показателей и ультразвуковых исследований эластометрических параметров структур карпального канала и срединного нерва.
Обследуемые с идиопатическим КТС, проходящие реабилитацию, были поделены на 4 группы:
Группа А – 25 обследуемых (10 спортсменов и 15 пациентов), которые получали только медикаментозную терапию.
Группа Б – 30 человек (16 спортсменов и 14 пациентов), в реабилитации которых применялся способ неинвазивного лечения карпального туннельного синдрома (Патент на изобретение № 2739277).
Группа В – 30 человек (14 спортсменов и 16 пациентов), получавших в комплексе лечения и реабилитации УЗИ-контролируемые блокады.
Группа Г – 30 пациентов (15 пациентов и 15 спортсменов), получавших в комплексе лечения и реабилитации УВТ на область карпального канала.
Критерии включения в исследование: возраст от 20 до 40 лет; соответствие клинических симптомов диагностическим критериям Американской академии неврологии; по результатам ЭНМГ необходимо снижение СРВ на дистальном участке срединного нерва по его сенсорным волокнам ниже 50 м/с, разница более 10 м/с между СРВ по сенсорным волокнам на дистальном участке срединного и локтевого нервов; нормальная сила мышц по результатам мануального тестирования и отсутствие гипотрофии мышц тенора по результатам осмотра: мышцы, противопоставляющей большой палец, короткого сгибателя большого пальца, короткая мышца, отводящая большой палец, первая и вторая червеобразные мышцы.
Критериями исключения из исследования являлись: наличие клинических данных об иной причине имеющихся у обследованных сенсорных симптомов: поражение срединного нерва проксимальнее или дистальнее запястного канала, невропатия локтевого или лучевого нервов, плечевая плексопатия, шейная радикулопатия, полиневропатия, поражение спинного или головного мозга; отказ от предлагаемого лечения или динамического наблюдения; наличие соматической патологии, способной вызвать вторичный карпальный туннельный синдром, а также способной повлиять на биохимический статус обследуемых (обострения хронических заболеваний, острые воспалительные заболевания и вирусные инфекции, наличие онкологических заболеваний); наличие противопоказаний для выполнения ЭНМГ (нарушение целостности кожных покровов и др.), противопоказаний для выполнения кинезиотейпирования и орте- зирования (повреждение кожных покровов, индивидуальная непереносимость материалов, применяемых для тейпирования, аллергические реакции), для УЗИ, УВТ. Все обследуемые были проинформированы о процедуре исследования и используемых методах диагностики и лечения, после чего от всех участников получено информированное согласие на участие в исследовании и использование полученных данных в научных целях.
Исследование являлось открытым, рандомизированным, контролируемым, проспективным. Группы обследуемых формировались адаптивной рандомизацией, группы были однородны по большинству признаков (пол, возраст, диагноз, стадия заболевания, степень неврологического дефицита).
В обязательном порядке обследуемые были информированы о факторах риска развития заболевания, давались рекомендации по коррекции повседневной, спортивной и трудовой деятельности. Также обследуемые информировались о существующих методах консервативного и оперативного лечения.
Контрольные осмотры проводились через 2 недели, через 1 месяц, через 3 месяца от начала терапии, забор крови, кроме того, осуществлялся еще и через 1 год.
Обследуемые Группы А получали медикаментозную терапию (препараты тиоктовой кислоты, ипидакрин, при наличии невропатического болевого синдрома габапентин или амитриптилин в рекомендованных в инструкции к препаратам дозировках).
Обследуемые Группы Б реабилитацию проходили с использованием авторского способа неинвазивной реабилитации карпального туннельного синдрома (Патент на изобретение № 2739277), что крайне важно в условиях ужесточения в настоящее время антидопингового контроля.
В основу разработки способа неинвазивного лечения карпального туннельного синдрома легло наличие доказанной э ффективности у кинейзиотейпирования д л я лечения пациентов с легкой степенью тяжести КТС и ортезирования предпле ч ья, которое требует д л ительного периода времени.
В связи с вышеизложенным у нас возникло предположение о то м , что совмещение ки-нейзиотейпирования и ортезирования может повысить эффективность лечения, уменьшить продолжительность ношения ортеза, что повысит приверженность пациентов к терапии. Н а ми был разработан способ неи н вазивного лечения карпального туннельного синдрома, который позволил совместить методики орте-з и рования, кенизиотейпирования, физических у п ражнений с непродолжительным периодом ношения аппарата. Сочетание 2 м е тодик позволило расширить объем карпального канала. На этапе создания устройства с помощью прототипа аппарата, выпол н енного из пластика, п р и проведении МРТ карпального канала удалось зафиксировать расширение к а рпального канала на 2 мм (размеры карпального канала до н а ложения аппарата составили 22,6×10,5 мм, после наложения устрой с тва – 22,8×12,5 мм).
Устройство накладывалось на 5–7 дней (рис. 2). Во время ношения устройства обслед у емый выполнял 10 раз в день упражнения в виде сгибания и разгибания паль ц ев кисти с повторением действия д о 100 раз в день.
Обследуемые Группы В получ а ли в комплексе лечения и реаби л итации УЗИ-контро-лируемые блокады с г л юкокорти к оидами с гидропрепаровкой срединного нерва на уровне карпального канала смесью 2 мл 2,5%-ного лидокаина + 1мг дипрос п ана. Применялось от 1 до 3 блокад с промежутками 7–14 дней.
Обследуемые Группы Г получ а ли в комплексе лечения УВТ на область карпального
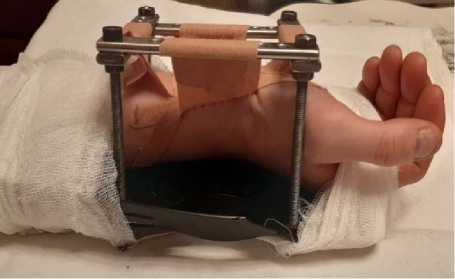
Рис. 2. Внешний вид устройства для неинвазивного лечения КТС Fig. 2. The device for non-invasive CTS treatment

канала. Режим процедур: 2.2 бар 6000 имп. радиальная на ладонную поверхность запястья, кисти и мышцы предплечья с обеих сторон 5 раз с интервалом 1 раз в неделю. Анкетирование обследуемых проводилось по валидизированной русскоязычной версии Бостонского опросника (BCTQ).
Для контроля эффективности реабилитации мы использовали способ оценки эффективности консервативного лечения синдрома карпального канала, разработанный А.А. Кин-зерским, С.А. Кинзерским, А.Ю. Кинзерским с соавт. (патент на изобретение RU 2601659) – УЗИ в В-режиме и режиме эластографии сдвиговой волны [11].
Оценивалась однородность изображения, а также показатель Emean срединного нерва и периневральных структур оценивались до лечения и в динамике. Если показатель Emean опускался ниже 200 кПа (–1,0 SD от средней величины), то лечение считалось эффективным и оно прекращалось. Если же Emean остался больше 200 кПа, то консервативное лечение и реабилитация продолжались [11].
При отсутствии улучшения или нарастании симптомов на фоне консервативной терапии пациент исключался из исследования с рекомендацией проведения оперативного вмешательства.
Статистическую обработку полученных данных выполняли с использованием пакета прикладных статистических программ SPSS, версия 21. Сравнение проводили с использованием U-критерия Манна – Уитни. Данные представлены в виде медианы, 2,5–97,5 процентилей, минимального (Min) и максимального (Max) значений. Взаимосвязь признаков изучалась корреляционным анализом по Пирсону(г). ROC-анализ (Receiver Operating Characteristic analysis – анализ функциональных характеристик приёмника).
Различия оценивали как статистически значимые, при р < 0,05; различия расценивали как тенденцию к достоверному при 0,05 < р < 0,1. Произведен расчет показателей информативности (чувствительность, специфичность, точность) по стандартным формулам с использованием клинических данных в сочетании с данными электромиографии в качестве референтного метода.
Результаты исследований и их обсуждение. Обследуемые всех групп были сопоставимы по полу и возрасту. Средний возраст обследуемых сопоставим во всех группах и так же, как в общей популяции, отмечается страдание КТС пациентов трудоспособного возраста. Достоверных различий между электрофизиологическими критериями у обследуемых выявлено не было (p > 0,05). Данный метод использовался в первую очередь для подтверждения диагноза КТС.
В группе А SSS до лечения – 2,10 ± 0,11б; в группе Б SSS до лечения – 2,35 ± 0,12б, в группе В – 2,38 ± 0,12б, в группе Г – 2,33 ± ± 0,12б (рис. 3).
Таким образом, по шкале BCTQ выраженность симптомов на момент начала реабилитации была средней и достоверно не отли-
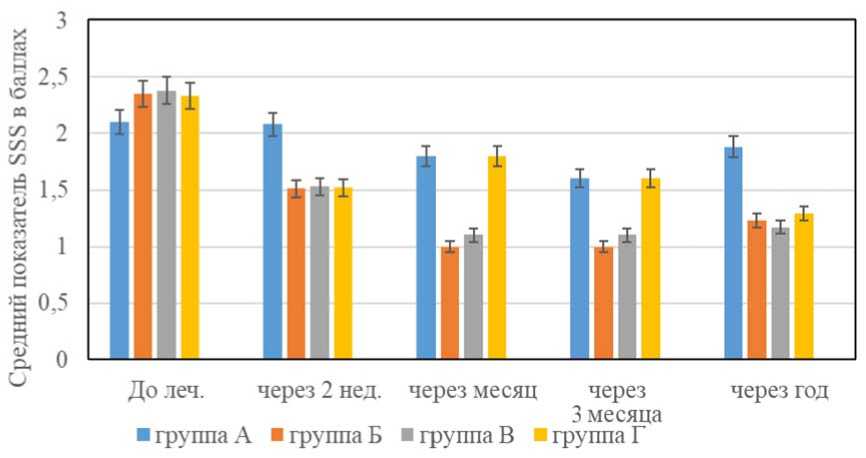
Рис. 3. Показатели SSS до и после реабилитации у обследованных
Fig. 3. SSS indicators before and after rehabilitation among participants
чалась (p > 0,05) в группах Б, В и Г. В группе А выраженность симптомов была менее значимой, хотя достоверных отличий от групп Б, В и Г также не имела (p > 0,05). Несмотря на то, что исходно в группы Б, В и Г попали обследуемые с более выраженной симптоматикой по Бостонской шкале и более продолжительной длительностью заболевания, у этих групп удалось получить клинически значимый эффект уже через 2 недели от начала терапии. Клинически значимым улучшением мы считали редукцию симптомов после лечения не менее чем на 0,8 по шкале SSS. У обследуемых группы медикаментозной терапии получить клинически значимого эффекта от лечения через 2 недели не удалось. Полный регресс всех симптомов произошел в группах Б, В и Г и сохранялся через 3 месяца, даже к году у обследуемых данных групп показатели тяжести симптомов и функциональной активности сохранялись ниже значений до реабилитации, что свидетельствует о стойком положительном эффекте реабилитации. Длительность ремиссии у обследуемых группы с аппаратным лечением достаточно продолжительна, в среднем 26,73 месяца, максимально – 44 месяца (по данным телефонного интервью). При сравнительном анализе средних показателей по шкале тяжести симптомов (SSS) Бостонского опросника BCTQ (см. рис. 3), мы видим, что к году после реабилитации тяжесть симптомов достоверно р < 0,05 уменьшилась в группах Б, В и Г в 1,91; 2,03 и 1,81 раза соответственно. В группе А к году после начала реабилитации показатели SSS практически возвращались к исходным значениям (не имели достоверных различий со значениями до реабилитации).
При сравнительном анализе средних показателей функциональных нарушений кисти (FSS) Бостонского опросника BCTQ (рис. 4) мы видим, что до лечения показатели были ниже в группе с медикаментозной терапией. FSS до лечения в группе А– 1,77 ± 0,09. FSS до лечения в группах Б, В и Г – 2,0 ± 0,1; 2,1 ± 0,11 и 2,0 ± 0,09 соответственно.
К году после реабилитации показатели FSS достоверно р < 0,05 уменьшилась в группах Б, В и Г в 1,48; 1,78 и 1,56 раза соответственно. В группе А к году после начала реабилитации показатели FSS не имели достоверных различий со значениями до реабилитации.
На рис. 5 и 6 представлены результаты исследования динамики содержания диеновых конъюгатов (первичных продуктов ПОЛ), а также кетодиенов и сопряженных триенов (вторичных продуктов ПОЛ) в группах обследуемых.
Наиболее значительно снижение содержания первичных и вторичных продуктов ПОЛ под влиянием проводимых реабилитационных мероприятий отмечено в группах В и Г, получавших в реабилитации УЗИ-контро-лируемое периневральное введение ГКС и УВТ.
В данных группах были пациенты с наиболее выраженными изменениями срединного
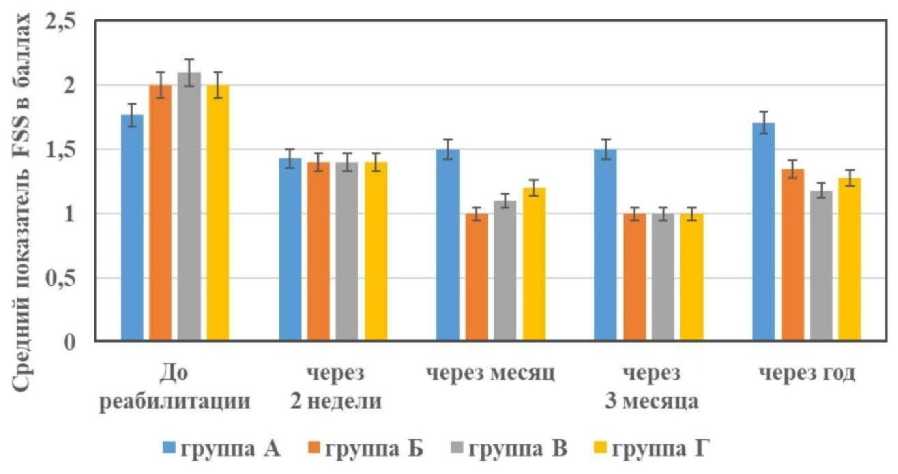
Рис. 4. Показатели FSS до и после реабилитации в группах Fig. 4. FSS indicators before and after rehabilitation in the groups
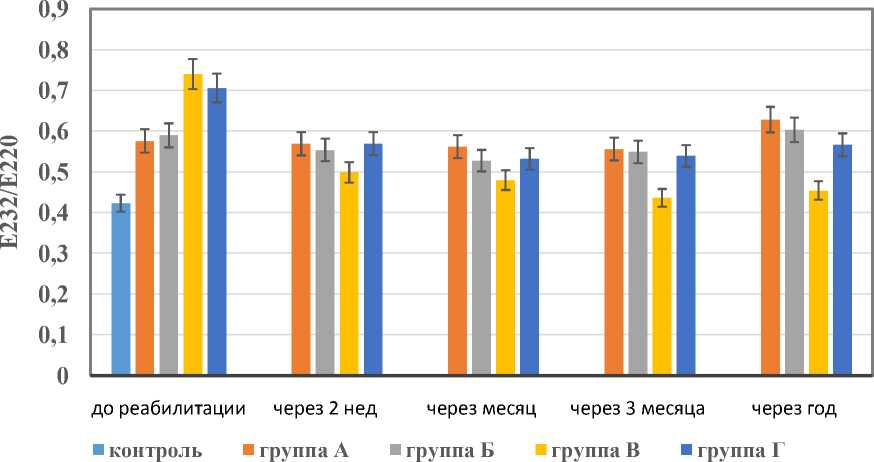
Рис. 5. Содержание первичных продуктов ПОЛ в сыворотке крови у пациентов обследуемых групп Fig. 5. Content of primary serum lipid peroxidation products in patients
0,8
0,7
0,6
0,5
ы oo
0,4
ы
0,3
0,2
0,1
illlllllll
до через 2 нед через месяц через 3 месяца через год реабилитации контроль группа А группа Б группа В группа Г
Рис. 6. Содержание вторичных продуктов ПОЛ в сыворотке крови в обследуемых группах Fig. 6. Content of secondary serum lipid peroxidation products in patients нерва на УЗИ (с явлениями отека нерва) и наиболее значительными повышениями содержания в сыворотке крови продуктов ПОЛ.
Содержание шиффовых оснований (конечных продуктов ПОЛ) в сыворотке крови у обследованных всех групп в процессе реабилитации достоверных изменений не имело.
Значимых клинических различий во всех группах до реабилитации не имелось, что еще раз свидетельствует в пользу необходимости проведения всем обследуемым с КТС УЗИ и биохимических исследований, так как при данной патологии имеет место синдром клинической диссоциации - незначительные клинические симптомы могут быть при значительном отеке и сдавлении нерва в туннеле. Но эти клинические изменения могут вводить врача в заблуждение, а несвоевременная коррекция реабилитационных мероприятий может привести к отсутствию возможности осуществить консервативное лечение и реабилитацию и перейти к оперативному лече- нию из-за упущенных сроков для эффективного проведения лечебных блокад и УВТ, позволяющих избежать оперативного лечения при своевременном их применении.
При более значительном исходном повышении (в 1,68–1,75 раза по сравнению с нормой) содержания продуктов ПОЛ в сыворотке крови у пациентов с карпальным синдромом и наличии отека срединного нерва по данным эластометрии при проведении УЗИ карпального канала наиболее эффективным является проведение периневрального введения ГКС, при наличии противопоказаний к проведению блокад методом оптимального выбора является проведение УВТ.
На ранних стадиях заболевания при отсутствии выраженного отека срединного нерва в запястном канале и повышении содержания липопероксидов не более чем в 1,5 раза по сравнению с нормой эффективно применение аппаратного лечения.
Заключение. При сравнении результатов комплексных биохимических, клинических и инструментальных исследований при различных способах лечения и реабилитации карпального туннельного синдрома доказано, что у пациентов может иметь место синдром клинической диссоциации в виде невыраженной клинической картины на фоне выраженного отека нерва и значительного повышения содержания первичных и вторичных продуктов ПОЛ в сыворотке крови. Данные пациенты имеют хорошие ближайшие и отдаленные результаты лечения и реабилитации при незамедлительном назначении УЗИ-контролируемого периневрального введения ГКС, при наличии противопоказаний к проведению блокад методом оптимального выбора является проведение УВТ.
Прогностически неблагоприятными факторами для успешного консервативного лечения и реабилитации являются значительный отек (по данным эластометрии) и сдавление нерва в туннеле, что коррелирует с повышением в сыворотке крови продуктов липопероксида-ции (r = 0,873–0,905).
Использование УВТ или способа неинвазивного лечения карпального туннельного синдрома позволяет получить хорошие результаты уже через 2 недели от начала терапии, эффект нарастает к 1-му месяцу и сохраняется до 3 месяцев у всех пациентов этих групп.
Эффективность периневрального введения ГКС при карпальном туннельном синдроме подтверждается многочисленными исследованиями. Данный метод позволяет быстро и эффективно бороться с отеком нерва в туннеле, со значительным повышением содержания липопероксидов в сыворотке крови, но он является инвазивным и его применение имеет ограничение у пациентов с сахарным диабетом, гипертонической болезнью.
Метод УВТ и способ неинвазивного лечения карпального туннельного синдрома лишены этих недостатков, что позволяет включать их в схемы реабилитации пациентов с КТС у данных групп пациентов.
На ранних стадиях заболевания и при отсутствии выраженного отека и асептического воспаления в запястном канале со значительным повышением активности ПОЛ эффективно применение аппаратного лечения, позволяющего в данном случае избежать применения периневрального введения ГКС и физиолечения, которые могут быть противопоказаны соматически отягощенным пациентам.
Список литературы Лечение и реабилитация карпального туннельного синдрома у спортсменов и пациентов
- Байтингер, А.В. Синдром карпального канала: современное состояние вопроса / А.В. Байтингер, Д.В. Черданцев // Вопросы реконструктивной и пластической хирургии. – 2018. – Т. 65 (2). – С. 12–18.
- Валидация Бостонского опросника по оценке карпального туннельного синдрома (Boston Carpal Tunnel Questionnaire) в России / Д.Г. Юсупова, Н.А. Супонева, А.А. Зимин и др. // Нервно-мышечные болезни. – 2018. – № 8 (1). – С. 38–45.
- Гильвег, А.С. Оценка эффективности хирургической декомпрессии срединного нерва при синдроме запястного канала у пациентов с различными стадиями заболевания / А.С. Гильвег, В.А. Перфенов, Г.Ю. Евзиков // Мед. алфавит. – 2018. – Т. 1, № 1 (338). – С. 61.
- Карпальный туннельный синдром: клиника, диагностика и современные подходы к лечению (краткий обзор) / А.В. Яриков, А.В. Туткин, А.А. Бояршинов и др. // Мед. альманах. – 2020. – № 3 (64). – С. 27–35.
- Карпальный туннельный синдром: основные вопросы диагностики, лечения и реабилитации (обзор) / Н.А. Супонева, М.А. Пирадова, Е.В. Гнедовская и др. // Ульянов. мед.-биол. журнал. – 2016. – № 2. – С. 91–97.
- Карпальный туннельный синдром: оценка необходимости реабилитационно-восстановительного лечения после эндоскопической декомпрессии срединного нерва в позднем и отдаленном послеоперационном периодах / Д.Г. Юсупова, А.А. Зимин, Д.А. Гри-шина и др. // Нервно-мышечные болезни. – 2019. – Т. 9, № 4. – С. 34–43.
- Киселев, В.Н. Использование локального введения кортекостероидов при лечении синдрома запястного канала / В.Н. Киселев, Н.Ю. Александров, М.М. Короткевич // Нервно-мышечные болезни. – 2018. – Т. 8. – С. 10–19.
- Междисциплинарный консенсус по локальному применению глюкокортикостероидов в реальной клинической практике / И.Н. Самарцев, С.А. Живолупов, Е.А. Трофимов и др. // Нервные болезни. – 2021. – № 4. – С. 74–84.
- Михайлюк, И.Г. Эффективность кинезиотейпирования у пациентов с начальной стадией карпального канала / И.Г. Михайлюк Н.Н., Спирина, Е.В. Сальникова // Нервно-мышечные болезни. – 2016. – Т. 6, № 3. – С. 28–35.
- Могилевич, В.В. Метод ударно-волновой терапии в практике врача-физиотерапевта / В.В. Могилевич, Н.М. Хренина // Военная медицина. – 2023. – № 1. – С. 59–65.
- Патент. Способ оценки эффективности консервативного лечения синдрома карпального канала / А.А. Кинзерский, С.А. Кинзерский, А.Ю. Кинзерский и др. – Бюл. 2016.11.10. – https://yandex.ru/patents/doc/RU2601659C1_20161110.
- Синдром запястного канала в киберспорте, профилактика, лечение – Чемпионат (championat.com). – https://www.championat.com/cybersport/article-3709551-sindrom-zapjastnogo-kanala-v-kibersporte-profilaktika-lechenie.html.
- Современные аспекты диагностики компрессионной невропатии срединного нерва в карпальном канале / А.А. Фоминых, Н.Б. Котов, А.Д. Лисенкова, А.О. Бессарабова // Вестник Балтийского федер. ун-та им. И. Канта. – 2019. – № 3. – С. 82–95.
- Эффективность локальной инъекционной терапии и ортезирования лучезапястного сустава при идиопатическом карпальном туннельном синдроме средней степени тяжести: результаты рандомизированного клинического исследования / Д.А. Грозова, Н.А. Супонева, Д.А. Гришина и др. // Нервно-мышечные болезни. – 2022. – Т. 12, № 2. – С. 19–27.
- Association between work-related biomechanical risk factors and the occurrence of carpal tunnel syndrome: an overview of systematic reviews and a meta-analysis of current research / Agnessa Kozak, Grita Schedlbauer, Tanja Wirth et al. , Ulrike Euler, Claudia Westermann, Albert Nienhaus // BMC Musculoskeletal Disorders. – 2015. – Vol. 16. – Р. 231. DOI: 10.1186/s12891-015-0685-0
- Chronic nerve compression – an experimental model in the rat / S.E Mackinnon, A.L. Dellon, A.R. Hudson, D.A. Hunter // Ann. Plast. Surg. – 1984. – Vol. 13. – Р. 112–120. DOI: 10.1097/00000637-198408000-00004
- Comparison of two manual therapy carpal tunnel syndrome: A randomized clinical trial / G.A. Talebi, P. Saadat, Y. Javadian, M. Taghipour // Caspian J. intern. Med. – 2020. – Vol. 11 (2). – Р. 163–170. DOI: 10.22088 /cjim.11.2.163
- Luchetti, D. Carpal tunnel syndrome / R. Luchetti, P. Amadio. – Berlin: Springer, 2007. – Р. 405.
- Sayegh, E.T. Open versus plinting in carpal tunnel syndrome endoscopic carpal tunnel release: a meta-analysis of randomized controlled trial / E.T. Sayegh, R.J. Strauch // Clin. Orthop. Relat. Res. – 2015. – Vol. 473 (3). – P. 1120–1132.
- Wang, K. A. Sonographic Median Nerve Change after Steroid Injection for Carpal Tunnel Syndrome / K. A. Wang, Y. Huang, J. Chiu // Muscle Nerve. – 2018. – Vol. 58 (3). – P. 402–406.


