Лечение пациента с диссеминированной герминогенной опухолью яичка на фоне терминальной хронической болезни почек, требующей проведения гемодиализа
Автор: Абляметова А.С., Зоринова А.В., Летучих А.Н., Исраелян Э.Р., Царева А.С., Румянцев А.А.
Журнал: Злокачественные опухоли @malignanttumors
Рубрика: Клинические случаи
Статья в выпуске: 3 т.14, 2024 года.
Бесплатный доступ
Среди онкологических пациентов существует когорта больных с терминальной хронической болезнью почек (ХБП), развившейся вследствие различных причин и требующей назначения гемодиализа. Проведение противоопухолевого лекарственного лечения при данном сопутствующем заболевании возможно, однако требует выбора наиболее оптимальных модифицированных режимов химиотерапии (ХТ) с целью достижения максимальной эффективности и минимизации токсичности лечения. В данном клиническом случае мы описываем наш лечебный подход для пациента, находящегося на гемодиализе, с метастатической несеминомной герминогенной опухолью (ГО) яичка неблагоприятного прогноза по классификации International Germ Cell Cancer Collaborative Group (IGCCCG). Нами был проведен анализ литературных данных, отражающих применение различных лекарственных препаратов и режимов ХТ, используемых для лечения ГО у пациентов с ХБП.
Герминогенная опухоль, химиотерапия, хроническая болезнь почек, гемодиализ
Короткий адрес: https://sciup.org/140310096
IDR: 140310096 | DOI: 10.18027/2224-5057-2024-019
Текст научной статьи Лечение пациента с диссеминированной герминогенной опухолью яичка на фоне терминальной хронической болезни почек, требующей проведения гемодиализа
ГО являются сравнительно редкой патологией, составляя около 1 % всех злокачественных новообразований, однако это наиболее частые опухоли у мужчин в возрасте 20–35 лет. Цисплатин-содержащая ХТ для пациентов с данным заболеванием позволяет достичь высокой частоты объективных ответов, что ассоциировано с улучшением отдаленных результатов лечения. Таким образом, ХТ является неотъемлемым компонентом в лечении ГО, одним из важных аспектов эффективности которой является соблюдение адекватной дозоинтенсивности несмотря на токсичность проводимой терапии [4,5]. Для других видов злокачественных новообразований стратегии по минимизации нежелательных явлений (НЯ) ХТ могут включать как отсрочки в лечении, так и снижение доз препаратов, однако эти варианты не приемлемы для пациентов с агрессивно протекающими ГО, так как могут вызвать резистентность к проводимой терапии [6].
Стандартным подходом для пациентов неблагоприятного прогноза по классификации IGCCCG является проведение 4 курсов ХТ в режиме ВЕР (блеомицин, этопозид, цисплатин), позволяющих обеспечить 5-летнюю общую выживаемость равную 67% [7]. При противопоказаниях к назначению блеомицина возможно проведение 4 курсов ХТ в режимах PEI (цисплатин, этопозид, ифосфамид) или TIP (паклитаксел, ифосфамид, цисплатин). При схожей эффективности обе комбинации являются более миело-токсичными [7,8].
Таким образом, стандартный подход к лекарственному лечению метастатических ГО хорошо известен. Однако существует когорта пациентов с ХБП, развившейся вследствие различных причин (сопутствующая патология, нефриты, лекарственное повреждение почек, нарушение физиологического пассажа мочи из-за обструкции мочевых путей), которым требуется проведение ХТ по поводу ГО. Проведение заместительной почечной терапии в виде гемодиализа позволяет преодолеть у данных пациентов ограничения к назначению цисплатина, связанные со сниженной скоростью клубочковой фильтрации, однако у них повышается риск развития гематологических НЯ. Ограниченные и противоречивые данные о концентрациях химиотерапевтических препаратов и их клиренсе в таких ситуациях затрудняют принятие решения в выборе оптимального режима ХТ, изменении дозы того или иного препарата. В исследовании CANDY, изучавшем проведение ХТу пациентов с почечной недостаточностью, получающих гемодиализ, продемонстрировано, что у 44% пациентов развилась токсичность вследствие недостаточной коррекции дозы химиопрепаратов ввиду отсутствия единых рекомендаций для данной группы пациентов [9].
КЛИНИЧЕСКИЙ СЛУЧАЙ
Пациенту Н., 46 лет, в марте 2018 года был установлен диагноз «Гранулематоз Вегенера с поражением почек (гломерулонефрит) и легких (пульмонит)», других проявлений заболевания отмечено не было. Получал специфическую терапию системными глюкокортикостероидами (ГКС) и ритуксимабом. С мая 2019 года находился на программном гемодиализе по поводу быстропрогрессирующего гломерулонефрита, ХБП 5-й стадии. При обследовании в рамках подготовки к трансплантации почки была выявлена опухоль правого яичка, метастазы в забрюшинных лимфатических узлах, легких. Пациент обследован:
-
• Ультразвуковое исследование (УЗИ) мошонки от 30.06.2020: в правом яичке образование до 41 мм;
-
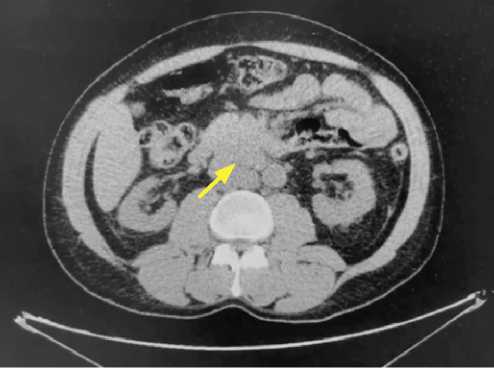
• Компьютерная томография (КТ) органов грудной клетки, органов брюшной полости, органов малого таза от 14.07.2020: в легких множественные метастазы до 10 мм; увеличенные забрюшинные лимфатические узлы (парааортальные, паракавальные) до 40 мм, подвздошный лимфатический узел справа до 14 мм (рис. 1);
-
• Концентрация опухолевых маркеров от 15.07.2020: альфа-фетопротеин (АФП) — 1062,38 нг/мл, бета-субъединица хорионического гонадотропина человека (бета-ХГЧ) — 30075 мМе / мл.
По месту жительства на первом этапе была выполнена орхофуникулэктомия (ОФЭ) справа 22.07.2020. По данным гистологического исследования образование представлено ГО смешанного строения, состоящей из эмбриональной карциномы (75 %), опухоли желточного мешка (10%), постпубертатной зрелой тератомы (10%), элементов трофобласта (5%), с лимфоваскулярной инвазией, с распространением в семенной канатик. При этом при контроле концентрации опухолевых маркеров от 14.08.2020 был выявлен рост концентрации АФП до 1853 нг/мл, бета-ХГЧ до 126165 мМе/мл, активности лактатдегидрогеназы (ЛДГ) до 1560 Ед /л (верхняя граница нормы 450 Ед/ л). Таким образом, пациенту был установлен диагноз — несемином-ная ГО правого яичка рТ3N2M1aS3 (IIIC стадия), неблагоприятный прогноз по IGCCCG.
Для дальнейшего лечения пациент обратился в НМИЦ онкологии имени Н.Н. Блохина. На момент обращения состояние пациента оценено как удовлетворительное, жалобы на боли в поясничной области и в паховой об-
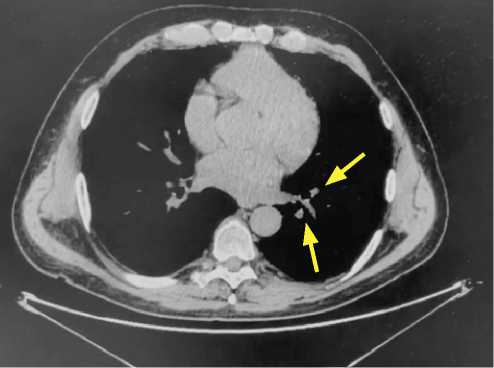
Рисунок 1. КТ перед началом лечения
Figure 1: CT scan before the start of treatment
ласти справа. По данным лабораторных исследований от августа 2020 года: анемия 2-й степени (гемоглобин 81 г/л), ХБП 5-й стадии (креатинин — 785 мкмоль/л, СКФ (по формуле СKD-EPI) — 6 мл/мин / 1,73 м 2 ).
По данным магнитно-резонансной томографии головного мозга от 15.08.2020: без патологии.
Учитывая неблагоприятный прогноз по IGCCCG, высокий уровень бета-ХГЧ, сопутствующую патологию (ХБП 5-й стадии), требующую проведения гемодиализа, было принято решение провести 1-й курс ХТ в стабилизационном режиме ЕР: этопозид 100 мг/м 2 в/в капельно + цисплатин 20 мг/м 2 в/в капельно в дни 1–3 на фоне проведения гемодиализа через час после окончания ХТ.
С 20.08.2020 по 24.08.2020 проведен 1 курс в режиме ЕР с последующими сеансами гемодиализа и с поддержкой гранулоцитарным колониестимулирующим фактором (Г-КСФ). Гемодиализ проводился на аппарате 4008S на диализаторе Fх100 с использованием бикарбонатного картриджа Bi-Bag (бикарбонатный сухой гранулированный 8,4 % концентрат). В качестве сосудистого доступа использовали артерио-венозную фистулу нижней трети левого предплечья, обеспечивающую скорость кровотока 240 мл/мин, общая антикоагуляция — 3500 Ед гепарина.
В межкурсовом интервале после 1 курса отмечено развитие гематологической токсичности (анемия 3 степени, нейтропения 3 степени), потребовавшей гемотрансфузии 2 доз эритроцитной взвеси, клинически отмечена положительная динамика в виде уменьшения болевого синдрома в поясничной области.
Пациент обсужден на онкологическом консилиуме, учитывая невозможность использования блеомицина ввиду высокого риска развития пульмональной токсичности в данной клинической ситуации (блеомицин не подвергается гемодиализу, возраст пациента старше 40 лет, метастатическое поражение легких, риск развития пульмонита на фоне гранулематоза Вегенера), принято решение о продолжении лечения в режиме TIP: пакли- таксел 120 мг/м2 в/в капельно в день 1 и 2 + ифосфамид 1500 мг/м2 в / в капельно (+ месна 100 % дозы ифосф-амида в/в) во 2–5 дни + цисплатин 25 мг/м2 в/в капельно во 2–5 дни, с 6 по 10 день — первичная профилактика фебрильной нейтропении (ФН) Г-КСФ.
С 04.09.2020 по 10.09.2020 проведен 1 курс в режиме TIP (суммарно 2 курс). Гемодиализ проводился в дни введения цисплатина через 1 час после окончания ХТ. Межкурсовой интервал осложнился развитием тромбоцитопении 4 степени с геморрагическим синдромом в виде носовых кровотечений, ФН 4 степени, сепсиса, что потребовало массивной сопроводительной терапии в условиях отделения реанимации и интенсивной терапии.
Учитывая дозолимитирующую токсичность проводимого лечения, было принято решение о редукции дозы паклитаксела до 175 мг/м 2 в день 1 и отмене 5 дня ХТ со 2 курса, что соответствует 25% редукции дозы цисплатина и ифосфамида. С 01.10.2020 по 05.10.2020 проведен 2 курс ХТ в режиме TIP с редукцией доз (суммарно 3 курс). После 2 курса ХТ было отмечено развитие анемии 2 степени.
С 20.10.2020 по 25.10.2020 проведен 3 курс ХТ в модифицированном режиме TIP (суммарно 4 курс). Межкурсовой интервал осложнился развитием артралгии 2 степени, полинейропатии 1 степени, анемии 2 степени, тромбоцитопении 3 степени, что привело к задержке очередного курса ХТ на 6 суток. Принимая во внимание гематологическую токсичность проводимого лечения, приведшую к задержке лечения, было решено провести 4 курс в режиме TIP с редукцией дозы ифосфамида до 1200 мг/м 2 в дни 2–4. С 17.11.2020 по 20.11.2020 проведен 4 курс ХТ 1 линии, без осложнений. Запланированное противоопухолевое лекарственное лечение было завершено в полном объеме.
Динамика опухолевых маркеров на фоне проведения ХТ 1-й линии представлена на графике 1.
По данным КТ через 3 недели после окончания ХТ отмечено значительное уменьшение количества и размеров
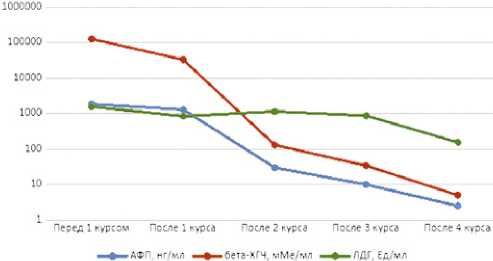
График 1. Динамика онкомаркеров на фоне ХТ
Diagram 1. Dynamics of oncomarkers during chemotherapy рассеянных мелких очагов в обоих легких, крупный участок инфильтрации в верхней доле слева практически перестал определяться; увеличенных забрюшинных лимфатических узлов не выявлено (рис. 2).
Уровень онкомаркеров от 12.12.2020 — в пределах нормы.
На момент последнего контакта с пациентом (май 2024 года) данных за прогрессирование заболевания, проявления поздней токсичности проводимой терапии не было. Пациент продолжает получать специфическую иммуносупрессивную терапию системными ГКС ежедневно и заместительную почечную терапию в виде гемодиализа 3 раза в неделю по поводу гранулематоза Вегенера.
Принимая во внимание отсутствие данных за прогрессирование ГО яичка в течение более 3 лет, наличие гранулематоза Вегенера в стадии ремиссии и терминальной ХБП, требующей проведения еженедельного гемодиализа, рекомендована трансплантация почки. На данный момент пациент включен в лист ожидания трансплантации донорской почки.
ОБСУЖДЕНИЕ
Данный клинический случай демонстрирует возможный вариант лечения пациента с ГО и ХБП, получающего гемодиализ. Несмотря на редукцию доз и развитие НЯ, у пациента был достигнут полные маркерный и радиологический ответы. ГО являются курабельным заболеванием даже при диссеминированных формах в связи с высокой чувствительностью к цисплатин-содержащей ХТ. Исключение данного препарата из схемы лечения значимо ухудшает отдаленные результаты [10]. Для пациентов с терминальной ХБП, получающих программный гемодиализ, нефротоксичность, связанная с цисплатином, уже не является лимитирующим фактором. Но данная когорта пациентов более подвержена другим дозозависимым НЯ, таким как миелосупрессия и нейропатия [11]. Ввиду быстрого и прочного связывания цисплатина с белками плазмы крови его элиминация посредством гемодиализа наиболее эффективна при сокращении интервала между введением препарата и началом гемодиализа, ведь именно связанная фракция оказывает большее влияние на развитие НЯ. Поэтому у больных с терминальной ХБП целесообразно снижение дозы препарата не менее, чем на 50% и немедленное проведение гемодиализа после ХТ (в течении 3 часов после окончания лечения). Однако такое снижение дозы цисплатина несет риск развития лекарственной резистентности [12,13]. Таблица 1 отражает сравнительную характеристику препаратов, используемых при лечении ГО, и их рекомендуемые дозы при лечении пациентов, находящихся на гемодиализе [14–16].
Ввиду отсутствия консенсуса по тактике ведения данной когорты пациентов ранее опубликованные клинические случаи отражают различные подходы к лечению. В одном из описанных наблюдений пациенту с внегонад-ной ГО средостения и терминальной ХБП на первом этапе было выполнено хирургическое лечение в объеме удале-
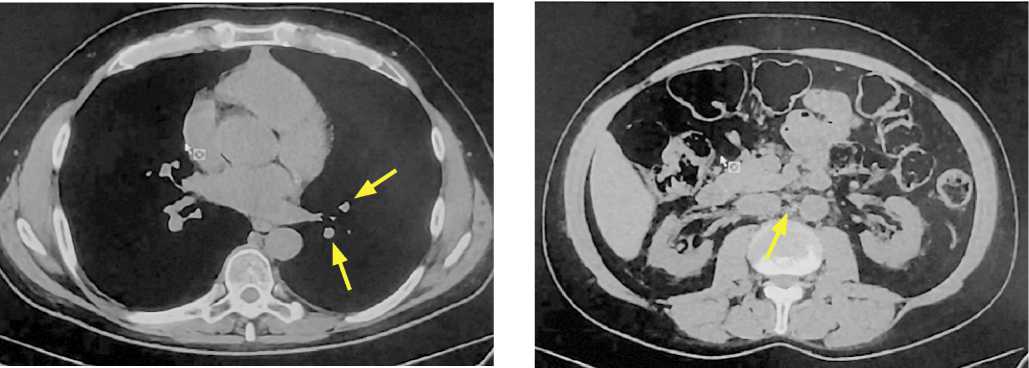
Рисунок 2. КТ после окончания лечения
Figure 2: CT scan after the treatment completion
ния опухоли средостения с последующим проведением ХТ в режиме ЕР с редукцией доз препаратов (цисплатина на 50 % и этопозида на 40%) в дни 1–5 и с Г-КСФ профилактикой. При попытке эскалации доз до 75 % от стандартных отмечена панцитопения 3–4 степени. При сроке наблюдения за пациентом 12 месяцев не отмечено прогрессирования заболевания [17].
Kieran J. Moore с соавторами представили несколько иной подход. Пациенту с несеминомной ГО яичка неблагоприятного прогноза по IGCCCG и ХБП 5 стадии после ОФЭ проводилась ХТ в режиме ЕР со стандартной дозой цисплатина (20 мг/м 2 ) и редукцией дозы этопозида на 40% (60 мг / м 2 ) в дни 1–5 на фоне Г-КСФ профилактики. Гемодиализ проводился в дни ХТ через 1 час после ее завершения. Лечение осложнилось ФН 3 степени и сенсорной нейропатией нижних конечностей 3 степени, приведшей к ограничению двигательной активности. В течение 10-летнего периода наблюдения отмечена некоторая регрессия нейропатии, тем не менее пациент нуждается в посторонней помощи, признаков прогрессирования ГО не отмечено [11].
Michael Froehner и соавторы описывают клинический случай пациента с ГО яичка и терминальной ХБП, которому проводилась ХТ в режиме ЕР с редукцией дозы цисплатина на 50% (10 мг/м 2 ) и дозы этопозида на 40 % (60 мг / м 2 ) в дни 1–5 с последующей эскалацией до режима PEI с 3 курса на фоне Г-КСФ профилактики. Гемодиализ проводился через 1 час после завершения ХТ. Межкурсовой интервал (после 3 курса в режиме PEI) осложнился развитием облитерирующего бронхиолита с организующейся пневмонией, приведшие к задержке 4 курса ХТ на 2 месяца. В течение следующего курса (с редукцией дозы ифосфамида на 25%) отмечен эпизод эпилепсии. По завершении ХТ 1 линии был достигнут полный маркерный ответ, через 15 месяцев после завершения лечения данных за прогрессирование не получено [18].
Принимая во внимание высокие риски развития кровотечения, синдрома распада опухоли, инфекционных осложнений, наличие у пациента ХБП, требующей проведения гемодиализа, первый курс ХТ в представленном нами клиническом случае был проведен в режиме EP с редукцией доз препаратов на 40 %.
В собственном ретроспективном исследовании, проведенном на базе онкоцентра имени Н. Н. Блохина, включавшем пациентов с ГО и тяжелым соматическим статусом и/или сверхвысокой концентрацией опухолевых маркеров, было продемонстрировано, что проведение первого цикла ХТ в режиме ЕР с редукцией доз (так называемый «стабилизационный» курс) позволило снизить число жизнеугрожающих осложнений с 76 % до 44% без ухудшения общей выживаемости (отношение рисков 0,99, 95 % доверительный интервал 0,44–2,26) в сравнении с историческим контролем (ХТ в полных дозах). После проведения 1 курса в стабилизационном режиме и улучшения общего состояния пациента лечение продолжалось согласно прогнозу по IGCCCG [19].
Безусловно, стандартом 1 линии ГО неблагоприятного прогноза является 4 курса ХТ в режиме BEP [20]. Однако в данном случае применение блеомицина было ограничено тем фактом, что препарат не подвергается гемодиализу, обуславливая крайне высокий риск развития фатального пульмонита [21]. Альтернативой ХТ в режиме BEP является ифосфамид-содержащие схемы [22,23]. Прямое сравнение режимов BEP и TIP в 1 линии ХТу пациентов с промежуточным и неблагоприятным прогнозами по IGCCCG показало их равную эффективность (одногодичная выживаемость без прогрессирования в обеих группах 72%) при большей гематологической токсичности последнего [23].
После 2 лет наблюдения кривая выживаемости пациентов с ГО выходит на плато и риск дальнейшего прогрессирования крайне низок. В нашем случае на качество жизни и прогноз значительное влияние оказывает терминальная ХБП, в связи с чем было рекомендовано рассмотрение возможности выполнения трансплантации почки.
Данное клиническое наблюдение демонстрирует важность терапии больных с ГО и тяжелой сопутствующей патологией в специализированных центрах, имеющих достаточный опыт в лечении данной когорты пациентов [24,25].
ВЫВОДЫ
Наш клинический случай описывает возможный вариант лечения пациента с распространенной ГО яичка и терминальной ХБП, требующей проведение гемодиализа, с достижением полного ответа. Однако токсичность проводимого лечения показывает необходимость более подробного изучения измененной фармакокинетики химиопрепаратов, разработки оптимальных модифицированных режимов ХТ для пациентов со злокачественными заболеваниями, находящихся на гемодиализе, с целью достижения наилучших отдаленных результатов лечения при минимизации токсичности терапии.


