Лечение плоскоклеточного рака кожи с применением криогенных технологий
Автор: Байкалова Ольга Игоревна, Беляев Алексей Михайлович, Прохоров Георгий Георгиевич, Раджабова Замира Ахмед-Гаджиевна
Журнал: Сибирский онкологический журнал @siboncoj
Рубрика: Опыт работы онкологических учреждений
Статья в выпуске: 6 т.19, 2020 года.
Бесплатный доступ
Введение. Заболеваемость раком кожи растет повсеместно. Плоскоклеточный рак кожи занимает второе место по частоте среди эпителиальных опухолей. Существующие методы лечения больных с плоскоклеточным раком кожи нередко сопровождаются локальными рецидивами, при этом 10-летняя выживаемость при пораженных региональных лимфатических узлах не превышает 20 %, а при наличии отдаленных метастазов составляет менее 10 %. Цель исследования - оценить результаты лечения пациентов с плоскоклеточным раком кожи с применением современных криогенных технологий. Материал и методы. Исследование проводилось на базе ФГБУ «НМИЦ онкологии им. Н.Н. Петрова» Минздрава России с 2013 по 2019 г. В исследование включены 64 пациента с диагнозом плоскоклеточный рак кожи, которые были разделены на две группы. Первая группа состояла из 32 больных, у которых основным методом лечения была криодеструкция опухоли. Вторая группа включала 32 человека, которым были выполнены различные виды хирургических вмешательств. Результаты. Сравнение результатов лечения больных с плоскоклеточным раком кожи при начальных стадиях заболевания при использовании криохирургического лечения не показало отличий от традиционного хирургического лечения. Применение криодеструкции имело ряд преимуществ. В частности, сократилась продолжительность операции в среднем на 54 %. Процедура может быть выполнена бескровно, а в сложных случаях объем кровопотери меньше, чем во время хирургического вмешательства. Пациенты легко перенесли процедуру криодеструкции, Интенсивность болевого синдрома после криодеструкции по показателям шкалы «ВАШ» в первые сутки ниже на 70 %, чем в хирургической группе. Срок пребывания в стационаре после криодеструкции опухоли может быть сокращен на 7-9 дней (57 %). Отдаленные косметические потери после криодеструкции опухоли менее выражены. Осложнений вследствие проведения криогенного лечения либо после него не отмечено. При хирургическом лечении локальные осложнения отмечены у 3 (9,4 %) человек, что укладывается в общеизвестную статистику. У 40,6 % пациентов старческого возраста с индексом коморбидности Чарлсон более 7 баллов, с тяжелыми сопутствующими заболеваниями, сочетающимися с местнораспространенными формами поражения, которым в большинстве случаев показана только паллиативная терапия, проведено эффективное криогенное лечение. Выводы. Криодеструкция в лечении больных плоскоклеточным раком кожи является безопасным методом, не ухудшает ближайшие и отдаленные результаты по сравнению с хирургическим вмешательством и может служить методом выбора для лечения больных с отягощенным коморбидным статусом.
Плоскоклеточный рак кожи, криогенное лечение, криодеструкция, циторедукция
Короткий адрес: https://sciup.org/140254063
IDR: 140254063 | УДК: 616.5-006.61-08 | DOI: 10.21294/1814-4861-2020-19-6-99-105
Текст научной статьи Лечение плоскоклеточного рака кожи с применением криогенных технологий
Заболеваемость раком кожи растет повсеместно. На долю плоскоклеточного рака кожи (ПКРК) приходится 20–25 % от всех эпителиальных злокачественных новообразований кожи [1, 2]. Выявленный на ранней стадии плоскоклеточный рак кожи имеет хороший прогноз и характеризуется 90 % пятилетней выживаемостью [3]. Несмотря на это, на долю ПКРК приходится 20 % смертей от рака кожи, а абсолютные значения смертности равны таковым при меланоме [4].
Согласно рекомендациям, хирургическое иссечение, дополненное при необходимости лучевой терапией, является основным методом лечения плоскоклеточного рака кожи [5]. Для начальных стадий заболевания возможно применение электрокоагуляции и кюретажа, лазерной вапоризации, криодеструкции [6].
Плоскоклеточный рак кожи часто развивается на рубцах и хронических язвах, а также имеет место у пациентов с иммуносупрессией, что обусловливает трудности его лечения. Средний возраст заболевших варьирует в диапазоне от 60 до 70 лет, что нередко сочетается с выраженной сопутствующей патологией и тоже ограничивает арсенал возможных вариантов лечения [6]. Все перечисленные факторы ограничивают возможности радикального лечения. При невыполнимости хирургического и лучевого лечения возможно применение местной химиотерапии [6]. В системной химиотерапии ПКРК известно более 20 комбинаций, среди которых наиболее эффективно сочетание паклитаксела с карбоплатином [7]. Но химиотерапия обладает достаточно выраженным уровнем токсичности, особенно при сочетании нескольких препаратов, что может ограничивать ее применение у пожилых пациентов. Ингибиторы EGFR имеют меньшую токсичность, но невысокую (25–45 %) частоту ответа при ПКРК. Возможности ингибиторов контрольных точек пока исследуются, но уже опубликованы обнадеживающие данные, где общая частота ответов для распространенного и метастатического ПКРК составляет более 50 % [8]. Для пациентов с иммуносупрессей эта опция остается недоступной.
Существующие методы лечения больных с ПКРК нередко сопровождаются локальными рецидивами, 10-летняя выживаемость при пораженных региональных лимфатических узлах не превышает 20 %, а при наличии отдаленных метастазов составляет менее 10 % [4]. Криогенный метод применяется у пожилых пациентов с сопутствующей соматической патологией, что не сопряжено с осложнениями [8–10].
Известно, что нет ни одного вида злокачественных клеток, которые были бы устойчивы к криогенному воздействию или приобретали бы к нему резистентность. Метод используется в лечении инфицированных опухолей [9]. Криогенное лечение вызывает минимальную общую реакцию организма, что позволяет проводить манипуляцию в амбулаторных условиях. В настоящее время нет единого мнения относительно показаний к криогенному лечению при плоскоклеточном раке кожи в зависимости от гистотипа, локализации и распространенности опухоли. Криохирургическое воздействие, как и иные методы лечения, не всегда дает ожидаемые результаты, но в настоящее время возможности метода увеличились за счет появления нового оборудования и совершенствования методов диагностики.
Цель исследования состояла в оценке результатов лечения пациентов с ПКРК с применением современных криогенных технологий.
Материал и методы
Исследование проведено в ФГБУ «НМИЦ онкологии им. Н.Н.Петрова» Минздрава России на базе хирургического отделения опухолей костей, мягких тканей и кожи, хирургического отделения опухолей головы и шеи. Проанализированы результаты лечения 64 пациентов с ПКРК различных локализаций, которые проходили лечение на базе ФГБУ «НМИЦ онкологии им. Н.Н.Петрова» Минздрава России с 2013 по 2019 г. Период наблюдения составил от 3 мес до 5 лет.
Для достижения цели исследования больные были разделены на 2 группы. Первая группа (основная) состояла из 32 больных, у которых основным методом лечения была криодеструкция опухоли. Вторая группа (контрольная) включала 32 пациента, которым были выполнены различные виды хирургических вмешательств. Для проведения анализа группы были составлены методом «копи-пара» (формирование выборки путем подбора для каждой единицы наблюдения исследуемой группы «копи-пары» по нескольким признакам).
Критериями включения в исследование являлись наличие морфологически верифицированного ПКРК, отсутствие регионарных и отдаленных метастазов, наличие подробного анамнеза, сходство клинической картины, схожий объем клиникорентгенологических исследований, достаточный для статистической обработки. Из 32 пациентов основной группы было 15 (46,9 %) мужчин и 17 (53,1 %) женщин. Возраст пациентов в криогенной группе варьировал от 44 до 91 года. В контрольной группе – 18 (56,2 %) мужчин и 14 (43,8 %) женщин. Возраст пациентов находился в диапазоне от 31 до 92 лет. Статистических различий в соотношении пола пациентов в сравниваемых группах не по- лучено. В связи с тем, что основной контингент пациентов с ПКРК составляли лица пожилого и старческого возраста, большинство из них имели сопутствующую патологию.
Стадирование опухолевого процесса осуществляли в соответствии с 8-й версией Международной классификации злокачественных опухолей 2017 г. По размеру опухоли в результате выделения категории «Т» каждая группа включала равное число больных с первичной опухолью Т1 – 20 (62,5 %) человек, с Т2 – 4 (12,5 %), с Т3 – 8 пациентов (25,0 %).
По локализации первичного очага также было соблюдено равенство групп. В каждой из сравниваемых групп опухоли кожи головы имели место у 24 (75 %) больных, в том числе в зоне высокого риска у 14 пациентов, в области среднего риска в 8 случаях; на коже туловища у 3 (9,4 %) больных; на коже верхних конечностей у 1 (3,1 %); на коже нижних конечностей у 2 (6,2 %); на коже промежности у 2 (6,2 %). Оценка локального статуса дополнительно включала ультразвуковое сканирование и МРТ зоны поражения.
Выбор способа криодеструкции зависел от локализации, формы, размера опухоли и глубины инвазии. Техника выполнения криодеструкции соответствовала методическим рекомендациям, разработанным в ФГБУ «НМИЦ онкологии им. Н.Н. Петрова» Минздрава России. Для процедуры криодеструкции применяли разные аппараты: криораспылитель (типа РА-01), криодеструктор «КРИОИНЕЙ» с плоскими и коническими аппликаторами, медицинскую криотерапевтическую систему (МКС), оснащенную вакуумными термоизолированными криозондами диаметром 1,5 и 3 мм. Размер и форму аппликатора подбирали индивидуально в зависимости от особенностей опухолевого процесса. Обязательным условием являлось достижение полной адгезии с распространением зоны оледенения не менее чем на 5 мм от видимой границы опухоли. Экспозиция на уровне –40 ºС по краю аппликатора составляла 5 мин. Пассивное оттаивание обычно занимало 10–15 мин, после чего цикл охлаждения повторяли еще дважды при тех же параметрах. Методика орошения опухоли спреем хладагента позволяла выполнить криодеструкцию при сложном рельефе экзофитной части опухоли, если аппликационный способ не обеспечивал надежной адгезии аппликатора с изъязвленной кожей. Пункционный способ с применением малоинвазивных криозондов отечественной криотерапевтической системы «МКС» применяли для криодеструкции опухолей, сложных по форме и значительных по объему и глубине распространения. Обезболивание включало проводниковую, регионарную, инфильтрационную анестезию, реже – комбинированный наркоз.
Мониторинг процесса криодеструкции осуществлялся при помощи физикальных методов и контроля зарегистрированных температурных
Таблица 1/table 1
Интраоперационные показатели у больных ПКРК intraoperative parameters in patients with cutaneous squamous cell carcinoma
|
Показатели/ Parameters |
Основная группа/ Study group |
Контрольная группа/ Control group |
p |
|
Длительность операции, мин/ Duration of surgery, min |
40,9 ± 1,7 |
89,4 ± 12,8 |
0,001 |
|
Кровопотеря, мл/Blood loss, ml |
7,6 ± 2,1 |
37,5 ± 13,7 |
0,03 |
Гемотрансфузия/Blood transfusion
0 1 <0,05
параметров в зоне криодеструкции. Локальную температуру регистрировали многоканальным термоизмерительным комплексом «Термоскани» либо встроенной системой термоконтроля аппарата «МКС» с применением игольчатых термопар.
Критериями сравнения криогенного и хирургического видов лечения являлись длительность операции или процедуры, объем кровопотери, болевой синдром, осложнения, функциональные и эстетические результаты, качество жизни, без-рецидивный период.
Результаты и обсуждение
В группу криогенного лечения вошли 9 пациентов, которым отказано в проведении лечения в городских стационарах, что было связано с невозможностью проведения адекватного анестезиологического пособия либо с технической невыполнимостью. Четырем пациентам была предложена в качестве лечения только лучевая терапия, от которой они отказались. Таким образом, у 13 (40,6 %) пациентов криодеструкция оказалась единственно возможным вариантом лечения.
Длительность операции оказалась достоверно выше в контрольной группе. При криогенном лечении время манипуляции составило 41 ± 1,7 мин против 89 ± 12,8 мин в контрольной группе (p<0,05). Кровопотеря при криодеструкции более чем в 5 раз ниже по сравнению с хирургическим методом: в основой группе кровопотеря колебалась от 5 до 70 мл и в среднем составила 7,6 ± 2,1мл, а во время хирургического вмешательства – от 5 мл до 400 мл, в среднем – 37,5 ± 13,7 мл (p=0,03) (табл. 1).
В группе криогенного лечения длительность болевого синдрома составила 0,91 ± 1,23 дня, в контрольной группе 3,69 ± 1,85 дня (р<0,05). Рразличия носят статистически значимый характер. При этом больные основной группы в первые дни послеоперационного периода не нуждались в анальгетической терапии, только в одном случае пациент принимал препарат из группы нестероидных противовоспалительных средств на протяжении 3 дней, в то время как в контрольной группе потребность в обезболивании составила 4,9 ± 1,36 дня.
Осложнений после криогенного лечения не выявлено, 2 пациента предъявляли жалобы на длительную лимфорею – характерную особенность криогенного лечения. В обоих случаях опухоль располагалась на коже промежности и соответствовала T2 и Т3. В контрольной группе у 3 (9,4 %) больных зафиксированы осложнения после операции, которые представлены краевым некрозом лоскута в 2 (6,3 %) случаях, серомой значительных размеров – в 1 (3,1 %) случае. Все осложнения выявлены после лечения первичных опухолей с распространенностью T3.
Хорошие эстетические результаты упоминаются многими авторами как достоинство криогенного метода лечения. В нашем исследовании через 1–1,5 мес обычно наступала эпителизация раны и формировался рубец при поражениях, размерами не превышающих 3 см, кроме случаев многоэтап-
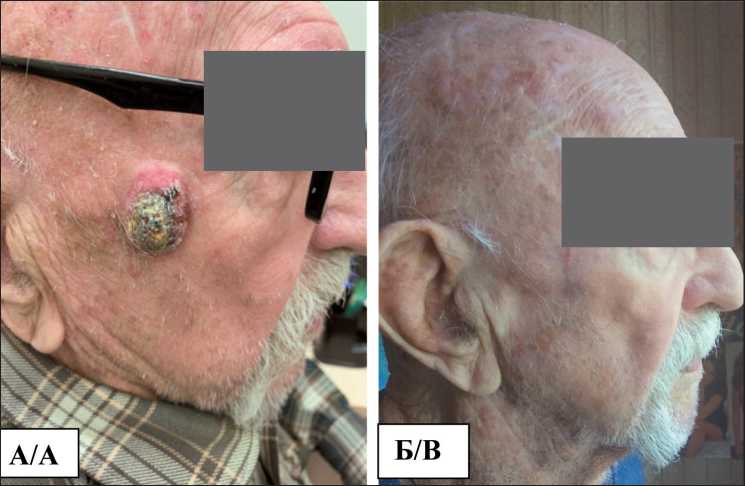
Рис. 1. А) Больной 87 лет. Плоскоклеточный рак кожи скуловой области T3N0M0. Б) Тот же больной через 6 мес после криогенного лечения. Полная регрессия опухоли и формирование малозаметного рубца
Fig. 1. A) An 87-year-old man. Cutaneous squamous cell carcinoma of the zygomatic region (T3N0M0). B) The same patient 6 months after cryosurgery. Complete tumor regression and the formation of a subtle scar
Таблица 2/table 2
Распределение больных плоскоклеточным раком кожи по прогрессированию заболевания distribution of patients with squamous cell skin cancer according to disease progression
|
Прогрессирование/ Disease progression |
Основная группа/ Study group |
Контрольная группа/ Control group |
р |
|
Местный рецидив/ Local recurrence |
5 (15,6 %) |
5 (15,6 %) |
>0,05 |
|
Метастатическое поражение регионарных лимфоузлов/ Lymph node metastases |
1 (3,1 %) |
5 (15,6 %) |
>0,05 |
|
Всего/Total |
6 (21,9 %) |
10 (31,3 %) |
>0,05 |
Cumulative Proportion Surviving (Kaplan-Meier) о Complete + Censored
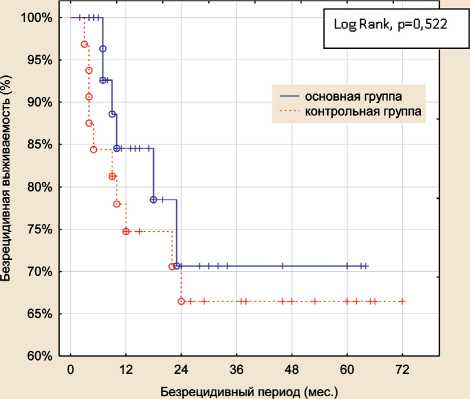
Рис. 2. Безрецидивная выживаемость больных плоскоклеточным раком кожи в зависимости от метода лечения Fig. 2. Disease-free survival of patients with squamous cell skin cancer depending on the type of treatment ного криогенного лечения у больных с первичной опухолью T3. Но в большинстве случаев, у 28 (87,5 %) пациентов, через 6–8 мес после криодеструкции рубец становился мягким и приобретал цвет окружающих тканей, при осмотре через 1 год и более визуально было трудно различить участок кожи, на котором ранее локализовалась злокачественная опухоль (рис. 1). Косметический дефект меньше тревожил пациентов из группы криогенного лечения по сравнению с группой прооперированных пациентов.
Общая трехлетняя выживаемость больных в группе криогенного лечения составила 67 %, в группе сравнения – 78 %, полученные различия статистически недостоверны (p>0,05). Cкорректированная выживаемость больных в основной группе составила 97 %, в контрольной группе – 84 %, полученные различия статистически недостоверны (p>0,05). При оценке безрецидивной выживаемости медиана наблюдения не достигнута, но достоверных различий также не получено. Трехлетняя безрецидивная выживаемость в основной группе составила 78 %, в контрольной группе – 69 % (p>0,05) (рис. 2).
Прогрессирование рака кожи после криодеструкции наблюжалось у 6 (19 %) больных, в том числе при опухолях, соответствующих T1 – у 1 (3,1 %), Т2 – у 1 (3,1 %), Т3 – у 4 (12,5 %) пациентов. В контрольной группе прогрессирование заболевания было отмечено у 10 пациентов (31 %), в том числе при T1 – у 5 (15,6 %); T2 – у 1(3,1 %); Т3 – у 4 (12,5 %) больных. При анализе сроков и структуры прогрессирования выявлено, что в обеих группах во всех случаях эти события произошли в первые два года после лечения, чаще всего наблюдались местные рецидивы (табл. 2).
После сравнительной оценки эффективности разных методов лечения выявленное преимущество одного из них не может служить поводом для императивных рекомендацией к его повсеместному применению. Метод криодеструкции опирается на результаты полноценного предоперационного обследования с применением современных методов локальной диагностики и мониторинга процедуры с использованием термометрии, ультразвукового сканирования и нередко – современных криотерапевтических систем. Сложность методики криодеструкции обусловлена объемом подготовки.
Заключение
По итогам проведенного анализа можно отметить, что криогенное лечение больных с плоскоклеточным раком кожи в начальных стадиях заболевания (Т1) позволяет добиться стойкой ремиссии, хороших эстетических и функциональных результатов, равных последствиям радикальной операции. Использование криогенного метода у больных плоскоклеточным раком не ухудшает отдаленные результаты лечения, демонстрируя сопоставимые с хирургическим лечением показатели 3-летней общей и безрецидивной выживаемости. Криодеструкция является безопасным видом лечения и может быть методом выбора при лечении больных ПКРК с отягощенным коморбидным статусом.
Список литературы Лечение плоскоклеточного рака кожи с применением криогенных технологий
- Amaral T., Osewold M., Presser D., Meiwes A., Garbe C., Leiter U. Advanced cutaneous squamous cell carcinoma: real world data of patient profiles and treatment patterns. J Eur Acad Dermatol Venereol. 2019; 33 Suppl 8: 44-51. 10.1111/jdv. 15845. DOI: 10.1111/jdv.15845
- Soura E., Gagari E., Stratigos A. Advanced cutaneous squamous cell carcinoma: how is it defined and what new therapeutic approaches are available? Curr Opin Oncol. 2019 Sep; 31(5): 461-8. 10.1097/ CCO.0000000000000566. DOI: 10.1097/CCO.0000000000000566
- Hollestein L.M., de Vries E., Nijsten T. Trends of cutaneous squamous cell carcinoma in the Netherlands: increased incidence rates, but stable relative survival and mortality 1989-2008. Eur J Cancer. 2012 Sep; 48(13): 2046-53. DOI: 10.1016/j.ejca.2012.01.003
- Hillen U., Leiter U., Haase S., Kaufmann R., Becker J., Gutzmer R., Terheyden P., Krause-Bergmann A., Schulze H.J., Hassel J., Lahner N., Wollina U., Ziller F., Utikal J., Hafner C., Ulrich J, Machens H.G., Weishaupt C., Hauschild A., Mohr P., Pfohler C., Maurer J., Wolff P., Windemuth-Kieselbach C., Schadendorf D., Livingstone E.; Dermatologic Cooperative Oncology Group (DeCOG). Advanced cutaneous squamous cell carcinoma: A retrospective analysis of patient profiles and treatment patterns - Results of a non-interventional study of the DeCOG. Eur J Cancer. 2018 Jun; 96: 34-43. DOI: 10.1016/j.ejca.2018.01.075
- Heppt M.V., Steeb T., Berking C., Nast A. Comparison of guidelines for the management of patients with high-risk and advanced cutaneous squamous cell carcinoma a systematic review. J Eur Acad Dermatol Ve-nereol. 2019 Dec; 33 Suppl 8: 25-32. 10.1111/jdv. 15846. DOI: 10.1111/jdv.15846
- National Comprehensive Cancer Center. NCCN clinical practice guidelines in oncology. Squamous Cell Skin Cancer [Internet]. URL: www. nccn.org (cited 27.02.2020).
- Стуков А.Н., Бланка М.А., Семиглазова Т.Ю., Беляев А.М. Фармакотерапия опухолей. Посвящается памяти М.Л. Гершановича. СПб., 2017. 512 с.
- Gellrich F.F., Huning S., Beissert S., Eigentler T., Stockfleth E., Gutzmer R., Meier F. Medical treatment of advanced cutaneous squamous-cell carcinoma. J Eur Acad Dermatol Venereol. 2019 Dec; 33 Suppl 8: 38-43. DOI: 10.1111/jdv.16024
- Прохоров Г.Г., Беляев А.М., Прохоров Д.Г. Основы клинической криомедицины. СПб.-М.; 2017. 608 с.
- Green A.C., Olsen C.M. Cutaneous squamous cell carcinoma: an epidemiological review. Br J Dermatol. 2017 Aug; 177(2): 373-381. DOI: 10.1111/bjd.15324


