Лечение радиоактивным йодом доброкачественных заболеваний щитовидной железы, протекающих с синдромом тиреотоксикоза
Автор: Ваюта Нелли Павловна
Журнал: Ученые записки Петрозаводского государственного университета @uchzap-petrsu
Рубрика: Медицинские науки
Статья в выпуске: 7 (101), 2009 года.
Бесплатный доступ
Заболевания щитовидной железы, тиреотоксикоз, радиойодтерапия
Короткий адрес: https://sciup.org/14749606
IDR: 14749606
Текст статьи Лечение радиоактивным йодом доброкачественных заболеваний щитовидной железы, протекающих с синдромом тиреотоксикоза
В Республике Карелия в 1959 году была создана радиологическая лаборатория при гематологическом отделении Республиканской больницы. Одной из главных целей работы лаборатории было лечение радиоактивным йодом больных с заболеваниями щитовидной железы, протекающих с синдромом тиреотоксикоза. В начале 90-х годов ХХ века поставки йода были прекращены, РИТ была возобновлена в 2003 году. Таким образом, Республика Карелия относится к тем немногим регионам Российской Федерации, которым до ступен этот эффективный, безопасный, относительно дешевый метод лечения больных с синдромом тиреотоксикоза, что и определяет его востребованность не только в нашей стране, но и в большинстве стран мира. Данному методу лечения посвящен в последнее время ряд работ (см., например, [1], [2], [3], [4], [5]).
Поскольку в последние годы изменились цели и показания к радиологическим исследованиям больных с патологией щитовидной железы, цели лечения больных с синдромом тиреотоксикоза (излечение это – гипотиреоз), снят возрастной ценз для использования радиойодтерапии, мы решили проанализировать результаты лечения наших больных за последние годы и уточнить необходимость внесения коррекции в практику радиойодтерапии.
Цель нашего исследования – оценить:
-
1. Показания к проведению РИТ у больных;
-
2. Переносимость больными РИТ и ее побочные эффекты (развитие пострадиационных тиреоидитов);
-
3. Эффективную дозу вводимого радиофармпрепарата (йод-131 (I-131));
-
4. Эффективность терапии (достижение гипотиреоза или эутиреоза);
-
5. Динамику объема и функции щитовидной железы спустя 6–12 месяцев после РИТ.
Анализировались 106 историй болезни больных с синдромом тиреотоксикоза, лечившихся в эндокринологическом отделении РБ в 2005– 2006 годах. Возраст больных от 20 до 79 лет: 20– 30 (n – 6), 31–35 (n – 6), 36–40 (n – 13), старше 50 (n – 83), мужчин было 22, женщин – 84.
Этиологическая структура тиреотоксикоза у больных:
-
1. Диффузный токсический зоб (болезнь Грейвса) – 97 (91,6 %) больных.
-
2. Токсическая аденома – 3 (2,8 %) больных.
-
3. Диффузно-узловой токсический зоб – 6 (5,6 %) больных, «с функциональной автономией» – 3, без «функциональной автономии» – 3.
Серьезная сопутствующая патология (ИБС, фибрилляция предсердий) имелась у 6 (5,6 %) больных.
МЕТОДЫ ИССЛЕДОВАНИЯ
У всех больных исследовался уровень св. Т 4, ТТГ, УЗИ щитовидной железы, тест захвата щитовидной железой I-131 через 10 мин, через 2, 4, 6, 24 часа после введения радиофармпрепарата. При наличии узлов в щитовидной железе выполнялась тонкоигольная аспирационная биопсия узлов (ТАБ) для исключения онкопатологии, сцинтиграфия с ТХ-99 для выявления «функциональной автономии узлов».
У 20 больных через 5–6 дней после введения I-131 исследованы СОЭ, фибриноген, С-реак-тивный белок для исключения пострадиационного тиреоидита. У 27 (случайная выборка) через 6–12 месяцев после введения радиофармпрепарата в динамике исследовали УЗИ и ТТГ.
Все больные до введения изотопа получали тиреостатическую терапию (мерказолил, тиома-зол). Тиреотоксикоз был устранен у 104 больных, в 2 случаях эутиреоз не достигнут из-за развития лейкопении на мерказолил. Всем больным с противопоказаниями к длительной консервативной терапии предлагались на выбор 2 альтернативных варианта лечения: РИТ или струмэктомия. Больные сделали выбор в пользу РИТ и дали подписку о согласии на ее проведение. За 10 дней до введения изотопа тиреостати-ческие препараты отменялись.
РЕЗУЛЬТАТЫ ИССЛЕДОВАНИЯ
Больные с диффузным токсическим зобом были разбиты на 4 группы:
1-я группа – 41 (38,6 %) больной с впервые диагностированной болезнью Грейвса, длительность заболевания – 3–4 месяца.
2-я группа – 37 (35,0 %) больных с рецидивом болезни Грейвса после отмены тиреостати-ческой терапии через 1,5–2 года постоянного приема тиреостатических препаратов, длительность заболевания – от 3 до 5 лет.
3-я группа – 28 (26,4 %) больных с рецидивом тиреотоксикоза после струмэктомии. Длительность заболевания – до 10 лет, количество рецидивов тиреотоксикоза после операции – от 5 до 7.
4-я группа – 27 (25,5 %) больных из общей группы (случайная выборка пациентов). Оценивалась функции и объем щитовидной железы в динамике через 6–12 месяцев после введения I-131.
Во всех группах результаты исследования были однотипны, что позволило анализировать их одной общей группой.
Следует отметить помолодевший контингент больных, отобранных для РИТ. Если 10 лет тому назад это были преимущественно больные старше 50–60 лет, то после снятия возрастного ценза для РИТ в Республиканской больнице стали лечить больных молодого возраста. Лица от 20 до 40 лет составили 26 %.
Поскольку одним из показаний к РИТ является умеренное увеличение щитовидной железы до 40 мл, мы анализировали этот показатель по данным УЗИ. Объем щитовидной железы у исследованных колебался в больших пределах: от 16 до 128 мл. Больные были разделены на две подгруппы. Средний объем (M ± SD) соответствовал следующим величинам: 29,0 ± 10,74 мл (n – 94); 70,95 ± 25,45 мл (n – 12). У большинства больных он не превышал 40–50 мл, только у 6 человек зоб был от 60 до 130 мл. Это больные с большими зобами, серьезной кардиальной патологией, с высоким риском оперативного вмешательства и бесперспективностью дальнейшей длительной медикаментозной терапии. РИТ для них была альтернативой.
Обязательным условием РИТ является высокий захват изотопа щитовидной железой. У всех исследованных был диагностирован гипертест. Пределы колебаний максимального захвата I-131 щитовидной железой колебались от 42 % в единичных случаях до 92 %. Средние величины захвата I-131 при проведении теста через 6 часов после введения были равны – 71,64 ± 18,49 %, через 24 часа – 69,67 ± 19,51 %.
Показаниями к радиойодтерапии были определены следующие признаки:
-
1. Диффузный токсический зоб 1–2-й степени (29,0 ± 10,7 мл) – у 88,7 % больных.
-
2. Тяжелая сопутствующая кардиальная патология (ишемическая болезнь сердца, нарушения сердечного ритма, сердечная недостаточность) у больных с большим объемом зоба (от 60 до 130 мм) – у 5,6 %.
-
3. Диффузный токсический зоб, диагностированный впервые с умеренным и устраненным тиреотоксикозом – 38,6 %.
-
4. Рецидив тиреотоксикоза после многолетней консервативной терапии – 35,0 %.
-
5. Рецидивы тиреотоксикоза после струмэкто-мии – 26,4 %.
-
6. «Функциональная автономия» при узловых зобах (токсическая аденома, многоузловой токсический зоб) – 6,36 %.
-
7. Упорная лейкопения при приеме тиреостати-ков – 1,5 %.
-
8. Гипертест с I-131 – 100 %.
Таким образом, выбор пациентов для РИТ соответствовал общепринятым критериям.
Несмотря на то что РИТ для лечения больных используется с 1942 года, вопрос о вводимой лечебной дозе I-131 до сих пор остается дискута-бельным: в разных странах и лечебных учреждениях вопрос о дозе радиофармпрепарата решается по-разному: кто-то вводит фиксированную дозу I-131 – 200, 400, 600, 800 мБк или от 5 до 20 мКи; кто-то рассчитывает терапевтическую активность I-131 по формуле, учитывая объем щитовидной железы и процент захвата радиоактивного йода; кто-то определяет поглощенную ЩЖ дозу йода и, исходя из нее, рассчитывает терапевтическую активность вводимой дозы.
Доза вводимого всем нашим больным радиофармпрепарата определялась эмпирически. В Республиканской больнице в предшествующие годы рассчитывали поглощенную дозу по сложной формуле, определяя эффективный период полувыведения I-131, исследуя тест поглощения в течение 4–5 суток. Рассчитанная разовая доза не превышала 240 мБк и вводилась внутривенно. Поскольку внутривенно разрешено вводить не более 200 мБк радиоактивного йода, больным вводили I-131 в дозе от 110 до 360 мБк в один или два приема. При определении дозы учитывались объем щитовидной железы и результаты теста поглощения йода.
Дозу 110 мБк получили 19 (18,0 %) больных, дозу от 170 до 240 мБк – 80 (75,4 %); 7 (6,6 %) больным было введено 220, 270, 320, 360, мБк в 2 приема.
Как видно на рис. 1, у 82 % больных доза введенного I-131 соответствовала допустимым терапевтическим дозам, а у 18,0 % больных она была низкой.
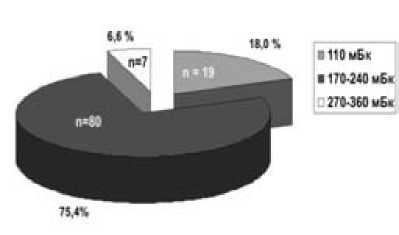
Рис. 1. Распределение больных с синдромом тиреотоксикоза по введенной дозе I-131 (n – количество больных)
У большинства больных эффективность вводимой дозы препарата мы оценивали косвенно. Большинству больных после РИТ на 2–3 месяца назначали прием тиреостатических препаратов в поддерживающей дозе, после их отмены контролировались уровни св. Т 4, ТТГ через 3 и 6 месяцев. Эта группа больных всегда наблюдалась эндокринологом по месту жительства или в Республиканской поликлинике. При возврате клинических и лабораторных признаков тиреотоксикоза больные вновь поступали в эндокринологическое отделение РБ для дополнительного введения радиофармпрепарата. Если через 6– 12 месяцев у больных не было рецидива тиреотоксикоза и не было необходимости дополнительно вводить I-131, результаты лечения оценивались как успешные. Стойкий эутиреоз и гипотиреоз расценивались как эффективная терапия.
У 96 больных (90,6 %) возврата симптомов тиреотоксикоза не наблюдалось. Эффективной оказалась первично выбранная доза I-131. У 10 больных (9,4 %) наблюдался рецидив тиреотоксикоза, что потребовало дополнительного введения радиоактивного йода. Из них 7 больным I-131 был довведен. Причинами рецидива тиреотоксикоза были явно недостаточная первоначальная доза изотопа (110 мБк) при низком проценте его поглощения (42–45 %) или низкая доза йода в расчете на 1 мл объема щитовидной железы.
Радиойодтерапию больные перенесли хорошо. Ни в одном случае не было выявлено нежелательных побочных эффектов. Ни у одного больного не отмечено клинических признаков пострадиационного тиреоидита (жалоб, болезненности щитовидной железы, болей при глотании и повороте шеи). У 15 больных исследованы острофазовые показатели и СОЭ. Отклонений от нормальных величин не было.
В настоящее время критерием эффективности терапии больных с заболеваниями щитовидной железы, протекающих с синдромом тиреотоксикоза, принято считать достижение гипотиреоза после радикальной терапии. Развитие гипотиреоза исключает возможность рецидива заболевания. Однако многими эндокринологическими школами стойкий эутиреоз рассматривается также как вариант успешной терапии.
Функция щитовидной железы по уровню ТТГ оценивалась у 27 больных через 6–12 месяцев после радиойодтерапии. Гипотиреоз диагностирован у 20 больных (ТТГ от 6 до 75 мкед/мл); у 7 из них – субклинический, у 13 – манифестный. У 7 человек функция щитовидной железы соответствовала норме (ТТГ от 2,5 до 4 мкед/мл). Показатели уровня ТТГ указаны на рис. 2.
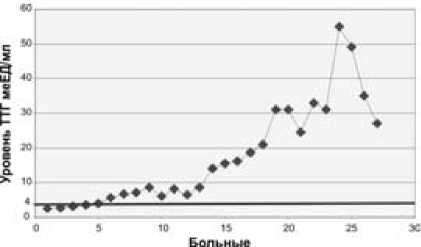
Рис. 2. Показатели ТТГ больных с синдромом тиреотоксикоза через 6–12 месяцев после радиойодтерапии
Анализ результатов УЗИ щитовидной железы у этих же больных показал уменьшение объема щитовидной железы после РИТ в среднем на 54,6 %. Изменение в динамике объема щитовидной железы у исследованных больных представлено на рис. 3.
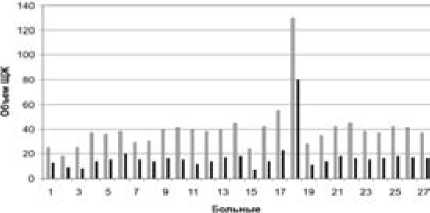
Рис. 3. Изменение объема щитовидной железы после РИТ:
■ – до лечения; ■ – после лечения.
ВЫВОДЫ
-
1. Радиойодтерапия эффективна у 100 % больных с заболеваниями щитовидной железы, протекающих с тиреотоксикозом, при однократном или дробном введении 110–340 мБк.
-
2. Невысокие разовые дозы радиофармпрепарата – от 110 до 240 мБк (ниже расчетной) оказались достаточными у 91,6 % обследованных после однократного введения препарата, что свидетельствует о целесообразности титрования дозы у ряда больных.
-
3. РИТ – безопасный метод лечения, он легко переносится больными. Ни в одном случае не наблюдало сь побочных действий и осложнений, в том числе и пострадиационного тиреоидита.
-
4. Уменьшение объема зоба через полгода-год после РИТ на 54,4 % позволяет использовать радиойодтерапию как альтернативу стумэк-томии для больных с большими зобами и тяжелой сопутствующей патологией.
Через 6–12 месяцев после введения радиоактивного йода эутиреоз констатирован у 26 %, гипотиреоз – у 74 % обследованных.
Большая частота рецидивов после длительной терапии тиреостатическими препаратами и струмэктомии (61,4 % обследованных – больные с рецидивирующим течением тиреотоксикоза от 3 до 10 лет) требует более жесткого отбора больных для консервативной терапии и более раннего решения о необходимости проведения радиойодтерапии в этой группе больных.
Список литературы Лечение радиоактивным йодом доброкачественных заболеваний щитовидной железы, протекающих с синдромом тиреотоксикоза
- Герасимов Г. А., Мельниченко Г. А., Петунина Н. А., Федак И. Р. Современные представления о лечение тиреотоксикоза радиоактивным йодом. Комментарии к рекомендациям европейских экспертов//Проблемы эндокринологии. 1997. № 1. С. 28-31.
- Древаль А. В., Цыб А. Ф., Нечаева О. А., Комердус И. В. и др. Эффективность лечения диффузного токсического зоба в зависимости от расчетной терапевтической активности радиоактивного йода//Проблемы эндокринологии. 2007. Т. 53. № 2. С. 45-48.
- Древаль А. В., Цыб А. Ф., Нечаева О. А., Комерду с И. В. и др. Влияние лечения радиоактивным йодом на течение эндокринной офтальмопатии//Клиническая и экспериментальная тиреоидология. 2007. Т. 3. № 3. С. 33-40.
- Стронгин Л. Г., Шестакова Г. В., Будкина М. Л., Сидорова Н. А. и др. Эффективность 131-J в лечении болезни Грейвса (предварительный анализ собственного опыта)//Клиническая и экспериментальная тиреоидология. 2006. Т. 2. № 3. С. 56-58.
- Фадеев В. В., Дроздовский Б. Я., Гусева Т. Н. и др. Отдаленные результаты лечения токсического зоба радиоактивным 131-J//Проблемы эндокринологии. 2005. № 1. С. 3-10.


