Лечение ультразвуковой абляцией гормонорезистентного локализованного и местно-распространенного рака предстательной железы
Автор: Хаметов Равиль Зиннюрович, Соловов Вячеслав Александрович, Матяш Яна Сергеевна, Фесенко Денис Владимирович, Шаплыгин Леонид Васильевич
Журнал: Вестник медицинского института "РЕАВИЗ": реабилитация, врач и здоровье @vestnik-reaviz
Рубрика: Клиническая медицина
Статья в выпуске: 1 (9), 2013 года.
Бесплатный доступ
В статье представлено исследование по оценке клинической эффективности лечения гормонорезистентного локализованного и местно-распространенного рака предстательной железы методом ультразвуковой абляции. Экспериментально доказано, что ультразвуковая абляция является безопасным и малоинвазивным методом лечения, эффективность которого подтверждается в 90 %.
Гормонорезистентный рак, предстательная железа, ультразвуковая абляция
Короткий адрес: https://sciup.org/14344031
IDR: 14344031 | УДК: 616/618
Текст научной статьи Лечение ультразвуковой абляцией гормонорезистентного локализованного и местно-распространенного рака предстательной железы
Цель исследования: оценить клиническую эффективность HIFU терапии при лечении гормонорезистентного рака предстательной железы.
Объекты и методы исследования. Исследование было одобрено этическим комитетом ГУЗ СОКОД. От всех больных было получено информированное согласие на проведение исследования. Триста сорок одному пациенту с ГРРПЖ провели HIFU терапию с сентября 2007 по декабрь 2011 года в Самарском областном клиническом онкологическом диспансере. Критерии включения в исследование: пациенты, не являющиеся кандидатами для РПЭ и ДЛТ, с локализованным и местно-распространенным ГРРПЖ. Медиана гормонотерапии до возникновения гормонорезистентности составила 20 (3-48) месяцев. Трехкратный рост ПСА на фоне проводимого лечения трактовался как развитие ГРРПЖ в соответствии с критериями ASTRO [9]. Критерии исключения из исследования: пациенты с метастатическим РПЖ, прорастание опухоли в прямую кишку или отсутствие прямой кишки. Пациенты были разделены на 2 группы в соответствии с распространенностью и риском прогрессии: локализованный ГРРПЖ, низкий риск – количество пациентов 237, Глисон ≤7, стадия T1-2N0M0, возраст 69 (60-89) лет, ПСА перед HIFU 40,0 (5,8-92,9) нг/мл, среднее значение объема простаты - 39,3 (28-92) куб.см; местно-распространенный ГРРПЖ, с высоким риском развития прогрессии – количество пациентов 104, Глисон ≤9, стадия T2-3N0M0, возраст 72 (52-83) года, ПСА перед HIFU 30,3 (20,1-60) нг/мл, среднее значение объема простаты - 41,2 (25-198) куб.см. Лечение проводили под спинальной или эпидуральной анестезией. Процедура HIFU выполнялась на роботизированной системе Ablatherm® (EDAP, Лион, Франция). Среднее время наблюдения после ультразвуковой абляции составило 36 (3-52) месяцев. После лечения определяли уровень ПСА каждые 3 месяца, проводили МРТ и биопсию простаты в случае роста ПСА.
Результаты. 238 пациентам была выполнена трансуретральная резекция (ТУР) одновременно с процедурой HIFU; 69 ТУР была выполнена за месяц до HIFU терапии в связи с большим объемом простаты. 34 пациентам была выполнена только ультразвуковая абляция. Средний объем резецированной ткани простаты во время ТУР составил 30 (5-80) куб.см. Ультразвуковая абляция продолжалась 120 (60-245) минут. Среднее время госпитализации -7 (2-19) дней. У пациентов, кому выполнялись ТУР+HIFU, катетер удаляли через 7 (3-21) дней. У пациентов, кому выполняли только процедуру HIFU, катетер удаляли через 14 (10 -28) дней. Результаты уровня ПСА после HIFU терапии представлены в таблице 1.
Таблица 1
Динамика уровня ПСА после HIFU терапии
|
Группы пациентов ГРРПЖ |
Уровень ПСА через 12 мес., нг/мл |
Уровень ПСА через 36 мес., нг/мл |
Биохимический рецидив через 36 мес., % |
|
Локализованный |
0,04 (0-2,24) |
0,2 (0,02-2,0) |
4,5 |
|
Местнораспространенный |
0,05 (0-48,4) |
1,18 (0,04-7,45) |
20 |
Через 12 месяцев наблюдения в группе с низким риском прогрессии медиана уровня ПСА составила 0,04 нг/мл; в группе с высоким риском прогрессии - 0,05 нг/мл. Через 36 месяцев после HIFU в группе с низким риском прогрессии значение медианы ПСА составило 0,2 нг/мл; в группе с высоким риском прогрессии - 1,18 нг/мл.
В течение первых месяцев после процедуры отмечались следующие побочные эффекты: недержание мочи I ст. – 18 (5,3%) пациентов, недержание мочи II ст. - 32 (9,4%) пациента. Недержание купировалось у всех пациентов в течение 3-6 месяцев на фоне проводимой консервативной терапии. У 33 (9,7%) пациентов в течение первых 12 месяцев после операции возникла стриктура простатического отдела уретры, что потребовало проведения ТУР. У 2 (0,6%) пациентов в течение 1 месяца после лечения развился ректоуретральный свищ, который потребовал наложение эпицистостомы и колостомы. Свищи закрылись самостоятельно в течение 6-12 месяцев.
Через 6 месяцев после лечения средний объем простаты составил 9,3 (2-18) куб.см. Объем был статистически значимо уменьшен по сравнению с начальным объемом (p<0,01).
У 70 % пациентов отмечалось улучшение качества жизни по шкале IPSS, у 30% осталось без изменений.
Одним из значимых преимуществ HIFU терапии является возможность повторить лечение в случае продолженного роста опухоли или местного рецидива. 7 (2%) пациентам была проведена повторная HIFU терапия при возникновении местного рецидива.
Таким образом, наши наблюдения показали, что HIFU терапия была успешна у 90,9% пролеченных пациентов. Был проведен анализ безрецидивной выживаемости по Каплан-Мееру, который показал 95,5 % эффективность HIFU терапии в группе с низким риском прогрессии (локализованный РПЖ) и 80% в группе с высоким риском прогрессии (местнораспространенный РПЖ) (рис.1).
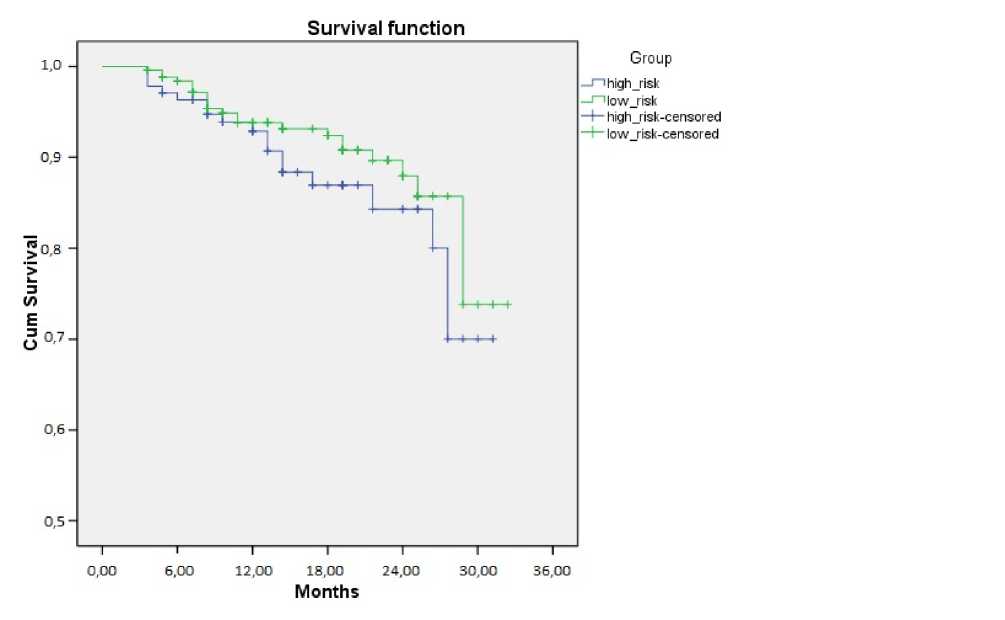
Рис. 1. Анализ безрецидивной выживаемости по Каплан-Майеру в соответствии с риском прогрессии в группах после лечения HIFU
Обсуждение. В России локализованный РПЖ, когда возможно радикальное лечение, выявляется только у 36,6% [1]. При этом у больных I-II стадии после проведения радикальной простатэктомии или лучевой терапии в 25-50% случаев развивается рецидив РПЖ [14]. Поэтому пациентам, не подходящим для хирургического или лучевого лечения, и с рецидивом РПЖ назначается гормональная абляция: билатеральная орхиэктомия или максимальная андрогеновая блокада. В настоящее время ни один из существующих антиандрогенных препаратов не превзошел результаты хирургической кастрации; показатели безрецидивной и общей выживаемости больных РПЖ остаются неизменными в течение нескольких десятилетий (12-24 и 24-36 месяцев соответственно) [15]. После начала гормонального лечения через 12-16 месяцев у 80-85% пациентов развивается ГРРПЖ. Гормональная терапия второй и третьей линий, химиотерапия эффективна только в 15-20% случаев и не приводит к значительному увеличению продолжительности жизни пациентов, обладая при этом существенными побочными эффектами [6, 7, 8].
Тактика и стратегия ведения пациентов с ГРРПЖ не разработаны, не существует клинически обоснованных рекомендаций. Публикации о фокальной терапии данной категории больных малочисленны, основаны на малом клиническом материале и имеют непродолжительный период наблюдений. На сегодняшний день опубликованы долгосрочные [11] и среднесрочные результаты [10, 12] HIFU терапии РПЖ. По данным европейского многоцентрового исследования, включавшего 559 пациентов с РПЖ группы низкого и умеренного риска, Thüroff и соавт. [12] сообщили об отрицательном результате биопсии после HIFU терапии у 87,2% из 288 пациентов с периодом наблюдения не менее 6 мес. Blana и соавт. оценили результаты HIFU у 146 пациентов со средним периодом наблюдения 22,5 мес. [11]. Средний дооперационный уровень ПСА составил 7,6 нг/мл, в то время как средний уровень ПСА через 3 мес. после терапии составил 0,07 нг/мл. У 93,4% из 137 больных, доступных для наблюдения, не обнаружено опухоли при биопсии зоны воздействия. В другом исследовании HIFU проводили 517 пациентам с локализированным или местно-распространенным РПЖ [13]. При медиане наблюдения пять лет безрецидивная выживаемость составила 72% для всех пациентов ( p <0,0001). В среднем, безрецидивная выживаемость зарубежных авторов составляет от 66 до 84% при сроке наблюдения от 5 до 14 лет.
В данном исследовании мы предприняли попытку оценить возможности HIFU терапии у пациентов ГРРПЖ. Полученные нами данные свидетельствуют о том, что HIFU терапия ГРРПЖ клинически эффективна. Результаты лечения показали, что при 3-летнем наблюдении HIFU терапия была в целом успешна у 90,9% пациентов. Анализ безрецидивной выживаемости по Каплан-Мееру показал 95,5 % эффективность HIFU терапии в группе с низким риском прогрессии (локализованный РПЖ) и 80% в группе с высоким риском прогрессии (местно-распространенный РПЖ). При этом отмечались умеренные краткосрочные побочные эффекты, однако у большинства пациентов улучшилось качество жизни. Тем не менее, наши исследования остаются незавершенными. Очевидно, что требуются более длительные наблюдения для оценки эффективности HIFU терапии у пациентов с ГРРПЖ.
Заключение. Ультразвуковая абляция является безопасным, малоинвазивным методом лечения локализованного и местно-распространенного гормонорезистентного рака предстательной железы, эффективным в 90% случаев, с умеренными временными побочными эффектами.
Список литературы Лечение ультразвуковой абляцией гормонорезистентного локализованного и местно-распространенного рака предстательной железы
- Давыдов М.И. Статистика злокачественных новообразований в России и странах СНГ в 2005 г./М.И. Давыдов, Е.М. Аксель//Вестник РОНЦ им. Н.Н. Блохина РАМН. -2007. -Т.18, №2. -С.1-156.
- Лопаткин Н.А. Рак предстательной железы/Н.А. Лопаткин [и др.]. -М.: НИИ урологии Минздрава РФ, 2002.
- Носов А.К. Гормонорезистентный рак предстательной железы/А.К. Носов, Н.А. Воробьев//Практическая онкология. -2008. -Т9. -№2. -С. 104-116.
- Jemal A. et al. Gender Statistics, 2010. CA Cancer J. Clin, 2010, July 7.
- Prostate Cancer Treatment Guidelines, v.2. 2010
- Tannock IF, Osoba D, Stockler MR, et al. Chemotherapy with mitoxantrone plus prednisone or prednisone alone for symptomatic hormone-resistant prostate cancer: a Canadian randomized trial with palliative end points. J Clin Oncol 1996; 14:1756-64.
- Petrylak DP, Tangen CM, Hussain MH, et al. Docetaxel and estramustine compared with mitoxantrone and prednisone for advanced refractory prostate cancer. N Engl J Med 2004; 351:1513-20.
- Tannock IF, de Wit R, Berry WR, et al. on behalf of the tax 327 Investigators. Docetaxel plus prednisone or mitoxantrone plus prednisone for advanced prostate cancer. N Engl J Med 2004; 351:1502-12.
- ASTRO. Consensus Statement. Guidelines for PSA Following Radiation Therapy. Int J Radiat Oncol Biol Phys 1997; 37: 1035-41.
- Gelet A, Chapelon JY, Bouvier R, Rouvie‘re O, Lyonnet D, Dubernard JM Transrectal high intensity focused ultrasound for the treatment of localised prostate cancer: factors influencing the outcome. Eur Urol (2001) 40: 124-129.
- Blana A, MuratFJ, Walter B, Thuroff S, Wieland WF, Chaussy C, et al. First analisys of the long-term result with High-intensity focused ultrasound with localised prostate cancer.Eur. Urol. 2008; 53: 1194 -201.
- Thuroff S, Chaussy C, Vallancien G, et al. High-intensity focused ultrasound and localized prostate cancer: efficacy results from the European multricentric study. J Endourol 2003; 17 (8): 673-7.
- Uchida T, Shoji S, Nakano M, Hongo S, Nitta M, Murota A, Nagata Y. Transrectal high-intensity focused ultrasound for the treatment of localized prostate cancer: eight-year experience. Int J Urol 2009. Nov; 16(11):881-6.
- Djavan B., Moul J.W., Zlotta A. et al. PSA progression following radical prostatectomy and radiation therapy: new standards in the new Millennium//Eur Urol. -2003. -Vol. 43, № 1. -Р. 12-27.
- Hellerstedt B.A., Pienta K.J. The current state of hormonal therapy for prostate cancer//C.A. Cancer J. Clin. -2002. -Vol. 52. -P. 154-179.


