Легочный альвеолярный протеиноз (клинический случай)
Автор: Шаповалова Т.Г., Рябова А.Ю., Шашина М.М., Межидова З.В.
Журнал: Саратовский научно-медицинский журнал @ssmj
Рубрика: Внутренние болезни
Статья в выпуске: 4 т.17, 2021 года.
Бесплатный доступ
В статье представлено клиническое наблюдение пациента с легочным альвеолярным протеинозом, редким интерстициальным заболеванием из группы болезней накопления. Клинический случай демонстрирует сложности, возникающие при диагностике этого заболевания, в том числе дифференциальной диагностике с пневмонией вследствие отсутствия патогномоничных клинических и компьютерно-томографических симптомов. Рассмотрены варианты лечебной тактики. Повышение осведомленности врачей об этой нозологии будет способствовать своевременной его диагностике и лечению.
Клинико-рентгенологические особенности, легочный альвеолярный протеиноз, лечебная тактика
Короткий адрес: https://sciup.org/149140127
IDR: 149140127 | УДК: 616.24-008.4-07-08
Текст научной статьи Легочный альвеолярный протеиноз (клинический случай)
аккумулирования в альвеолах: врожденный, вторичный и аутоиммунный, причем последний составляет более 90% всех случаев [3]. Эта форма связана с активацией иммуноглобулинов класса G к гранулоцитарно-макрофагальному колониестимулирующему фактору (ГМ-КСФ) и уменьшению количества функциональных альвеолярных макрофагов. аутоиммунной формой заболевания чаще встречается у мужчин в возрасте от 39 до 51 года. Самой редкой формой ЛАП (1 % случаев) является врожденная, связанная с мутациями в белках-рецепторах ГМ-КСФ. Выделяют также вторичную форму ЛАП, при которой антитела к ГМ-КСФ не выявляются. Этот вариант ЛАП развивается у пациентов с гемобласто- зами и первичными иммунодефицитами и составляет примерно 4-6% [3].
Цель — демонстрация клинического наблюдения пациента с легочным альвеолярным протеинозом, редкой диффузной интерстициальной патологией из группы болезней накопления.
Получено информированное согласие пациента на публикацию данных из истории болезни.
Описание клинического случая. Трудности диагностики и особенности течения ЛАП демонстрирует наше клиническое наблюдение. В пульмонологическое отделение ГУЗ «Саратовская городская клиническая больница № 8» был госпитализирован пациент 41 г. с жалобами на кашель с отделением умеренного количества слизистой мокроты в течение дня, одышку при быстрой ходьбе, подъеме на третий этаж. Проживает в городе. Из анамнеза известно, что с 2017 г. несколько раз госпитализировался в терапевтические стационары города с диагнозом «Внебольничная двусторонняя пневмония» с положительным эффектом на фоне антибактериальной терапии. За последний год периодически отмечал подъемы температуры тела до 38 ºС, появление одышки при быстрой ходьбе, подъеме по лестнице. При выполнении флюорографического обследования в феврале 2019 г. (рис. 1) выявлены инфильтративные двусторонние изменения в легких. Госпитализирован в терапевтическое отделение. Изменения в легочной ткани были расценены сначала как пневмонические, однако положительной динамики на фоне антибактериальной терапии получено не было.
При выполнении компьютерной томографии легких обнаружены множественные участки «матового стекла» и консолидации легочной ткани, расположенные как субплеврально, так и центрально, без признаков снижения легочных объемов (рис. 2). Заподозрена идиопатическая интерстициальная пневмония и для верификации диагноза рекомендована биопсия легких. В ноябре 2019 г. выполнена видеоторакоскопия с атипичной резекцией верхней доли левого легкого и биопсией лимфоузла средостения. Гистологическое исследование выявило в просветах части альвеол эозинофильный материал, тонкие межальвеолярные перегородки, с наличием крахмальных телец, в лимфатическом узле — очаговую пролиферацию гистиоцитов (рис. 3). Заключение гистологического исследования: легочный альвеолярный про-теиноз.
При поступлении в пульмонологический стационар в январе 2020 г. общее состояние пациента было расценено как удовлетворительное. Пациент эпизодически курит около 25 лет. Работал на нефтеперерабатывающем заводе в течение 17 лет. С детских лет страдал сезонной бронхиальной астмой, сенсибилизирован к пыльце деревьев. Регулярной поддерживающей противоастматической терапии не получал. В анамнезе пищевая аллергия на рыбу по типу крапивницы, отека Квинке. В 2017 г. выявлен сахарный диабет ІІ типа, уровень гликированного гемоглобина менее 6,5% достигнут. Повышенного питания (ожирение І степени): индекс массы тела 33,2 кг/м2. Частота дыхания — 16 в мин. Грудная клетка правильной формы. При аускультации легких дыхание ослабленное везикулярное. Сатурация в покое 93%. Выраженность одышки по шкале mMRS (modified Medical Research Council) составила 1 балл. Гемодинамические показатели удовлетворительные. Общий анализ крови без патологии. В биохимиче-
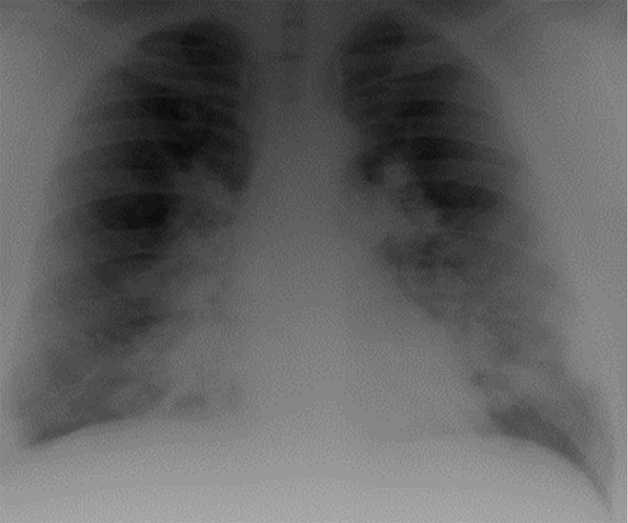
Рис. 1. Пациент 41 г. Флюорограмма в прямой проекции: инфильтративные двусторонние изменения в легочной ткани
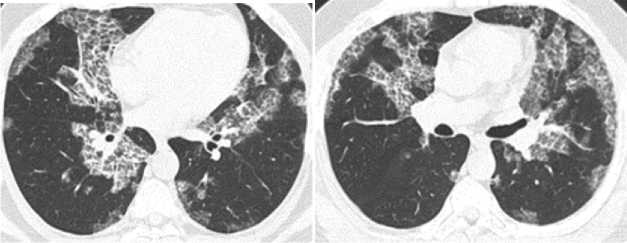
А Б
Рис. 2. Пациент 41 г. Компьютерно-томографический срез легких:
А — множественные участки «матового стекла» и консолидации легочной ткани, расположенные как субплеврально, так и центрально, без признаков снижения легочных объемов; Б — симптом «сумасшедшей исчерченности» (сrazy-paving sign)
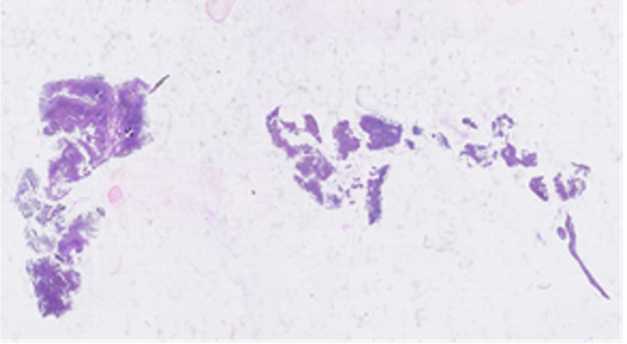
Рис. 3. Легочный альвеолярный протеиноз. В просветах части альвеол зернистый эозинофильный материал, межальвеолярные перегородки тонкие, обычного строения, встречаются крахмальные тельца ском анализе отмечено умеренное повышение лактатдегидрогеназы до 250 Ед./л. При фибробронхо-скопии выявлены признаки эндобронхита І степени. При выполнении спирометрии нарушений функции внешнего дыхания не обнаружено. При проведении теста с 6-минутной ходьбой выявлена десатурация до 85%, субъективно переносимость физической нагрузки пациент оценивал по шкале Борга на 12 бал- лов, пройденная дистанция составила 535 м (при должной длине — 603 м). Электрокардиограмма: ритм синусовый, блокада правой ветви левой ножки пучка Гиса. Допплер-эхокардиография признаков декомпенсации кровообращения не выявила, систолическое давление в легочной артерии, фракция выброса левого желудочка в пределах нормы.
Обсуждение. У данного пациента больше данных, свидетельствующих об аутоиммунном варианте ЛАП, поскольку гематологические и иммунодефицитные заболевания у него не были диагностированы, а врожденные варианты ЛАП обычно манифестируют в раннем детском возрасте [4]. Этиология ЛАП неизвестна, тем не менее обсуждается роль курения, воздействия факторов окружающей среды, включая кремнезем, тальк, цемент, каолин, алюминий, титан, индий и целлюлозу [4]. Индекс курящего человека у нашего пациента был менее 10. В течение ряда лет он имел профессиональный контакт с такими веществами, как пары этанола, нефтяные пары, эфиры, однако мы не нашли в литературе сведений о возможной связи развития ЛАП с воздействием этих веществ. Основные симптомы ЛАП — одышка и кашель [3]. Лихорадка может быть проявлением как аутоиммунного варианта ЛАП, так и вторичной инфекции. Кровохарканье, лихорадка и боль в груди — редкие симптомы при аутоиммунном ЛАП, при их наличии необходим дифференциальный диагноз [5]. Обычно заболевание прогрессирует медленно [1], но описаны и быстропрогрессирующие варианты течения [3]. У пациентов с ЛАП возможно развитие оппортунистических инфекций, в том числе бактериальных пневмоний [3]. У нашего пациента до установления диагноза на протяжении нескольких лет диагностировались внебольничные пневмонии, разрешавшиеся на фоне антибактериальной терапии.
Диагностическое значение биомаркеров для диагностики ЛАП неоднозначно. Так, уровень лактатдегидрогеназы повышался у половины пациентов с ЛАП [3], что наблюдалось и в нашем случае. Однако наиболее клинически значимым в настоящее время считается увеличение содержания антител к ГМ-КСФ более 2,8 мкг/мл [6]. Бронхоскопия со взятием жидкости бронхоальвеолярного лаважа является золотым стандартом диагностики ЛАП и у 75% пациентов позволяет подтвердить диагноз, не прибегая к открытой биопсии легких [7]. Жидкость бронхоальвеолярного лаважа при ЛАП — это маслянистая, молочно-белая, непрозрачная субстанция, которая при отстаивании образует белый осадок [8]. При цитологическом исследовании жидкости бронхоальвеолярного лаважа обнаруживаются крупные пенистые макрофаги. Они содержат эозинофильные гранулы и внеклеточный глобулярный гиалиновый материал, который окрашивается Шифф-йодной кислотой в лилово-пурпурный цвет [9]. Еще одним важным методом диагностики является компьютерная томография легких, хотя патогномоничных радиологических признаков ЛАП нет. Могут быть обнаружены такие симптомы, как уплотнения паренхимы легких по типу «матового стекла», ретикулярные изменения, а также паттерн «булыжной мостовой» (paving stonesign) или «сумасшедшей исчерченности» (crazy-paving). Последний характеризуется утолщением междольковых перегородок в участках повышения плотности по типу «матового стекла» [10], признаки которого имелись и у нашего пациента (рис. 2). Вместе с тем появление симптома «crazy-paving» может быть связано и с другими патологическими процессами, в том числе гиперчувствительным пневмонитом, аденокарциномой, инфекциями [10]. Так, опыт ведения пациентов с двусторонними изменениями в легких в условиях пандемии показал, что ретикулярные изменения на фоне «матового стекла» превалируют при новой коронавирусной инфекции, вызванной вирусом SARS-CoV-2, и встречаются чаще, чем «матовое стекло» и консолидаты [11]. У нашего пациента было принято решение для выполнения открытой биопсии легких с целью дифференциальной диагностики с опухолевым процессом, а также гиперчувствительным пневмонитом, учитывая характер его профессиональной деятельности.
В настоящее время стандартным методом терапии аутоиммунного ЛАП является проведение лечебного тотального бронхоальвеолярного лаважа [9]. Тотальный бронхоальвеолярный лаваж показан при наличии симптомов дыхательной недостаточности, появлении одышки в покое или наличия десатурации кислорода при выполнении теста с 6-минутной ходьбой [3]. Пациенты с легкой одышкой или без симптомов могут получать симптоматическую терапию с мониторингом легочной функции и проведением КТ легких в динамике [3]. Клинические исследования, посвященные заместительной терапии ГМ-КСФ, были проведены в конце 1990-х гг., но их результаты оказались неоднозначными. По эффективности она значительно уступала тотальному бронхоальвеолярному лаважу, однако такая терапия продолжает рассматриваться в качестве альтернативной [3]. Учитывая стабильное состояние нашего пациента, отсутствие нарушений функции внешнего дыхания по результатам спирометрии, длину пройденной дистанции в тесте с 6-минутной ходьбой 535 м при должной 603 м, было принято решение на данном этапе о наблюдательной тактике ведения пациента. Рекомендовано повторное обследование через 3 мес., включающее компьютерную томографию легких, спирометрию, по показаниям — бодиплетизмографию и диффузионный тест для решения вопроса о выполнении тотального бронхоальвеолярного лаважа.
Заключение. Представленное клиническое наблюдение иллюстрирует трудности диагностики ЛАП ввиду редкости данной патологии, а также отсутствия патогномоничных клинических и компьютернотомографических симптомов. Верификация диагноза у нашего пациента стала возможна только после проведения открытой биопсии легкого.
Список литературы Легочный альвеолярный протеиноз (клинический случай)
- Il’inskiy VI, Shamsutdinova NG, Nurullina GI, et al. Alveolar proteinosis as a rare case of in the practice of a pulmonologist. Practical medicine 2018; 16 (7): 133–5. Russian (Ильинский В. И., Шамсутдинова Н. Г., Нуруллина Г. И. и др. Альвеолярный протеиноз как редкий случай в практике врача-пульмонолога. Практическая медицина 2018; 16 (7): 133–5).
- Brimkulov NN, Stepanyan IE, Tarabrin YeA, et al. Pulmonary alveolar proteinosis: clinical case and litarature review. Meditsina Kyrgyzstana 2017; (4): 7–14. Russian (Бримкулов Н. Н., Степанян И. Э., Тарабрин Е. А. и др. Легочный альвеолярный протеиноз: клинический случай и обзор литературы. Медицина Кыргызстана 2017; (4): 7–14).
- Anayev EKh. Pulmonary alveolar proteinosis: diagnosis and treatment. Practical Pulmonology 2019; (2): 34–42. Russian (Анаев Э. Х Легочный альвеолярный протеиноз: диагностика и лечение. Практическая пульмонология 2019; (2): 34–42).
- Lev NS, Rozinova NN, Shmelev EI. Interstitial lung diseases in children. Russian Bulletin of Perinatology and Pediatrics 2014; 59 (1): 15–21. Russian (Лев Н. С., Розинова Н. Н., Шмелев Е. И. Интерстициальные болезни легких у детей. Российский вестник перинатологии и педиатрии 2014; 59 (1): 15–21).
- Borie R, Danel C, Debray MP, et al. Pulmonary alveolar proteinosis. European Respiratory Review 2011; 20 (120): 98–107.
- Nishimura M, Yamaguchi E, Takahashi A, et al. Clinical significance of serum anti-GM–CSF autoantibody levels in autoimmune pulmonary alveolar proteinosis. Biomarkers in Medicine 2018; 12 (2): 151–9.
- Kamboj A, Lause M, Duggirala V. Severe pulmonary alveolar proteinosis in a young adult. The American Journal of Medicine 2018; 131 (5): e199–200.
- McElvaney OJ, Horan D, Franciosi AN, et al. Pulmonary alveolar proteinosis. QJM: Monthly Journal of the Association of Physicians 2018; 111 (3): 185–6.
- Borie R, Danel C, Debray MP, et al. Pulmonary alveolar proteinosis. European Respiratory Review 2011; 20 (120): 98–107.
- Hansell DM, Bankier AA, MacMahon H, et al. Fleischner Society: Glossary of terms for Thoracic Imaging. Radiology 2008; 246 (3): 697–722. DOI: 10.1148 / radiol. 2462070712.
- Vinokurov AS, Belenkaya OI, Zolotova EA, et al. Differential diagnosis of bilateral lungs opacities in the hospital for admission of community-acquired pneumonia — not only COVID-19. Medical visualization 2020; 24 (2): 79–95. Russian (Винокуров А. С., Беленькая О. И., Золотова Е. А. и др. Дифференциальная диагностика двусторонних изменений легких на опыте стационара по приему внебольничных пневмоний — не только COVID-19. Медицинская визуализация 2020; 24 (2): 79–95).


