Лейкоцитарный профиль у экспериментальных животных при моделировании раневого процесса в условиях низкогорья и в период деадаптации к высокогорью
Автор: Ниязов Батырхан Сабитович, Мамакеев Ж.Б., Сабитов А.А., Маманов Н.
Журнал: Бюллетень науки и практики @bulletennauki
Рубрика: Медицинские науки
Статья в выпуске: 11 т.6, 2020 года.
Бесплатный доступ
В статье представлен лейкоцитарный профиль у экспериментальных животных при моделирование раненого процесса в условиях низкогорья и в период деадаптации к высокогорью. Животные были разделены на 3 серии: I серия - контрольная, постоянно обитающие в условиях г. Бишкек; II серия - опытная, после 3-х дневного пребывания на экспериментальной высокогорной базы КГМА им. И. К. Ахунбаева в составе ЦНИЛ, перемещенные в условия г. Бишкек с последующим моделированием и наблюдением за течением раневого процесса; III серия - опытная, после 30-ти дневного пребывания на экспериментальной высокогорной базы КГМА им. И. К. Ахунбаева в составе ЦНИЛ, перемещенные в условия г. Бишкек с последующим моделированием и наблюдением за течением раневого процесса. Анализ полученных лейкограмм показывает, что в группе гнойного воспаления в период деадаптации к высокогорью после кратковременного пребывания в горах на 3-е сутки исследования отмечается лейкоцитоз, в ходе исследования отмечено снижение данного показателя и на 30-й день не достигал нормы.
Высокогорье, деадаптация, раневой процесс
Короткий адрес: https://sciup.org/14117669
IDR: 14117669 | УДК: 612.112:616-001.4-092.9:612.275.9 | DOI: 10.33619/2414-2948/60/28
Текст научной статьи Лейкоцитарный профиль у экспериментальных животных при моделировании раневого процесса в условиях низкогорья и в период деадаптации к высокогорью
Бюллетень науки и практики / Bulletin of Science and Practice
УДК 612.112:616-001.4-092.9:612.275.9
Проблема лечения гнойных ран сохраняет актуальность, несмотря на то, что в последние десятилетия в области экспериментальной и клинической медицины достигнуты, безусловно, определенные успехи [1–2]. Поверхность раны не является стерильной и колонизирована многочисленными патогенными микроорганизмами [3]. Среди всех хирургических больных раневая инфекция встречается у 35–45% больных [4–5].
В последнее время было отмечено, что любые изменения природной среды (урбанизация, естественные и техногенные катастрофы) имеют влияние на течение раневого процесса, так как влияют на изменение биологических свойств раневой микрофлоры и иммунной защиты человека [6–8]. Условия высокогорья и другие природные особенности не являются исключением.
Проблемы механизмов адаптации организма человека и животных к факторам высокогорья, особенно в Киргизской Республике, являются актуальными [9–10].
Актуально является цитологическая оценка динамики репаративных процессов экспериментальных ран в ходе лечения в период деадаптации к высокогорью.
Цель исследования — на основании цитологического исследования определить влияние мази «Левомеколь» на течение раневого процесса в период деадаптации к высокогорью.
Материал и методы исследования
С целью выполнения поставленных целей и задач исследования соответственно плану были проведены ряд экспериментов и лабораторных исследований на базе Проблемной научно-исследовательской лаборатории клинической и экспериментальной хирургии Национального хирургического центра Министерства здравоохранения Кыргызской Республики и экспериментальной высокогорной базы КГМА им. И. К. Ахунбаева в составе Центральной научно-исследовательской лаборатории на перевале Туя-Ашуу.
Материалом исследования для эксперимента послужили 150 беспородных половозрелых разнополых кроликов весом 3,5–4,0 кг. Все животные прошли обязательную вакцинацию, дегельминтизацию и выдерживания в карантине сроком 21 день.
Дизайн исследования, основные правила содержания и ухода были согласованны с Комитетом по Биоэтике КГМА им. И. К. Ахунбаева. Лабораторные животные содержались в равных условиях вивария, одинаковом уходе руководствуясь базисными нормативными документами: «Санитарные правила по устройству, оборудованию и содержанию экспериментально-биологических клиник (вивариев)» и в соответствии с нормативами ГОСТ «Содержание экспериментальных животных в питомниках НИИ» 1978 г. Кормление осуществлялось по нормам, установленным приказом Минздрава СССР №1179 от 10.10.1983 г. «Об утверждении нормативов затрат кормов для лабораторных животных в учреждениях здравоохранения», со свободным доступом к воде.
Опыты выполнялись в соответствии с правилами лабораторной практики (GLP) (приказ №708 от 23 августа 2010 г. «Об утверждении правил лабораторной практики»); правилами гуманного обращения с животными, регламентированных «Правилами проведения работ с использованием экспериментальных животных», утвержденных Приказом МЗ СССР №742 от 13.11.84 г. «Об утверждении правил проведения работ с использованием экспериментальных животных»; на основании положений изложенных в Хельсинской декларации Всемирной медицинской ассоциации норм асептики и антисептики 1964 г., дополненной в 1975, 1983, 1989 гг. и с учетом требований Европейской конвенции о защите позвоночных животных, используемых для экспериментов или иных научных целей (Страсбург, 18 марта 1986 г.).
Все оперативные вмешательства проводились под общим наркозом с соблюдением правил асептики и антисептики. С целью введения лабораторных животных в медикаментозный сон использовался Кетамин в/в, из расчета 7 мг/кг веса.
У экспериментальных животных раневой процесс вызывался по методике описанным ниже.
Животные были разделены на 3 серии:
I серия — контрольная серия, кролики (50 особей), постоянно обитающие в условиях г. Бишкек;
II серия — опытная серия, кролики (50 особей), после 3-х дневного пребывания на экспериментальной высокогорной базы КГМА им. И. К. Ахунбаева в составе ЦНИЛ, перемещенные в условия г. Бишкек с последующим моделированием и наблюдением за течением раневого процесса;
III серия — опытная серия, кролики (50 особей), после 30-ти дневного пребывания на экспериментальной высокогорной базы КГМА им. И. К. Ахунбаева в составе ЦНИЛ, перемещенные в условия г. Бишкек с последующим моделированием и наблюдением за течением раневого процесса.
В каждой серии животные были разделены на 2 группы.
-
1 группа — животные, с экспериментальной моделью асептического воспаления (25 особей);
-
2 группа — животные, с экспериментальной моделью микробного воспаления (25 особей).
Методика моделирования раны
После введения животных в медикаментозный сон, животных фиксировали в положении на животе.
Асептическое воспаление моделировали путем подкожного введения в межлопаточную область 0,3 мл скипидара на вазелиновом масле. Перед этим у животных в межлопаточной области выстригали шерсть и подкожно вводили 0,5 мл воздуха [2]. Подкожное введение скипидара приводило к развитию асептического воспаления. Так, через 1 сутки от начала введения скипидара у крыс клинически развивалась картина острого воспаления с явлениями гиперемии. Очаг воспаления визуально без особенностей. В области введения скипидара отмечался выраженный отек ткани, при пальпации резко болезненный. При вскрытии обнаруживался ожог мягких тканей с элементами некроза, очаг ограничен, ярко выраженный сосудистый рисунок.
Острое гнойное воспаление моделировали по следующей методике: после предварительной подготовки операционного поля, по трафарету диаметром 50 мм, выполненному из листа рентгеновской пленки, на область планируемого разреза 1% спиртовым раствором бриллиантового зеленого наносились контуры стандартной обширной раны округлой формы в межлопаточной области. По намеченному контуру рассекалась кожа, поверхностная фасция. На дне раны надсекали мышцы скальпелем. Образовавшийся кожный лоскут стандартного размера переворачивали шерстью вниз к поверхности раневого дефекта с последующим подшиванием к свободному кожному краю и подлежащим тканям по всему периметру непрерывным швом капроновой нитью №4. Через 48 ч удаляли лоскут, после удаления лоскута наблюдалась инфицированная рана с классическими признаками воспаления [1].
Все исследования проводились на 3, 7, 15, 20 и 30 день исследования, включая в себя оценку и контроль за течением раневого процесса на основании местных клинических данных, показатели лейкоцитарной формулы по общепринятой методике, микробиологическое исследование, определение цитокинов плазмы крови в динамике раневого процесса.
Для оценки клинической картины, в указанные сроки у животных изучались динамика показателей лейкоцитарной формулы. Забор крови проводили в количестве 3,0 мл, после чего вводили в вакутейнер для забора крови. Общий клинический анализ крови с подсчетом лейкоцитарной формулы произведено в лаборатории НХЦ МЗ КР
Для статистической обработки полученных данных использовалась пакет компьютерной программы IBM SPSS 23.0. Проверку нормальности распределения количественных признаков проводили с использованием критерия Колмогорова - Смирнова. Для оценки статистической значимости различий при сравнении по количественному признаку – параметрические и непараметрические методы (ANOVA, критерий Краскаля-Уоллеса), в качестве апостериорного критерия выбран критерий Тьюки. Выборочные параметры проводимые далее обозначены следующим образом: М — среднее, s (δ) — стандартное отклонение (квадратическое отклонение), n — объем анализируемой группы. Статистически достоверным критическим значением уровня значимости считался р˂0,05.
Результаты и обсуждение
Так, в первые сутки после моделирования асептического воспаления в крови у животных установлено резкое снижение клеток лейкоцитарного пула.
В очаге воспаления отмечалась картина сильнейшего ожога мягких тканей и появление очагов некроза. По-видимому, введение скипидара для организма животных явилось сильным стрессогенным фактором, для мобилизации которого потребовалось определенное время.
Седьмые сутки исследования охарактеризовались увеличением общего содержания лейкоцитов, преимущественно за счет повышения лимфоцитов и нейтрофилов, что способствовало усилению воспалительной реакции у экспериментальных животных. Последний, четырнадцатый, срок исследования отмечен «угасанием» лейкоцитарной реакции крови, что могло свидетельствовать лишь о том, что воспаление находится на последней разрешающей стадии. Действительно, от гнойной инфильтрации тканей не оставалось и следа, поврежденная ткань оказалась полностью замещенной грануляционной тканью. Окружающая ткань оказалась без видимых повреждений.
В группах асептического воспаления лейкоцитоз по всем дням исследования был достоверно ниже, чем в группе гнойного воспаления (ГВ-Н). Так на 3-й день он составил 10,8±0,1 × 109/л (р˂0,05). В последующие дни отмечалось снижение данного показателя: на 7-ой день 11,3±0,2 х 109/л, на 15-ый день 10,6±0,2 × 109/л (р˂0,05), на 20-ый день 9,7±0,1 × 109/л (р˂0,05) и к концу исследования он равен 9,2±0,1 × 109/л (Рисунок 1.).
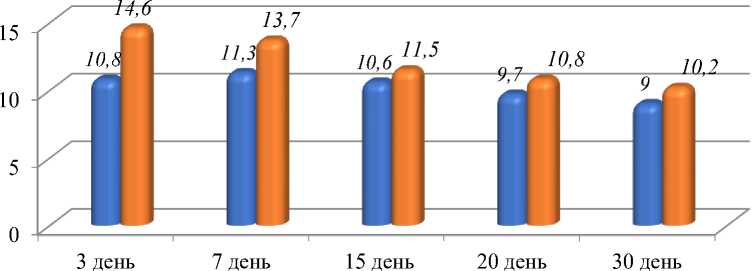
■ АВ-Н
■ ГВ-Н
Рисунок 1. Количество лейкоцитов в группах серии г. Бишкек.
Количество лейкоцитов в группе гнойного воспаления (ГВ-Н) в первые дни исследования было выше и достоверно отличалось от групп асептического воспаления.
Так, на 3-й день лечения показатель был равен 14,6±0,2 × 109/л (р˂0,005), на 7-й день — 13,7±0,3 × 109/л (р˂0,005). Однако, в последующие дни количество лейкоцитов снизилось, и достоверно было выше, чем в группе асептического воспаления (АВ-Н). Так, на 15-й день — 11,5±0,1 × 109/л (р˂0,05), на 20-й день — 10,8±0,1 × 109/л (р˂0,05) и на 30-й день лечения 10,2±0,3 × 109 /л (р˂0,05).
Из вышеизложенного следует заключить, что, инициированное скипидаром, асептическое воспаление без лечения переходит в стадию разгара на 7 сутки, тогда как к двухнедельному сроку исследования благодаря собственным защитным механизмам организма крыс завершается разрастанием грануляционной ткани. Однако следует отметить, что полного заживления раны без видимых признаков воспаления к этому сроку исследования не происходило.
В период деадаптации нами также была прослежена динамика изменения лейкоцитов и лейкоцитарной реакции крови. Так, на 3 и 7 дни наблюдения количество лейкоцитов у здоровых кроликов после 3-х дневного пребывания на высоте 3200 м над уровнем моря составило 11,4±0,09 и 11,3±0,1 × 109/л. Снижение количества лейкоцитов наблюдается в анализах, полученных на 15 и 20-ые сутки исследования, и составляло 10,8±0,1 и 10,7±0,1 × 109/л.
В начале исследования, на 3-е сутки наблюдения количество лейкоцитов в группе асептического воспаления в период деадаптации к высокогорью после 3-х дневного пребывания в горах (АВ-Д3) было равно 10,2±0,2 × 109/л (р˂0,05).
На 7-й день количество лейкоцитов в данной группе равно 11,4±0,1 × 109/л, на 15-е сутки от момента начало исследования — 10,6±0,2 × 109/л, на 20-е сутки снизилось до 9,8±0,2 × 109/л, и на 30-е сутки равен 9,2 11,5±0,1 × 109/л (р˂0,05), при этом данные были достоверно ниже, чем в остальных группах (р˂0,05).
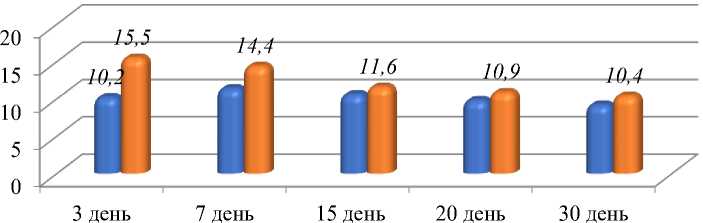
Рисунок 2. Количество лейкоцитов в группах серии деадаптации — 3 дня.
и АВ-Д3
J ГВ-Д3
Так же как и в контрольной серии, во всех группах данной серии (период деадаптации после 3-х дневного пребывания в горах) в первые дни эксперимента отмечается сдвиг лейкоформулы влево.
Заключение
Анализ полученных лейкограмм показывает, что в группе гнойного воспаления в период деадаптации к высокогорью после кратковременного пребывания в горах на 3-е сутки исследования отмечается лейкоцитоз, где составил 15,5±0,2 × 109/л (Рисунок 2). В ходе исследования отмечено снижение данного показателя и на 7-й день эксперимента равен — 14,4±0,2 × 109/л (р˂0,05), 15-й день — 11,6±0,1 × 109/л (р˂0,05), 20-й день — 10,9±0,2 × 109/л (р˂0,05), и на 30-й день не достигал нормы и равен был — 10,4 ±0,3 × 109/л (р˂0,05).
Список литературы Лейкоцитарный профиль у экспериментальных животных при моделировании раневого процесса в условиях низкогорья и в период деадаптации к высокогорью
- Луцевич О. Э. Современные взгляды на патогенез и лечение гнойных ран // Хирургия. 2011. №5. С. 72-77.
- Мохова О. С. Современные методы лечения гнойных ран // Журнал анатомии и гистопатологии. 2013. Т. 2. №4. С. 15-21.
- Плотников Ф. В. Комплексное лечение пациентов с гнойными ранами в зависимости от способности микроорганизмов-возбудителей формировать биопленку // Новости хирургии. 2014. Т. 22. №5. С. 575-581. DOI: 10.18484/2305-0047.2014.5.575
- Блатун Л. А. Местное медикаментозное лечение ран // Хирургия. 2011. №4. С. 51-59.
- Воронин А. С. Применение раневых покрытий в комплексном лечении ран и раневой инфекции кожи и мягких тканей // Аспирантский вестник Поволжья. 2010. №7-8. С. 158-161.
- Толстов А. В. Новиков И. В. Подсевалова И. В. Анализ современных способов местной профилактики и лечения ограниченных ожогов в Самарском регионе // Известия Самарского научного центра Российской Академии наук. 2015. Т. 17. №5 (3). С. 879-882.
- Войнов В. В., Вербицкий Е. В. Исследование сомнологических аспектов острой адаптации человека к высокогорью // Физиология человека. 2014. Т. 40. №6. С. 46-57. DOI: 10.7868/S013116461405018X
- Илиаджиева Л. М., Мадаминова М. А. Состояние вкусового анализатора и его роль в адаптации организма человека к высокогорью // Вестник КГМА им. И.К. Ахунбаева. 2011. №4. С. 59-62.
- Муратов Ж. К. Влияние высокогорных факторов на организм человека // Новое слово в науке: перспективы развития. 2016. №1-1 (7). С. 129-133.
- Покровский М. П., Макарова М. С. Цитология раневого экссудата как показатель процесса заживления. М.: Медгиз., 1942. С. 42.


