Лекарственная устойчивость и частота выделения бактерий рода Proteus у больных хроническим остеомиелитом
Автор: Розова Л.В., Науменко З.С., Клюшин Н.М., Аранович А.М.
Журнал: Гений ортопедии @geniy-ortopedii
Рубрика: Оригинальные статьи
Статья в выпуске: 3, 2003 года.
Бесплатный доступ
Изучены частота выделения и чувствительность к антибиотикам 218 штаммов Proteus spp., выделенных у больных хроническим остеомиелитом. Показано, что из 17 тестировавшихся антибиотиков наибольшей активностью обладают цефотаксим, цефтазидим, амикацин и ципрофлоксацин. Сравнительный анализ полученных данных с данными 1982-1983 гг. показал, что частота выделения протеев у больных хроническим остеомиелитом к 2000-2001 гг. снизилась на 29,7%.
Хронический остеомиелит, микробиологическое исследование, антибиотикочувствительность
Короткий адрес: https://sciup.org/142120639
IDR: 142120639
Текст научной статьи Лекарственная устойчивость и частота выделения бактерий рода Proteus у больных хроническим остеомиелитом
В структуре последствий гнойных осложнений после ортопедо-травматологических операций остеомиелит занимает одно из ведущих мест. Данные литературы последних лет свидетельствуют, что в возникновении гнойновоспалительных заболеваний значительно возросла роль грамотрицательных микроорганизмов. Особую актуальность приобретают инфекции, вызванные условно-патогенными грамот-рицательными микроорганизмами, включая бактерии рода Proteus . Показано, что при острых гнойных процессах протей выявляется в монокультуре у 3,4% больных, а при хронических гнойных процессах этот показатель возрастает до 26,2% [2, 3, 6, 14].
Микрофлора остеомиелитического очага имеет полимикробный характер. Протей, находясь в ране с другими возбудителями, усугубляет тяжесть гнойного процесса и способствует отягощению инфекции. Микробный синергизм может быть направлен против лечебных препаратов или снижать резистентность организма [11]. Namavar и сотрудники продемонстрирова- ли, что Bacteroides fragilis, выделяя во внешнюю среду особые вещества, защищает в смешанной культуре P. mirabilis от бактерицидного действия человеческих лейкоцитов [15]. В то же время протей, обладающий высокой резистентностью к антибиотикам, защищает чувствительные бактерии от действия антибактериальных препаратов.
В этиологии внутрибольничной инфекции основное значение имеют штаммы с множественной лекарственной устойчивостью. Известно, что структура антибиотикорезистентности возбудителей различается в зависимости от географического района их выделения и меняется с течением времени [13]. Сведения о распространенности устойчивых микроорганизмов на территории России значительно различаются в зависимости от профиля стационара и категории обследуемых больных. Так, например, чувствительность Proteus spp. к одному из широко распространенных антибиотиков – ампициллину – варьирует от 0 до 58,9% [10, 13].
В связи с изложенным выше, цель настояще- го исследования – оценка частоты выделения бактерий рода Proteus у больных хроническим остеомиелитом в крупном ортопедо- травматологическом стационаре и характеристика чувствительности клинических штаммов к лекарственным препаратам.
МАТЕРИАЛ И МЕТОДЫ
Исследование проводилось на базе отделения гнойной ортопедии Российского научного центра “Восстановительная травматология и ортопедия” (РНЦ “ВТО”), г. Курган. Отделение развернуто на 70 коек и специализируется на лечении больных с гнойной инфекцией опорнодвигательного аппарата. Обследование проводилось в 2000-2001 гг. Полученные результаты сравнивались с имеющимися в лаборатории данными 1982-1983 гг. В общей сложности из
683 проб отделяемого ран и свищей больных хроническим остеомиелитом выделено 218 штаммов Proteus spp., которые послужили объектом исследования. Выделение, родовую и видовую идентификацию бактериальных культур проводили согласно руководствам [4, 12]. Чувствительность к антибиотикам определяли методом диффузии в агар с использованием стандартных дисков и среды АГВ [7].
РЕЗУЛЬТАТЫ И ОБСУЖДЕНИЕ
В 1982-1983 гг. бактерии рода Proteus были обнаружены в 184 пробах из 467 исследованных, что составило 39,4%. Протей был изолирован у 47,3% лечившихся больных. Подавляющее большинство культур (83,7%) по комплексу признаков относилось к виду P. mirabilis . Кроме этого вида были выявлены P. morganii (7,6%), P. vulgaris (6,5%) и P. rettgeri (1,6%). К 2000-2001 гг. частота выделяемости протея снизилась – протей был обнаружен в 19% исследованных проб у 17,6% больных. Видовой спектр изолированных штаммов изменился незначительно: так же, как и 20 лет назад, среди выделенных штаммов преобладал P. mirabilis , однако удельный вес этого вида еще более возрос и составил 94%, одновременно снизилась частота встречаемости других видов ( P. vulgaris – 3% и P. penneri – 3%).
Заслуживает внимания тот факт, что феномен «роения», клиническая значимость которого полностью не выяснена, наблюдался у 8% штаммов, изолированных в 1982-1983 гг., тогда как в 2000-2001 гг. эта особенность была характерна почти для всех (94,3%) изученных штаммов.
Основу лечения гнойно-воспалительных заболеваний, вызываемых представителями семейства Enterobacteriaceae, к которому относится род Proteus, в настоящее время составляют бета-лактамные антибиотики. Для энтеробактерий характерно широкое распространение устойчивости, связанной с продукцией бета-лактамаз (плазмидных широкого и расширенного спектров, а также хромосомных) [7]. Для P. mirabilis характерна продукция плазмидной бета-лактамазы класса А. Плазмиды с геном резистентности склонны к быстрому распространению. Клиницисты отмечают, что формирование резистентности госпитальных штаммов микроорганизмов, обусловленной продукцией бета-лактамаз, к традиционным беталактамным пре- паратам значительно снижает эффективность лечения больных с различными гнойными инфекциями. Это группа больных с обширными посттравматическими ранами, трофическими язвами, хроническим остеомиелитом и пр., длительно получающих антибактериальную терапию в стационарных условиях [5].
Для полной характеристики чувствительно-сти/резистентности к лекарственным препаратам бактерий, выделенных у больных в 2000-2001 гг., было протестировано 17 антибиотиков (табл. 1).
Изученные штаммы протеев проявили резистентность к действию следующих β-лактамных антибиотиков: бензилпенициллину, ампициллину – 100% культур, карбенициллину – 66,7% и пиперациллину – 54,5% культур. Устойчивость к цефа-золину и цефалексину – цефалоспоринам I поколения – составила соответственно 64,3% и 85,7%.
В то же время была отмечена высокая активность цефалоспоринов III поколения, содержащих ингибиторы, способные подавлять плаз-мидные бета-лактамазы широкого спектра класса А. Все изученные штаммы протеев проявили чувствительность к действию цефотаксима и цефтазидима: соответственно в 15,4% и 21,4% – умеренную, в остальных случаях – высокую.
Чувствительность протеев к аминогликозидам различалась в зависимости от препарата, как это видно из данных, представленных в таблице. Высокой активностью против представителей Proteus обладал амикацин. Отметим, что не выявлено ни одного штамма, резистентного к этому препарату. Из литературных источников известно, что аминогликозиды обладают мощным и более быстрым, чем беталактамные антибиотики, бактерицидным действием. Они активно проникают через клеточную мембрану микробной клетки, вызывая нарушение синтеза белка микробной клетки и ее гибель [8].
Таблица 1
Чувствительность к антибиотикам бактерий рода Proteus , выделенных у больных хроническим остеомиелитом в 2000-2001 гг.
|
Антибиотики |
Всего изучено штаммов |
S |
I |
R |
|||
|
абс. |
% |
абс. |
% |
абс. |
% |
||
|
Бета-лактамы Пенициллины бнзилпенициллин |
51 |
- |
- |
- |
- |
51 |
100 |
|
ампициллин |
14 |
- |
- |
- |
- |
14 |
100 |
|
карбенициллин |
3 |
- |
- |
1 |
33,4 |
2 |
66,6 |
|
азлоциллин |
4 |
2 |
50 |
1 |
25 |
1 |
25 |
|
пиперациллин |
11 |
4 |
36,4 |
1 |
9,1 |
6 |
54,5 |
|
Цефалоспорины первого поколения цефазолин |
14 |
2 |
14,3 |
3 |
21,4 |
9 |
64,3 |
|
цефалексин |
14 |
- |
- |
2 |
14,3 |
12 |
85,7 |
|
третьего поколения цефотаксим |
29 |
24 |
82,8 |
5 |
17,2 |
- |
- |
|
цефтазидим |
14 |
11 |
78,6 |
3 |
21,4 |
- |
- |
|
Аминогликозиды канамицин |
50 |
7 |
14,0 |
6 |
12,0 |
37 |
74,0 |
|
гентамицин |
51 |
24 |
47,0 |
3 |
6,0 |
24 |
47 |
|
амикацин |
13 |
13 |
100 |
- |
- |
- |
- |
|
Тетрациклины тетрациклин |
51 |
2 |
3,9 |
2 |
3,9 |
47 |
92,2 |
|
Полимиксины полимиксин |
50 |
1 |
2,0 |
1 |
2,0 |
48 |
96,0 |
|
Хинолоны ципрофлоксацин |
40 |
235 |
85,7 |
2 |
5,0 |
3 |
7,5 |
|
Линкозамины линкомицин |
37 |
- |
- |
- |
- |
37 |
100 |
|
Другие препараты хлорамфеникол |
40 |
3 |
7,5 |
2 |
5,0 |
35 |
87,5 |
Примечание: S – чувствительные; I – умеренно чувствительные; R – устойчивые.
Активным антибиотиком в отношении Proteus spp. являлся ципрофлоксацин, относящийся к хинолонам: к нему были чувствительны 92,5% изолятов. Однако исследователи отмечают, что повсеместное использование фтор-хинолонов, начиная с 1993 года, привело к появлению резистентности к ципрофлоксацину и офлоксацину [1]. Резистентность к фторхиноло-нам опосредуется аминокислотными заменами в бактериальных ферментах, приводящими к накоплению мутаций и снижению активности фторхинолонов. Гены ферментов локализованы на хромосоме, следовательно, распространение резистентности происходит преимущественно на фоне мощного селективного прессинга антимикробными препаратами. При отсутствии препарата резистентные клоны, как правило, вытесняются чувствительными. В связи с этим во избежание снижения клинической эффективности фторхинолонов рекомендуется комплекс мероприятий по ограничению их применения на догоспитальном этапе.
К хлорамфениколу, тетрациклину, полимиксину, линкомицину оказались резистентны 88 – 100% штаммов.
Сравнительный анализ лекарственной устойчивости протеев к действию антибактериальных препаратов, тестировавшихся как в 1982-1983 гг., так и в 2000-2001 гг. показал, что частота выделения резистентных штаммов либо значительно возросла, либо не изменилась и осталась на высоком уровне (рис. 1). Так, если в начале 80-х годов штаммы, устойчивые к ампициллину, выявлялись в 31% случаев, то в 2000-2001 гг. все изученные штаммы были резистентны к этому препарату. На 60,6% увеличилась частота выделения штаммов, устойчивых к действию карбе-нициллина, на 34% – к действию гентамицина. За 20 лет еще более снизилась эффективность лин-комицина, левомицетина и полимиксина. Не эффективны в отношении протея бензилпенициллин, тетрациклин. Отметим, что по результатам сходного исследования, проведенного в отделении гнойной ортопедии РНЦ «ВТО» в начале 1990-х годов, протеи характеризовались также низкой чувствительностью к антибиотикам, однако к действию ряда препаратов (ампициллин, карбенициллин, канамицин) от 37 до 43% изолированных штаммов сохраняли чувствительность, а гентамицин был одним из самых активных препаратов и подавлял рост 90% штаммов [6], тогда как в настоящее время к этому антибиотику проявляют хорошую чувствительность лишь 47% штаммов. Подобные результаты свидетельствуют о динамичном формировании резистентности бактерий в условиях стационара. Мониторинг чувствительности протеев к антибактериальным препаратам, проводимый в клинических лабораториях, позволяет своевременно оценить уровень лекарственной устойчивости этого возбудителя и является обоснованием для изменения схемы антибиотикотерапии больных хроническим остеомиелитом.
0 "
ПЕН ЛИН ТЕТ КАН
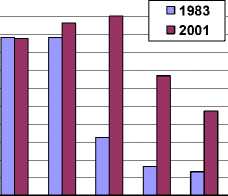
ЛЕВ ПОЛ АМП КАР ГЕН
ПЕН – бензилпенициллин, ЛИН – линкомицин
ТЕТ – тетрациклин, КАН – канамицин, ЛЕВ – левомицетин, ПОЛ – полимиксин, АМП – ампициллин, КАР – карбенициллин, ГЕН – гентамицин.
Рис. 1. Устойчивость изолятов Proteus spp. у больных хроническим остеомиелитом к действию антибиотиков (% резистентных штаммов)
Таким образом, несмотря на то, что в последние годы были внедрены в клиническую практику новые антибактериальные препараты с различными, порой уникальными фармакологическими свойствами (защищенные пенициллины, цефалоспорины III и IV поколений, карба-пенемы, фторхинолоны, новые макролиды и др.), прогресс медицинской науки незамедлительно сказался на эволюции микроорганизмов и способствовал появлению полирезистентных штаммов. По результатам бактериологического обследования можно констатировать резистент- ность протея к большинству изученных препаратов. Общеизвестно, что грамотрицательные бактерии в целом более устойчивы, чем грампо-ложительные, к антибактериальным агентам и вообще ксенобиотикам. Эту “присущую от природы” относительную резистентность грамот-рицательных бактерий принято объяснять наличием в их оболочке дополнительного барьера проницаемости – внешней мембраны [9, 16]. Длительное сохранение гнойного очага, бессистемное применение антибактериальных препаратов неизбежно приводит к селекции в остеомиелитическом очаге госпитальной флоры, резистентной к традиционно используемым группам антибиотиков. Высокая устойчивость к антибактериальным препаратам характеризует протей как опасного и проблемного возбудителя, особенно при продолжительной госпитализации пациентов в условиях стационара.
Проведенное исследование показало, что бактерии рода Proteus , выделяемые у больных хроническим остеомиелитом, сохраняют высокую чувствительность к действию цефотаксима, цефтазидима, амикацина и ципрофлоксацина. При эмпирической терапии (до получения данных микробиологического исследования у конкретного больного) представляется нецелесообразным применение антибиотиков «старого» поколения в связи с риском инфекции, вызванной устойчивыми возбудителями.


