Лекарственное поражение печени после пульс-терапии метилпреднизолоном: описание клинического случая
Автор: Шумская Ю.Ф., Нефедова Т.С., Ахмедзянова Д.А., Бакирханов Д.С., Газизова Ю.А., Мнацаканян М.Г.
Журнал: Сибирский журнал клинической и экспериментальной медицины @cardiotomsk
Рубрика: Клинические случаи
Статья в выпуске: 3 т.37, 2022 года.
Бесплатный доступ
Приведен клинический случай развития острого гепатита, подтвержденного гистологическим исследованием биоптатов печени. Пациентке 24 лет в связи с дебютом рассеянного склероза проведена пульс-терапия метилпреднизолоном, при контроле через 15 дней показатели печеночных ферментов в пределах нормы. При обследовании через 2 мес. в анализах крови отмечено развитие синдрома цитолиза. Исключены очевидные причины гепатита, для верификации диагноза выполнена биопсия печени, по данным которой выявлена картина острого гепатита высокой гистологической активности с развитием субмассивных некрозов. Ситуация трактована как лекарственное поражение печени после пульс-терапии метилпреднизолоном. На фоне терапии пероральным преднизолоном процесс купирован. Представленный клинический случай описывает развитие тяжелого острого гепатита после пульс-терапии высокими дозами метилпреднизолона у пациентки с дебютом рассеянного склероза.
Лекарственное поражение печени, метилпреднизолон, пульс-терапия, гепатотоксичность, рассеянный склероз, описание случая
Короткий адрес: https://sciup.org/149141302
IDR: 149141302 | УДК: 616.36-085.065.099 | DOI: 10.29001/2073-8552-2022-37-3-144-148
Текст научной статьи Лекарственное поражение печени после пульс-терапии метилпреднизолоном: описание клинического случая
Лекарственные поражения печени (ЛПП) – это повреждения печени, вызванные лекарственными препаратами или их метаболитами. ЛПП представляют собой наиболее частую причину развития острой печеночной недостаточности, которая может приводить к необходимости трансплантации печени [1, 2]. Сложности для клиницистов заключаются в невозможности предугадать развитие поражения печени, а также в отсутствии специфических диагностических тестов. Это приводит к вынужденной необходимости рассмотрения ЛПП в качестве диагноза исключения, способствует увеличению периода времени от начала заболевания до инициации терапии, а также к продолжению применения токсичных препаратов. Последнее особенно актуально в отношении использования кортикостероидов, так как именно препараты этой группы являются терапией первой линии для лечения тяжелых гепатитов, в частности аутоиммунного генеза [3], в связи с чем недооцениваются возможные риски ЛПП вследствие приема этой группы препаратов. Высокие дозы метилпреднизолона внутривенно активно используются для лечения острых периодов различных аутоиммунных заболеваний, например, рассеянного склероза [4]. Мы приводим клинический случай развития острого гепатита, подтвержденного гистологическим исследованием биоптатов печени после лечения дебюта рассеянного склероза пульс-терапией метилпреднизолоном.
Клинический случай
Пациентка 24 лет в марте 2020 г. отметила онемение кожи передней поверхности туловища, затем конечностей. В июне 2020 г. выполнена МРТ головного мозга: МР-признаки многоочагового поражения супра- и инфратенториальных структур головного мозга, удовлетворяющих критериям пространственного и временного распространения MAGNIMS 2016 и McDonald 2017, характерных для проявлений рассеянного склероза с наличием активных очагов. В связи с дебютом рассеянного склероза проведена пульс-терапия метилпреднизолоном (1000 мг в/в в течение 5 дней), при контроле через 15 дней показатели печеночных ферментов в пределах нормы. При обследовании перед началом терапии интерфероном бета 1а в августе 2020 г. в анализах крови отмечено повышение АЛТ до 204,2 ед/л (при норме до 31), АСТ 121,2 ед/л (при норме до 33) при нормальных показателях ЩФ, ГГТ и билирубина. Контроль анализов через 2 нед.: АЛТ 1679 ед/л, АСТ 681 ед/л, ГГТ 48 ед/л (при норме до 73), ЩФ 49 ед/л (при норме до 360), билирубин общий 43,6 мкмоль/л (при норме до 21), непрямой 29,4 мкмоль/л (при норме до 15). Исключены вирусные гепатиты: anti-HAV IgM, anti-HEV IgM, HbsAg, anti-HCV, anti-HIV, anti-CMV IgM, EBV VCA IgG отрицательны. Ультразвуковое исследование (УЗИ) органов брюшной полости: дисфор-мия желчного пузыря, признаки взвеси в желчном пузыре. При тщательном расспросе исключен алкогольный генез поражения, лекарственных препаратов, биологически активных добавок и растительных средств пациентка не принимала. Начата терапия адеметионином перорально 1200 мг/сут. В анализах крови через неделю: АЛТ 1903 ед/л, АСТ 926 ед/л, ГГТ 71 ед/л, билирубин общий 41,5 мкмоль/л. Пациентка госпитализирована в гастроэнтерологическое отделение.
При поступлении предъявляла жалобы на желтушность склер, кожных покровов, общую слабость. Общее состояние относительно удовлетворительное, при осмотре кожные покровы физиологической окраски, иктеричность склер. Печень не увеличена. В анализах крови: АЛТ 1475 ед/л, АСТ 620 ед/л, ГГТ 70 ед/л, ЩФ 136 ед/л, общий билирубин 47,2 мкмоль/л, прямой билирубин 12 мкмоль/л (при норме до 5). Показатели функции почек, СРБ, иммуноглобулины, электрофорез белков, сывороточный церулоплазмин – в пределах референса. При исследовании серологических маркеров аутоиммунного гепатита: SLA/ LP, LC-1, LKM-1, gp210, PML, Sp100, M2-3E, AMAM2, SSA/ Ro-52 отрицательны.
Выполнена трепан-биопсия печени. По результатам гистологического исследования: дольковое и балочное строение прослеживается не везде. Единичные внутри-дольковые некрозы гепатоцитов (от 1–3 до 5–6 клеток) с лимфо-макрофагальной инфильтрацией. Значительное количество центрилобулярных сливающихся некрозов гепатоцитов с лимфо-макрофагальной (с примесью эозинофилов и нейтрофилов) инфильтрацией, занимающих от половины до 2/3 площади долек. В этих участках отмечается резорбция детрита с оголением стромы печени, очаговые кровоизлияния, скопления макрофагов, заполненных цероидом, окрашенным билирубином (рис. 1, 2).
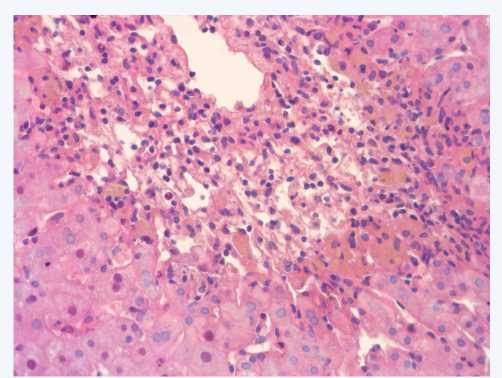
Рис. 1. Центрилобулярные некрозы гепатоцитов с лимфо-макрофагальной инфильтрацией. Окраска гематоксилин/эозин. Увеличение × 400
Fig. 1. Centrilobular necrosis of hepatocytes with lymphocyte and macrophage infiltration. Hematoxylin/eosin staining. 400× magnification
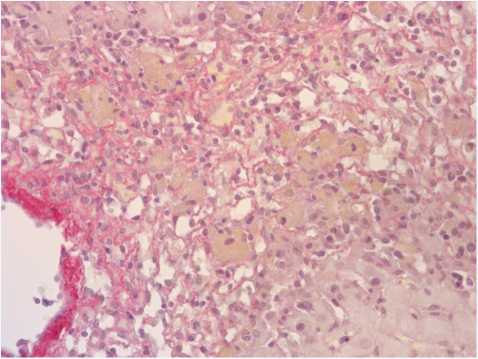
Рис. 2. Резорбция детрита с оголением стромы печени, скопления макрофагов, заполненных цероидом, окрашенным билирубином. Окраска гематоксилин/эозин. Увеличение × 250
Fig. 2. Detritus resorption with liver stroma exposure. Clusters of macrophages filled with a ceroid stained with bilirubin. Hematoxylin/eosin staining. 250× magnification
Умеренная диффузная гипертрофия и очаговая гиперплазия клеток стенки синусоида, морфологическая картина острого гепатита высокой гистологической активности с развитием субмассивных некрозов в стадии резорбции, индекс гистологической активности по Knodell: 10-3-1-1 (15); стадия фиброза 1. Несмотря на низкий показатель по шкале RUCAM (2 балла), говорящий о низкой вероятности связи поражения печени и приема препарата, предположено развитие отсроченного лекарственного поражения печени по варианту идиосинкразии.
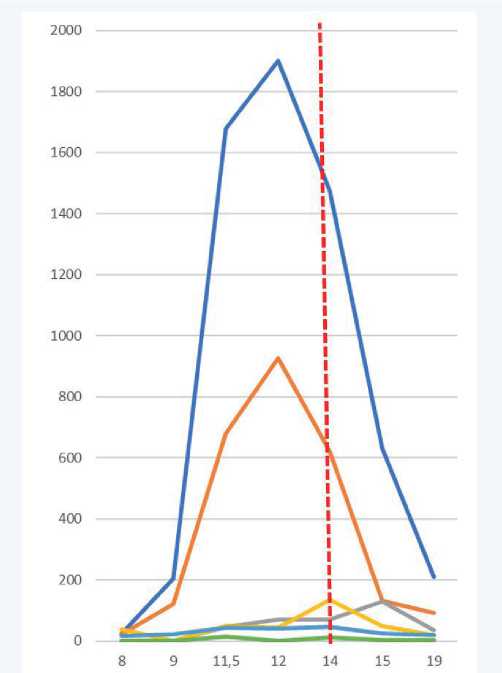
Учитывая тяжесть поражения печени по данным гистологического исследования, массивный воспалительный инфильтрат и крупные зоны резорбции, было принято решение начать противовоспалительную терапию глюкокортикостероидами: преднизолон 40 мг перорально в течение 7 дней с постепенным снижением дозы до 20 мг (прием в течение 4 нед.) с последующим снижением дозы вплоть до полной отмены. Через неделю после начала лечения: АЛТ 633 ед/л, АСТ 132 ед/л, ГГТ 130 ед/л, ЩФ 49 ед/л, общий билирубин 24,1 мкмоль/л, прямой билирубин 5,1 мкмоль/л. При контроле анализов через 1 мес. уровень АЛТ составил 211 ед/л, АСТ 92 ед/л, ГГТ 36 ед/л, общий билирубин 20 мкмоль/л; через 3 мес. все ранее указанные показатели в пределах нормальных значений (динамика биохимических показателей представлена на рис. 3).
-АЛТ, ед/л
ALT, U/L
4 СТ, ед/л AST, U/L ■ГП", ед/л
ЩФ,6Д/> 1
ALP, U/L
^■•Общ. билирубин, ммоль/л
Total bilirubin, mmol/L
—П|р.билирубикI, ммоль/л
Direct bilirubin, mmol/L
GGT, U/L
Рис. 3. Динамика биохимических показателей в течение заболевания (указаны недели от проведения пульс-терапии). Красной пунктирной линией указан момент начала терапии преднизолоном
Fig. 3. Dynamics of biochemical parameters during the disease (weeks from pulse therapy are indicated). The red dotted line indicates the start of prednisone therapy
Дискуссия
Представленный клинический случай описывает развитие тяжелого ЛПП по типу острого гепатита после пульс-терапии высокими дозами метилпреднизолона у пациентки с дебютом рассеянного склероза. Побочные эффекты применения высоких доз глюкокортикостероидов, такие как нарушение толерантности к глюкозе, повышение артериального давления, тахикардия, эрозивно-язвенное поражение желудочно-кишечного тракта, нарушения сна широко известны. Однако гепатотоксичность, вызванная глюкокортикостероидами, редко попадает в поле зрения клиницистов.
ЛПП, ассоциированные с метилпреднизолоном, описаны в литературе в основном у пациентов с демиелинизирующими заболеваниями [5–8] и офтальмопатией Грейвса, вероятно, ввиду более частого употребления пульс-тера-пии высокими дозами метилпреднизолона. Исследование V. Nociti и соавт. показало, что у 8,6% пациентов с рассеянным склерозом, получающих лечение высокими дозами метилпреднизолона, отмечено развитие ЛПП [9]. Тяжесть течения гепатита варьируется от легких асимптомных форм до тяжелых, вплоть до летального исхода, как показали в своей работе M.E. Zoubek и соавт. [10].
Сложность в лечении пациентки состояла в дифференциации аутоиммуноподобного фенотипа ЛПП от собственно истинного лекарственно-индуцированного аутоиммунного гепатита, не всегда сопровождающегося повышением определяемых аутоантител [3]. Как возможный вариант дифференциации нами была рассмотрена оценка ответа на терапию преднизолоном и динамическое наблюдение. Вопрос эффективности начала терапии преднизолоном в данной клинической ситуации дискутабелен, принятое нами решение о начале терапии основывалось на данных гистологического исследования и возможности предупреждения новых волн некрозов гепатоцитов.
Таким образом, ЛПП, ассоциированное с метилпреднизолоном, не является редким побочным явлением, однако требует исключения альтернативных диагнозов. Пациенты с картиной острого гепатита требуют полноценного обследования, включающего лабораторные и инструментальные данные, в том числе биопсию печени, а также тщательный сбор анамнеза: употребление алкоголя, прием лекарственных средств и биологически активных добавок.
С нашей точки зрения, важным является повышение осведомленности врачей о гепатотоксичных эффектах высоких доз метилпреднизолона и повышение настороженности в отношении этой проблемы.
Заключение
При проведении терапии высокими дозами метилпреднизолона необходимо мониторирование показателей функции печени, учитывая гепатотоксичный эффект препарата.
Список литературы Лекарственное поражение печени после пульс-терапии метилпреднизолоном: описание клинического случая
- Kuna L., Bozic I., Kizivat T., Bojanic K., Mrso M., Kralj E.et al. Models of Drug Induced Liver Injury (DILI) - Current issues and future perspectives. Curr. Drug Metab. 2018;19(10):830-838.
- Grewal P., Ahmad J. Severe liver injury due to herbal and dietary supplements and the role of liver transplantation. World J. Gastroenterol. 2019;25(46):6704-6712.
- European Association for the Study of the Liver. EASL Clinical Practice Guidelines: Autoimmune hepatitis. J. Hepatol. 2015;63(4):971-1004.
- Berkovich R.R. Acute multiple sclerosis relapse. Continuum (Minneap Minn.). 2016;22(3):799-814.
- D'Agnolo H.M.A., Drenth J.P.H. High-dose methylprednisolone-induced hepatitis in a patient with multiple sclerosis: А case report and brief review of literature. Neth. J. Med. 2013;71(4):199-202.
- Monteserín L., Jiménez M., Linares P., Rodríguez-Martín L., Álvarez-Cuenllas B., Álvarez-Cañas C. et al. Acute hepatitis secondary to high-dose intravenous methylprednisolone. Gastroenterol. Hepatol. 2018;41(8):508-509.
- Oliveira A.T., Lopes S., Cipriano M.A., Sofi a C. Induced liver injury after high-dose methylprednisolone in a patient with multiple sclerosis. BMJ Case Rep. 2015;2015:bcr2015210722.
- Rotondo E., Graziosi A., Di Stefano V., Mohn A.A. Methylprednisolone-induced hepatotoxicity in a 16-year-old girl with multiple sclerosis. BMJ Case Rep. 2018;11(1):e226687.
- Nociti V., Biolato M., De Fino C., Bianco A., Losavio F.A., Lucchini M. et al. Liver injury after pulsed methylprednisolone therapy in multiple sclerosis patients. Brain Behav. 2018;8(6):e00968.
- Zoubek M.E., Pinazo-Bandera J., Ortega-Alonso A., Hernández N., Crespo J., Contreras F. et al. Liver injury after methylprednisolone pulses: A disputable cause of hepatotoxicity. A case series and literature review. United European Gastroenterol J. 2019;7(6):825-837.


