Лекция по остеологии. Многоуровневый характер структуры минерального матрикса и механизмы его формирования
Автор: Аврунин А.С., Тихилов Р.М., Аболин А.Б., Щербак И.Г.
Журнал: Гений ортопедии @geniy-ortopedii
Рубрика: Лекция
Статья в выпуске: 2, 2005 года.
Бесплатный доступ
Авторы представляют данные анализа литературы по структуре минерального матрикса костной ткани в лекционной форме. По их мнению, он представляет собой четырехуровневую структуру. Первый уровень внутренняя структура минерала, второй морфология минерала, третий копланарное объединение минералов, четвертый макроструктурное объединение минералов в единый комплекс внутри каждого костного органа. Показаны наиболее вероятные механизмы, определяющие стабильность воспроизведения параметров минерального матрикса на каждом уровне. В результате их функционирования формируются те варианты структуры минерального матрикса, которые являются запрограммированным отражением специфики данного участка органических структур.
Минеральный матрикс
Короткий адрес: https://sciup.org/142120811
IDR: 142120811
Текст обзорной статьи Лекция по остеологии. Многоуровневый характер структуры минерального матрикса и механизмы его формирования
При использовании современных научноисследовательских технологий мы зачастую сталкиваемся с физиологическими процессами, которые не удается связать с какой-либо известной анатомо-морфологической структурой. И наоборот: электронный микроскоп позволяет увидеть множество структурных деталей, функциональное значение которых неясно или вовсе неизвестно. Настоящее сообщение является попыткой связать морфологические характеристики минерального матрикса и физиологические механизмы его формирования. Необходимость подобной систематизации вызвана тем, что, несмотря на большой массив публикаций посвященных исследованию костной ткани [5, 7-11, 13, 14, 16, 27, 29, 35, 36], последняя остается одной из наименее изученных структур организма. В значительной мере это обусловлено трудностями определения истинных параметров минерального матрикса, так как костная ткань на этапе подготовки к исследованию подвергается различным механическим, химическим, температурным и другим воздействиям. В результате, как отмечает Kim с соавторами [26], возможны трансформация минеральной фазы, повреждение минералов, изменение их размеров и так далее. Тем не менее, к настоящему времени накоплен значительный объем фактических данных, характеризующих минеральный матрикс костной ткани, в том числе его состав, структуру, обмен и регулирование [5, 7-11, 13, 14, 16, 27, 29, 35, 36].
Понятие «минеральный матрикс» возникло как следствие деления межклеточного вещества костной ткани на органическую и минеральную составляющие. Анализ современных данных позволяет выделить четыре уровня организации минерального матрикса:
-
1) первичный (внутренняя структура минерала);
-
2) вторичный (морфология минерала, т. е. его форма и размеры);
-
3) третичный (копланарное1 объединение минералов);
-
4) четвертичный (объединение минералов в единый комплекс внутри каждого костного органа).
Первичная структура. В костной ткани обнаружены дикальцийфосфатдигидрат, октакальцийфосфат, аморфный фосфат кальция, трикальцийфосфат и гидроксиапатит. Структурное сходство перечисленных соединений фосфатов кальция позволяет образовывать смеси по типу «сэндвич» или «вещество на поверхности». Иными словами, в одном минерале возможно объединение нескольких форм кристаллических решеток с одновременным включением структуры аморфного компонента [9].
В минеральном матриксе нормальной костной ткани содержание аморфного фосфата кальция не превышает 5 %. Минералы представлены преимущественно гидроксиапатитом, содержащим по 5-10 % СО 3 2- " и НРО 4 2- групп [26, 31]. Доля ионов НРО 4 2- уменьшается с возрастом, что обусловлено их замещением ионами СО 3 2- [9, 30]. В основе этих сдвигов лежит гете-роионный обмен2, в результате которого в кристаллическую решетку гидроксиапатита включаются также Mg2+, Sr2+, Ra2+, Na+, CO32-, F- и др. [13]. В итоге состав кристаллов (в основном, его поверхностные слои) отражает состав интерстициальной жидкости окружающей минерал.
Каковы же механизмы, обеспечивающие преимущественное формирование именно гидроксиапатита? Ведь в обычных условиях построение его наименьшей структурной единицы Са 10 (РО 4 ) 6 (ОН) 2 требовало бы одновременного столкновения 18 ионов, обладающих необходимой энергией активации, что совершенно невозможно из статистических соображений. В то время как аморфная фаза формируется достаточно легко при достижении в растворе минимально необходимой концентрация ионов Са2+ и НРО 4 2- [13].
В настоящее время можно выделить три таких механизма:
-
1. Инициация формирования гидроксиапатита путем эпитаксии3 на органической матрице [22].
-
2. Формирование гидроксиапатита путем эпитаксии на ранее образовавшихся кристаллах (их гидратном слое) [13].
-
3. Перестройка различных фаз минералов в гидроксиапатит под влиянием ионного насоса клеток остеоцитарного ряда [1,4, 11].
Инициация формирования гидроксиапатита путем эпитаксии на органической матрице. Основным нуклеатором4 процесса кристаллизации является костный сиалопротеин. На него приходится 8-12 % от общего количества неколлагеновых белков. Это обильно фосфорилированный протеин, имеющий высокое сродство не только к ионам кальция (связывает до 83 Са2+), но и к кристаллам гидроксиапатита. Поэтому костный сиалопротеид может не только способствовать зарождению кристалла, но и эффективно ограничивать его рост в зависимости от своего физического состояния (иммобилизованный или растворенный) [22].
Роль фосфопротеинов в инициации кристаллообразования подтверждается тем, что увеличение их концентрации в декальцинированной костной ткани значительно уменьшает требуемое для нуклеации время (лаг-период). Причем замена костного фосфопротеина на фосвитин (из желтка яйца), имеющий ряд аналогичных химических и структурных характеристик, не изменяют характера минералообразования. Этот процесс не возникает после удаления 90 % и более фосфата из любого фосфопротеина [32].
Другим условием минерализации коллагеновых структур является наличие ковалентной связи между фосфопротеинами и фибриллами коллагена [32]. Подобная жесткая фиксация фосфопротеинов обеспечивает необходимую пространственную ориентацию гидроксиапатита по осям (длина, ширина, толщина) при его формировании путем эпитаксии на органической матрице. Это обеспечивает также и пространственную ориентацию минеральных структур на третичном и четвертичном уровнях организации минерального матрикса относительно ориентации органического. А в связи с тем, что ультраструктура органического матрикса формируется соответственно силовым линиям, то, следовательно, и ультраструктура минерального также формируется соответственно преобладающим векторам механических нагрузок. В результате все элементы костной ткани располагаются соответственно силовым линиям в костном органе.
Формирование гидроксиапатита путем эпитаксии на ранее образовавшихся кристаллах. В настоящее время есть все основания предполагать, что большинство кристаллов гидроксиапатита формируется путем эпитаксии на гидратной оболочке «первичного» кристалла, т.е. сформи- рованного на органической матрице. Образование гидратного слоя обусловлено электрическим полем, возникающим вокруг минерала в связи с асимметрией ионных групп входящих в его состав. Внутри кристалла каждый катион окружен удерживающим его полем, создаваемым анионами, и, наоборот, каждый анион окружен полем, созданным катионами. Однако на поверхности кристалла возникают остаточные электрические заряды каждого находящегося в нем иона. Это приводит к тому, что вокруг кристалла в виде мозаики возникают слои адсорбированных ионов с противоположным по знаку зарядом. Последовательные слои ионов фосфата и гидратированных ионов кальция, имеют стереометрические параметры, аналогичные параметрам решетки гидроксиапатита [13]. Тем самым создаются условия для формирования новых кристаллов гидроксиапатита путем эпитаксии на ионах гидратной оболочки минерала.
Перестройка различных фаз минералов в гидроксиаппатит под влиянием ионного насоса клеток остеоцитарного ряда . В процессе минерализации органического матрикса по разным причинам могут возникать отклонения в структуре минерала и для преобразования их в гидроксиапатит требуется механизм, обеспечивающий ускоренную перестройку. Этот процесс определяется действием остеоцитарного насоса, вызывающего попеременное уменьшение и увеличение в интерстициальной жидкости концентрации минералообразующих ионов (эффект «качелей»)5. В результате минерал то формируется, то частично рассасывается. Поэтому преобразование аморфной структуры в кристаллическую происходит благодаря постоянному химическому взаимодействию минерала с омывающей его межклеточной жидкостью [1, 4, 11].
Проследим теперь, как этот процесс приводит к "созреванию" минерала, то есть, к получению наиболее устойчивой (наименее растворимой) его формы. В основе этого лежит тот факт, что энергия отрыва иона от аморфной фазы ниже, чем от кристаллической. Поэтому, когда ионный насос обеспечивает экскрецию ионов из костной ткани и происходит растворение минерального вещества, в первую очередь удаляются ионы, входящие в состав аморфной фазы. Вероятность отрыва элемента, входящего в состав кристаллической фазы, заметно ниже. Когда же ионный насос нагнетает минералообразующие ионы в интерстициальную жидкость, их концентрация увеличивается, начинается отложение минерального вещества, и часть ионов оказывается в более устойчивом состоянии, формируя кристаллическую решетку. Следовательно, в дальнейшем вероятность их отрыва при растворении минера- ла намного ниже. Таким образом, под действием ионного насоса происходит ускоренное преобразование аморфной фазы в кристаллическую [1].
Описанные выше физиологические механизмы обеспечивают преимущественное формирование гидроксиапатита и обладают взаимодополняющими свойствами. Однако необходимо подчеркнуть, что основополагающим элементом этого процесса все же являются стереохимические параметры органического матрикса. Остановимся на некоторых аспектах его формирования.
Взаимосвязь органического и минерального матрикса . Формирование органического матрикса начинается после внутриклеточного синтеза его компонентов и продолжается после их секреции во внеклеточную среду, где процесс организации органических структур идет путем самосборки. Одним из его элементов является объединение молекул коллагена в протофибриллы и микрофибриллы, затем в фибриллы, а фибриллы в волокна. Завершает этот процесс формирование волокнистого каркаса матрикса с характерной для костной ткани структурой. В эту структуру встраиваются разнообразные неколлагеновые белки [2, 3, 12, 15].
Спектр органических компонентов, синтезированных клетками остеоцитарного ряда, зависит от особенностей регуляторно-метаболического статуса организма в конкретный момент времени. Например, гормон роста и паратгормон вызывают увеличение синтеза белка, связывающего инсулинподобный фактор роста III. Концентрация инсулинподобного фактора роста I возрастает под влиянием паратгормона. Под действием 17β-эстрадиола увеличивается содержание инсу-линподобных факторов роста I и II и фактора трансформации 1β [33, 34].
Таким образом, можно говорить о существовании определенной программы самосборки органического матрикса, структура которого определяется следующими условиями: совокупностью синтезируемых клетками компонентов, ионным составом среды, рН внеклеточной среды и т. д. А в связи с тем, что все эти условия определяются регуляторно-метаболическим статусом организма в момент формирования органического матрикса, то в итоге формируется наиболее вероятный в конкретных условиях вариант объединения молекул в единое целое.
Выявление же незначительных отклонений затруднительно, так как морфологическое распределение неколлагеновых белков в костной ткани известно плохо, их трудно распознать под электронным микроскопом, а количественные характеристики их состава зависят от типа кости [15]. Тем не менее, установлено, что у пациентов, страдающих болезнью Педжета, распределение остеопонтина зависит от типа и тяжести болезни. Существенные различия найдены и в распределении остеонектина, остеокальцина и декорина между нормальной костной тканью и синтезированной de novo при болезни Педжета [25]. Выявленные сдвиги отражают отклонение в их синтезе и/или инкорпорации в процессе ремоделирования кости и могут явиться следствием нарушения трансляции костного матрикса, а затем и его минерализации.
После формирования органического матрикса лаг-период до начала отложения минералов занимает около 8 суток. После инициации этого процесса образование минеральных структур протекает лавинообразно [21]. В указанный временной интервал происходит ферментное преобразование органического матрикса, включая разрушение ингибиторов минералообразования [18, 23].
По-видимому, в результате ферментного воздействия создаются определенные физикохимические условия, включая формирование структуры «каналов» для движения ионных потоков (кальция и фосфатов) в направлении центров инициации. Движение потока ионов в направлении последних определяется тем, что при формировании минерала переход ионов из растворимого в нерастворимое состояние в участке инициации вызывает локальное снижение их концентрации в растворе. В результате образуется градиент концентраций, который и определяет направление движения ионных потоков. Остеоцитарный насос обеспечивает при этом постоянное восполнение концентрации минералообразующих ионов в интерстициальной жидкости зоны зарождения кристаллов.
В связи с тем, что преобразование растворимой фазы в нерастворимую всегда происходит при участии центров инициации, последние можно разделить на две группы: обеспечивающие формирование кристаллической структуры путем эпитаксии (по-видимому, это основной вариант) и инициирующие формирование аморфной структуры. Именно количественное соотношение этих центров определяет преимущественно кристаллическую структуру большинства «первичных» минералов, а характер распределения этих центров в органическом матриксе и их пространственная ориентация обеспечивает специфику третичного и четвертичного уровней пространственной организации минеральной фазы.
Вторичная структура. Морфология кристаллов определяется их формой и размерами. В настоящее время выделено два варианта их формы: пластинчатые и стрежнеобразные (игольчатые) [9]. Проведенные в последние годы электронномикроскопические исследования изолированных кристаллов из костной ткани рыбы, цыпленка, мыши и быка выявили только кристаллы, имеющие форму очень тонких пластин [26]. Стержне- и иглообразных кристаллов не установлено ни в одном из образцов костей. Объём- ные стереоснимки, полученные при электронной микроскопии молодых изолированных кристаллов, показали, что кристаллические пластинки апатита могут быть изогнуты, согнуты, а также свернуты на себя и на близлежащие кристаллы. В результате возникает иллюзия, что это иглоподобные (стержнеподобные) кристаллы [30]. Их ширина 3-5 нм, длина колеблется от 5-7 нм до 100-120 нм. Кристаллы же пластинчатой формы имеют средние размеры 1,5-3,5 нм х 5-10 нм х 40-50 нм (табл. 1). То есть, можно предположить, что увеличение длины иглоподобных кристаллов связано с объединением нескольких изогнутых микрокристаллов в единый комплекс.
Таблица 1
Размеры кристаллов
|
Исследованный образец кости |
Ширина (нм) |
Длина (нм) |
Толщина (нм) |
|
Бык [26] |
15,8 ± 7,2 (2,9-42,2) |
27,3±7,2 (6,9-61,7) |
<1,5-2 |
|
Мышь [26] |
12,0±4,3 (3,9-26,5) |
21,2±7,6 (6,9-50,0) |
<1,5-2 |
|
Цыпленок [26] |
12,2±4,8 (2,9-26,5) |
23,3±8,4 (8,8-53,9) |
<1,5-2 |
|
Сельдь [26] |
15,4±10,0 (2,3-58,5) |
37,3±19,0 (2,6-98,3) |
<1,5-2 |
|
Человек [8] |
7-8 |
13-14 |
2-4 |
|
По данным литературы [13] |
- 7,5 |
«20 |
3-4 |
Другим морфологическом параметром являются размеры кристаллов. В этой связи обращает на себя факт близости их средних значений не только у разных организмов, но и при формировании in vitro. Следовательно, должен существовать единый механизм, определяющий эти параметры. В последние годы дискутируется роль органических молекул в этом процессе. Это связано с тем, что стереохимические параметры белков кости создают возможность их связывания с образовавшимися кристаллами, что может обеспечивать торможение кристаллического роста в определенных направлениях.
Однако если бы этот механизм действительно определял размеры кристаллов, белки находились бы между кристаллами, образующими копланарные объединения. Подобное внедрение сомнительно по двум причинам. Во-первых, оно сделало бы невозможным синтез кристаллов путем эпитаксии на гидратной оболочке первичных кристаллов. Во-вторых (и это главное), применение современных технологий не выявило межкристаллического (внутрикопланарного) расположения белковых молекул.
Вернее всего, ограничение размеров кристаллов вызвано тем, что гидроксиапатит, содержащийся в костной ткани, обладает очень малой растворимостью. Как известно, при смешивании растворов соли (точка А на рис. 1) происходит некоторая агрегация ионов. Эти твердые частицы стабильны лишь в том случае, если они очень малы. При возрастании концентрации ионов в растворе (при переходе от точки Б к точке В) состояние раствора можно считать метастабильным, так как действительная величина растворимости превышает нормальную растворимость, или растворимость «макрокристаллов». При таких концентрациях часть вещества может находиться в твердой фазе, но радиус частиц может варьировать только от R1 до R2. Эти частицы не будут спонтанно расти, так как более крупные кристаллы растворяются лучше, чем мелкие [13]. По нашему мнению, именно этот механизм ограничивает размеры кристаллов в костной ткани, в то время как белковые ингибиторы кристаллообразования, скорее всего, влияют на параметры третичного уровня организации минерального матрикса.
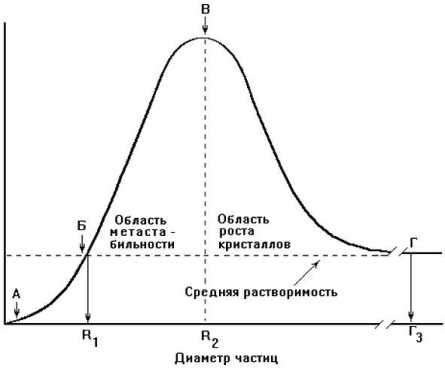
Рис. 1. Теоретическая зависимость между размером частиц и растворимостью какой-либо соли, предсказанная уравнением Кнаппа [13]
Третичная структура. При образовании новых кристаллов на гидратной оболочке ранее сформированных возникают их копланарные объединения, в которых минералы объединены конец в конец или бок в бок. При этом полного слияния кристаллических решеток микрокристаллов не происходит. Размеры копланарных объединений находятся в следующих пределах: длина 29,9-37,3 нм, ширина 18,8-21,9 нм [8]. Каков же механизм, обеспечивающий формирование подобной структуры? По-видимому, это результат рассмотренного выше процесса эпитаксии кристаллов на гидратной оболочке «первичного» кристалла, сформированного на органической матрице. Обращает на себя внимание малый разброс размеров копланарных объединений, что свидетельствуют о наличии ограничительного механизма, определяющего эти размеры. С одной стороны, на это может влиять характер распределения и размеры гидрофильных и гидрофобных участков в молекулах белков в зоне роста копла-нарных объединений минералов. С другой стороны распределение белковых ингибиторов роста кристаллов (о которых было сказано вы- ше). Эти два механизма не взаимоисключают, а дополняют друг друга.
Определенную роль играет и то обстоятельство, что в органическом матриксе центры кристаллизации имеют строгую пространственную повторяемость распределения основного центра кристаллизации костного сиалопротена [22] и соответствующее чередование гидрофильных и гидрофобных участков в коллагеновых структурах. В этих условиях рост копланарных объединений может ограничиваться расстоянием от центра инициации первичного кристалла до ближайшего гидрофобного участка. Подобный механизм базируется на ультраструктурной пространственной повторяемости элементов, формирующих органический матрикс, и поэтому определяет малый разброс размеров копла-нарных объединений.
Четвертичная структура. Минералы располагаются внутри коллагеновых фибрилл и внефибриллярно. В межфибриллярных пространствах копланарные объединения кристаллов, прилегающие к коллагеновым фибриллам, окружают их, формируя манжетки, и контактируют с внутрифибриллярными минеральными образованиями. На отдалении от коллагеновых фибрилл кристаллические объединения входят в состав плотных групп, в которых они размещаются в одном направлении. По отношению друг к другу такие группы расположены под разными углами. Внутрифибриллярные объединения кристаллов образуют ряд параллельных, спирально закрученных пластов [8].
Образование подобной упорядоченной структуры возможно в том случае, если основным механизмом формирования минералов является эпитаксия. В этом случае пространственное расположение центров инициации первичных кристаллов определяет направление их осей соответственно особенностям структуры органического матрикса в данном участке. Последующие кристаллы растут, формируя копланарное объединение, также путем эпитаксии на данном кристалле, протекающей в соответствии с расположением его осей. Оси очередного копланарного объединения определяются уже пространственным расположением следующего центра инициации. Следовательно, происходит некоторый сдвиг направления осей по отношению к предыдущему копланарному объединению. В результате формируется определяемый структурой органического матрикса пространственный вариант структуры минерального. По сути, последняя является запрограммированным отражением не только особенностей распределения органических молекул в костной ткани, но и особенностей их вторичного, третичного и четвертичного уровней организации, отражающих основные направления силовых линий механических нагрузок в каждом костном органе. Нарушение функционирования любого из рассмотренных выше механизмов приведет к нарушению структуры минерального матрикса, что вызовет изменение механических свойств костной ткани в целом. Это в свою очередь вызовет нарушение процесса механотрансдукции и нарушит равновесие между резорбцией костной ткани и ее синтезом, что мы и наблюдаем в процессе старения организма.


