Лимфангиолейомиоматоз легких (описание клинического случая)
Автор: Шашина М.М., Шаповалова Т.Г., Казимирова Н.Е., Рябова А.Ю., Архангельская Е.Е., Лифанова Д.В., Чернышкова М.А.
Журнал: Саратовский научно-медицинский журнал @ssmj
Рубрика: Внутренние болезни
Статья в выпуске: 4 т.13, 2017 года.
Бесплатный доступ
Представлено клиническое наблюдение пациентки с доказанной диффузно-узловой формой лимфангио-лейомиоматоза легких, рассмотрены особенности течения процесса на фоне патогенетической терапии, включающей сиролимус и прогестерон. Повышение осведомленности врачей об этом заболевании будет способствовать своевременной его диагностике и лечению.
Антиэстрогенная терапия лам, диагностика лам, лимфангиолейомиоматоз легких (лам)
Короткий адрес: https://sciup.org/14918557
IDR: 14918557
Текст научной статьи Лимфангиолейомиоматоз легких (описание клинического случая)
1 Введение. Актуальность работы обусловлена недостаточной информированностью врачей о лим-фангиолейомиоматозе (ЛАМ), что приводит к поздней диагностике, развитию осложнений и преждевременной смерти пациентов.
Описание клинического случая. Трудности диагностики и особенности течения ЛАМ демонстрирует наше клиническое наблюдение. В пульмонологическое отделение ГУЗ «Саратовская ГКБ № 8» была госпитализирована пациентка 43 лет с диагнозом ЛАМ. Из анамнеза известно, что в течение пяти лет после перенесенной ОРВИ ее беспокоил непродуктивный кашель постоянного характера. При выполнении флюорографического обследования патологии выявлено не было. В 2015 г. на фоне психоэмоционального стресса усилился кашель, появились кровохарканье в виде прожилок крови, одышка. Рентгенография органов грудной клетки выявила диссеминированный процесс в легких с наличием множественных очаговых образований (рис. 1). Проводилось углубленное обследование, направленное на исключение онкологической и специфической причины заболевания.
По результатам компьютерной томографии высокого разрешения (КТВР) легких подтверждено наличие диссеминированного процесса в легких с наличием многочисленных мягкотканых очаговых образований диаметром от 3 до 10 мм. Дифференциально-диагностический ряд, кроме онкологической и специфической природы заболевания, включал также поражение легких в рамках системного васкулита (гранулематоз Вегенера). Открытая биопсия выполнена в январе 2016 г в Санкт-Петербургском НИИ фтизиопульмонологии. При проведении гистологического и иммуногистохимического исследования обнаружена метастазирующая лейомиома с наличием в ткани легкого множественных пролифератов, состоящих из веретеновидных мономорфных клеток со слабо выраженным полиморфизмом. Митотическая активность в опухоли отсутствовала, пролиферативная активность по экспрессии антигена раковой опухоли (Ki-67) составила менее 2%. Отмечалась позитивная реакция опухолевых клеток на антитела к гладкой мускулатуре (SMA), десмин, эстрогеновые и прогестероновые рецепторы, виментин; негативная на моноклональные антитела, которые реагируют с антигенами, присутствующими в меланоцитарных опухолях (HMB-45).
В апреле 2016 г. пациентка госпитализирована в клинику пульмонологии Первого Санкт-Петербургского государственного медицинского университета им. И. П. Павлова (ПСПбГМУ) , где подтверждена узловая форма ЛАМ. При выполнении КТВР органов грудной клетки в динамике, с последующим пересмотром изображения в условиях высокого разрешения и построения реформаций изображения (MPR) отмечалась отрицательная динамика в виде увеличения количества и размеров очагов в обоих легких. Во всех отделах легких визуализировались многочисленные мягкотканые, хаотически расположенные очаги диаметром от 3 до 10 мм, причем их количество и размеры увеличились по сравнению с данными 2015 г. В верхнем этаже переднего средостения определялась инволютивная ткань вилочковой железы размерами 1,3х1,7 см. Проходимость трахеи, главных и долевых бронхов не нарушена.
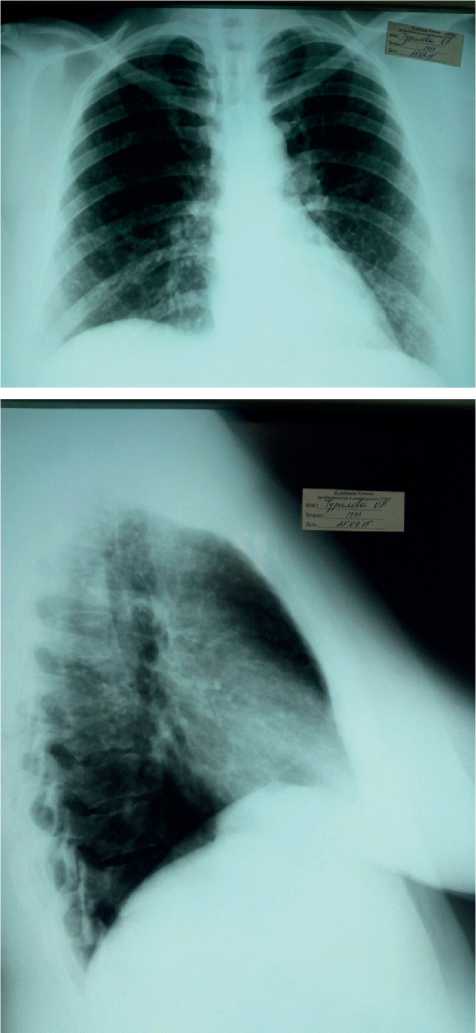
Рис. 1. Рентгенограммы легких от сентября 2015 г.
Ствол легочной артерии 27 мм, ее ветви не расширены (рис. 2).
При обследовании выявлены также железодефицитная анемия (эр. 4,2 млн, Hb 87 г/л, гематокрит 31 %, железо сыворотки крови 2,9 мкмоль/л), ускорение СОЭ до 35 мм/ч. По данным спирометрии, показатели проходимости дыхательных путей в пределах нормы, однако диффузионная способность легких (ДСЛ) умеренно снижена (66% ДВ), альвеолярный объем составил 4,42 л (84% ДВ) за счет неадекватности вентиляционно-перфузионных отношений. Отмечалась также значительная гипоксемия (в арте-риализированной крови РаСО235 мм рт.ст., РаО261 мм рт.ст.). По данным КТ органов малого таза, в области дна матки выявлено мягкотканое образование 5,9х5,0 см; левый яичник 4,4х3,1 см, поликистозной структуры, правый достоверно не определяется. Ги-
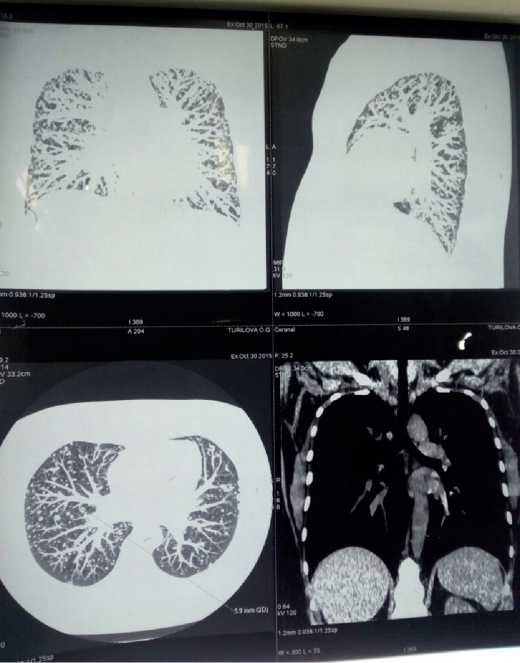
Рис. 2. КТВР легких от 26 апреля 2016 г.
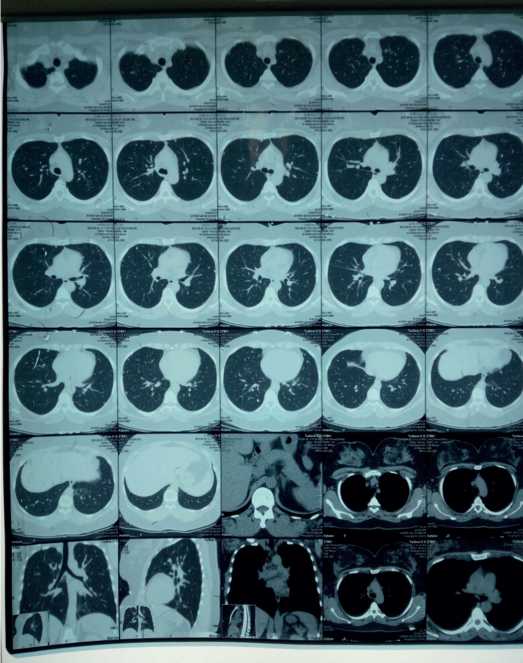
Рис. 3. КТВР легких от 8 ноября 2016 г.
стологическое исследование выявило лейомиому с участками пролиферации (все представленные сведения взяты из выписки из истории болезни в клинике пульмонологии ПСПбГМУ от апреля 2016 г.). Диагноз сформулирован как «Гистологически доказанное прогрессирующее течение очаговой формы лимфангиолейомиоматоза легких». Пациентка получала терапию в соответствии с рекомендациями Европейского респираторного общества (ЕРО): оксипрогестерона капронат по 1,0 в/м 1 раз в неделю, сиролимус 1 мг 1 раз в день, рекомендованы также ацетилцистеин 600 мг 1 раз в день, препараты железа, омепразол.
Следующая госпитализация состоялась через полгода в плановом порядке в ноябре 2016 г. в ту же клинику. Самочувствие пациентки было относительно стабильным, одышка не нарастала, эпизодов кровохарканья не было. На КТВР легких отмечалась картина множественных гематогенных образований в легочной ткани без отчетливой динамики по сравнению с данными предыдущего исследования от 22 апреля 2016 г. (рис. 3).
По данным спирометрии, ЖЕЛ и проходимость дыхательных путей на нижней границе нормы. ДСЛ умеренно снижена за счет неадекватности вентиляционно-перфузионных отношений (59% ДВ), альвеолярный объем составил 82% ДВ. Вместе с тем обнаруживалась значительная гипоксемия (РаО263 мм рт.ст.). При выполнении эхокардиографии (Эхо-КГ) выявлены признаки нерезкой перегрузки правых отделов сердца, как-то: расширение правых отделов, гипертрофия правого желудочка (ПЖ), легочная гипертензия 1 степени, диастолическая дисфункция миокарда ПЖ. Сократительная функция левого желудочка сохранена, фракция выброса (ФВ) составила 63%. Улучшились показатели периферической крови (эр. 5,1, Hb 117, гематокрит 39%, железо 4,1
мкмоль/л), однако сохранялось ускорение СОЭ до 40 мм/ч. Проведен консилиум с участием профессора М. М. Ильковича. Констатировано гистологически доказанное прогрессирующее течение диффузно-очаговой формы ЛАМ и рекомендовано продолжение терапии сиролимусом, прогестерон отменен.
В пульмонологическое отделение ГУЗ «Саратовская ГКБ № 8» пациентка госпитализирована в феврале 2017 г. с жалобами на прогрессирование одышки в течение месяца, непродуктивный кашель, привкус крови во рту при кашле. Ухудшение самочувствия связывала со стрессовой ситуацией. При осмотре состояние относительно удовлетворительное. Рост 166 см, вес 107 кг. Следует отметить, что постоянную прибавку массы тела пациентка отмечала с 30 лет. ИМТ составил 38,8 (экзогенно-конституциональное ожирение І степени). Кожные покровы обычной окраски и влажности, чистые. Грудная клетка правильной формы, равномерно участвует в акте дыхания, при перкуссии ясный легочный звук. Дыхание везикулярное над всеми отделами легких. ЧД 16 в мин. Область сердца внешне не изменена, однако границы расширены вправо на 2 см, тоны приглушены, сокращения ритмичные. Пульс 82 в мин, АД 160 и 90 мм рт.ст (в анамнезе артериальная гипертензия III степени с 32 лет, гипотензивные препараты принимала нерегулярно). По другим органам без особенностей. По данным рентгенографии и КТВР легких от 1 февраля 2017 г. (в динамике, через два месяца после предыдущей) отмечена отрицательная динамика в виде увеличения количества и размеров узелковых образований в легких (рис. 4, 5).
При выполнении спирометрии выявлено нарушение функции внешнего дыхания по рестриктивному типу умеренной степени: ЖЕЛ 2,12 л (64% от ДВ), ФЖЕЛ 2,37 л (71 % ДВ), ОФВ 1 2,22 мл (65% ДВ), ОФВ 1 /ФЖЕЛ 104,36 (129% ДВ). При ультразвуковом
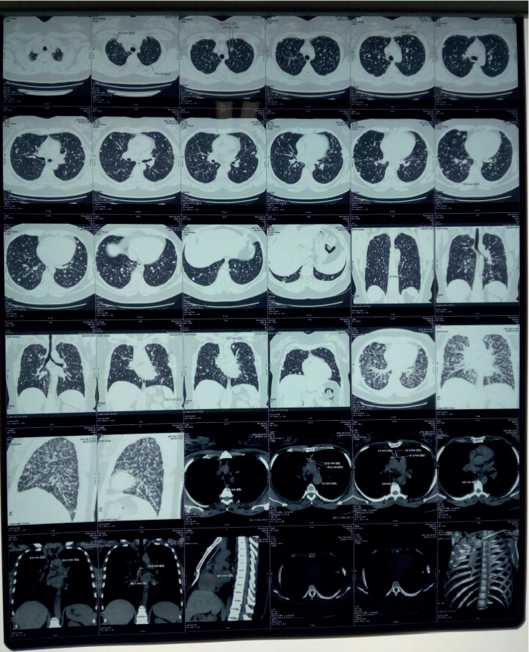
Рис. 5. КТВР легких от февраля 2017: отрицательная динамика в виде нарастания количества и увеличения размеров узелковых образований в легких
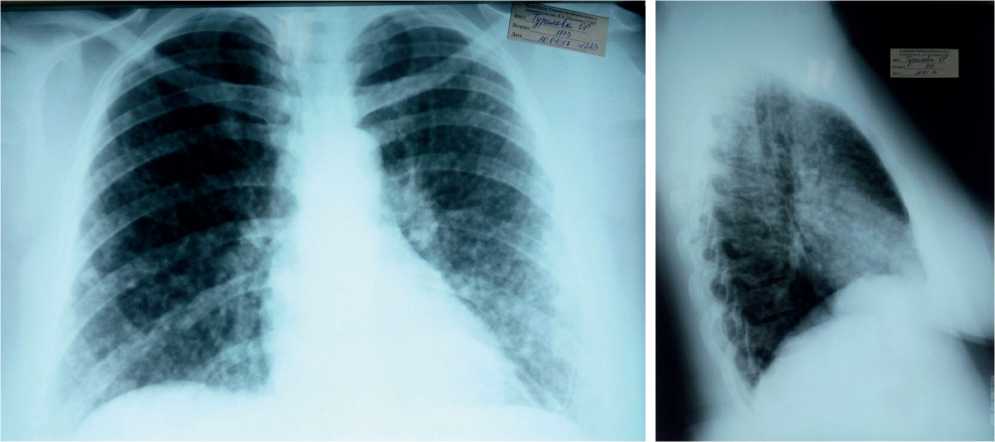
Рис. 4. Рентгенограммы легких от января 2017 г.
сканировании обнаружены киста диаметром 0,3 см и изоэхогенный узел 0,4 см в правой доле щитовидной железы, умеренные диффузные изменения печени и почек. В общем анализе крови обращало на себя внимание ускорение СОЭ до 30 мм/ч, лейкоцитарная формула и биохимические показатели в пределах референсных значений. Выполнена заочная консультация в клинике пульмонологии ПСПбГМУ и рекомендовано возобновление терапии прогестероном, оперативное лечение лейомиомы матки и контрольная госпитализация через полгода.
Обсуждение. ЛАМ — это редкое полисистемное заболевание, проявляющееся кистозной перестройкой паренхимы легких с развитием прогрессирующей дыхательной недостаточности, а также узловой пролиферацией специфических ЛАМ-клеток, преимущественно в лимфатических сосудах и лимфатических узлах. Заболевание, как правило, возникает у женщин репродуктивного возраста 18–50 лет [1, 2]. Истинную заболеваемость и распространенность ЛАМ из-за его редкости определить не представляется возможным. Считается, что первое описание ЛАМ выполнено в 1937 г. В руководстве по диагностике и лечению ЛАМ, подготовленном группой экспертов по инициативе ЕРО в 2010 г., указывается, что распространенность ЛАМ составляет 1 случай на 400 тыс. взрослых женщин [3]. Таким образом, ориентировочная численность пациенток может достигать 25–30 тысяч. [4]. Многие авторы отмечают значительный рост данной патологии в последние годы в различных странах мира, который связывают с широким распространением компьютерно-томографического скрининга грудной клетки, так как рутинная рентгенография не позволяет визуализировать характерные для этой патологии изменения в легких [3–5].
Этиология ЛАМ до сих пор окончательно не установлена. Имеются данные о наличии генетического дефекта — мутаций в генах туберозного склероза (TSC1 и TSC2) [3, 6, 7]. Эти мутации выявляются как в спорадических случаях ЛАМ, так и в случаях ЛАМ, ассоциированного с туберозным склерозом (ТС). ТС (болезнь Бурневилля — Прингла) — редкая системная наследственная дисплазия, которая характеризуется комбинированным опухолевидным поражением с формированием гамартом кожи, головного мозга, глазных яблок, сердца, почек и легких [1, 4, 8]. Распространенность ТС значительно выше, чем ЛАМ, и, в случае диагностики в детском возрасте, варьируется от 1 на 6800 до 1 на 17300. ЛАМ среди этих больных диагностируется в 30-40%, в том числе и у лиц мужского пола [5, 9]. Гистологические изменения при спорадическом и при ЛАМ, ассоциированном с ТС (ЛАМ-ТС), идентичны, что позволяет предполагать общие генетические и патофизиологические механизмы обоих заболеваний. Отмечено, что на развитие и прогрессирование ЛАМ могут влиять женские половые гормоны. Так, ряд авторов наблюдали обострение ЛАМ во время беременности или на фоне приема эстрогенов, а также контрацептивных препаратов [3, 4, 7]. Напротив, отмечено уменьшение скорости прогрессирования заболевания после наступления менопаузы. Обнаружена связь возникновения пневмоторакса (одного из клинических проявлений ЛАМ) с периодом менструации [8].
С патогенетической точки зрения ЛАМ можно рассматривать как многофокусный опухолеподобный процесс, обусловленный генетическим дефектом, который определяет аномальный ответ мышечных клеток [4]. В легких появляются особые ЛАМ-клетки, которые представляют собой эпителиоидные или похожие на миофибробласты веретенообразные клетки. Происхождение ЛАМ-клеток неизвестно. Они могут метастазировать по кровеносным или лимфатическим сосудам аналогично клеткам злокачественных опухолей. Метастазированию способствуют продуцируемые ЛАМ-клетками ферменты [4, 5]. Предполагается, что ЛАМ-клетки экспрессируют рецепторы к эстрогену и прогестерону, причем последние оказывают влияние на их пролиферацию. Так, в 80% случаев на ЛАМ-клетках обнаруживаются поверхностные прогестероновые (PRs) и эстрогеновые (ERs) рецепторы, что косвенно подтверждает важную роль женских половых гормонов в развитии болезни [7, 9]. Однако окончательно роль эстрогенов в патогенезе ЛАМ остается нераскрытой, как и не доказана клиническая эффективность антиэстрогенной терапии (тамоксифен, прогестерон, овариэктомия) при этой патологии [3]. Следует отметить особенности гинекологического анамнеза нашей пациентки: в возрасте 25 и 27 лет — аборты, с 35 лет отмечала нарушение менструального цикла, боли внизу живота. В 2012 г. диагностирована миома матки и выполнена миомэктомия, назначалась терапия буселерином — синтетическим аналогом гонадотропин-рилизинг гормона, оказывающим антигонадотропное, антиэстро-генное, противоопухолевое действие. В 2014 г. вновь по данным УЗИ и КТ малого таза обнаружена миома матки в сочетании с аденомиозом, причем согласно гистологическому заключению лейомиома матки с участками пролиферации. Дважды при госпитализации в клинику пульмонологии ПСПбГМУ пациентке рекомендовано выполнение оперативного лечения рецидивирующей лейомиомы матки, от которого пациентка отказалась.
Выделяют две морфологические формы данного заболевания: очаговую (возникновение в легких опухолевидных образований, морфологическая структура которых соответствует лейомиомам) и диффузную, для которой характерны множественные мелкокистозные изменения различного диаметра, увеличивающиеся в объеме по мере прогрессирования заболевания [1, 4, 5]. Таким образом, в легочной ткани развивается диссеминированный патологический процесс в виде опухолевидного разрастания гладкомышечных волокон по ходу мелких бронхов, бронхиол, стенок кровеносных и лимфатических сосудов с последующей микрокистозной трансформацией. Однако особенностью нашего случая было развитие у пациентки узловой формы заболевания. Очаговая узловая форма ЛАМ часто протекает бессимптомно, выявляется при профилактическом флюорографическом исследовании и имеет более благоприятное течение. При диффузной форме первым симптомом обычно является одышка и прогрессирующая дыхательная недостаточность (в 94% случаев). К клиническим проявлениям относят также рецидивирующий спонтанный пневмоторакс (80-81 %), кровохарканье (44%), боли в грудной клетке (34%), хилоторакс (28%). Кроме того, возникают опухолевидные образования (ангиомиолипомы) почек, орга- нов брюшной полости. Возможно развитие хилопе-рикарда, хилезного асцита, хилурии, хилоринореи [4, 5]. У нашей пациентки заболевание дебютировало с непродуктивного кашля, одышка и кровохарканье появились значительно позже, через 2 года, что в целом соответствовало очаговой форме на ранних стадиях заболевания. В дальнейшем, в связи с прогрессированием дыхательной недостаточности, диагностирована очагово-диффузная форма заболевания.
ЛАМ может диагностироваться с разной степенью вероятности (достоверный, вероятный или сомнительный) в зависимости от клинических данных, наличия или отсутствия гистологического подтверждения, внелегочных проявлений, КТ-картины [3]. У нашей пациентки согласно критериям ЕРО (2010 г.) диагноз ЛАМ был достоверным, так как имелась сходная с ЛАМ картина изменений в легких на КТВР и свойственная ЛАМ патологическая картина в био-птате легкого, а также лейомиома матки [3]. После установления диагноза в соответствии с рекомендациями ЕРО была начата патогенетическая антиэ-строгенная терапия прогестероном в сочетании с иммуносупрессором сиролимусом. Этот препарат пока не вошел в рутинную клиническую практику в нашей стране. В рекомендациях указано, что лечение этим препаратом должно проводиться только в специализированных экспертных медицинских учреждениях, в которых концентрируются больные ЛАМ [3]. В данном случае осуществлялось необходимое наблюдение в клинике пульмонологии ПСПбГМУ . На фоне проводимой терапии достигнута относительная стабилизация процесса, без отрицательной клиникорентгенологической динамики. Быстрая прогрессия заболевания (выраженная отрицательная динамика КТ, усугубление дыхательных расстройств), наступившая в течение последних двух месяцев, могла быть обусловлена изменением терапии: отменой прогестерона и сохраняющейся гинекологической патологией, так как пациентка отказывалась от оперативного лечения. Это косвенно подтверждает обсуждающееся неблагоприятное влияние эстрогенов на развитие ЛАМ, а также целесообразность назначения антиэстрогенной терапии.
Заключение. Особенностью рассмотренного клинического случая ЛАМ явилось отсутствие характерного мультикистозного поражения легких. Рентгенологическая картина представлена мультифокальными узловыми образованиями, что весьма затруднило диагностику на первоначальном этапе. Верификация диагноза стала возможна лишь после проведения биопсии легкого и выполнения иммуногистохимического исследования. До настоящего времени окончательно не определено место прогестерона в комплексной терапии ЛАМ. На фоне отмена прогестерона в представленном клиническом наблюдении отмечалось прогрессирование заболевания.
Авторский вклад: концепция и дизайн исследования — М. М. Шашина; получение данных и анализ данных — М. М. Шашина, Е. Е. Архангельская, Д. В. Лифанова, М. А. Чернышкова, Н. Е. Казимирова; написание статьи — М. М. Шашина, Т. Г. Шаповалова, А. Ю. Рябова; утверждение рукописи для публикации — Т. Г. Шаповалова.
Список литературы Лимфангиолейомиоматоз легких (описание клинического случая)
- Илькович M. M. Интерстициалыные и орфанные заболевания легких. М.: ГЭОТАР-Медиа, 2016; 346 с.
- El-Chemaly S, Henske EP. Towards personalised therapy for lymphangioleiomyomatosis: lessons from cancer. Eur Respir Rev 2014; 23 (131); 30-35
- Johnson SR, Cordier JF, Lazor R, et al. European Respiratory Society guidelines for the diagnosis and management of lymphangioleiomyomatosis. Eur Respir J 2010; 35: 14-26
- Park HY, et al. A nationwide survey of lymphangioleiomyomatosis in Korea: recent increase in newly diagnosed patients. J Korean Med Sci 2010; 25 (8): 1182-1186
- Леншин А. В., Ильин А. В., Крайнов С. А. Лимфангиолейомиоматоз легких (клинико-рентгенологическое наблюдение, обзор литературы). Бюллетень физиологии и патологии дыхания 2014; 52: 97-109
- Аверьнов А. В., Лесняк B.H., Коган E.A. Редкие заболевания легких: диагностика и лечение. М.: Медицинское информационное агентство, 2016; 245 с.
- Harari S, Torre О, Moss J. Lymphangioleiomyomatosis: what do we know and what are we looking for? Eur Respir Rev 2011; 20 (119): 34-44
- Cordier JF, Johnson SR. Orphan Lung Diseases/Ed. by J. F. Cordier. Eu. Respir Mon 2011; 54: 46-83
- Гараханян А.А., Куколь Л.В., Рудиков В.Б. Лейомиоматоз: трудности диагностики (клинический случай). Вестник СПбГУ 2015; 11 (4): 127-133.


