Лимфатические микрососуды в миокарде: артефакт или объективная реальность?
Автор: Марков Игорь Иванович, Малыхина Татьяна Викторовна, Низаметдинова Динара Рустамовна
Журнал: Морфологические ведомости @morpholetter
Рубрика: Оригинальные исследования
Статья в выпуске: 1 т.27, 2019 года.
Бесплатный доступ
Большая часть современной информации о лимфатическом русле сердца получена методом внутритканевой резекции различных красителей, в том числе и массы Герота. Малая информативность и многочисленные артефакты не позволяют считать полученные этим методом данные о лимфатических микрососудах миокарда достоверными. Цель работы - подтвердить или опровергнуть данные о наличии в миокарде лимфатических микрососудов, с использованием различных методов их выявления. Изучено микрососудистое русло миокарда интактных экспериментальных животных, крыс (n=7), кошек (n=3), кроликов (n=3), выявленное методами Гранта и Ранвье-Гойера в модификации И.И. Маркова. В качестве контроля использовался универсальный метод импрегнации аргирофильных структур. Полученные данные дают основания считать, что в миокарде млекопитающих лимфатические микрососуды отсутствуют.
Миокард, лимфатические микрососуды, млекопитающие
Короткий адрес: https://sciup.org/143177284
IDR: 143177284
Текст научной статьи Лимфатические микрососуды в миокарде: артефакт или объективная реальность?
Марков И.И., Малыхина Т.В., Низаметдинова Д.Р. Лимфатические микрососуды в миокарде: артефакт или объективная реальность?// Морфологические ведомости.- 2019.- Том 27.- № 1.- С. 15-20. (27).01.15-20
Markov II, Malykhina TV, Nizametdinova DR. Lymphatic microvessels in the myocardium: artifact or objective reality? Morfologicheskie Vedomosti – Morphological Newsletter. 2019 March 31;27(1):15-20. (27).01.15-20
Введение . Существуют ли лимфатические микрососуды в миокарде? Постановка вопроса противоречит традиционным представлениям о том, что сердце млекопитающих обладает чрезвычайно густой и разветвленной лимфатической сетью, которая представляет собой «лимфатическую губку» [1-2]. Эти представления требуют тщательной ревизии, поскольку базируются на результатах, полученных малоинформативными методами, дающими многочисленными артефакты [3-6]. Лимфатическое русло сердца начинается многочисленными слепыми капиллярами эндокарда, которые затем продолжаются в миокарде и в эпикарде [7-9]. В миокарде лимфатические капилляры располагаются в межмышечной соединительной ткани, а также вокруг артерий и вен [10]. В лимфатическом русле миокарда продолговатые лимфатические капилляры диаметром 20-30 мкм чередуются с расширенными резервуар-подобными капиллярами диаметром до 150 мкм [11-12]. В них происходит накопление лимфы, а ее периодический отток происходит под влиянием ритмических сокращений миокарда [13-14]. По данным литературы [15], лимфатические капилляры между мышечными пусками миокарда были обнаружены еще в ХIХ веке [16-17]. Позднее было установлено, что лимфатические капилляры могут образовывать сплетения вокруг мышечных пучков миокарда [18]. При этом автор не нашел в миокарде отводящих лимфатических сосудов, хотя в эксперименте им было установлено, что отток лимфы из миокарда происходит в лимфатические сосуды эпикарда.
В.В. Федяй [1961] считает, что структура соединительной ткани миокарда и связанной с ней генетически и функционально лимфатической системы в известной степени отражает состояние обменных процессов в мышце сердца [цит. по 19, с. 75]. Автор продемонстрировал лимфатическое русло миокарда, инъецированное синей массой Герота при увеличении препаратов в 30 раз. В другой работе автор с помощью той же методики установил, что у млекопитающих в миокарде «сеть лимфатических капилляров обильна» [20]. Она состоит «из многочисленных тонких капилляров, оплетающих кровеносные сосуды и мышечные пучки сердечного мускула [цит. по 20, с. 12]. Наиболее существенной особенностью внутриорганного лимфатического русла сердца низших позвоночных является наличие в миокарде капилляров, обособленных от русла лимфатических капилляров эпикарда, сообщающихся непосредственно с полостью желудочка. Автор считает, что эти лимфатические капилляры «подобны венам Тебезия теплокровных и человека» [цит. по 20, с.12].
Начальными элементами лимфатической сети миокарда являются не сами лимфатические капилляры, а их боковые ответвления [21]. Эти микрососуды - прекапилляры диаметром 5-10 мкм. Именно они «и являются истинными корнями лимфатической сети миокарда. Они осуществляют глубокий дренаж его интерстиция. По этим «прекапиллярам» лимфа поступает в лимфатические капилляры, а затем в резервуар-подобные лимфососуды миокарда» [цит. по 21, с. 36]. При этом авторы обращают внимание на специфическую особенность лимфатических сосудов: они ориентированы не вдоль, а поперек мышечных волокон миокарда и сопровождающих их кровеносных капилляров [21]. К сожалению, иллюстрации лимфатических микрососудов миокарда в этой работе мало информативны и невысокого качества. Таким образом, совершенно очевидно, что современная информация о морфологии лимфатического русла сердца находится на уровне 70–80-х годов ХХ века. Отсутствие адекватных методов выявления стенки лимфатических микрососудов вместе с окружающими их тканями не позволяет решить следующие основные спорные вопросы лимфологии: 1 - о связи лимфатических микрососудов с интерстициальным пространством; 2 - о лимфо-венозных анастомозах; 3 - о механизмах образования лимфы и вазомоторной активности безмышечных лимфатических микрососудах; 4 - о клапанном аппарате.
В самых современных зарубежных гистологических атласах приводится всего лишь 6 иллюстраций лимфатических микрососудов [22-23]. Большая часть из них (5) – это иллюстрации лимфатических микрососудов в соединительной ткани на гистологических срезах, окрашенных рутинными методами. Есть лишь одна иллюстрация – электронограмма лимфатического капилляра слизистой оболочки полости носа крысы [23], нет ни одной микрофотографии лимфатических микрососудов миокарда. Только в одной монографии [24] демонстрируются сканнограммы коррозионных препаратов лимфатических миокарда крысы (см. в ист. 24, рис. 26, рис. 46-48). Однако, достоверно доказать их локализацию в миокарде вряд ли представляется возможно, поскольку слепки лимфатических микрососудов выявлены изолированно, без контакта с кардиомиоцитами. На указанных рисунках 46 и 47 лимфатические микрососуды находятся поверхностнее многочисленных кровеносных капилляров, вероятнее всего миокардиальных. Такие взаимоотношения лимфатических и кровеносных микрососудов позволяют считать, что лимфатические микрососуды расположены в эпикарде, а кровеносные – в миокарде. Тем не менее, несмотря на отсутствие объективных и достоверных данных о лимфатическом русле сердца и, прежде всего, миокарда, клинические данные свидетельствуют о важной роли лимфатического дренажа в патогенезе острого инфаркта миокарда [23-25].
Цель работы – подтвердить или опровергнуть данные о наличии в миокарде лимфатических микрососудов, используя различные методы их выявления.
Материалы и методы исследования. Изучено микрососудистое русло экспериментальных животных: крыс (n=7), кошек (n=3), кроликов (n=3). Животные содержались в виварии ООО «Самарская ветеринарная клиника «Друг». Все манипуляции с ними проводились в соответствии с Российскими (приказ Минздрава СССР № 755 от 12.08.1977; Методические указания Минздрава РФ «Деонтология медико-биологического эксперимента») и Европейскими (директивы ЕС «О защите животных, используемых в экспериментальных и научных целях») этическими нормативами. Животные содержались в клетках на подстилке из деревянных стружек в условиях естественного освещения (12 часов темного и 12 часов светлого времени) при температуре 18-22оС и относительной влажности 55-60%. Животные имели свободный доступ к воде и сбалансированному корму. Для идентификации элементов микрососудистого русла использовался метод суправительной интрасосудистой импрегнации по Ранвье-Гойера в модификации И.И. Маркова и метод Гранта [28-29], в качестве контроля использовали метод импрегнации аргирофильных структур [30].
Результаты исследования и обсуждение . Различные слои миокарда желудочков: поверхностный, средний и глубокий имеют различную плотность упаковки своих структурных элементов: кардиомиоцитов и их ядер, клеток соединительной ткани, капилляров и других микрососудов. Плотность упаковки этих элементов миокарда инвариантна относительно объема сердца. Она может служить интегральной оценкой их размеров и их количества. Наибольший объем в миокарде занимают кардиомиоциты. Их ядра занимают значительно меньший объем: плотность упаковки составляет около 0,12 см3/см3. Капилляры и микрососуды занимают 0,076 см3/см3 объема миокарда. При этом 2/3 объема микрососудистого русла занимают капилляры. Это наиболее характерно для глубокого слоя миокарда. Соединительная ткань в миокарде составляет 0,09 см3/см3, 2/3 объема которой занимают клеточные элементы. Объем клеток соединительной ткани и ее коллагеновых структур достоверно уменьшается от поверхностного слоя миокарда по направлению к его глубокому слою.
Результаты изучения серийных гистологических срезов миокарда также свидетельствуют о значительных вариациях структурной организации микрососудистого русла в его различных слоях. Для поверхностного слоя миокарда характерна параллельная ориентация длинных узких капилляров и небольшое число косо ориентированных межкапиллярных соустий. В среднем слое миокарда преобладают достаточно сложные сосудистые конструкции с большим числом межкапиллярных соустий. В глубоком слое миокарда сосудистые конструкции еще более усложняются, а диаметр их значительно увеличивается. Коллагеновый каркас миокарда связывает его микрососуды с мышечными волокнами. Он хорошо выражен в участках миокарда, соответствующих его механической оси сокращений: в передней сосочковой мышце, в нижней трети передней, боковой и в верхней трети задней стенки левого желудочка. Коллагеновые волокна соединяют смежные мышечные волокна друг с другом, объединяя их в параллельно расположенные мышечные пучки. При этом они вплетаются в базальную мембрану мышечных волокон почти перпендикулярно и, таким образом, служат для поддержания материального регистра саркомеров соседних мышечных волокон. Коллагеновые волокна, объединенные в тяжи, фиксируются к адвентиции артерий и перивазальным структурам микрососудов с одной стороны и к мышечным волокнам – с другой. При этом сами мышечные волокна по отношению к стенке микрососудов располагаются или продольно, или под различными углами. В первом случае, коллагеновые тяжи фиксируются только к определенным участкам стенки микрососудов, там, где есть перивазальные клетки (рис. 1). Возникает неравномерность их диаметров в виде синусоидальной амплитуды при укорочении коллагеновых тяжей за счет увеличения объема мышечных волокон в систолу желудочков. Во втором случае, коллагеновые тяжи подходят к стенке микрососудов, предварительно разделившись на 2-3 мелких пучка. Фиксация их к базальной мембране и к перивазальным клеткам микрососудов происходит, как и в первом случае, только в определенных участках (рис. 2). Коллагеновые тяжи, идущие от мышечных волокон, расположенных под углом к стенке микрососудов, в 2-3 раза длиннее межволоконных тяжей. Поэтому их влияние на изменение диаметра микрососудов во время сердечного цикла более выражено и носит характер перистальтической волны.
Для микрососудов миокарда характерна выраженная гетерогенность эндотелиоцитов: необычная деформация их формы и высокая вариабельность размеров. При этом эндотелиоциты капилляров, расположенных в зоне вставочных дисков кардиомиоцитов, имеют большие размеры, чем эндотелиоциты капилляров, расположенных параллельно мышечным волокнам. Кроме того, первые менее деформированы, чем вторые (рис. 3, 4). Эндотелиоциты синусоидных венул миокарда имеют тонкие фестончатой формы контуры и общие границы с 4-мя или 6-юсоседними эндотелиоцитами
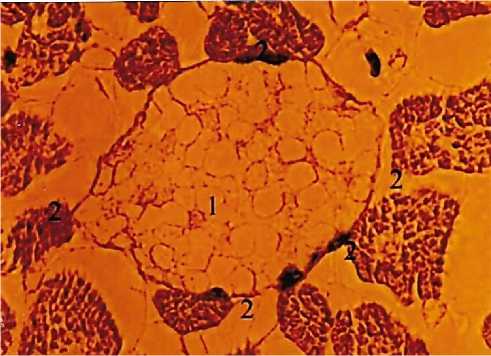
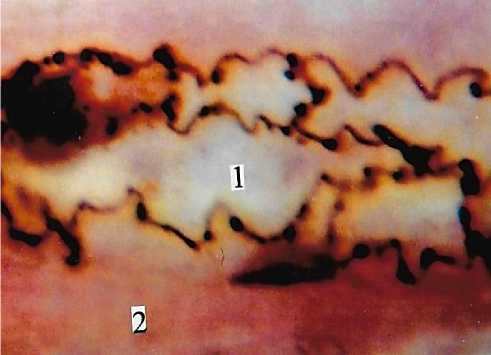
Рис. 1. Фиксация продольно расположенных сердечных мышечных волокон к стенке венулы. 1 - просвет венулы; 2 -мышечные пучки. Универсальный метод импрегнации. Ув.: х400.
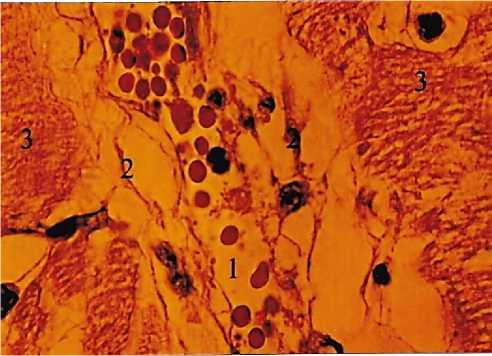
Рис. 2. Фиксация коллагеновых волокон к стенке венулы миокарда. 1 - просвет венулы; 2 - коллагеновые волокна; 3 -мышечные волокна. Универсальный метод импрегнации. Ув.: х400.
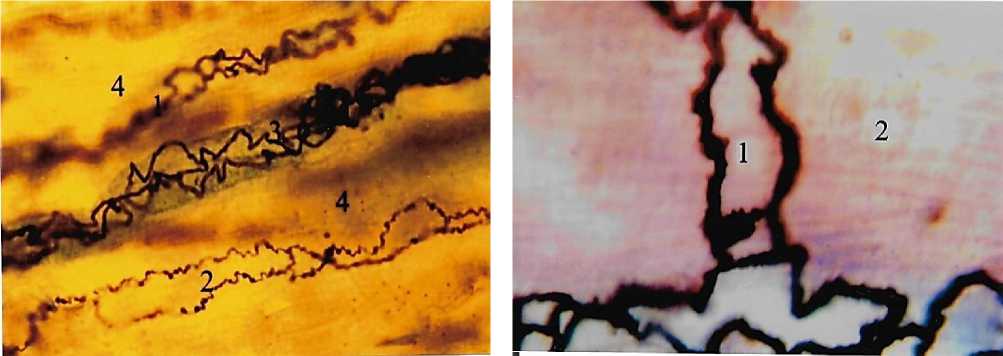
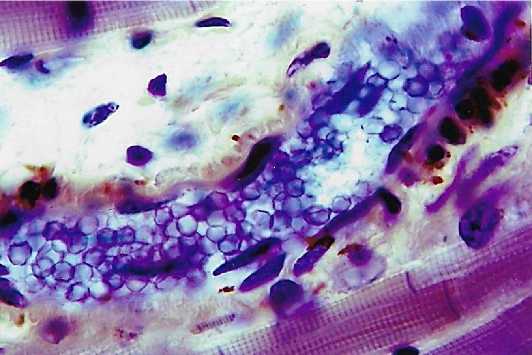
Рис. 3. Эндотелиоциты капилляров (1, 2, 3), расположенные параллельно сердечным мышечным волокнам (4). Интрасосудистая импрегнация по Ранвье-Ройеру. Ув.: х400.
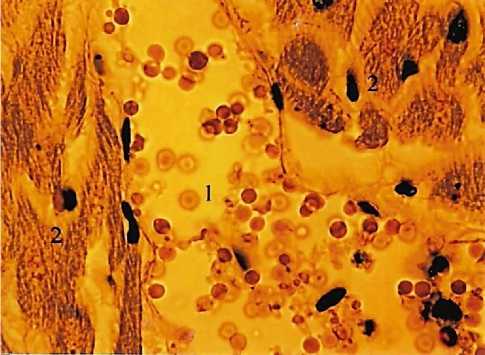
Рис. 5. Эндотелиоциты (1) синусоидной венулы миокарда Рис. 6. Синусоидная венула (1) миокарда (2).
(2). Интрасосудистая импрегнация по Ранвье-Ройеру. Ув.: Универсальный метод импрегнации. Ув.: х400.
х600.
Рис. 4. Эндотелиоциты (1) капилляра, расположенного в зоне вставочного диска кардиомиоцита (2). Интрасосудистая импрегнация по Ранвье-Гойеру. Ув.: х900.
(рис. 5). Стенка их подобна стенке лимфатического микрососуда: она образована только эндотелиоцитами и перивазальных клеток не содержит (рис. 6). Просвет микрососудов миокарда всегда заполнен эритроцитами, имеющими форму сфероцитов (рис. 7). Изменение внутреннего диаметра микрососудов миокарда контролируется эндотелиоцитами, способными к резкому увеличению объема цитоплазмы и ядра за счет их гидротопического набухания. Они способны заполнять участки разветвлений и слияний микрососудов диаметром до 60 мкм. Расположение таких эндотелиоцитов в зонах с низких напряжением сдвига свидетельствует об их реакции на изменения скорости кровотока: замедление его вызывает увеличение эндотелиоцитов, ускорение – их уменьшение и уплощение. Эндотелиоциты, находящиеся на входе и на выходе безмышечных микрососудов миокарда, функционируют как сфинктеры. В микрососудистом русле миокарда отсутствуют гладкомышечные сфинктеры, существование которых в нем признается большинством авторов [31-32].
Однако, во многих случаях понятие о прекапиллярной регуляции кровотока ограничивается только физиологическими представлениями о существовании прекапиллярного сопротивления и прекапиллярных резистивных сосудов [33]. Поэтому в физиологической литературе понятие «прекапиллярный сфинктер» является только функциональным, а не морфологическим.
Этот механизм регуляции кровотока не является универсальным, поскольку прекапиллярные гладкомышечные сфинктеры во многих органах, в том числе, и в миокарде не обнаружены [34]. Основная роль в регуляции кровотока в миокарде отводится взаимоотношениям его коллагенового каркаса с мышечными волокнами. Пространственные взаимоотношения в микрососудистом русле миокарда построены по модульному типу. Это своеобразие ангиоархитектоники делает невозможным перераспределение крови между параллельно расположенными капиллярами и, следовательно, свидетельствует об обязательном участии в гемоциркуляции всех без исключения элементов модуля. Таким образом, количество функционирующих модулей зависит от функциональной активности
Рис. 7. Артериола миокарда. Окр.: гематоксилин-эозин. Ув.: х600. миокарда. Для них характерно преобладание венозных микрососудов над артериальными: коэффициент соответствия составляет 0,35, т.е. объем венулярных микрососудов в 3,5 раза превышает объем артериальных микрососудов. Циркуляторный гомеостаз в миокарде достигается без развития интерстициального оттока только благодаря высокому гематокриту в его микрососудистом русле. Малый диаметр капилляров миокарда и их небольшое количество в модуле компенсируется их значительной протяженностью. В связи с этим их суммарная поверхность превосходит суммарную поверхность всех остальных компонентов модуля. За счет активной работы эндотелиоцитов объемный кровоток в микрососудах миокарда пропорционален третьей степени их радиуса [35], а скорость кровотока в них не зависит от величины гематокрита в диапазоне от 30% до 70% [31]. В связи с этим в интерстициальное пространство миокарда поступает лишь небольшой объем ультрафильтрата плазмы крови. Он резорбируется синусоидными венулами, структурная организация которых оптимальна для этого процесса. Известно, что активность синтеза белков в миокарде чрезвычайно мала. Лишь скелетные мышцы и головной мозг имеют еще более низкий уровень метаболизма белков [36]. Отсюда следует, что в миокарде нет и не должно быть лимфатических микрососудов, основным назначением которых является утилизация биологического «мусора». При функциональной нагрузке на сердце, когда миокардиальный кровоток увеличивается более чем в 5 раз [32], очевидно, должен увеличиваться и выход плазмы крови за пределы микрососудистого русла. В интактном сердце этого не происходит, поскольку функционирует механизм премиокардиальной гемосепарации [37-38]. В результате кровь с низким гематокритом поступает в микрососуды эпикарда, а кровь с высоким гематокритом – в микрососуды миокарда и эпикарда. Ультрафильтрат плазмы крови, поступивший в интерстициальное пространство субэпикардиальной рыхлой соединительной ткани, резорбируется ее мощным лимфатическим руслом. Более того, обнаружены его прямые связи с полостью перикарда. Отсюда, назначение эпикарда, как биологического фильтра - формирование необходимых условий для адекватного кровоснабжения миокарда. В замкнутых кругах кровообращения плазма крови призвана, по мнению некоторых авторов [39], поддерживать чистоту межклеточной среды путем локализации и удаления биологического «мусора». Ультрафильтрация плазмы крови в процессе гемосепарации сопровождается выходом биологического «мусора» и нейтрофильных гранулоцитов в интерстициальное пространство. Для выполнения эндоэкологической функции денатурации и удаления биологического «мусора» в субэпикардальной рыхлой соединительной ткани есть все необходимые условия: многочисленные лимфатические микрососуды, артериоло-венулярные анастомозы и значительная популяция нейрофильных гранулоцитов.
Заключение. Таким образом, сосудистые конструкции в миокарде, которые в целом ряде работ принимались за лимфатические микрососуды [1-12, 40], в реальной действительности являются венозными микрососудами. Доказать присутствие лимфатических микрососудов в миокарде можно было бы и на гистологических препаратах, окрашенных рутинными методами, если бы они были объективной реальностью. Отсутствие лимфатического русла в миокарде способствует уменьшению в нем концентрации воды, и, тем самым, сохранению в сердце нормального температурного режима. Необходимость равномерного отвода тепла от всего объема миокарда обусловлена его постоянной работой при коэффициенте полезного действия равным 40% [41]. Полученные данные согласуются с мнением Uibs и Chapman [42], которые также не признают наличия лимфатического русла в миокарде и в эндокарде млекопитающих.
Список литературы Лимфатические микрососуды в миокарде: артефакт или объективная реальность?
- Zhdanov D.A. Obshchaya anatomiya i fiziologiya limfaticheskoy sistemy.- L.: Medgiz, 1952. - 336 s.
- Vyrenkov Yu.E. Limfaticheskaya sistema serdtsa v patologii i eksperimente// Grudnaya khirurgiya.- 1975.- № 5.- S. 42-48.
- Gerota D. Zur techigne der lymphgesininection. Eine nene inectionmasser. Polychrome iniection. Anat Anz. 1886;12:216-221.
- Vyrenkov Yu.E. Metody issledovaniya limfaticheskoy sistemy/ V kn.: Limfaticheskaya sistema v eksperimente i klinike.- M., 1971.- S. 22-23.
- Zhemchuzhnikova L.E. Limfaticheskaya sistema serdtsa v norme i pri perikardite// Vestnik khirurgii.- 1960.- № 1.- S. 72-80.
- Chumakov V.Yu. Vnutriorgannoe limfaticheskoe ruslo serdtsa krupnogo rogatogo skota// Arkhiv anatomii.- 1990.- № 2.- S. 65-68.
- Zhemchuzhnikova L.E. Limfaticheskoe ruslo serdtsa nekotorykh vidov mlekopitayushchikh/ V kn.: Voprosy morfologii krovenosnoy i limfaticheskoy sistem.- L.: Tr. LSGMI, 1970.- T. 90.- S. 175-179.
- Romashin O.V. Osobennosti strukturnoy organizatsii epikardial'noy limfaticheskoy seti serdtsa detey rannego vozrasta// Arkhiv anatomii.- 1987.- № 10.- S. 67-72.
- Didkovskiy A.P. Limfaticheskie sosudy serdtsa v norme i v usloviyakh infarkta miokarda. - Avtoref. dis. kand. med. nauk. - Kiev, 1968.- 23 s.
- Casley-Smith JR. The fine structure of lymphatics, and the varying of lymph concentration using freeze-substitution. Folia angiology. 1980;28(10-12):272-279.
- Gavrish A.S., Paukov V.S. Zakonomernosti perestroyki limfaticheskogo rusla serdtsa pri narushenii limfoottoka// Arkhiv patologii.- 1991.- № 3.- S. 4-11.
- Johnson RA. The lymphatic system of the heart. Lymphology. 1969;2(3):95-108.
- Rusn'yak I., Feldi M., Sabo D. Fiziologiya i patologiya limfaticheskoy sistemy.- Budapesht: Izd-vo AN Vengrii, 1957.- 467s.
- Cohnheim J. Uber die Folden der Kranzarterienverschliessung fuer das Herz. Arch Pathol Anat Physiol Klin Med. 1881;86:503-537.
- Miller AJ, Pick R. Ventricular endomyocardial changes after impairment of cardiac lymph flow in dogs. Heart J. 1963;25:290-295.
- Ranvier L. Development des vaisseaux lymphatiques. Com Ren Acad Scien. 1895;121:1105-1131.
- Ebert EX. Uber lymphgefasse des Herzen. Virch Arch. 1866;37:128-130.
- Drinker CK. Cardiac lymph flow pressure and structure. Amer J Physiol. 1940;130(1):43-55.
- Fedyay V.V. Stroenie soedinitel'noy tkani i limfaticheskoy sistemy miokarda cheloveka// Arkhiv anatomii. - 1961.- № 2.- S. 75-81.
- Fedyay V.V. Vozrastnye izmeneniya vnutriorgannogo rusla serdtsa// Arkhiv anatomii.- 1965.- № 3. - S. 60-65.
- Vyrenkov Yu.E., Soboleva E.L., Beklemeshev M.A. Morfologicheskie osobennosti gemo-limfaticheskogo rusla miokarda// Arkhiv anatomii.- 1981.- № 5.- S. 30-38.
- Zhunkeyra L.K., Karneyro Zh. Gistologiya. Atlas.- M.: GEOTAR, Medgiz, 2009.- 576s.
- Kyummel' V. Tsvetnoy atlas po tsitologii, gistologii i mikroskopicheskoy anatomii.- M.:2007.- 513s.
- Kupriyanov V.V., Borodin Yu.I., Karaganov Ya.L., Vyrenkov Yu. Mikrolimfologiya.- M.: Meditsina, 1983.- 288s.
- Gareev G.Sh. Korrektsiya narushennogo limfodrenazha serdtsa i ee rol' pri pryamoy revaskulyarizatsii serdechnoy myshtsy v usloviyakh ostrogo infarkta miokarda.- Avtoref. dis. kand. med. nauk.- M., 1988.- 39s.
- Ismailova Z.D., Mamedov Ya.D. i dr. Vliyanie obzidana na metabolicheskie protsessy v krovi i limfe pri ostrom infarkte miokarda// Byull. eksper. biol. i med.- 1991.- № 1.- S. 20-22.
- Mamedov Ya.D. Infarkt miokarda. Limfaticheskaya sistema serdtsa. Patofiziologiya i patogeneticheskie osnovy lecheniya.- M.: Meditsina, 1989.- 224s.
- Markov I.I. Impregnatsiya vnutriorgannogo limfaticheskogo rusla po Ranv'e// Arkhiv anatshchmii.- 1985.- № 6.- S. 77-79.
- Markov I.I. Sposob issledovaniya makrososudistogo rusla bol'shogo sal'nika// Avtorskoe svidetel'stvo SSSR № 1619100 ot 08.09.1990 g.
- Markov I.I., Petrov E.S., Markova V.I. Universal'nyy metod elektivnogo vyyavleniya argirofil'nykh struktur// Morfologicheskie vedomosti.- 2016.- № 1.- S. 116-119.
- Dzhonson P. Perifericheskoe krovoobrashchenie.- M.: Meditsina, 1982.- 440s.
- Folkov B., Nil E. Krovoobrashchenie.- M.: Meditsina, 1976.- 464s.
- Parin V.V. Meerson F.Z. Ocherki klinicheskoy fiziologii krovoobrashcheniya.- M.: Nauka, 1960.- 230s.
- Gabain L.I., Adyshirin-Zade E.A. Morfologicheskie aspekty mestnoy regulyatsii krovotoka v miokarde// Arkhiv anatomii.- 1986.- № 12.- S. 37-43.
- Morimoto S, Kato S et al. Narrowing of the ventricular cavity associated with transited ventricular wall thickening reduced stroke volume in patient with acute myocarditis. Circulation. 2003;67(6):490-494.
- Rumyantsev P.P. Kardiomiotsity v protsesse reproduktsii, differentsirovki i regeneratsii.- L.: Nauka, 1982.- 228s.
- Markov I.I., Markov A.I. i dr. Rol' ekstraorgannykh arteriy i mikrososudistogo rusla organov v formirovanii gistologicheskikh bar'erov// Morfologicheskie vedomosti.- 2002.- № 1-2.- S. 75-79.
- Markov I.I. Strukturnaya organizatsiya gistogematicheskikh bar'erov s pozitsiy kontseptsii o gemoseparatsii/ V kn.: Novye tekhnicheskie resheniya v eksperimental'noy meditsine.- Samara, 1994.- S. 45-49.
- Titov V.N. Ateroskleroz-problema obshchey biologii: narushenie biologicheskikh funktsiy pitaniy i endoekologii// Usp. sovr. biol.- 2009.- № 2.- S. 124-143.
- Feola M, Glick G. Cardiac lymph flow and composition in acute myocardial ischemia in dogs. Amer J Physiol. 1975;22(1):44-48.
- Marchetti C. Lymph vessels of the rabbit heart Lymphology. 1986;19(1):33-37.
- Uibs CL, Chapman JB. Cardie energetic. Handbook of Physiology. 1979;2(1):775-804.


