Лимфотропное введение фотосенсибилизатора как модель таргетной терапии гнойно-воспалительных заболеваний у больных хирургического профиля
Автор: Брехов Е.И., Ягудаев Д.М., Саидов А.С., Калягина Н.А., Кузнецова Ю.О.
Журнал: Хирургическая практика @spractice
Рубрика: Оригинальные исследования
Статья в выпуске: 2, 2014 года.
Бесплатный доступ
Исследование посвящено доказательству наличия зон гуморальной связи кожно-подкожной ткани с определенными внутренними органами с целью улучшения результатов лечения гнойно-воспалительных заболеваний у больных хирургического профиля. Работа основана на экспериментальном изучении особенностей накопления препарата (фотосенсибилизатор) в органах после внутривенного и лимфотропного введения при наличии патологического процесса в органе (лабораторные мыши с экспериментальной моделью воспаления яичек). Детектирование накопления препарата осуществлялось с помощью спектроанализатора посредством волоконно-оптического зонда, подсоединенного к He-Ne лазеру. Выявлено, что лимфотропное введение позволяет сохранять высокие концентрации препарата в органе в течение длительного времени (более 24 часов), внутривенное введение позволяет быстро достичь более высоких концентраций препарата в органе в течение первых часов с дальнейшим понижением. При лимфотропном введении отмечается более избирательное накопление препарата в пораженном яичке в течение длительного времени (6-24 часа) по сравнению с внутривенным. На экспериментальной модели доказано наличие гуморальной связи кожно-подкожной ткани с определенными внутренними органами (паховая область - яичко), что позволит осуществлять адресную (таргетную) доставку лекарственных препаратов в орган-мишень, снизить их кратность и дозы. Выявлено значительное (более чем 2-кратное) превышение концентрации препарата в печени, почках и селезенке после внутривенного введения по сравнению с лимфотропным, что говорит о возможном снижении гепато-, нефро- и спленотоксичности вводимых препаратов.
Лимфология, гнойно-воспалительные заболевания, таргетная терапия, фотосенсибилизатор
Короткий адрес: https://sciup.org/142211569
IDR: 142211569 | УДК: 616-002.1;
Текст научной статьи Лимфотропное введение фотосенсибилизатора как модель таргетной терапии гнойно-воспалительных заболеваний у больных хирургического профиля
Адресная доставка лекарственных препаратов, а также сохранение высоких концентраций препаратов в пораженных органах и тканях являются одними из наиболее актуальных проблем современной медицины. Поэтому, чрезвычайно важными являются поиск и разработка новых путей введения лекарственных веществ. Одним из методов введения, позволяющих создавать высокие концентрации препаратов в органах-мишенях и длительно их удерживать, является эндолимфатическое введение. В настоящие время разработано множество мето- дов эндолимфатического введения: лимфососудистое, интра-нодулярное, лимфотропное введение, экстракорпоральная лимфосорбция и реинфузия лимфы, искусственное лимфообращение, управляемое дренирование грудного протока. Экспериментальные поиски и клинические наблюдения позволили использовать преимущественно 2 метода эндолимфатического введения: прямое эндолимфатическое введение лекарственных препаратов через катетеризированный периферический лимфатический сосуд и непрямое лекарственное насыщение лимфатической системы. Преимущество второго метода в том, что он малоинвазивен, не требует прямого оперативного вмешательства, особых хирургических навыков и доступен для выполнения врачами любых специальностей [1]. В основе метода регионарной лимфотропной терапии лежит тот факт, что введение лекарственных препаратов в определенную часть тела позволяет добиться насыщения только того региона лимфатической системы, который дренирует эту часть [2].
Наиболее эффективным и одновременно простым методом насыщения лимфатической системы медикаментами является лимфотропная терапия, обеспечивающая высокие и длительно сохраняющиеся концентрации в патологическом очаге и региональных лимфатических капиллярах и узлах лекарственных препаратов [3].
При воздействии факторов, нарушающих транспорт лимфы (заболевания и патологические состояния самой лимфатической системы, различные заболевания тканей и органов воспалительного, опухолевого и склеротического генеза, эндогенная интоксикация, хирургические вмешательства и т.д.), включаются компенсаторно-приспособительные механизмы, такие как усиление пропульсивной деятельности лимфангионов, включение резервных путей, раскрытие коллатералей, увеличение емкости лимфатического русла, ретроградный ток лимфы [4]. Указанные механизмы дают представление о возможности использования обратного тока лимфы, возникающего при остром воспалении и других патологических состояниях органов и тканей, в качестве основы для лекарственной лимфогенной терапии (как прямого, так и непрямого лекарственного насыщения лимфатической системы).
Лимфологические методы с успехом применяются во многих областях медицины: в хирургии [5–7], гинекологии [8], терапии [9, 10], фтизиатрии [11, 12], онкологии [2, 13] и др. В литературе представлены данные о накоплении препаратов в печени, почках, поджелудочной железе и других органах и тканях при лимфотропном введении [3]. Однако при вышеуказанных методах эндолимфатического введения побочным эффектом является поступление препарата в здоровые органы и ткани. Разработаны методы лимфотропной и «эпицентральной терапии по Юрьину», обеспечивающие значительное уменьшение такого поступления. Особую роль играет открытие Л.М. Юрьи-ным эффекта и зон гуморальной связи кожно-подкожной ткани с определенными внутренними органами, воздействия на интерстициальный гуморальный транспорт и лимфатический дренаж тканей, связи лимфатических путей на поверхности тела с внутренними органами [4, 14, 15]. При этом значительно снижается суточная доза препарата и продолжительность курса лечения [4, 14, 15]. Доставка лекарственных препаратов в органы-мишени при лимфотропной терапии происходит либо через через тканевой и лимфососудистый транспорт (ткань → лимфатическая система → орган – эпицентр накопления), либо минует его (ткань → ткань → орган – эпицентр накопления).
В настоящее время нет фундаментальных данных, подтверждающих наличие гуморальной связи между кожно-подкожной тканью и определенными внутренними органами. Использование фотосенсибилизатора в качестве маркера позволит доказать или опровергнуть данную теорию. Поскольку ретроградный ток в лимфатической системе возможен только при наличии патологии, нами была создана экспериментальная модель воспаления. В качестве наиболее доступной модели нами было выбрано воспаление яичка. Целью работы является доказательство наличия зон гуморальной связи кожно-подкожной ткани с определенными внутренними органами. Для выполнения поставленной цели нами была поставлена задача: изучить особенности распределения и накопления фотосенсибилизатора «Фотодитазин» в качестве маркера при его лимфотропном (в зону Юрьина) и внутривенном введении у здоровых лабораторных животных и животных с экспериментальной моделью патологического процесса в органах в различные временные промежутки в зависимости от способа введения
Материалы и методы
Экспериментальное исследование по изучению распределения, накопления и выведения фотосенсибилизатора «Фотоди-тазин» в органах и тканях белых лаборатороных мышей-самцов проводилось в два этапа: на первом этапе – в органах и тканях здоровых мышей, а на втором этапе – при введении препарата лимфотропно и внутривенно в органах и тканях мышей с экспериментальной моделью воспаления яичек. В качестве маркера для спектральных измерений был использован фотосенсибилизатор хлоринового ряда «Фотодитазин».
На первом этапе лабораторным животным вводился фотосенсибилизатор инсулиновым шприцом в концентрации 5 мг/ кг в объеме 20 мкл. По способу введения мыши были разделены на 2 группы: основную (35 шт) и контрольную (35 шт). Животным основной группы «Фотодитазин» вводился лимфотропно (подкожно, в зону Юрьина в паховую область), контрольной группы – в хвостовую вену. Детектирование сигнала обратного рассеяния и флюоресценции яичек мышей в обеих группах осуществлялось через 15, 130, 240, 360, 480, 720 и 1440 минут.
На втором этапе изучалось распределение и накопление препарата у животных с моделью воспаления. Острое асептическое воспаление яичка было вызвано посредством введения 10-ти мкл 10%-го раствора формалина в яичко белым лабораторным мышам. Мыши были разделены на 2 группы по такому же принципу, как и на первом этапе: основную (25 шт) и контрольную (25 шт). Спустя 2-е суток после моделирования воспаления, мышам вводился фотосенсибилизатор инсули- новым шприцом в концентрации 5 мг/кг в объеме 20 мкл. Детектирование сигнала обратного рассеяния и флюоресценции внутренних органов мышей (яичек, печени, почек и селезенки) в обеих группах осуществлялось через 15 минут, 130 минут, 6 часов, 14 часов и 24 часа.
На обоих этапах исследования сразу после выведения животных из эксперимента (цервикальной дислокацией) в указанные временные точки их фиксировали и послойно вскрывали брюшную полость, затем производились измерения флюоресценции органов, обусловленной содержанием фотосенсибилизатора, с помощью спектроанализатора «LESA-01-BIOSPEC». В качестве источника излучения для передачи излучения к исследуемым органам и возбуждения флюоресценции использовался He-Ne лазер с длиной волны 632,8 нм и выходной мощностью из торца волокна 5 мВт. К спектрометру подсоединялся волоконно-оптический зонд с одним освещающим и шестью приемными волокнами (диаметром 200 мкм). При измерениях зонд находился «в контакте» с органами и тканями мыши. Регистрация спектров производилась в диапазоне 400–900 нм. После обработки спектральных сигналов были получены данные в виде индекса флюоресценции (отн. ед.) (сигнала флюоресценции, отнесенного к сигналу обратного рассеяния). Для анализа были отобраны спектрограммы по максимальному полученному сигналу для каждого органа и исследуемой временной точки.
Результаты исследования
Результаты экспериментального исследования на здоровых лабораторных животных. При сравнительном анализе данных, полученных в эксперименте на здоровых мышах, выявлено, что на первых минутах при лимфотропном введении наблюдается избирательное накопление препарата в яичке, находящемся со стороны места введения, по сравнению с контрлатеральным (рис. 1). В связи с медленным оттоком фотосенсибилизатора из места лимфотропного введения в первые часы (15 минут – 6 часов) накопление «фотодитазина» при внутривенном введении оказалось выше, чем при лимфотропном. С течением времени наблюдается увеличение содержания препарата при лимфотропном введении по сравнению с внутривенным. Также было выявлено, что при внутривенном введении накопление фотосенсибилизатора происходит до 240 мин., а затем преобладает его постепенное выведение из органа. В то время как при лимфотропном способе введения препарат удерживается вплоть до 480-ти минут, что говорит о более пролонгированном нахождении фотосенсибилизатора при данном способе введения. После временной точки в 12 часов (720 минут) концентрация препарата в яичке уменьшается и графики, отвечающие обоим способам введения, устремляются в одну точку.
Результаты экспериментального исследования на лабораторных животных с экспериментальной моделью воспаления. Посредством сравнительного анализа было выявлено, что на отрезке времени от 15-ти минут до 6-ти часов индекс флюоресценции яичек с воспалением при внутривенном введении в среднем в 1,27 раз выше, чем при лимфотропном. (рис. 2). Тем не менее флюоресценция при лимфотропном введении все равно остается на высоком уровне в течение этого временного промежутка. На временном отрезке от 6-ти и до 24-х часов индекс флюоресценции при лимфотропном введении, в среднем, в 2,1 раза выше, чем при внутривенном. Также стоит отметить, что и при лимфотропном, и при внутривенном введении флюоресценция здорового яичка значительно ниже, чем у больного и при обоих методах введения находится на одном уровне. Выявлено, что после 6-ти часов разница между флюоресценцией здорового яичка и яичка с воспалением при лимфотропном введении выше, чем при внутривенном. Сохранение высоких концентраций препарата в течение более длительного времени в органе-мишени при лимфотропном введении в зону Юрьина, по сравнению с внутривенным, говорит о наличии гуморальной связи кожно-подкожной ткани с внутренними органами (паховая зона – яичко).
При сравнительном анализе данных, полученных в эксперименте на здоровых мышах и в эксперименте у мышей с моделью воспаления, выявлено, что у здоровых мышей флюоресценция
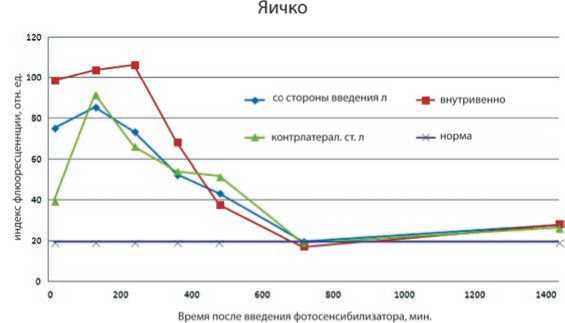
Рис. 1. Флюоресценция яичек при внутривенном (внутривенно) и лимфотропном (л) введении. Со стороны введения (яичко со стороны введения), яичко с контрлатеральной стороны от введения (контрлатерал.ст.)
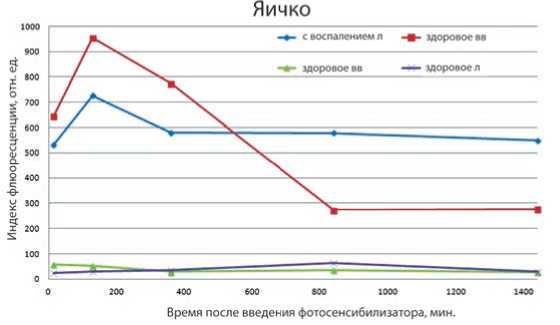
Рис. 2. Флюоресценция здоровых яичек (здоровое) и яичек с воспалением (с воспалением) при внутривенном (вв) и лимфотропном (л) введении
яичка при лимфотропном введении ниже, чем при внутривенном, в течение 24-х часов. В то время как при моделировании воспаления лимфотропное введение обладает главным преимуществом перед внутривенным: более длительным содержанием препарата в органе в достаточно высоких концентрациях.
При анализе спектральных сигналов других органов было отмечено, что на 15-ти минутах флюоресценция печени в 2,21 раза выше при внутривенном введении, чем при лимфотропном (рис. 3). Далее, на временном промежутке от 15-ти минут до 14-ти часов флюоресценция при внутривенном введении в 1,24–1,93 раз выше, чем при лимфотропном. В дальнейшем, с 14-ти и до 24-х часов, было отмечено, что индекс флюоресценции при лимфотропном введении в 1,27–1,7 раз, чем при вну- тривенном.
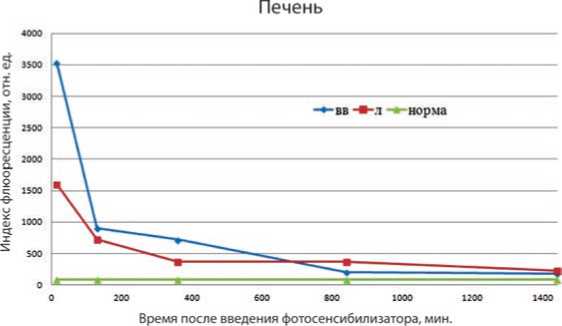
Рис. 3. Флюоресценция печени при внутривенном (вв) и лимфотропном (л) введении
Как показывает исследование, флюоресценция селезенки при лимфотропном введении на временном промежутке от 15-ти минут до 6-ти часов в 1,28–2,47 раз ниже, чем при внутривенном (рис. 4). На 6-ти часах индекс флюоресценции при лимфотропном введении становится в 1,14 раз выше, чем при внутривенном. Однако на 6–24-х часах флюоресценция при обоих методах выходит на один уровень.
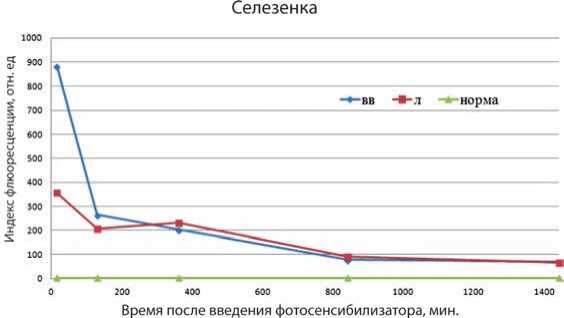
Рис. 4. Флюоресценция селезенки при внутривенном (вв) и лимфотропном (л) введении
Данные о флюоресценции почек в различные временные промежутки говорят о том, что индекс флюоресценции при лимфотропном введении на временном промежутке от 15-ти до 6-ти часов в 1,31–2,58 раз ниже, чем при внутривенном (рис. 5). В дальнейшем, на 14–24-х часах, флюоресценция при лимфотропном введении начинает незначительно превышать (в 1,10–1,19 раз) таковой при внутривенном.
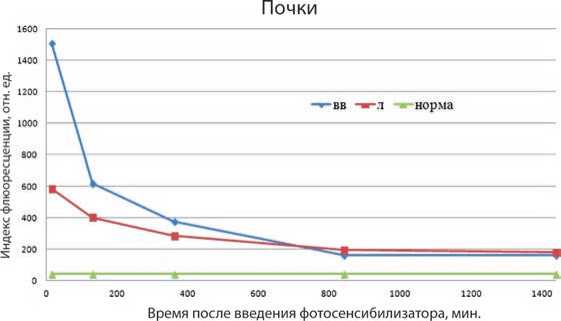
Рис. 5. Флюоресценция почек при внутривенном (вв) и лимфотропном (л) введении
Как и флюоресценция селезенки, флюоресценция печени, почек после 14-ти часов при обоих способах введения выходят на один уровень.
Обсуждение
На экспериментальной модели доказано наличие гуморальной связи кожно-подкожной ткани с внутренними органами (паховая область – яичко), что позволит осуществлять адресную доставку лекарственных препаратов в пораженный орган. Лимфотропное введение позволяет сохранять высокие концентрации препарата в органе в течение длительного времени (более 24 часов), в то время как внутривенное введение препарата позволяет быстро достичь более высоких концентраций препарата в тканях в течение первых часов с дальнейшим понижением. Отмечено, что при лимфотропном введении происходит более избирательное накопление препарата в пораженном яичке в течение длительного времени (6–24 часа) по сравнению с внутривенным. Выявлено значительное (более чем 2-кратное) превышение концентрации препаратов в печени, почках и селезенке на 6–14 часах после внутривенного введения по сравнению с лимфотропным, что говорит о потенциально возможном снижении гепато-, нефро-, спленотоксичности вводимых препаратов.
Исходя из результатов проведенного экспериментального исследования, нами был использован указанный метод введения лекарственных препаратов в лечении 25 больных острыми воспалительными заболеваниями яичка и его придатка в отделении урологии ГБУЗ ГКБ № 51 Департамента здравоохранения города Москвы. Выявлено, что лимфотропное введение в зоны Юрьина антибактериальных препаратов при остром эпидидимоорхите и эпидидимите обладает рядом преимуществ по сравнению с традиционными методами: улучшение клинической картины в более ранние сроки, более быстрая нормализация лабораторных показателей крови и ультразвуковой картины, уменьшение среднего койко-дня, что не только повышает эффективность лечения пациентов, но и улучшает медико-экономические показатели.
Заключение
Таким образом, полученные данные могут быть эффективно использованы для обеспечения адресной доставки различных препаратов, повышения концентрации препаратов в органе-мишени и уменьшения кратности введения, что в итоге приведет к улучшению результатов лечения гнойно-воспалительных заболеваний не только в урологии, но и у больных хирургического профиля. Не менее важным, на наш взгляд, являются перспективы использования данной методики в онкологии при проведении химиотерапии.
Список литературы Лимфотропное введение фотосенсибилизатора как модель таргетной терапии гнойно-воспалительных заболеваний у больных хирургического профиля
- Ярема И.В. Метод лекарственного насыщения лимфатической системы//Хирургия. 1999. № 1. С. 14-16.
- Коненков В.И., Наров Ю.Э., Любарский М.С., Морозов В.В. Методы клинической лимфологии в онкологии. Новосибирск: Издательский дом «Историческое наследие Сибири», 2010. 216 с.
- Буянов В.М., Данилов К.Ю., Радзиховский А.П. Лекарственное насыщение лимфатической системы. Киев: Наук. Думка, 1991. 136 с.
- Левин Ю.М., Свиридкина Л.П., Матвеев Г.Н., Бабаков А.В. Эндоэкологическая медицина и эпицентральная терапия: новые принципы и методы. М: Изд-во «Щербинская типография», 2000. 383 с.
- Зубарев П.Н., Синченко Г.П., Курыгин А.А. Эндолимфатическая и лимфотропная лекарственная терапия в абдоминальной хирургии. СПб.: Фолиант, 2005. 224 с.
- Ярема В.И. Хирургические подходы к лечению сепсиса с точки зрения лимфатического патогенеза. Aвтореф. дис..докт. мед. наук. М., 2009. 51 c.
- Чернеховская Н.Е., Шишло В.К., Шевхужев З.А. Основы взаимодействия no-терапии и лимфотропной антибиотикотерапии при лечении трофических язв//Хирургическая практика. 2013. №1. с. 9-14.
- Назарова О.Н. Лимфотропная озонотерапия в комплексном лазерохирургическом лечении осложненных эктопий шейки матки. Автореф. дис. … канд. мед. наук. М., 2006. 19 с.
- Вялова С.В. Лимфотропная терапия дисциркуляторной энцефалопатии у больных артериальной гипертензией среднего и пожилого возраста. Дис. …канд. мед. наук. М., 2005. 122 с.
- Левин Ю.М., Свиридкина Л.П., Топорова С.Г. Эндоэкологическая реабилитация по Левину (ЭРЛ) в условиях стационара терапевтического профиля. Методические рекомендации № 9/171. М., 1999. 12 с.
- Казаков А.В. Лимфотропная противотуберкулезная терапия в сочетании с ронколейкином в комплексном лечении больных распространенными формами туберкулеза легких. Автореф. дис. … канд. мед.наук. Новосибирск, 2011. 22 с.
- Цгоева Е.А. Эффективность лимфотропных методов лечения у больных ограниченными формами туберкулеза легких в условиях пенитенциарной системы//Пермский медицинский журнал. 2009. Т. 26. № 5. С. 40-44.
- Наров Ю.Э. Патогенетические аспекты сорбционных и лимфотропных методов коррекции эндотоксикоза у онкологических больных на фоне полихимиотерапии. Дис..докт. мед. наук. Новосибирск, 2005. 268 с.
- Левин Ю.М. Лечение, оздоровление, профилактика в условиях кризиса экологии организма. М.: Изд-ство МГОУ, 1998. 231 с.
- Левин Ю.М. Основы лечебной лимфологии. М.: Медицина, 1986. 287 c.


