Липидный метаболизм в раннем онтогенезе кур и его генетическая и эпигенетическая регуляция
Автор: Чугунова Е.Г., Позовникова М.В.
Журнал: Вестник Пермского университета. Серия: Биология @vestnik-psu-bio
Рубрика: Генетика
Статья в выпуске: 2, 2025 года.
Бесплатный доступ
Липидный метаболизм – сложный процесс, критически важный для развития организма. В раннем онтогенезе кур, начиная с инкубационного периода и продолжаясь в неонатальный период, происходит интенсивное накопление и перераспределение липидов, обеспечивающих энергией и строительным материалом растущий организм. Этот процесс находится под влиянием паратипических факторов и строгим контролем генетических и эпигенетических механизмов. Генетическая регуляция липидного обмена в этот период осуществляется целым каскадом генов. Ключевую роль играют гены, кодирующие ферменты, участвующие в липолизе, липогенезе, транспорте и метаболизме жирных кислот. Транскриптомные исследования, анализирующие экспрессию генов на уровне микроРНК (мРНК), позволяют изучить эти изменения в динамике развития. Однако генетическая информация не является единственным фактором, определяющим липидный метаболизм. Эпигенетические механизмы, такие мРНК играют значительную роль в тонкой настройке экспрессии генов, вовлеченных в жировой обмен. МикроРНК – это короткие некодирующие РНК, которые регулируют экспрессию целевых генов, влияя на стабильность их мРНК и эффективность трансляции. Они могут взаимодействовать с мРНК генов, кодирующих ключевые ферменты липидного обмена, изменяя их активность и, следовательно, влияя на уровень липидов в крови и тканях. В данном обзоре рассмотрены некоторые аспекты липидного обмена, вклад генетических и эпигенетических компонент, вовлеченных в регуляцию липогенеза и адипогенеза в период раннего онтогенеза кур.
Эмбрион, куры, жировой обмен, ген, микроРНК
Короткий адрес: https://sciup.org/147250955
IDR: 147250955 | УДК: 575.174.015.3; 636.52 | DOI: 10.17072/1994-9952-2025-2-204-223
Текст научной статьи Липидный метаболизм в раннем онтогенезе кур и его генетическая и эпигенетическая регуляция
Вопросы регуляции липидного метаболизма кур давно являются областью пристального интереса с производственной и научной точки зрения. Это связано с тем, что жировая ткань в организме, несомненно, важна и играет центральную роль в регуляции энергетического метаболизма тела как на органном, так и на системном уровне. Это не только депо энергии для организма, но и источник различных биологически активных факторов (адипокинов), участвующих в многочисленных метаболических путях и поддержании гомеостаза клеток [Luo, Liu, 2016]. Помимо этого, накопление абдоминального жира рассматривают как негативный фактор, а увеличение содержания внутримышечного жира является предпочтительным, т. к. значительно увеличивает органолептические свойства мяса [Cui et al., 2022]. Депонирование жира – это сложный динамический процесс, регулируемый гормональными и клеточными факторами, включает ряд этапов, таких как дифференцировка адипоцитов, синтез, транспортировку и разложение липидов [Nematbakhsh et al., 2021].
Развитие куриного эмбриона происходит в уникальной полузакрытой системе – яйце, которое служит резервуаром питательных веществ, предварительно синтезированных организмом курицы. Важнейшую роль в этом процессе играют липиды, синтезирующиеся de novo в печени курицы и запасающиеся исключительно в желтке. Липиды играют ключевую роль в развитии эмбриона птицы, являясь основным источником энергии и структурным компонентом клеточных мембран. Изучение особенностей липидного метаболизма в эмбриональный период у кур позволяет лучше понять процессы роста и развития, а также разрабатывать стратегии оптимизации инкубации для повышения выводимости и качества цыплят. Известно, что изменение режима инкубации (температура, влажность) могут приводить к физиологическим изменениям у эмбриона как в положительную (повышение выводимости цыплят), так и в отрицательную сторону (пороки развития и гибель) [Бессарабов и др., 2021]. В общей сложности моделирование систем инкубации приводит к «переключению» генетического программирования у эмбриона. Идентификация и комплексное изучение различных факторов, в том числе генетических и эпигенетических, которые вовлечены в регуляцию липидного метаболизма в эмбриогенезе кур, может улучшить наше понимание обменных процессов, что позволит разрабатывать новые подходы в селекции птицы.
Множество полногеномных ассоциативных исследований (GWAS – Genome-Wide Association) с использованием данных чипов SNP с высокой плотностью ранее было проведено для сужения областей и выявления казуальных генов, которые влияют на признаки отложения жира у кур [Zhang et al., 2020; Pan et al., 2024; Munyaneza et al., 2022]. Однако в последние десятилетия вопросы регуляции генов становятся куда более приковывающими внимание исследователей, чем центральная догма молекулярной биологии. Так, например, эукариотический геном содержит менее 2% белковых кодирующих областей, а значительная часть генома транскрибируется некодирующими РНК (нкРНК), размер, которых варьирует от 20 нуклеотидов до 100 т.п.н. НкРНК вовлечены в регуляцию многих биологических процессов в организме, в том числе в регуляцию липидного метаболизма. Среди этих нкРНК особое внимание исследователей привлекли микроРНК [Li et al., 2017]. Это обширный класс коротких некодирующих РНК длиной около 22 п.н., впервые обнаруженных у Caenorhabditis elegans в 1993 г. [Lee et al.,1993]. С момента открытия этих молекул прошло много лет, в течение которых происходило активное изучение их биогенеза и функции у многих видов животных и птиц, что значительно повлияло практически на все области биологии и изменило наш взгляд на регуляцию генов. МикроРНК эволюционно консервативны, идентифицируются у широкого круга видов животных [Pasquinelli et al., 2000]. Как правило, мРНК регулируют экспрессию специфических генов на посттранскрипционном уровне путем связывания с комплементарными молекулами РНК, что приводит к репрессии трансляции или деградации мРНК и изменению уровня клеточного белка в клетках различных типов тканей [Bartel et al., 2004]. Благодаря своим уникальным свой- ствам микроРНК были признаны важными регуляторами гомеостаза холестерина и жирных кислот, метаболизма липидов [Shao et al., 2019], адипогенеза [Huang et al., 2015] и отложения жира [Cui et al., 2018].
В данном обзоре рассмотрены некоторые вопросы особенностей липидного метаболизма у кур в эмбриональный период, описаны факторы, оказывающие влияние на интенсивность липидного обмена во время инкубации, и приведен ряд аспектов по вкладу генетических и эпигенетических (микроРНК) составляющих, непосредственно связанных с липогенензом и адипогенезом у кур.
Липидный метаболизм в эмбриональный период развития кур
Уникальной особенностью птиц, сформировавшейся эволюционно и радикально отличающих их от млекопитающих, является развитие эмбриона вне тела матери. В течение 21 дня развития единственным источником питания для эмбриона являются только питательные вещества яйца – белок и желток. Желток, значимый источник питательных веществ для развивающегося эмбриона, содержит макромолекулярные комплексы, включающие липиды, белки, витамины, минералы и другие важные микроэлементы. Энергия, необходимая цыплятам для роста и развития, обеспечивается в три этапа (рис. 1).
Вылупление
Физиологические этапы эмбриогенеза
Начало инкубации
Формирование хорио аллант оиса
Переход на легочное дыхание
Формирование эмбриона структурно завершено
Закладка органов и тканей
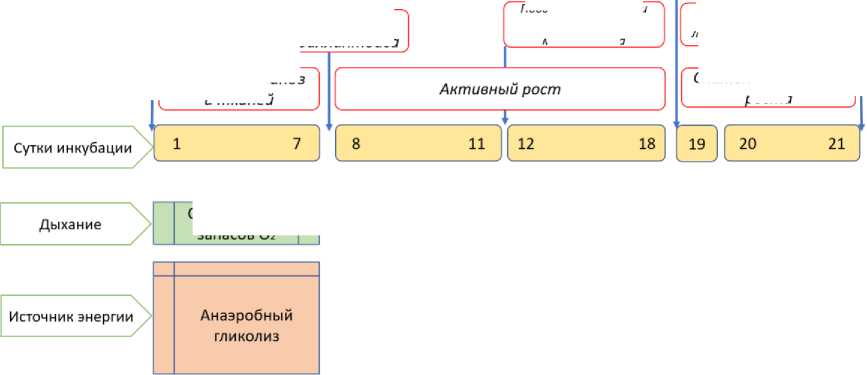
Снижение скорости роста
Обильное снабжение Оз липидов желтка
Ограничение запасов Оз
Анаэробный катаболизм Глюконеогенез Окисление
Повышение скорости липидного метаболизма
Ограничение запасов Оз

Рис. 1. Периоды эмбрионального развития эмбрионов кур и их основные физиологические и метаболические изменения (адаптировано из [De Oliveira et al., 2008])
[Periods of embryonic development of chicken embryos and their main physiological and metabolic changes (adapted from [De Oliveira et al., 2008])]
В начале эмбрионального развития питательные вещества яичного желтка доставляются через расширяющуюся сосудистую систему [Burley et al., 1993]. Энергия, затрачиваемая в это время, в основном вырабатывается за счет анаэробного гликолиза из доступной глюкозы. [Speake et al., 1998]. К восьмому дню развития у эмбриона полностью сформирован хориоаллантоис, который способен обеспечить адекватный обмен O2-CO2 и поддерживать активный эмбриональный рост. Вплоть до 19 дня инкубации (начало легочного дыхания) основным источником энергии являются липиды яичного желтка. В момент, когда цыпленок начинает дышать самостоятельно, активируются механизмы анаэробного катаболизма и глюконеогенеза, однако именно процесс окисления липидов яичного желтка является основным источников общей энергии эмбриона, что в целом определяет интенсивность роста и развития цыпленка [van der Wagt et al., 2020]. Последняя треть инкубации характеризуется повышением активности липидного метаболизма и около 80% всех содержащихся в желтке жиров мобилизуется и всасывается эмбрионом. Избыток липидов депонируется в печени. После вылупления относительное количество сложных эфиров стерола в ткани печени значительно уменьшается, в то время как содержание ТАГ повышается. Такое увеличение содержания ТАГ сопровождается быстрым изменением состава жирных кислот, которое не связано с эмбриональным развитием. Содержание жирных кислот в образующемся ТАГ заметно отличается от ТАГ, абсорбированного из желтка. Эти изменения в липидном и жирнокислотном составе печени свидетельствует о быстром изменении роли печени в липидном обмене только что вылупившихся цыплят [Wang et al., 2017]. Таким образом, в этот период вплоть до вылупления происходят значительные метаболические изменения с переключением в сторону липолиза. В период вылупления и в неонатальный период жировая ткань является основным местом хранения триацилглицерина, при этом происходит перенос эфира холестерина из яичного желтка в печень, что, в свою очередь, служит источником энергии. Также у цыплят наблюдается высокий уровень гликемии (2 г/л) и низкая чувствительность к экзогенному инсулину [Braun, Sweazea, 2008], при этом высокий уровень глюкозы в крови регистрируется и у взрослых особей, что считается уникальной особенностью птиц [Sweazea, 2022]. Также именно во вторую половину инкубации начинает формироваться внутримышечная жировая ткань. По данным Liu et al. [2017], у куриных эмбрионов с 17-го дня эмбрионального (E17) до 1-го дня постнатального развития внутримышечный жир быстро депонируется, но его количество в мышцах резко снижается в ходе более позднего развития.
Особенностью развития жировой ткани у эмбрионов кур является доминирование гиперплазии преадипоцитов с последующей гипертрофией и образованием незрелых адипоцитов, чувствительных к отложению липидов [Gavrilova et al., 2009]. Адипоциты быстро созревают и уже к 14-му дню инкубации у эмбрионов большая их часть являются однокамерными, при этом многокамерные клетки на этой стадии почти не обнаруживаются [Chen et al., 2014].
По данным ряда авторов, уровень метаболизма липидов в печени ассоциирован с накоплением абдоминального жира у кур. При этом развитие жировой ткани в эмбриональном и раннем постнатальном периодах определяет процесс ее роста на всю жизнь у цыплят [Ailhaud et al., 1992; Guo et al., 2011].
Таким образом, понимание механизмов динамических изменений метаболизма липидов во время эмбрионального периода и периода после вылупления цыпленка расширяет понимание физиологических особенностей развития жировой ткани у кур.
Факторы, влияющие на липидный обмен эмбриона
Одним из ключевых факторов, обеспечивающих сохранность и здоровье цыплят, является режим инкубации, а именно температура и относительная влажность. Исследования показывают, что даже незначительные изменения температуры (в пределах 1℃) и/или влажности могут в значительной степени определять выводимость цыплят [Tona et al., 2022]. Так, повышение температуры инкубации увеличивает теплопродукцию эмбриона, а пониженная – снижает. Особенно критически важными являются первые 18 суток. Высокие или низкие температуры инкубации с 1-го эмбрионального дня до периода вылупления напрямую влияют на степень использования и всасывания веществ яичного желтка путем изменения экспрессии генов ткани желточного мешка, которые, в свою очередь, отвечают за всасывание и переваривание желтка. Изменение липидного обмена эмбриона под воздействием абиогенных стресс-факторов, в свою очередь, влияет на выводимость и качество цыплят [Dayan et al., 2020].
Во время инкубации б́óльшая часть питательных веществ желтка используется через ткань желточного мешка — внеэмбриональную ткань, которая обволакивает желток. Ткань желточного мешка является основным местом переваривания, всасывания и переноса питательных веществ из желтка к эмбриону. Кроме того, она продуцирует пищеварительные ферменты, экспрессирует переносчики питательных веществ и синтезирует желчные кислоты, которые имеют решающее значение для переваривания липидов желтка [Yadgary et al., 2010]. Инкубирование яиц при низких (36.3°C) и высоких (39.3°C) температурах приводит к снижению потребления желтка. Однако в этом исследовании эмбрионы были подвергнуты температурному стрессу со дня закладки в инкубатор до E18, а с E18 и до дня вылупления температура инкубации для всех групп 37.8°С [Dayan et al., 2020]. Стоит отметить, что изменение уровня метаболизма эмбриона под воздействием температурного фактора напрямую зависит от того, на каком этапе эмбриогенеза происходит воздействие стресс-фактора. Так, инкубирование яиц при температуре 37.5°C до 11-го дня инкубации с последующим воздействием более высокой температуры – 39.5°C – в течение 4 часов ежедневно с 12-го по 18-й день инкубации оказало положительное влияние на эмбриональное развитие за счет изменения роста эмбриона, тканевого метаболизма и частоты дыхания. У этих цыплят была значительно более низкая масса желточного мешка и более высокая масса печени, что косвенно свидетельствовало о повышенном потреблении желтка. Также у них наблюдалось повышение содержания общего белка, альбумина, IgM, глюкозы, кальция, общего антиоксиданта и T3 и снижение уровня АСТ, АЛТ, холестерина, Т4 и кортикостерона в сравнении с цыплятами, не подвергшихся тепловому стрессу [Iraqi et al., 2024].
Инкубация при переменных температурах на протяжении всего периода инкубации в сочетании круглосуточным красным освещением приводила к изменению массы тела и внутренних органов эмбрионов и цыплят кросса Ломанн Браун после вылупления на фоне измененных показателей интенсивности дыхания. Совместное действие температурного и светового фактора, по мнению авторов, способствовало изменению нейроэндокринных механизмов регуляции роста, метаболизма, иммунных реакций, терморегуляции и реакций на стресс у эмбрионов и цыплят [Челнокова и др., 2022]. Понижение влажности в инкубаторе до 43% вызывало уменьшение сырого жира (смесь триглицеридов жирных кислот и сопутству- ющих веществ) в эмбрионах, что указывает на снижение потребления желтка эмбрионом. Также вылупившиеся цыплята из этой группы имели низкие значения живой массы по сравнению с цыплятами из контрольной группы [Peebles et al., 2001a/b].
Возраст матери также влияет на липидный метаболизм эмбрионов. Так, например, относительная масса желточного мешка на 12-й и 18-й день инкубации была выше в яйцах, полученных от кур на 36-й неделе, по сравнению с яйцами, полученными на 27-й неделе. Можно предположить, что скорость усвоения желтка эмбрионами от 36-недельных кур снижена по сравнению эмбрионами, полученными от 27недельных кур. Также можно предположить замедление роста эмбрионов от 36-недельных кур, т. к. в среднем относительная масса эмбрионов была снижена, в то время как относительная масса желточного мешка, наоборот, увеличена. Концентрация холестерина, липопротеинов высокой плотности, липопротеинов низкой плотности в плазме крови ниже у цыплят от 36-недельных кур, что может говорить о низкой скорости усвоения и использования желтка [Peebles et al., 2001a/b].
Можно заключить, что метаболизм эмбрионов, в том числе липидный, обладает высокой пластичностью в ответ на изменяющиеся режимы инкубации, а также зависит от возраста матери. Это позволяет уже на эмбриональном уровне регулировать интенсивность обмена веществ эмбриона и получать птицу с заданными свойствами. Однако изучение вопросов генетический и эпигенетической регуляции необходимы, т. к. позволяют понять биологическую составляющую этих изменений.
Транскриптомные изменения и функции генов, участвующих в регуляции липидного метаболизма в ранний неонатальный период развития кур
Куры, в отличие от млекопитающих, обладают некоторыми уникальными свойствами жирового обмена. Они имеют врожденную нечувствительность к инсулину, что выражается в естественной гипергликемии (>200 мг/дл во время голодания), при этом они не чувствительны к высоким дозам экзогенного инсулина [Simon et al., 1989]. Но отсутствие у них бурой жировой ткани делает их более чувствительными к тепловому стрессу. Другой уникальной особенностью является утрата геномных локусов пяти основных адипокинов млекопитающих: лептин ( LEP ) [Pitel et al., 2010], ингибитор активатора плазминогена-1 ( PAI-1 ), фактор некроза тканей альфа ( TNFA ), резистин и оментин [Đaković et al., 2014]. Все это указывает на наличие альтернативных генетических составляющих регуляции тех механизмов, за которые отвечают вышеуказанные гены у млекопитающих, а именно потребление корма, аппетит, энергетический баланс. Тем не менее, кур рассматривают как оптимальный биологический объект в вопросах изучения генетических основ регулирования липидного метаболизма [Burt, 2007].
Отдельный интерес представляют гены, вовлеченные в регуляцию липидного метаболизма во время эмбрионального развития и в ранний неонатальный период. Именно в эти критические периоды закладываются основы метаболической активности организма птиц.
Рядом исследователей показано, что количество экспрессируемых генов и их транкриптационная активность различна в зависимости от типа ткани, стадии развития (эмбрион и ранние неонатальные цыплята) и от породы. Основное внимание исследователей сосредоточено на анализе генов, экспрессируемых в грудных мышцах и тканях печени. Это связано с тем, что печень является центральным органом липидного метаболизма, а липиды, запасаемые адипоцитами в эмбриональном периоде, транспортируются в мышечные волокна и используются для роста и обеспечения энергетических потребностей на ранних стадиях развития [Liu et al., 2016]. Впоследствии, уже на более поздних этапах жизни, липиды вновь депонируются в мышцах, формируя внутримышечный жир, который, помимо прочего, является важным селекционным признаком.
Анализ транскриптома тканей грудных мышц кур породы Shouguang с помощью РНК-секвенирования позволил выявить кластер генов липидного метаболизма, преимущественно вовлеченных в такие пути, как β-окисление жирных кислот, гомеостаз липидов, деградация жирных кислот. Экспрессия генов данного кластера увеличивался от E17 до D1 и затем уменьшался от D1 до D14, а наиболее значимыми и активноэкспрессирующимися в эмбриональный период были гены ACADL, ACAT1, HADHA, ACADS, ECHS1 и AUH [Liu et al., 2020]. В исследовании, проведенном на бройлерах Arbor Acres и китайской местной курице Lushi, гены IGF2BP3 и HMGCR, были определены как потенциальные биомаркеры развития грудных мышц и отложения внутримышечного жира. Уровень экспрессии на Е10, Е14, Е18 и D1 был выше у бройлеров, однако общим для обеих пород было достоверное снижение активности генов от Е10 до D1 [Tian et al., 2021]. Данные транскриптома, полученные из грудных мышц и печени инбредной линии с повышенным содержанием абдоминального жира в китайской породе карликовых кур Jingxing-Huang, позволили идентифицировать гены, ассоциированные с отложением жира и экспрессируемые в период с 12 дня инкубации по 180 день жизни цыплят. В тканях грудных мышц было выявлено 8545 генов. При этом изменения транскиптома было более значительным на Е12 (708 генов), достигая минимума к D1 (57 генов). Анализ сети взвешенной коэкспрессии генов (WGCNA, Weighted Gene Coexpression Network Analysis) позволил выявить гены-концентраторы фазы гиперплазии (E12 по D21) и фазы гипертрофии жировых клеток (D07 по D180). Авторы предположили, что неаннотированный ген ENSGALG00000041996 может играть ключевую роль в отложении жира на ранних стадиях развития грудных мышц цыплят путем регуляции генов сигнального пути PPAR – CD36 и ACADL [Xing et al., 2020]. Транскриптомный профиль тканей печени также показал различия в зависимости от стадии развития эмбрионов и цыплят. Так, количество дифференциально экспрессируемых генов было высоким на Е12 (343 гена), снижалось к Е17 (311 генов) и на D1 было минимальным (108 генов). При этом гистологически отложение липидов фиксировали с Е17, а наличие адипоцитов – с D21. Гены MFGE8, HHLA1, CKAP2 и ACSBG2 положительно коррелировали с массой абдоминального жира у цыплят и были идентифицированы как гены-концентраторы [Xing et al., 2021]. Развитие липидных капель в печени куриного эмбриона связано с изменением содержания печеночных белков. Исследование протеомного профиля печени эмбрионов кур в период с 12 по 20 день инкубации выявило, что белки APOA4, FABP2 и CYP51A1 играют важную роль в регуляции липогенеза и активности антиоксидантных ферментов на стадии эмбрионального развития цыплят [Shen et al., 2023].
Транскриптомный анализ печени цыплят белого леггорна определил группы генов, дифференциально экспрессируемых в переходные периоды E18-E20, E20-D0 и D0-D1. Анализ IPA показал их участие во многих различных процессах развития и метаболизма (табл. 1). При этом основной молекулярноклеточной функцией являлся метаболизм липидов [Hicks et al., 2017].
Таблица 1
Основные клеточные пути и функции, связанные с развитием печени у кур [Hicks et al., 2017] [Primary cellular pathways and functions associated with liver development in chickens [Hicks et al., 2017]]
|
Сравнение временных точек |
Основные канонические пути |
Ведущие активирующие регуляторы |
Молекулярные и клеточные функции |
Развитие и функционирование физиологической системы |
|
Е18-Е20 |
путь убиквитинирования белка; ответ развернутого белка; пуриновые нуклеотиды de Novo Biosynthesis II; активация FXR/RXR; сигнализация рецептора арильного углеводорода |
TP53; бета-эстрадиол; XBP1; PPARA; HNF4A |
гибель и выживание клеток; клеточный рост и пролиферация; метаболизм аминокислот; биохимия малых молекул; липидный метаболизм |
выживание организма; развитие и функционирование пищеварительной системы; морфология органов; развитие и функционирование соединительной ткани |
|
Е20-D0 |
активация FXR/RXR; активация LXR/RXR; ингибирование функции RXR, опосредованное LPS/IL-1; сигнализация острой фазы ответа; система коагуляции |
TP53; PPARA; бета-эстрадиол; метилпреднизолон; MYC |
липидный метаболизм; биохимия малых молекул; молекулярный транспорт; гибель и выживание клеток; метаболизм амино кислот |
выживание организма; развитие и функционирование пищеварительной системы; развитие и функционирование печеночной системы; морфология органов; развитие организма |
|
D0-D1 |
сигнализация EIF2; опосредованное LPS/IL-1 ингибирование функции RXR; митохондриальная дисфункция; сигнализация острой фазы ответа; активация FXR/RXR |
PPARA; HNF4A; метилпреднизолон; пириниксо-вая кислота; MYC |
метаболизм аминокислот; биохимия малых молекул; метаболизм липидов; молекулярный транспорт; метаболизм углеводов |
развитие и функционирование пищеварительной системы; развитие и функционирование печеночной системы; морфология органов; развитие организма; морфология тканей |
|
D1-D3 |
биосинтеза холестерина; биосинтез холестерина I; биосинтез холестерина II (через 24,25-дигидроланостерол); биосинтез холестерина III (через десмостерол); митохондриальная дисфункция |
PPARA; SREBF1; SCAP; POR; SREBF2 |
липидный обмен веществ; молекулярный транспорт; биохимия малых молекул; метаболизм витаминов и минералов; выработка энергии |
развитие и функционирование пищеварительной системы; развитие и функционирование печеночной системы; морфология органов; развитие организма; развитие и функционирование соединительной ткани |
Крупномасштабное исследование по анализу транскриптома печени эмбрионов (Е16, Е18 и Е20) и цыплят-бройлеров Росс×Росс (D1, D3 и D9) показало, что синтез липидов был ингибирован в печени вылупившихся цыплят по сравнению с эмбрионами. В период позднего эмбриогенеза (E16-E20) преобладало β-окисление липидов желтка, гликолиз и глюконеогенез, которые точно контролируются факторами транскрипции (PPARA, PPARGC1A, NR1H4 и SIRT1, SERTAD2, KLF11, KLF13 и KLF15) [Cogburn et al., 2018]. Другими исследователями было установлено, что гены печеночного липогенеза, такие как ACC, ChREBP, CPT1, ELOVL6, FAS, PPAR, SCD1 и SRRBP, имели разные модели экспрессии в течение эмбри- онального периода и в первую неделю после вылупления, которые могут быть активированы ChREBP [Liu et al., 2020a/b].
Таблица 2 содержит информацию о ряде аннотированных ключевых генах, играющих важную роль в регуляции обмена липидов в раннем онтогенезе кур.
Таблица 2
Аннотированные гены, участвующие в регуляции липидного метаболизма в раннем онтогенезе кур [Annotated genes involved in the regulation of lipid metabolism during early ontogeny of chickens]
|
Ген |
Идентификационный номер |
Функциональная роль в липидном метаболизме |
Пути KEGG (липидный метаболизм) |
|
CD36 (молекула CD36) |
LOC417730 |
Связывает длинноцепочечные жирные кислоты и может функционировать в транспорте и/или как регулятор транспорта жирных кислот |
gga03320 – Сигнальный путь PPAR; gga04920 – Адипоцитокиновый сигнальный путь |
|
ACADL (длиноцепочечная ацил-КоА-дегидрогеназа) |
LOC424005 |
Участвует в метаболизме жирных кислот |
gga00071 – Распад жирных кислот gga 01212 – Метаболизм жирных кислот gga03320 – Сигнальный путь PPAR gga01040 – Биосинтез ненасыщенных жирных кислот gga00062 – Удлинение жирных кислот |
|
ACADS (ацил-КоА-дегидрогеназа с короткой цепью от С-2 до С-3) |
LOC416969 |
Участвует в бета-окислении жирных кислот с использованием ацил-КоА-дегидрогеназы |
gga00071 – Распад жирных кислот gga01212 – Метаболизм жирных кислот |
|
ACAT1 (ацетил-КоА ацетилтрансфераза 1) |
LOC418968 |
Участвует в развитии жировой ткани |
gga00071 – Распад жирных кислот gga01212 – Метаболизм жирных кислот |
|
ACSBG2 (член семейства пузырьковых ацил-КоА-синтетаз 2) |
LOC420090 |
Опосредует активацию длинноцепочечных жирных кислот как для синтеза клеточных липидов, так и для деградации посредством бета-окисления |
gga00071 – Распад жирных кислот gga01212 – Метаболизм жирных кислот gga03320 – Сигнальный путь PPAR; gga00061 – Биосинтез жирных кислот |
|
MFGE8 (молочный жировой глобул EGF и домен фактора V/VIII) |
LOC415494 |
Участвует в регуляции усвоения пищевых триглицеридов и клеточному поглощению жирных кислот |
- |
|
HMGCR (3-гидрокси-3-метилглутарил-КоА-редуктаза) |
LOC395145 |
Участвует в биосинтезе холестерина |
gga01100 – Метаболические пути |
|
HADHA (гидроксиацил-КоА-дегидроге-наза/3-кетоацил-КоА-тиолаза/еноил-КоА-гидратаза (трифункциональ-ный белок), альфа-субъединица |
LOC395929 |
Участвует в бета-окислении жирных кислот, процессе метаболизма жирных кислот, реакции на инсулин |
gga00071 – Распад жирных кислот gga01212 – Метаболизм жирных кислот gga00062 – Удлинение жирных кислот gga01100 – Метаболические пути |
|
AUH (AU РНК связывающая метилг-лутаконил-КоА гидратаза) |
LOC427269 |
Участвует в бета-окислении жирных кислот |
gga01100 – Метаболические пути |
Характеристики некоторых наиболее важных генов были обобщены.
Ген ACC (ацетил-КоА карбоксилаза) – фермент, ограничивающий скорость синтеза жирных кислот, катализирует карбоксилирование ацетил-КоА до малонил-КоА. Малонил-КоА, синтезируемый ACC , является важнейшим регулятором липидного обмена, т. е. окисления и синтеза жирных кислот [Tian et al., 2009]. Согласно исследованию Liu et al. [2020a/b], экспрессия ACC в печени увеличивалась с E17 и достигла пика на E19, но снизилась на D1, что свидетельствует о том, что эмбриональная печень обладает способностью к синтезу жирных кислот de novo на поздних этапах эмбрионального роста. Об этом говорят и более ранние исследования, которые показали, что экспрессия белка ACC в печени увеличивалась с Е12 до вылупления, при этом в головном мозге его экспрессия оставалась постоянной, в мышцах груди только на Е12 и в малых количествах, а в сердце не была обнаружена [Proszkowiec-Weglarz et al., 2009].
Ген FASN (синтаза жирных кислот) является ключевым ферментом в синтезе жирных кислот, который катализирует синтез длинноцепочечных жирных кислот путем конденсации ацетил-КоА и малонил-КоА в сложной семистадийной реакции. Количество мРНК FAS достигает максимума непосредственно перед вылуплением, за которым следует постепенное снижение. На культурах первичных гепатоцитов эмбрионов кур было установлено, что обработка клеток инсулином приводила к активации экспрессии FASN [Zhang et al., 2022].
Ген ChREBP кодирует одноименный белок (взаимодействующий белок-подобный фактор). Идентифицирован как транскрипционный репрессор и играет решающую роль в связи углеводного метаболизма с липогенезом de novo . Cверхэкспрессия ChREBP увеличивала накопление липидов как в мышечных клетках in vitro , так и в ТА-мышцах мышей и кур in vivo (р <0.05) за счет активации пути липогенеза de novo . Добавление в рацион кур фруктозы сопровождалось активацией ChREBP , увеличением содержания и изменением липидного профиля внутримышечного жира у цыплят (р <0.05), что в целом повышало вкусовые качества мяса [Wang et al., 2024]. Выращивание цыплят-бройлеров, начиная с 28 дня при тепловом стрессе в течение 7 дней, значительно повышало уровень экспрессии мРНК ChREBP в тканях печени, что, по мнению авторов, указывало на значимую роль гена ChREBP в процессе усиления синтеза жира, вызванного хроническим тепловым стрессом [Lu et al., 2019].
Ген CPT1 кодирует фермент карнитин-пальмитоилтрансферазы-1, который катализирует перенос ацильной группы конъюгатов длинноцепочечных жирных кислот с КоА на карнитин. Дефицит фермента приводит к снижению скорости бета-окисления жирных кислот. Добавление конъюгированной линолевой кислоты в рацион кур-производителей приводило к некоторым изменениям липидного метаболизма в печени 5-тисуточных цыплят (потомков) на фоне повышенной экспрессии гена CPT1 [Fu et al., 2022]. Другими авторами было высказано предположение, что снижение катаболизма липидов, а не увеличение липидного анаболизма способствует отложению внутримышечного жира у кур. Так, у цыплят в возрасте 120–180 дней в мышечной ткани груди наблюдалось подавление экспрессии генов, вовлеченных в сигнальный путь PPAR ( CPT1A, SLC27A1, LPL, ABCA1 ) [Qiu et al., 2017].
Ген LRP2 (мегалин) – крупный представитель семейства генов LDLR , содержащий 4 кластера LA-повторов. Хотя многие белки, которые связываются с LRP1, также являются лигандам и для мегалина, характер его экспрессии и специфичность к определенным лигандам объясняют физиологическую роль, отличную от роли LRP1. Мегалин необходим для развития переднего мозга посредством поглощения липопротеинов, содержащих аполипопротеин B, нейроэпителием эмбриона. Другой его важной функцией является участие в метаболизме некоторых липофильных витаминов [Schneider et al., 2007]. Ранее у кур мегалин не был идентифицирован, однако позднее LRP2 был указан как ген, участвующий в поглощении липидов и их метаболизме. Отклонение от оптимальной температуры инкубации (например, на 1.5°C ниже или выше 37.8°C) приводило к изменению экспрессии данного гена в тканях желточного мешка. Повышение температуры инкубации вызывало снижение экспрессии LRP2 , начиная с E11, что можно объяснить снижением использования желтка эмбрионом [Dayan et al., 2020].
Ген ACAA2 (ацетил-КоА-ацилтрансфераза 2) в основном катализирует последнюю стадию β-окисления жирных кислот в митохондриях. Согласно исследованиям, содержание ACAA2 было значительно выше в E19 по сравнению с E14 в куриных эмбрионах, что указывает на усиление липолиза, обеспечивающего энергию для роста с E14 до E19 [Peng et al., 2018]. Однако данные других авторов свидетельствуют, наоборот, о высокой экспрессии в E12 и E14, т. к. именно в это время активен печеночный метаболизм, что согласуется с острой потребностью эмбриона в период, когда темпы роста и метаболизма максимальны, а энергия в основном обеспечивается β-окислением жирных кислот, полученных из липидов желтка [Petit et al., 2024].
Ген ApoB кодирует аполипопротеин B (apoB). ApoB представляет собой один из ключевых элементов группы липопротеинов, отвечающих за перемещение разнообразных липидов, включая триглицериды и холестерин. Этот белок является незаменимым компонентом в составе липопротеинов низкой плотности, что подчеркивает его значимость в процессе липидного обмена. Исследования указывают на то, что процесс синтеза и выделения apoB100 осуществляется непосредственно куриным желточным мешком de novo. При исследовании кур-несушек было обнаружено, что липопротеины низкой плотности в их плазме под- вергаются частичному протеолитическому изменению в результате рецепторно-опосредованного эндоци-тоза внутри яйцеклетки, где они преобразуются и сохраняются как липопротеины желтка. Липопротенины, содержащие apoB100, синтезируется печенью цыпленка, в то время как apoB48 не вырабатывается ни одним из органов. Печень также аккумулирует значительные запасы липидов, тогда как тонкий кишечник не располагает такими запасами. Однако он обладает уникальной способностью к производству и выделению, непосредственно до или сразу после процесса вылупления, липопротеинов, так называемых портомикро-нов, которые содержат apoB100 [Nimpf et al., 1989; Tarugi et al., 1990; Eresheim et al., 2014].
Ген SCD1 кодирует ключевой фермент синтеза жирных кислот стеароил-КоА десатуразу, который, в свою очередь, катализирует биосинтез мононенасыщенных жирных кислот. У кур данный ген экспрессируется повсеместно, но наиболее высокая экспрессия наблюдается в гипоталамусе, почках, печени и жировой ткани [Dridi et al., 2007]. Наивысший уровень экспрессии SCD1 в печени эмбрионов кур Arbor Acre был зафиксирован на E19, после чего, с E19 до D3, происходило его снижение, а с D3 до D7 уровень оставался без изменений [Liu et al., 2020a/b]. Исследование, поведенное на гепатоцитах цыплят, показало, что инсулин регулирует экспрессию гена SCD1 , стимулируя его транскрипцию [Mauvoisin et al., 2007].
В целом, изучение генетических основ липидного метаболизма у кур на протяжении нескольких десятилетий позволило накопить значительный объем данных. В геноме кур были определены локусы количественных признаков (QTL), однонуклеотидные полиморфизмы (SNP), методом GWAS и полногеномного секвенирования определены гены кандидаты признаков отложения подкожного и абдоминального жира у различных пород и популяций кур [Abdalla et al., 2018; Li et al., 2023]. Уже на сегодняшний день идентифицируются и изучаются все новые гены и семейства генов, вовлеченные в регуляцию липидного метаболизма кур [Wei et al., 2024; Zhu et al., 2024], что еще раз подчеркивает актуальность этого вопроса в современной науке.
Молекулы микроРНК как эпигенетические регуляторы липидного метаболизма у кур в ранний неонатальный период развития
Метаболизм можно рассматривать как динамичную систему, которая способна быстро реагировать на изменяющиеся условия внешней среды (питание, условия содержания, стресс-факторы и др.) для поддержания гомеостаза. Дисбаланс этих процессов может часто иметь негативные последствия, приводящие к различным заболеваниям. Критическим периодом для цыплят является переход от эмбрионального периода к периоду вылупления, что связано с необходимостью быстрой адаптации организма к новому источнику питательных веществ – корму. Переход от питания с высоким содержанием жиров (желтка) на высокоуглеводное питание (корм) сопровождается «переключением» метаболизма с липолиза (окисления жирных кислот) и глюконеогенеза на гликолиз и липогенез (превращение углеводов в жиры) в течение первых нескольких дней после вылупления [Speake et al.,1998]. Физиология метаболических перестроек в целом изучена хорошо, однако регуляторные механизмы, лежащие в основе этих процессов, изучены все еще недостаточно. Значительную роль в поддержании гомеостаза организма играют регуляторные РНК, в том числе микроРНК.
МикроРНК представляют собой класс посттранскрипционных регуляторов экспрессии генов, повсеместно встречающихся у животных. Их функции связаны с контролем экспрессии генов в разнообразных биологических процессах, включая практически все аспекты системной регуляции метаболизма. Ключевой ролью микроРНК является регулирование динамики метаболических реакций и поддержание гомеостатического баланса организма [Agbu et al., 2021]. В аспекте регуляции метаболизма липидов микроРНК участвуют в контроле синтеза, транспорта и деградации холестерина и жирных кислот, а также образовании липопротеинов низкой и высокой плотности (ЛПНП и ЛПВП). Существующие данные указывают на то, что микроРНК могут функционировать как значимые “посттранскрипционные регуляторы” липидного обмена. Это означает, что одна молекула микроРНК, как правило, взаимодействует с 3'-нетранслируемыми областями нескольких различных мРНК, участвующих в различных стадиях одного конкретного метаболического или сигнального пути. Например, одна микроРНК может быть нацелена на несколько мРНК ферментов, играющих ключевую роль в печеночном липогенезе. В результате изменения уровня одной такой микроРНК может оказывать влияние на различные этапы данного пути, активируя или ингибируя его. В тоже время несколько микроРНК могут быть нацелены на один ген (рис. 2) [Novák et al., 2015; Nematbakhsh et al., 2021].
Регуляция микроРНК осуществляется на протяжении всего их жизненного цикла: от биогенеза до деградации. При этом уровень экспрессии отдельных микроРНК подвержен динамическим изменениям в ходе онтогенеза. Точная и скоординированная регуляция этих молекул является критическим фактором для обеспечения нормального развития организма [Kotagama et al., 2024] На сегодняшний день база данных микроРНК miRBase ( содержит информацию о 882 предшественниках микроРНК, которые генерируют 1232 зрелые микроРНК для Gallus Gallus. Учитывая тот факт, что многие из них консервативны у других видов, можно предположить их схожие функции. В виду динамической приро- ды экспрессии микроРНК необходимо исследовать их в различные временные периоды для того, чтобы четко понять, как каждая из микроРНК демонстрирует свою активность во время развития эмбриона и определить, какова может быть каждая из их функций [Darnell et al., 2006].
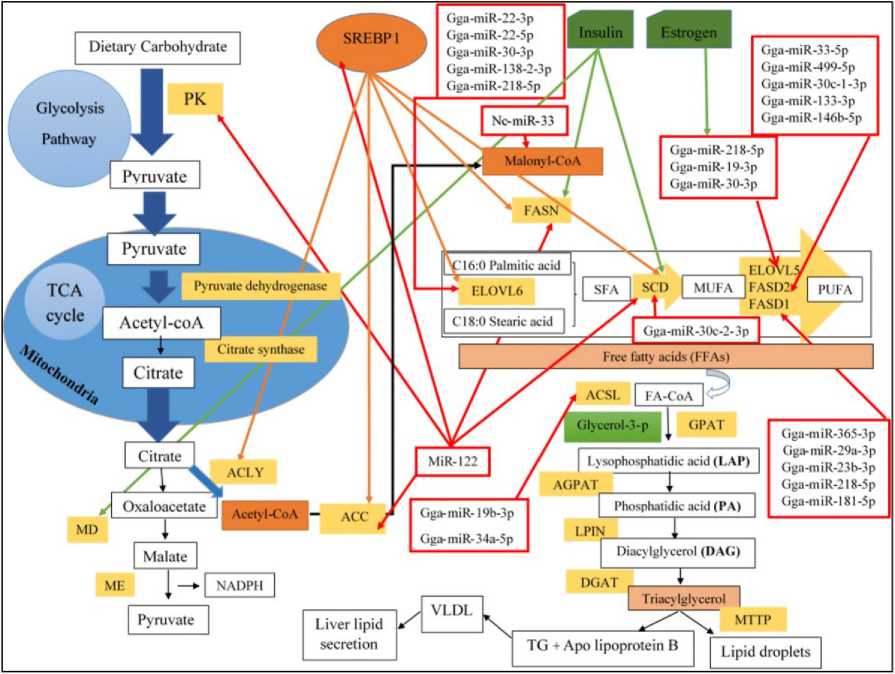
Рис. 2. Схематическое изображение липогенеза de novo в гепатоцитах кур и его регуляции на транскрипционном и посттранскрипционном уровнях. Красные, оранжевые и зеленые линии обозначают мишени различных микроРНК, белок-связывающий элемент ответа на стерол (SREBP1) как фактор транскрипции и гормоны в гепатоцитах кур соответственно [Nematbakhsh et al., 2021] [Schematic representation of de novo lipogenesis in chicken hepatocytes and its regulation at transcriptional and posttranscriptional levels. Red, orange, and green lines indicate targets of different microRNAs, sterol response element binding protein (SREBP1) as a transcription factor, and hormones in chicken hepatocytes, respectively [Nematbakhsh, et al., 2021]]
В первые 5 суток эмбриогенеза высокоэкспрессируются микроРНК, участвующие в регуляции таких процессов, как деление клеток, миграция клеток, межклеточная коммуникация, дифференцировка и апоптоз. При этом профиль экспрессии микроРНК эмбриональных тканей менялся в зависимости от суток инкубации [Liao et al., 2023].
По данным других авторов, у эмбрионов кур белого леггорна на 11, 15 и 20 день инкубации методом секвенирования с использованием технологии пиросеквенирования 454 Life Sciences было идентифицировано 110 известных, 14 новых куриных микроРНК и 36 гомологичных куриных микроРНК. Также методом нозерн-блот-анализа были продемонстрированы пространственная и временная экспрессии некоторых микроРНК, из которых miR-133a и miR125b показали различные паттерны экспрессии в зависимости от дня развития эмбриона (Е11, E15 и E20) и ткани (печень, селезенка и бурса) [Hicks et al., 2008].
Важную роль жировой ткани в метаболическом переключении подтверждают исследования тран-скриптома и микроРНКома жировой ткани эмбрионов (E18, E20) и цыплят (D0, D1, D3). Методом секвенирования нового поколения (NGS) было выявлено 111 микроРНК, показывающих различные паттерны экспрессии в эмбриональный и постэмбриональный периоды, при этом только miR-10b демонстрировала высокий уровень экспрессии во всех временных точках наблюдения. Анализ взаимодействия генов и микроРНК IPA (Ingenuity Pathway Analysis) данных транскриптома жировой ткани выявил ряд канонических путей, которые показали четкое разграничение между переходом от эмбрионального периода к вылуплению. Так, например, miR-107 и miR-454 и целевой ген BHLHE40 и miR-103, miR-145 и miR-26a и ген KLF4 демонстрировали реципрокную адипоцитарную экспрессию в жировой ткани эмбрионов на 18й день инкубации и 3-х суточных цыплят. Ген BHLHE40 – ингибитор циркадных ритмов, регулирует транскрипцию SREBF1 – одного из ключевых регуляторов метаболизма жирных кислот. Ген KLF4 – фактор транскрипции – участвует в процессах дифференцировки и пролиферации, выступает как регулятор адипогенеза на ранних этапах эмбриогенеза у млекопитающих [Birsoy et al., 2008]. Обратную картину показали miR-15a и GHR. Так, на фоне стабильно повышающейся экспрессии GHR от Е18 до D3 экспрессия miR-15a неуклонно снижалась [Hicks, Liu, 2021].
Как упоминалось выше, у эмбрионов центральным метаболическим органом является печень. У птиц печень, а не жировая ткань, является основным местом утилизации эмбриональных липидов и синтеза липидов после вылупления. В последнюю неделю эмбрионального развития происходит резкое депонирование липидов и холестерина в печени, а после вылупления увеличивается липогенная способность печени [Noble, Cocchi, 1990; Feast et al., 1998; Moran, 2007].
С использованием метода высокоточного секвенирования было установлено, что в период между Е18 и 3-ми сутками после вылупления (D3) у цыплят леггорнов в тканях печени изменялся профиль экспрессии 31 микроРНК, связанных с процессами синтеза липидов и холестерина. Так, двукратное изменение экспрессии 14-ти микроРНК наблюдалось между E18 и E20, а между E20 и D0 количество дифференциально экспрессируемых микроРНК сократилось до пяти. Прогнозирование целей in silico в сочетании с анализом путей IPA позволило выявить потенциальные метаболические мишени мРНК для let-7c, miR-20b и miR-183 которые предположительно регулируют ряд генов, связанных с метаболизмом липидов и углеводов. Для всех трех микроРНК подтвержденной мишенью был ген FADS1 , а, например, для miR-20b, экспрессия которой подавлялась при вылуплении, в качестве целевых генов были определены ADIPOR2, FADS1 и MSMO1 . Ген FADS2 был также целевым геном для let-7c, а ген и SQLE – для let-7c и miR-183. FADS1 и FADS2 участвуют в биосинтезе ненасыщенных жирных кислот. SQLE кодирует фермент, который катализирует первый этап оксигенации в биосинтезе стеринов [Hicks et al., 2017].
Искусственная задержка процессов метаболического переключения посредством голодной выдержки в течение 48 часов у цыплят-бройлеров (Ross 708) опосредовала повышение уровня относительной экспрессии miR-454 , miR-20b и miR-34а и снижение экспрессии miR-33 в тканях печени на 2 и 3 день после вылупления. Экспрессия целевых генов MSMO1 и GPT2 для miR-454, участвующих в биосинтезе холестерина и глюконеогенезе, соответственно снижалась, что, по мнению авторов, было связано с низким уровнем ферментов, необходимых для реализации процессов глюконеогенеза у суточных цыплят до момента первого приема корма, как источника для выработки глюкозы в организме [Hicks et al., 2019].
В других исследованиях по изучению профиля экспрессии miR-33 у 4-х недельных цыплят-бройлеров (Arbor Acres) была показана ее значимая роль в регуляции липидного обмена и энергетического гомеостаза путем негативного регулирования экспрессии генов CROT и HADHB в печени [Shao et al., 2019]. CROT и HADHB – ферменты, связывающие жирные кислоты с карнитином, а снижение активность этого ферментного комплекса приводит к накоплению липидов в печени [Dagher et al., 2021; Lin et al., 2021].
Информация о ряде наиболее значимых микроРНК, идентифицированных на разных стадиях эмбриогенеза и в разных тканях кур (белый леггорн), была обобщена и представлена в табл. 3.
Таблица 3
Сведения о некоторых значимых микроРНК, высоко экспрессируемых на разных стадиях эмбриогенеза кур (белый леггорн)
[Information on some significant microRNAs highly expressed at different stages of chicken (White Leghorn) embryogenesis]
|
Сутки инкубации |
Метод определения |
Всего микроРНК |
Ткань |
микроРНК |
Число целевых генов* |
Ссылка |
|
Е1 |
Illumina HiSeq Xten от Gene Denovo Biotechnology Co. |
2459 |
эмбрион |
miR-363-3p |
854 |
[Liao et al., 2023] |
|
Е2 |
miR-26a-5p |
941 |
||||
|
Е3 |
||||||
|
Е4 |
miR-10a-5p |
228 |
||||
|
Е5 |
miR-199-5p |
473 |
||||
|
Е11 |
пиросеквенирование 454 Life Sciences |
160 |
ткани тела эмбриона (без конечностей и внутренних органов) |
mir-125b |
389 |
[Hicks et al., 2008] |
|
miR-133a |
351 |
|||||
|
miR-21 |
1223 |
|||||
|
miR-140 |
491 |
Окончание табл. 3
|
Сутки инкубации |
Метод определения |
Всего микроРНК |
Ткань |
микроРНК |
Число целевых генов* |
Ссылка |
|
Е18 |
секвенирование нового поколения (NGS) |
111 |
абдоминальная жировая ткань |
miR-451a |
- |
[Hicks, Liu, 2021] |
|
miR-34a |
296 |
|||||
|
miR-146b |
165 |
|||||
|
miR-15a |
1687 |
|||||
|
Е18 |
Illumina HiSeq 2500. |
134 |
печень |
miR-18а |
- |
[Hicks et al., 2017] |
|
miR-454 |
1057 |
|||||
|
miR-10b |
11 |
|||||
|
miR-107 |
1105 |
|||||
|
miR-182 |
166 |
|||||
|
miR-183 |
500 |
|||||
|
Е20 |
134 |
let-7c |
1145 |
|||
|
miR-29a |
688 |
Примечание: *данные получены с использованием онлайн ресурса mirDB .
Таким образом, микроРНК, вовлеченные в регуляцию метаболически важных генов и путей, связанных с липолизом, окислением липидов, липогенезом и метаболизмом глюкозы, динамически экспрессируются в различных органах и тканях на разных стадиях эмбриогенеза и в первые дни после вылупления цыплят, что указывает на их значимую роль во время метаболического переключения.
Заключение
Исследование процессов липогенеза и адипогенеза кур имеет важное значение как с экономической, так и с научной точки зрения. Эти процессы играют важную роль в накоплении и распределении жира в тканях тела курицы, тем самым повышая общее качество продуктов из птицы. Более того, изучение этих процессов дает ценную информацию о механизмах, лежащих в основе ожирения человека. Крайне важно изучать регуляторные механизмы, контролирующие липидный обмен во время эмбриогенеза кур, поскольку этот этап имеет решающее значение для определения количества жировых клеток, присутствующих в организме животного. Последующие фазы роста включают увеличение отложения жира исключительно за счет увеличения объема уже существующих жировых клеток, а не создания новых. На липидный обмен эмбриона влияют различные факторы, в том числе порода, пол, возраст и условия окружающей среды. Кроме того, куры обладают уникальными характеристиками, такими как наследственная гипергликемия и утрата геномных локусов пяти основных адипокинов млекопитающих. Поэтому изучение вопросов регуляции липидного обмена в период эмбриогенеза кур, охватывающих роль транскрипционных факторов, микроРНК и генов, а также их взаимодействие, имеет большое значение и предоставит ценные знания в этой области.


