Липиды листьев Plantago media (L.)
Автор: Гребенкина Т.М., Нестеров В.Н., Розенцвет О.А., Богданова Е.С.
Журнал: Известия Самарского научного центра Российской академии наук @izvestiya-ssc
Рубрика: Наземные экосистемы
Статья в выпуске: 5-1 т.13, 2011 года.
Бесплатный доступ
Исследован состав мембранных липидов, содержание хлорофиллов и каротиноидов в листьях растения Plantago media, собранного на территории национального парка «Самарская Лука». Установлена динамика исследуемых биохимических показателей в зависимости от времени суток.
Пигменты, липиды, жирные кислоты
Короткий адрес: https://sciup.org/148205754
IDR: 148205754 | УДК: 581.19
Текст научной статьи Липиды листьев Plantago media (L.)
Уровень перекисного окисления липидов (ПОЛ). Интенсивность ПОЛ в листьях растений оценивали по содержанию малонового диальдегида (МДА) после реакции с тиобарбитуровой кислотой [8]. Определение МДА проводили в трехкратной биологической повторности спектрофотометрически на приборе «Specol» (Германия) при длине волны 532 нм.
Экстракция и анализ липидов. Липиды выделяли по методу Блайя и Дайэра [19]. Количественное содержание суммарных липидов (СЛ) определяли взвешиванием аликвот экстрактов, высушенных в вакууме до постоянного веса. Идентификацию и количественное определение фосфолипидов (ФЛ), гликолипидов (ГЛ) и нейтральных липидов (НЛ) проводили по методам, описанным ранее [6, 10].
Анализ жирных кислот (ЖК). Для анализа ЖК использовали их метиловые эфиры, которые получали путем кипячения в 5% -ом растворе HCl в метаноле [6]. Полученные эфиры очищали препаративной ТСХ и анализировали на газо-жидкостном хроматографе “Хроматэк Кристалл 5000.1” (Рос- сия) с использованием капиллярной колонки, длиной 105 м и диаметром 0,25 мм “RESTEK” (США). Температура колонки - 180 C, испарителя и детектора - 260 C. Скорость тока газа-носителя (гелий) -20 мл/мин.
Статистика. Результаты экспериментов обрабатывали с помощью пакета офисных программ Microsoft Excel 2003. Значения в таблицах и рисунках представляют средние арифметические из 3-х биологических и 3-х аналитических повторностей и их стандартные ошибки.
РЕЗУЛЬТАТЫ
Растения подорожника собирали в утреннее, дневное и вечернее время, когда температура воздуха составляла 16, 32 и 23 C соответственно. Суммарное содержание пигментов было максимальным в утренние часы (1,8 мг/г сыр. массы), затем оно уменьшалось в течение светового дня, и достигало минимума в 21 ч (табл. 1). При этом снижалась концентрация как хлорофилла а (на 25%), так и хлорофилла b (на 33%). Однако соотношение зеленых пигментов показало, что в полуденное время концентрация хлорофилла b снижалась в большей степени, чем хлорофилла а . Содержание каротиноидов оставалось постоянным в течение дня, но их соотношение с зелеными пигментами менялось от 3,5 до 2,5.
Таблица 1. Состав и содержание пигментов в листьях P. media
|
Пигменты |
Концентрация, мг/г сырой массы |
||
|
7.00 ч |
14.00 ч |
21.00 ч |
|
|
Хлорофилл a |
0,8±0,3 |
0,7±0, 1 |
0,6±0,1 |
|
Хлорофилл b |
0,6±0,2 |
0,4±0, 1 |
0,4±0,1 |
|
Каротиноиды |
0,4±0,2 |
0,4±0, 0 |
0,4±0,1 |
|
Сумма пигментов |
1,8 |
1,5 |
1,4 |
|
Хлорофилл a / хлорофилл b |
1,3 |
1,8 |
1,5 |
|
Хлорофиллы/каротиноиды |
3,5 |
2,8 |
2,5 |
Следует также отметить, что в течение суток менялся водный режим растений. Так, содержание сухой массы в утреннее и вечернее время составило 20-23%, а в полуденное время - 27% (рис. 1).
Исходя из данных по содержанию МДА (рис. 2), установлено, что уровень ПОЛ увеличивался в послеполуденное время на 20% по сравнению с утренним и вечерним временем.
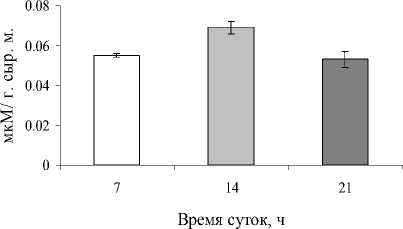
Рис. 2. Содержание МДА в листьях P. media в зависимости от времени суток
Содержание СЛ в расчете на 1 г сырой массы варьировало от 15,5 до 11,7 мг/г (табл. 2). Причем в утреннее и дневное время их количество больше, чем в вечернее. Большую часть СЛ (более 90%) составили полярные ГЛ и ФЛ, остальная часть пришлась на НЛ (6,0-8,6%). Количество ГЛ и ФЛ в утреннее и дневное время больше, чем в вечернее, а НЛ- постоянно в течение всего светового дня.
Таблица 2. Содержание липидов в листьях P. media в зависимости от времени суток
|
Липиды |
Концентрация, мг/г сырой массы. |
||
|
7 ч |
14 ч |
21 ч |
|
|
ГЛ |
10,0±0,1 |
9,7±1,7 |
7,2±0,9 |
|
ФЛ |
4,3±0,8 |
4,5±1,2 |
3,5±0,9 |
|
НЛ |
1,2±0,1 |
0,9±0,1 |
1,0±0,2 |
|
СЛ |
15,5±2,3 |
15,1±2,2 |
11,7±1,6 |
Примечание. ГЛ - гликолипиды, ФЛ - фосфолипиды, НЛ -нейтральные липиды, СЛ - суммарные липиды
Как показали наши результаты, состав ГЛ мало изменялся в течение дня (рис.3). Так, процентное содержание моногалактозилдиацилглицерина (МГДГ) увеличивалось не более чем на 3% в течение дня. Относительный вклад дигалактозилдиа-цилглицерина (ДГДГ) не менялся, а сульфохино-возилдиацилглицерина (СХДГ) – снижался пропорционально уве личению МГДГ.
[□ МГДГ □ ДГДГ □ СХДГ
a?
Время суток, ч
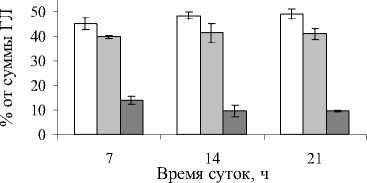
Рис. 3. Состав и содержание ГЛ в листьях P. media в зависимости от времени суток
Рис. 1. Содержание сухого вещества в листьях P. media в зависимости от времени суток
Главными ФЛ подорожника являются ФХ, ФЭ, ФГ и ФИ (рис. 4). Наиболее значимые изменения содержания ФЛ связаны со снижением относительного содержания ФХ, особенно в полуденное время, и соответственное этому снижению - увеличение вклада ФГ. В отношении других ФЛ следует отметить небольшое увеличение содержания ФК в вечернее время.
[п ФХ □ ФЭ □ ФГ □ ФИ ■ ФК ■ ДФГ
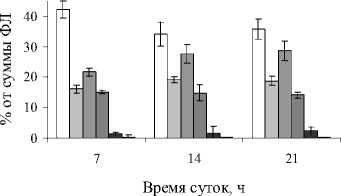
Рис. 4. Состав и содержание фосфолипидов в листьях P. media в зависимости от времени суток
Известно, что для адаптации растительных организмов к условиям обитания важен состав ЖК. Этот компонент мембранных липидов является наиболее обновляемым. В составе ЖК листьев подорожника обнаружено около 18 кислот (данные не приведены). Однако главными кислотами являются 16:0, 18:0, 18:2, 18:3 . Данные рис. 5 показывают, что состав главных ЖК оставался постоянным в течение всего светового дня.
ы 50 * 40
3 30 8 20
10 0
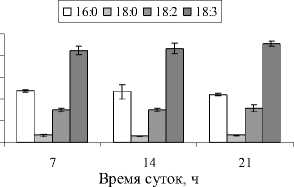
Рис. 5. Состав и содержание ЖК липидов в листьях P. media в зависимости от времени суток
ОБСУЖДЕНИЕ РЕЗУЛЬТАТОВ
Известно, что количество пигментов, липидов и их соотношение являются показателями нормального развития растений и протекания фотосинтетических реакций [3, 4, 9]. По результатам наших исследований, концентрация зеленых пигментов зависела от времени суток - в послеполуденное и вечернее время отмечены меньшие концентрации зеленых пигментов по сравнению с утренним временем. Известно, что одним из условий, влияющих на образование хлорофиллов, является достаточное для растения содержание влаги [7]. В полуденное время температура воздуха была вдвое выше, чем в утреннее время. Это вызывало изменение водного баланса и как следствие - снижение концентрации пигментов. Тогда же происходило наибольшее накопление МАД – конечного продукта ПОЛ. Вероятно, высокая температура и высокая интенсивность света в это время суток приводила к увели- чению образования активных форм кислорода в клетках, которые окисляют органические молекулы с образованием продуктов ПОЛ [3, 16]. Вероятно, уменьшение вклада ГЛ, связано с их частичным разрушением в результате ПОЛ в дневное и вечернее время. В то же самое время известно, что в условиях интенсивного освещения формируется большое число более мелких фотосинтетических единиц, что характерно для высокоактивных систем, увеличивается отношение хлорофиллов а/b, возрастает общая продуктивность фотосинтеза [9]. Обычно растения хорошо адаптированы к световому режиму места обитания. Адаптация фотосинтетического аппарата связана в том числе с изменением состава ГЛ. Достаточно постоянный состав ГЛ и небольшое накопление МГДГ к 14 ч свидетельствуют об эффективной адаптации подорожника к условиям освещенности. Полагают, что МГДГ необходим для превращения виолоксантина в зеак-сантин, способного принимать и рассеивать энергию с перевозбужденных антенных комплексов фотосистем [13, 20].
В отношении ФЛ показано, что наибольшие изменения связаны с уменьшением относительного вклада ФХ. Этот липид является субстратом для фосфолипазы D, действие которой направлено так же и на ФЭ [15]. Уменьшение концентрации ФХ и накопление ФК свидетельствует в пользу активации этого процесса. Увеличение концентрации ФГ в послеполуденное время может быть связано с необходимостью стабилизации комплексов фотосистем [9].
В отличие от состава полярных липидов, состав и содержание ЖК оставалось неизменным в течение всего светового дня.
Таким образом, в листьях растения P. media на хорошо освещенном склоне в течение всего светового дня выявлены изменения в содержании влаги, концентрации пигментов и полярных липидов. Прослежена зависимость: накопление ГЛ и зеленых пигментов отмечено в утренние часы; в послеобеденное время, при уменьшении содержания влаги в листьях растения, уменьшается концентрация хлорофиллов, возрастает уровень ПОЛ, увеличивается концентрация МГДГ и ФК; содержание же ЖК практически неизменно в течение всего светового дня. Полученные результаты свидетельствуют о динамичности биохимических характеристик, что может быть важным для выявления оптимального времени сбора лекарственного сырья.
Список литературы Липиды листьев Plantago media (L.)
- Алаудинова Е.В., Поваляева В.А., Миронов П.В. Липиды меристем лесообразующих хвойных пород Центральной Сибири в условиях низкотемпературной адаптации. 3. Особенности обмена нейтральных липидов меристем почек Larix Sibirica Ledeb., Picea obovata L. и Pinus silvestris L.//Химия растительного сырья. 2010. № 1. С. 67-74.
- Боголюбов А.С. и др. Компьютерный определитель травянистых растений средней полосы России. М.: Экосистема. 2004.
- Бриттон Г. Биохимия природных пигментов. М.: Мир, 1986. 422 с.
- Верещагин А.Г. Липиды в жизни растений. М.: Наука. 2007. 78 с.
- Ипатова В.И. Адаптация водных растений к стрессовым абиотическим факторам среды. М.: Графикон -принт. 2005. 224 с.
- Кейтс М. Техника липидологии. М.: Мир. 1975. 323 с.
- Кузнецов В.В., Дмитриева Г.А. Физиология растений. -М.: Высшая школа. 2005. -736 с.
- Лукаткин А.С., Голованова В.С. Интенсивность перекисного окисления липидов в охлажденных листьях теплолюбивых растений//Физиология растений. 1988. Т. 35. Вып. 4. С. 773-780.
- Мокроносов А.Т. Фотосинтез. Физиолого-экологические и биохимические аспекты. М. 2006. 448с.
- Нестеров В.Н., Розенцвет О.А., Мурзаева С. В. Изменение состава липидов у пресноводного растения Hydrilla verticillata (L. fil.) Royle в условиях аккумуляции и элиминации ионов тяжелых металлов//Физиология растений. 2009. Т. 56. № 1. С. 85-93.
- Оленников Д.Н., Samuelsen А.В., Танхаева Л.М. Подорожник большой (Plantago major L.). Химический состав и применение//Химия растительного сырья. 2007. № 2. С. 37-50.
- Олешко Г.И., Печерская Л.Г., Левинова В.Ф., Соснина С.А. Виды подорожника: содержание действующих веществ//Фармация. 2008. № 8. С. 21-24.
- Светлова Н.Б., Ситар О.В., Бацманова Л.М., Таран Н.Ю., Мусиенко М.М. Каротиноиды и гликолипиды в адаптивном ответе растений озимой пшеницы на действие оксидного стресса//Физиология и биохимия культурных растений. 2007. Т. 39. С. 168-173.
- Соснина С.А. Сравнительное фармакогностическое изучение, стандартизация сырья и фитопрепаратов видов рода Plantago L: автореф. дис. к.фарм.наук. Пермь. 2009. 140 с.
- Тарчевкий И.А. Сигнальные системы клеток растений. М.: Наука. 2002. 294 с.
- Тихонов А.Н. Защитные механизмы фотосинтеза//Соросовский образовательный журнал. 1999. № 11. С. 16-21.
- Чиркова Т.В. Клеточные мембраны и устойчивость растений к стрессовым воздействиям//Соросовский образовательный журнал. 1997. № 9. С. 12-17.
- Шишкин Б.К. Род 1381. Подорожник -Plantago L. Флора СССР. В 30-ти томах/Начато при руководстве и под главной редакцией акад. В.Л. Комарова. Л.: Издательство Академии Наук СССР. 1958. Т. XXIII. 148 с.
- Bligh E.G., Dyer W.J. A rapid method of lipid extraction and purification//Can. J. Biochem. Physiol. 1959. № 37. P. 911-917.
- Latowski D., Kruk J., Burda K. Skrzynecka-Jaskier M., Kostecka-Gugala F., Strzalka K. Kinetics of Violaxantin De-epoxidation by Violaxanthin De-epoxidase, a Xanthophylls Cycle Enzyme, is Regulated by Membrane Fluidity in Model Lipid Bilayers//Eur. J. Biochem. 2002. V. 269. P. 4656-4665.
- Lichtenthaler H.K. Сhlorophyll and Carotinoids: Pigments of Photosyntethetic Biomembranes//Methods. Enzimol. 1987. V. 148. P. 331-382.
- Maathuis Frans J.M., Prins Hidde B.A. Patch Clamp Studies on Root Cell Vacuoles of a Salt-Tolerant and a Salt-Sensitive Plantago Species//Plant Physiol. 1990. № 92. P. 23-28.
- Noor H., Juing M., Chee B.J., Kueh B.L. and Othman Zolkepli. Medicinal Properties of Plantago major: Hypoglycaemic and Male Fertility Studies//Pertanika J. Trap. Agric. Sci. 2000. № 1. P. 29 -35.
- Samuelsen Anne Berit. The traditional uses, chemical constituents and biological activities of Plantago major L. A review//Journal of Ethnopharmacology. 2000. № 71. P. 1-21


