Липиды Suaeda salsa (L.) Pall.: содержание, динамика, вариабельность в естественных условиях произрастания вида
Автор: Розенцвет Ольга Анатольевна, Нестеров Виктор Николаевич, Богданова Елена Сергеевна, Лысенко Татьяна Михайловна
Журнал: Известия Самарского научного центра Российской академии наук @izvestiya-ssc
Рубрика: Наземные экосистемы
Статья в выпуске: 3 т.15, 2013 года.
Бесплатный доступ
Исследовано содержание, сезонная динамика и вариабельность состава липидов фотосинтезирующих органов растений эвгалофита Suaeda salsa (L.) Pall., произрастающих в поймах рек Приэльтонья. Биотопы отличались по уровню степени засоления, влажности, анионному составу почвы. Показано, что в летние месяцы в суммарных липидах преобладали полярные липиды, а в сентябре увеличивалась доля нейтральных липидов. Установлено достоверное влияние анионного состава почвы на соотношение гликолипиды/фосфолипиды. По коэффициентам и размаху вариации выявлена степень пластичности мембранных липидов, что является основой пластичности вида в пределах региона исследований.
Абиотические факторы, вариация, динамика, фосфолипиды, гликолипиды, нейтральные липиды
Короткий адрес: https://sciup.org/148201732
IDR: 148201732 | УДК: 577.125.528
Текст научной статьи Липиды Suaeda salsa (L.) Pall.: содержание, динамика, вариабельность в естественных условиях произрастания вида
Богданова Елена Сергеевна, кандидат биологических наук Лысенко Татьяна Михайловна, кандидат биологических наук видов галотолерантных растений, выращенных в искусственных условиях среды [17]. В естественных условиях факторами, определяющими рост и развитие растений, становятся не только уровень засоления, но и состав солей, наличие в почве влаги, температура окружающей среды [15]. Однако, исследований механизмов регуляции основных путей клеточного метаболизма, включая липидный обмен, в естественных условиях засоления все еще недостаточно [5, 18].
Особое значение имеют регионы с экстремальными условиями обитания, например, такие как бассейн озера Эльтон (Приэльтонье). Особенностью данного региона является высокая степень засушливости с резким дефицитом осадков. Температурный режим отличается амплитудой экстремальных температур более 70 оС с абсолютным минимумом в январе (-31,1 оС) и абсолютным максимум в августе (41,1 оС) [2].
Цель данной работы состояла в исследовании факториальной нагрузки на качественный и количественный состав липидов в фотосинтезирующих органах Suaeda salsa (L.) Pall., их вариабельности и сезонной динамики в условиях Приэльтонья.
МАТЕРИАЛ И МЕТОДИКА
Выбранный вид Suaeda salsa (L.) Pall. является однолетним растением семейства Chenopodiaceae Vent., по стратегии накопления солей относится к эвгалофитам (накапливает соли в надземной части). Латинское название вида приведено по списку С.К. Черепанова (1995) [14]. Правильность определения вида подтверждена с.н.с. ЦСБС СО РАН (Новосибирск), к.б.н. М.Н. Ломоносовой.
Растения отбирали в июне (I), июле (II) и сентябре (III) 2011 г. на экспериментальных площадках размером 20 м х 20 м. в устьевых участках рек Большая Сморогда, Малая Сморогда, Чернавка, Хара, Ланцуг и Солянка, расположенных в Волгоградской обл. на солончаках типичных и впадающих в оз. Эльтон. Одновременно отбирали образцы почвы на глубине 15-20 см для определения кислотности, влажности, температуры, а также химического анализа. Степень засоления, кислотность и влажность почвы определяли в соответствии с методическими рекомендациями Н. Г. Федорец и М. В. Медведевой (2009) [13]. Анионный состав почвы проводился в водной вытяжке из 100 г почвы в сертифицированной лаборатории абиотических факторов в Институте экологии Волжского бассейна РАН.
Для биохимических анализов использовали листья 15–20 растений. Из объединенной биомассы листьев составляли три независимых биологических пробы (2–4 г сырой массы), деферментировали кипящим изопропанолом. Экстракцию, идентификацию, анализ липидов проводили, как описано ранее [9].
В таблицах и рисунках использованы средние арифметические значения из трех независимых биологических проб для каждого биотопа, а так же минимальные и максимальные значения каждого параметра для всех биотопов. Статистическую обработку результатов анализов проводили с использованием программ Statistica 6.0 for Windows, Microsoft Excel 2007 и Statgraphics Centurion XV. Взаимосвязь между абиотическими факторами среды и содержанием липидов оценивали, рассчитывая коэффициент корреляции Спирмена [6].
РЕЗУЛЬТАТЫ И ОБСУЖДЕНИЕ
Известно, что на живые организмы прямо или исследованных нами абиотических факторов в местах отбора растений S. salsa представлены на рисунке 1 и в таблице 1. Можно видеть, что в период наблюдений (июнь, июль и сентябрь) температура на поверхности почвы менялась в пределах 13,0 – 36,0 оС, влажность почвы – от 10,1 до 41,3 %, кислотность – от 6,8 до 7,8, содержание солей – от 0,2 до 3,1 г/л.
Сравнение условий обитания в отдельных биотопах показало, что наибольшее засоление почвы имели в поймах р. Б. Сморогда, М. Сморогда, Хара, а наименее – в пойме р. Солянка. Данные рисунка 1А свидетельствуют об изменении степени засоления почвы на разных биотопах в течение летне-осеннего периода. В начале летнего сезона влажность почвы составляла от 10,1 до 28,9 %, а количество растворенных в ней солей не превышало 0,2 – 1,0 г/л. В июле, повышение температуры окружающей среды, приводило к снижению влажности. В это же время степень засоления почвы увеличивалась в два и более раз (рис. 1 А, Г). В сентябре влажность почвы была выше, чем в летние месяцы, что способствовало снижению степени ее засоления.
Особенностью засоленных территорий является наличие слабощелочных и нейтральных почв, с преобладанием в их профиле сульфатов и хлоридов. В наших исследованиях было выявлено, что практически все отобранные образцы грунта обогащены сульфатами и хлоридами, при этом в некоторых пробах количество сульфатов достигало 3228 и хлоридов – 5247 мг/100 г (табл. 1).
косвенно влияют различные условия окружающей среды. Показатели некоторых
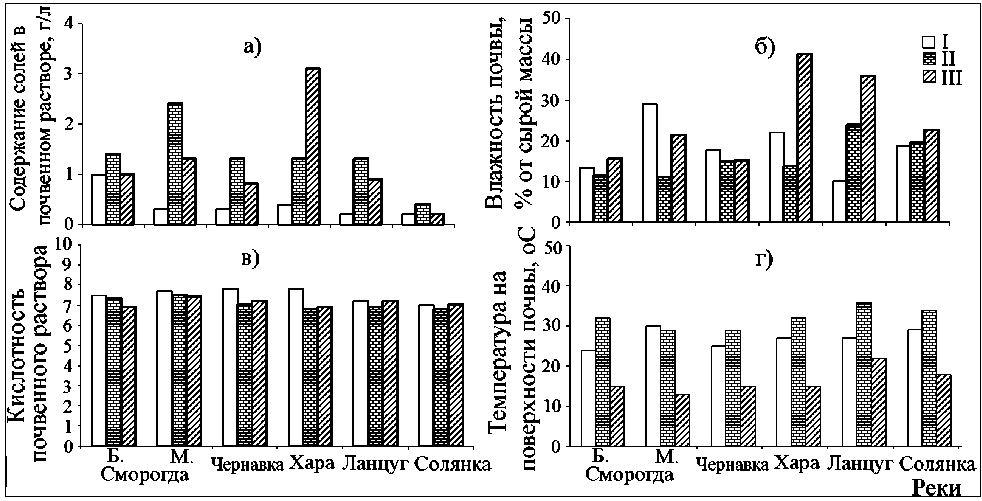
Рис. 1 . Динамика некоторых абиотических факторов в местах отбора растений за исследуемый период. I – июнь, II – июль, III – сентябрь
Таблица 1. Анионный состав почвы в местах отбора растений
|
Река |
Анионный состав почвы (мг/100г) |
|||||
|
аммоний |
нитриты |
нитраты |
фосфаты |
сульфаты |
хлориды |
|
|
Б. Сморогда |
0,12–1,50 |
0,01–0,07 |
0,10–1,50 |
0,15–0,49 |
206–1480 |
440–2658 |
|
М. Сморогда |
0,10–0,54 |
0,01–0,02 |
0,31–1,22 |
0,08–0,15 |
1479–3170 |
266–2730 |
|
Чернавка |
0,12–0,93 |
0,01–0,02 |
0,10–1,33 |
0,26–0,57 |
81–519 |
479–5247 |
|
Хара |
0,09–0,47 |
0,01–0,02 |
0,23–1,79 |
0,28–0,50 |
684–1153 |
1560–3581 |
|
Ланцуг |
0,17–1,96 |
0,01–0,02 |
1,37–3,88 |
0,34–0,47 |
217–3228 |
177–4609 |
|
Солянка |
0,11–0,47 |
0,01–0,03 |
0,20–0,33 |
0,13–0,16 |
50–77 |
344–1276 |
Методами математической статистики была установлена вариабельность исследованных абиотических факторов. Такие показатели, как влажность и уровень засоления почвы, отличались более широким размахом вариации
( K v = 31,5 – 42,8 и 47,0 – 81,4 %, соответственно) по сравнению с температурой воздуха и кислотностью почвы ( K v = 8,5 – 19,6 и 2,8 – 4,5 %, соответственно) (табл. 2).
Таблица 2. Динамика и вариабельность содержания липидов в фотосинтезирующих органах S. salsa
|
Липиды |
Содержание липидов (мг/г сырой массы) |
|||||||||||
|
I |
II |
III |
||||||||||
|
Х |
Min |
Max |
K v |
Х |
Min |
Max |
K v |
Х |
Min |
Max |
K v |
|
|
СЛ |
5,7 |
3,0 |
9,7 |
37,9 |
5,5 |
3,0 |
9,0 |
38,9 |
12,3 |
2,8 |
23,7 |
48,6 |
|
ГЛ |
2,6 |
1,0 |
4,1 |
48,8 |
2,4 |
1,3 |
3,2 |
29,5 |
1,9 |
0,5 |
3,4 |
63,4 |
|
МГДГ |
1,3 |
0,5 |
2,0 |
3,3 |
1,2 |
0,6 |
1,6 |
2,5 |
0,8 |
0,2 |
1,5 |
11,2 |
|
ДГДГ |
1,1 |
0,4 |
1,8 |
7,6 |
1,0 |
0,5 |
1,2 |
5,5 |
0,9 |
0,2 |
1,5 |
10,4 |
|
СХДГ |
0,2 |
0,1 |
0,3 |
22,3 |
0,2 |
0,2 |
0,4 |
22,7 |
0,2 |
0,1 |
0,4 |
11,0 |
|
ФЛ |
1,9 |
1,0 |
3,1 |
49,1 |
1,5 |
0,8 |
2,9 |
56,0 |
2,1 |
0,7 |
4,3 |
68,8 |
|
ФХ |
1,3 |
0,7 |
1,9 |
7,3 |
1,0 |
0,6 |
1,8 |
12,1 |
1,4 |
0,4 |
2,8 |
10,4 |
|
ФЭ |
0,2 |
<0,1 |
0,4 |
41,8 |
0,2 |
0,1 |
0,4 |
38,1 |
0,3 |
0,2 |
0,6 |
31,3 |
|
ФГ |
0,3 |
0,2 |
0,6 |
33,5 |
0,2 |
<0,1 |
0,4 |
35,8 |
0,3 |
<0,1 |
0,5 |
17,5 |
|
МК |
0,1 |
<0,1 |
0,2 |
24,4 |
0,1 |
<0,1 |
0,3 |
67,1 |
0,1 |
<0,1 |
0,4 |
54,3 |
|
НЛ |
1,2 |
1,0 |
2,5 |
25,1 |
1,6 |
0,9 |
2,9 |
63,6 |
8,3 |
1,6 |
16 |
60,1 |
|
ТАГ |
0,3 |
0,2 |
0,6 |
33,9 |
0,3 |
0,2 |
0,5 |
21,8 |
6,2 |
0,6 |
7,7 |
26,6 |
|
ДАГ |
<0,1 |
<0,1 |
0,1 |
25,5 |
<0,1 |
<0,1 |
0,2 |
29,9 |
0,2 |
0,1 |
0,9 |
145,7 |
|
СС |
0,2 |
0,1 |
0,3 |
17,1 |
0,3 |
0,2 |
0,4 |
30,1 |
0,5 |
0,2 |
2,0 |
80,7 |
|
ЭС |
<0,1 |
<0,1 |
0,1 |
17,4 |
<0,1 |
<0,1 |
0,1 |
43,0 |
0,1 |
<0,1 |
0,3 |
136,0 |
|
УВ |
0,1 |
<0,1 |
0,3 |
81,3 |
0,2 |
<0,1 |
0,6 |
77,5 |
0,3 |
0,2 |
1,1 |
47,1 |
|
В |
<0,1 |
<0,1 |
0,1 |
17,6 |
0,1 |
<0,1 |
0,3 |
49,6 |
0,1 |
<0,1 |
0,5 |
108,3 |
|
СЖК |
0,2 |
0,2 |
0,4 |
36,2 |
0,3 |
0,2 |
0,4 |
24,5 |
0,4 |
0,2 |
1,5 |
77,2 |
|
СП |
0,3 |
0,2 |
0,6 |
34,8 |
0,3 |
0,1 |
0,4 |
25,5 |
0,5 |
0,2 |
2,0 |
70,7 |
Примечание. Х – средние величины, Min – минимальные величины, Max – максимальные величины, Kv – коэффициент вариации, I – июнь, II – июль, III – сентябрь, СЛ – суммарные липиды, ГЛ – гликолипиды, МГДГ – моногалактозилдиацилглицерол, ДГДГ – дигалактозилдиацилглицерол, СХДГ – сульфхиновозилдиацилглицерол, ФЛ – фосфолипиды, ФХ – фосфатидилхолин, ФЭ –фосфатидилэтаноламин, ФГ – фосфатидилглицерин, МК – минорные компоненты, НЛ – нейтральные липиды, ТАГ – триацилглицерол, ДАГ – диацилглицерол, СС – свободные стерины,ЭС – эфиры стеринов, УГ – углеводороды, В – воска, СЖК – свободные жирные кислоты, СП – спирты
Полученные данные свидетельствуют о разнообразии условий произрастания S. salsa в пойменных участках рек, а также неоднородности почвы.
Для оценки влияния вариабельности абиотических факторов на состав и содержание липидов в фотосинтезирующих органах S. salsa было проанализировано содержание суммарных липидов (СЛ), соотношение основных групп липидов, таких как гликолипиды (ГЛ), фосфолипиды (ФЛ) и нейтральные липиды (НЛ). Результаты таблицы 2 показывают, что в летние месяцы содержание СЛ составляло 5,5–5,7 мг/г сырой массы, в осенний месяц их количество увеличилось более чем в два раза, при этом и размах вариации также увеличивался с интервала 3,0–9,7 до 2,8–23,7 мг/г сырой массы. В листьях S. salsa менялось и соотношение разных групп липидов. Например, в летние месяцы в пуле СЛ преобладали полярные липиды (ПЛ), а в сентябре увеличивалась доля НЛ, что очевидно было связано с созреванием семян (рис. 2). Однако, несмотря на то, что средние величины ПЛ оставались практически постоянными, их количественные вариации менялись в зависимости от биотопа и сезона. Так в летний период коэффициент вариации для ГЛ составлял 29,5% – 48,8%, в сентябре 63,4%, а ФЛ – 49,1– 56,0, в осенний месяц – 68,8 %.
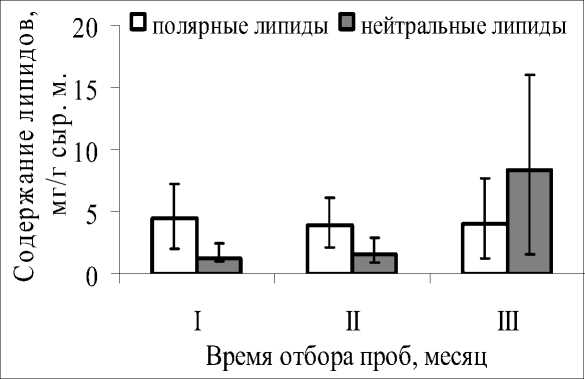
Рис. 2 . Содержание полярных и нейтральных липидов в фотосинтезирующих органах S. salsa ., максимальные и минимальные величины. I – июнь, II – июль, III – сентябрь
Представлены средние В регулировании взаимодействия клетки с внешней средой главную роль играют ФЛ, поскольку они формируют плазмалемму и тонопласт, а также большинство эндомембран. Во фракции ФЛ были индентифицированны: фосфатидилхолины (ФХ), фосфатидилэтаноламины (ФЭ), фосфатидилглицерины (ФГ). В таблице 1 показано, что этот состав характеризовался высоким содержанием ФХ (60 – 80 % от суммы ФЛ) по сравнению с ФЭ (10 – 30 %) и ФГ (10 – 20 %). Вероятно, это является особенностью галофитов по отношению к гликофитам, у которых процентное содержание ФЭ и ФГ несколько выше [17]. Следует отметить, что большое значение имеет анализ изменения соотношения двух основных компонентов фосфорсодержащих липидов ФХ и ФЭ. Уменьшение ФХ/ФЭ приводит к снижению структурированности и усилению проницаемости мембран, активирует работу рецепторов и ионных каналов [4]. В этой связи была проанализирована вариабельность этих липидов, а также вариабельность ФГ, ответственных за структурные свойства фотосинтетического аппарата [21]. Коэффициенты вариации количества этих ФЛ показывают, что содержание ФХ было более стабильным ( K v = 7,3 – 12,1) по сравнению с ФЭ ( K v = 31,3 – 41,8) и ФГ ( K v =17,5 – 35,8). Кроме указанных индивидуальных ФЛ были обнаружены и минорные компоненты: фосфатидилинозиты (ФИ), дифосфатидилиглицерины (ДФГ), фосфатидные кислоты (ФК), однако их содержание в листьях растений не превышало 10%.
Известно, что ГЛ локализуются преимущественно в фотосинтетических мембранах хлоропластов. Эта группа липидов доминировала среди СЛ в летние месяцы, когда происходит рост и развитие фотосинтезирующих органов растения (табл. 2). На фоне достаточно высокой вариабельности общего количества ГЛ, для главных составляющих этой группы липидов – моно- (МГДГ) и дигалактозилдиацилглицерины (ДГДГ) – характерна меньшая изменчивость в сравнении с сульфолипидом (СХДГ), что может свидетельствовать о стабильности мембран тилакоидов. Известно, что для эффективной работы фотосинтетического аппарата необходимо определенное соотношение МГДГ/ДГДГ. У растений, чувствительных к засолению, например, таких как Spinacia oleracea L. и Lycopersicum esculentum Mill. отношение МГДГ/ДГДГ составляет 1,7 и 2,1, соответственно. Солеустойчивые виды, Salicornia europaea L. и Atriplex Gmelinic С.A. Mey имеют отношение МГДГ/ДГДГ равное 1,1 и 1,0, соответственно [17]. В нашем случае в листьях растений S. salsa отношение МГДГ/ДГДГ в июне и июле было равным 1,2, а в сентябре – 0,9 (табл. 2), что совпадает с данными для солеустойчивых растений. Небольшая изменчивость величины МГДГ/ДГДГ, вероятно, связана с относительной независимостью и устойчивостью хлоропластных мембран к таким факторам окружающей среды, как засоление, наличие влаги, температура.
Анализ соотношения двух составляющих мембранных липидов – ГЛ и ФЛ – показал, что в июне и июле преобладали ГЛ, а в сентябре ФЛ (рис. 3). При этом наибольшая амплитуда вариации значений для ГЛ ( K v = 63,4) и для ФЛ ( K v = 68,8) отмечена в конце вегетационного периода.
Третьей группой липидов, выделяемых из нативных тканей, являются НЛ. В их составе обнаружены следующие компоненты: триацилглицерины (ТАГ), диацилглицерины (ДАГ), свободные фитостерины или стерины (СС), эфиры стеринов (ЭС), углеводороды (УГ), воски (В), свободные жирные кислоты (СЖК) и спирты (СП). Однако наибольшее значение с точки зрения регуляции «взаимоотношений»
клетки и среды имеют СС. В настоящее время известно, что стерины не только регулируют текучесть мембран, но и вместе с сфинголипидами составляют основу специфических мембранных доменов, называемых «рафтами», которые играют важнейшую роль в механизмах передачи сигналов в клетке [19]. Данные, представленные на рисунке 4, указывают на то, что соотношение ФЛ/СС менялось в сторону увеличения ФЛ и снижения доли СС. Можно предположить, что это связано с увяданием растительного организма, снижением интенсивности метаболических процессов и необходимости регулирования текучести мембран. По мере роста и старения увеличивалась и вариабельность данного класса липидов. Коэффициенты вариации СС в начале лета и осенью различались почти пятикратно. Все эти данные подтверждают, что на протяжении онтогенеза в тканях растения неоднократно меняются типы метаболизма, реализация которых в значительной степени зависела от внешних факторов и их сочетаний [8, 10]. Кроме того полученные данные говорят о высокой пластичности вида в пределах исследованного региона.
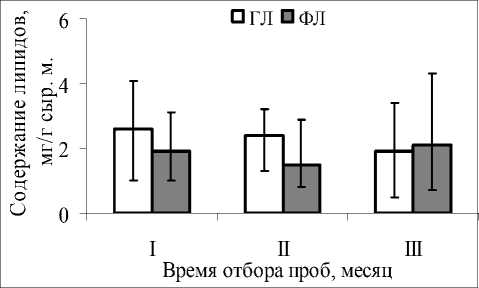
Рис. 3 . Содержание глико- и фосфолипидов в фотосинтезирующих органах S. salsa .
Обозначения как на рис. 2.
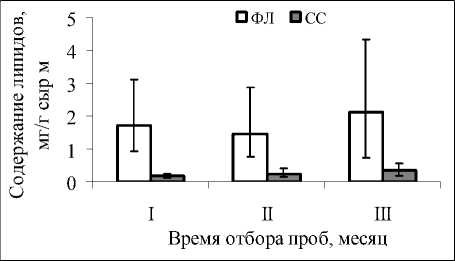
Рис. 4 . Содержание фосфолипидов и стеринов в фотосинтезирующих органах S. salsa .
Обозначения как на рис. 2.
Известно, если Кv менее 10 %, то это может служить основанием для отнесения показателя к категории «жестких». При Кv > 40% измеряемый показатель относится к категории высоко пластичных. С этой точки зрения для растений S. salsa в условиях Приэльтонья характерным является то, что такие мембранные липиды как МГДГ, ДГДГ и ФХ относятся к «жестким» или малопластичным, а ГЛ, ФЛ, СХДГ, ФЭ, ФГ и СС – к категории средней или высокой пластичности.
Учитывая неоднородность факторов среды, представляло интерес выявить степень их влияния на содержание липидов. Особое внимание было уделено таким факторам как уровень засоления, влаги, а также состав анионов почвы. Известно, что избыточное количество хлоридов и сульфатов, также как и общий уровень солей и в почве приводит к нарушению процесса дыхания и фотосинтеза у гликофитов [7], а аммоний и нитраты являются для растений преимущественно источниками азотного питания. Следует отметить, что достоверного влияния анионов солей, содержащихся в почве, на количество ГЛ или ФЛ не выявлено. В то же время установлена положительная корреляционная связь между отношением ГЛ/ФЛ и содержанием в почве хлоридов ( r = 0,49 при p <
0,04), отрицательная – между отношением ГЛ/ФЛ и содержанием в почве аммония и нитратов ( r = – 0,58 при P < 0,01 и r = –0,51 при p < 0,03, соответственно). В литературе имеются данные, что с ростом толерантности высших растений к NaCl возрастает и отношение ГЛ/ФЛ [17]. В нашей работе было показано, что засоление хлоридами и сульфатами вызывает у эвгалофита S. salsa увеличение данного отношения. На уровне индивидуальных классов липидов выявлена положительная корреляция в содержании ФХ и ФЭ с влажностью почвы ( r = – 0,51 и r = –0,46 при p < 0,01), но отрицательная – с содержанием сульфатов и хлоридов ( r = –0,46 при p < 0,03).
Таким образом, впервые проведен детальный анализ состава липидов, их динамики, вариабельности у эвгалофита S. salsa в условиях Приэльтонья. Показано, что условия произрастания S. salsa особенно отличались по уровню засоления, анионному составу почвы, влажности, которые изменялись в течение летнеосеннего периода. Установлено, что изменения состава и содержания разных групп липидов были связаны со стадией развития фотосинтезирующих органов и условиями среды. В частности, содержание НЛ в большей степени зависело от времени года и стадии вегетации, а мембранных ГЛ и ФЛ – с изменением уровня засоления и влажности почвы. От содержания хлоридов, аммония и сульфатов в почве зависело соотношение ГЛ/ФЛ, характеризующих соотношение хлоропластных и внепластидных мембран.
Работа выполнена при поддержке гранта РФФИ № 12-04-0111-а.
Список литературы Липиды Suaeda salsa (L.) Pall.: содержание, динамика, вариабельность в естественных условиях произрастания вида
- Аненхонов О.А., Кривобоков Л.В. Тенденции изменения флористического состава лесной растительности Северного Прибайкалья при потеплении климата//Экология. 2006. № 4. С. 280-286.
- Атлас почв СССР/под ред. И.С. Кауричева, И.Д. Громыко. М.: Колос, 1974. 168 с.
- Баженова О.И., Мартьянова Г.Н. Оценка изменений геокриологических условий субаридных районов Сибири при современном потеплении климата//География и природ. ресурсы. 2003. № 4. С. 51-58.
- Болдырев А.А. Матриксная функция биологических мембран//Соросовский образовательный журнал. 2001. № 7. С. 2-8.
- Иванова Т.В., Мясоедов Н.А., Пчёлкин В.П. и др. Повышенное содержание жирных кислот с очень длинной цепью в липидах вегетативных органов галофитов//Физиология растений. 2009. Т. 56. № 6. С. 871-878.
- Кобзарь А.И. Прикладная математическая статистика. Для инженеров и научных работников. М.: ФИЗМАТЛИТ, 2006. 816 с.
- Кузнецов В.В., Дмитриева Г.А.Физиология Растений. М.: Высшая школа, 2006. 810 с.
- Мокроносов А.Т., Гавриленко В.Ф. Фотосинтез. Физиолого-экологические и биохимические аспекты. М.: Изд-во МГУ, 1992. 320 с.
- Розенцвет О.А, Нестеров В.Н., Богданова Е.С. Влияние абиотических факторов на состав липидов Ulva intestinalis (L.) Link (Chlorophyta) в малых реках бассейна оз. Эльтон Прикаспийской низменности//Биол. внутрен. вод. 2012. № 2. С. 61-69.
- Романова А.К., Семенова Г.А., Новичкова Н.С. и др. Физиолого-биохимические и флуоресцентные показатели старения листьев сахарной свеклы в вегетативной фазе роста//Физиология растений. 2011. Т. 58. № 2. С. 221-233.
- Рослякова Т.В., Молчан О.В., Васекина А.В. и др. Солеустойчивость ячменя: взаимосвязь экспрессииизоформ вакуолярного Na+/H+-антипортера с накоплением 22Na+//Физиология растений. 2011. Т. 58. № 1. С. 28-39.
- Строганов Б.П., Кабанов В.В., Шевяков Н.И. и др. Структура и функции клеток при засолении. М.: Наука, 1970. 318 с.
- Федорец Н.Г., Медведева М.В. Методика исследования почв урбанизированных территорий. Петрозаводск: Карельский НЦ РАН, 2009. 84 с.
- Черепанов С.К. Сосудистые растения России и сопредельных государств (в пределах бывшего СССР). СПб.: Мир и семья, 1995. 992 с.
- Bybordi A., Tabatabaei S.J., Ahmadev A. Effect of salinity on the growth and peroxidase and IAA oxidase activities in Canola//J. Food. Agric. Environ. 2010. V. 8. № 1. P. 109-112.
- Duan D.Y., Li W.-Q., Liu X.-J. et al. Seed germination and seedling growth of Suaeda salsa under salt stress//Ann. Bot. Fennici. 2007. V 44. P. 161-169.
- Hirayama O., Mihara M. Characterization of Membrane Lipids of Higher Plants Different in Salt Tolerance//Agric. Biol. Chem. 1987. V. 51. P. 3215-3221.
- Ivanova A., Nechev J., Stefanov K. Effect of soil salinity on the lipid composition of halophyte plants from the sand bar of Pomorie//Gen. Appl. Plant Physiology. Special Issue. 2006. P. 125-130.
- Martin SW, Glover BJ, Davies JM. Lipid microdomains-plant membranes get organized. Trends Plant Sci. 2005;10:263-265.
- Ushakova S.A., Kovaleva N.P., Gribovskaya T.V. et al. Effect of NaCl concentration on productivity and mineral composition of Salicornia europaea as a potential crop for utilization NaCl in LSS//Adv. Space Res. 2005. V. 36. P. 1349-1353.
- Wada H., Murata N. Lipids in Thylakoid membranes and Photosynthetic Cells. In Lipids in Photosynthesis: Essential and Regulatory Function./Eds Wada H., Murata. N. Dordrecht: Springer, 2009. P. 1-9.


