Липопротеины высокой плотности плазмы крови как транспортная форма актиномицина Д
Автор: Поляков Лев Михайлович, Князев Роман Александрович, Рябченко Александр Владимирович, Трифонова Наталья Викторовна, Котова Мария Владимировна
Журнал: Сибирский онкологический журнал @siboncoj
Рубрика: Лабораторные и экспериментальные исследования
Статья в выпуске: 6 т.17, 2018 года.
Бесплатный доступ
Введение. Разработка новых и высокоэффективных средств противоопухолевой терапии является одной из приоритетных задач фармакологии. В работе представлено одно из решений данной проблемы, связанное с разработкой транспортных форм противоопухолевых препаратов. Цель исследования - изучить способность различных фракций липопротеинов плазмы крови (ЛПОНП, ЛПНП, ЛПВП) взаимодействовать с актиномицином Д и показать роль ЛПВП как транспортной формы актиномицина Д в клетки организма. материал и методы. Исследования выполнены с использованием немеченого и меченного тритием актиномицина Д, препаративного ультрацентрифугирования фракций липопротеинов плазмы крови крыс, хроматографии, а также в опытах in vivo c внутривенным введением комплексов ЛПВП с меченым актиномицином Д. Результаты. Показана важная роль ЛПВП в образовании комплексов с актиномицином Д по сравнению с ЛПНП и ЛПОН. Получены основные физико-химические характеристики взаимодействия ЛПВП и аполипопротеина А-I с актиномицином Д. Константы ассоциации были порядка 105 М-1, а число центров связывания для препарата составило 26 для ЛПВП и 12 для аполипопротеина А-I. В опытах in vivo с внутривенным введением крысам комплексов ЛПВП с меченным тритием актиномицином Д показано, что через 30 мин после введения наибольшая удельная радиоактивность была обнаружена в надпочечниках, затем в печени и почках. Вдвое меньшее содержание меченого препарата наблюдали в легких, жировой ткани, тимусе и селезенке. Слабое поглощение метки отмечено в ткани миокарда. заключение. Полученные результаты позволяют считать реальной возможность использования ЛПВП в качестве транспортной формы актиномицина Д в клетки организма.
Липопротеины плазмы крови, липопротеины высокой плотности, актиномицин д, транспортные формы цитостатиков, флуоресценция
Короткий адрес: https://sciup.org/140254227
IDR: 140254227 | УДК: 577.112:577.182.36:615.277.3 | DOI: 10.21294/1814-4861-2018-17-6-64-69
Текст научной статьи Липопротеины высокой плотности плазмы крови как транспортная форма актиномицина Д
Одним из приоритетных направлений современной фармакологии является создание терапевтических комплексов лекарственных средств, позволяющих осуществлять адресную доставку препаратов к клеткам-мишеням. Поиск переносчиков лекарственных соединений с целью увеличения их терапевтической эффективности и снижения побочных эффектов продолжается и в настоящее время. Активно изучается возможность применения липопротеинов плазмы крови как наноразмерной транспортной системы [1, 2]. Следует отметить, что активно пролиферирующие опухолевые клетки имеют повышенную потребность в липидах как в структурных компонентах, поэтому отличаются большей способностью захватывать липопротеиновые частицы [3]. В литературе достаточно широко представлена попытка использования липопротеинов низкой плотности в качестве транспортных форм для цитостатиков [4–6], однако в ряде работ указывают на возможность использования для этих целей липопротеинов высокой плотности [7–9].
Целью исследования явилось изучение возможности использования липопротеинов высокой плотности плазмы крови в качестве транспортной формы актиномицина Д.
Материал и методы
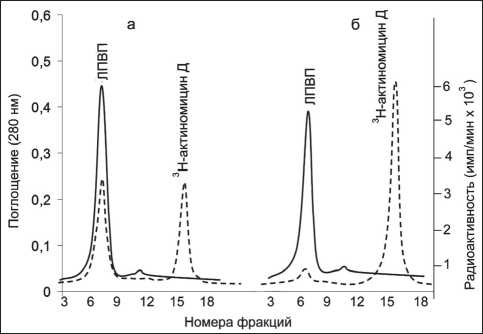
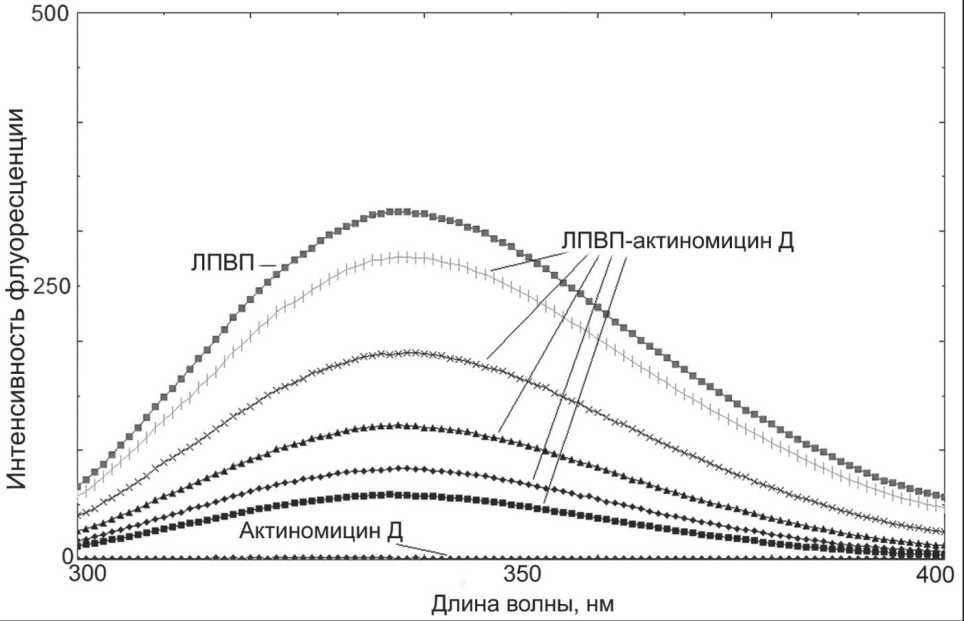
В работе использовали меченный тритием актиномицин Д (3Н-Акмц-Д) со специфической активностью 4,1 Ки/ммоль («Амершам», Англия). К 100 мл плазмы крови крыс добавляли ~5 μл 3Н-Акмц-Д (0,5 μКи). После инкубирования (30 мин при 20 оС) поэтапное выделение отдельных фракций липопротеинов из плазмы проводили методом ультрацентрифугирования в растворах KBr в присутствии 3 мМ ЭДТА-Na2на центрифуге («OptimaL-90K, Beckman-Coulter», Австрия) с использованием ротора 70.1Ti. [10]. Получали три основные фракции липопротеинов: липопротеины очень низкой плотности (ЛПОНП, 0,94 После ультрацентрифугирования фракцию ЛПВП подвергали хроматографическому разделению на колонке (0,8×40 см, Сефадекс G-50, «Pharmacia», Швеция). Элюент: 5мМ трис-НСl буфер, рН 7,4, 0,15 М NaCl, не содержащий 6 М мочевину. Профиль элюции регистрировали на УФ-детекторе («LKB», Швеция) при длине волны 280 нм. Кроме того, элюат анализировали на наличие радиоактивности. Измерение концентрации белка проводили на спектрофотометре (Evolution 300, «Thermo Scientific», США) в ЦКП «Спектрометрические измерения» на базе НИИ биохимии ФИЦ ФТМ, г. Новосибирск. В опытах in vivo эксперименты проведены на самцах крыс Вистар, массой 180–220 г. Исследования выполняли с соблюдением принципов гуманности, изложенных в директивах Европейского сообщества (86/609/ЕЕС) и Хельсинкской декларации, в соответствии с «Правилами проведения работ с использованием экспериментальных животных». Комплексы ЛПВП с меченным тритием актиномицином Д (0,5 мл, 0,5 μКи) на 100 г массы тела вводили в хвостовую вену крысы. Через 30 мин после введения животных подвергали декапитации под эфирным наркозом. Тушки крыс перфузировали 0,15 М NaCl через аорту и v. porta. Радиоактивность измеряли на жидкостном сцинтилляционном счетчике («Марк-II», США) в ЦКП НЦКЭМ. Величину радиоактивности органов и тканей рассчитывали в имп/мин на 1 мг ткани. Расчет констант ассоциации комплексов ЛПВП-актиномицин Д осуществляли методом тушения триптофановой флуоресценции [11]. Измерения проводили на спектрофлуориметре RF-5301PC («Shimadzu», Япония) при длине волны возбуждения 285 нм и эмиссии в диапазоне от 300 до 600 нм. Рабочий раствор (1 мМ) немеченого актиномицина Д («AppliChem», Германия) готовили из 10 мМ маточного раствора. Титрование проводили в термостатируемой кювете при температуре 20 ºС с добавлением аликвот рабочего раствора (1 мМ) немеченого актиномицина Д (по 2 мкл) к 2 мл ЛПВП. Молекулярные массы ЛПВП и аполипопротеина А-I принимались за 300 кДа и 28 кДа соответственно. Результаты и обсуждение Добавление меченного тритием актиномицина Д к плазме крови крыс и последующее ультрацентрифугирование показали, что более половины содержания меченого препарата находилось в составе ЛП-фракций и 40,3 % приходилось на фракцию инфранатанта (рис. 1). Обращает на себя внимание, что среди ЛП-фракций основная часть метки была в составе фракции ЛПВП (48,8 %). После ультрацентрифугирования фракция ЛПВП, содержащая меченый актиномицин Д, была подвергнута гель-хроматографии на сефадексе G-50 (рис. 2А). Пик радиоактивности препарата совпадал с объемом выхода фракции ЛПВП, хотя и отмечалось небольшое уменьшение удельной радиоактивности за счет сорбции меченного препарата гранулами сефедекса. Практически аналогичную хроматографическую картину мы получили после инкубации изолированной фракции ЛПВП с немеченым актиномицином Д. Наличие немеченого препарата в элюате оценивали методом его спектральной характеристики по максимуму поглощения при длине волны 440 нм. В результате хроматографического разделения пик поглощения при 440 нм полностью совпадал с объемом выхода фракции ЛПВП, что подтверждает возможность комплексообразования и, кроме того, указывает на сохранение устойчивости препарата в комплексе с частицами ЛПВП. Следует отметить, что процесс носил обратимый характер, поскольку введение в данную систему избыточного количества (10-6–10-7 М) немеченого актиномицина Д приводило к вытеснению метки из комплексов с ЛПВП (рис. 2Б). Для количественной оценки взаимодействия ЛПВП-актиномицин Д нами были использованы данные спектров излучения (флуоресценции). Взаимодействие ЛПВП с немеченым актиномицином Д сопровождалось тушением флуоресценции триптофанилов (рис. 3). При этом форма спектров, их полуширина практически не изменялись. Наблюдался небольшой сдвиг в длинноволновую область спектра, что объясняется локальными конформационными перестройками белкового компонента ЛПВП после взаимодействия его с препаратом. Практически сходные кривые тушения флуоресценции мы получили после инкубации основного белкового компонента ЛПВП – аполипопротеина А-I c актиномицином Д. Следует отметить, что в обоих случаях наибольшее снижение флуоресценции в точке эквимолярности составило около 80 %. Изучение временной зависимости тушения флуоресценции при одномоментном добавлении насыщающих количеств актиномицина Д показало, что полное насыщение связывающих областей ЛПВП и аполипопротеина А-I наблюдалось через 30 мин взаимодействия. На основании результатов полученных кривых тушения флуоресценции Рис. 1. Суммарное распределение радиоактивности (%) 3Н-актиномицина Д между фракциями ЛП плазмы крови крыс по результатам препаративного ультрацентрифугирования и с учетом молекулярных масс были получены основные физико-химические характеристики взаимодействия ЛПВП и аполипопротеина А-I с актиномицином Д. Константы ассоциации были порядка 105 М-1, а количество центров связывания для препарата составило 26 для ЛПВП и 12 для аполипопротеина А-I. Полученные результаты свидетельствуют, что связывание характеризуется недостаточно высоким сходством, поэтому его не следует характеризовать как высокоспецифическое. Однако следует заметить, что в настоящее время имеются данные о реализации биологически активного эффекта комплексов аполипопротеина А-I со стероидными гормонами с константами ассоциации аналогичного порядка – 105 М-1 [12]. Основываясь на этом, можно предположить, что и в данном случае комплексы ЛПВП-актиномицин Д попадут в клетки-мишени, а невысокая специфичность образованных комплексов будет способствовать «освобождению» препарата внутри клетки и эффективной реализации его цитостатического эффекта. Рис. 2. Связывание меченного тритием актиномицина Д с фракцией ЛПВП плазмы крови крыс: А – ЛПВП + меченный тритием актиномицин Д; Б – ЛПВП + меченный тритием актиномицин Д в присутствии 1000-кратного избытка немеченого актиномицина Д. Колонка: сефадекс G-50 (0,8×40 см). Элюент: 5 мМ Трис-НСl, рН 7,4, 0,15 М NaCl, 5 мМ ЭДТА. Сплошная линия – поглощение белка при 280 нм; пунктирная линия – радиоактивность Рис. 3. Тушение триптофановой флуоресценции ЛПВП при добавлении актиномицина Д; 1 – ЛПВП; 2–6 – добавление аликвот актиномицина Д к ЛПВП; 7 – актиномицин Д Доказательство возможности использования ЛПВП в качестве транспортной формы для доставки актиномицина Д в органы и ткани организма было продемонстрировано в опытах на животных. Для этого комплексы ЛПВП и меченного тритием актиномицина вводили в хвостовую вену крысы. Распределение радиоактивного препарата в органах и тканях крыс через 30 мин после введения приведено в таблице. Оказалось, что через 30 мин после внутривенного введения меченого препарата в комплексе с ЛПВП наибольшая удельная радиоактивность была обнаружена в надпочечниках, затем – в печени и почках. Как минимум, вдвое меньшее поглощение меченого препарата наблюдали в легких, жировой ткани, тимусе и селезенке. Совсем слабое поглощение метки отмечено в ткани миокарда. Обращает на себя внимание высокое накопление препарата надпочечниками. Этот факт вполне понятен, так как в стероидпродуцирующих органах крыс для синтеза стероидных гормонов используется холестерин сосудистого происхождения – эфиры холестерина ЛПВП [13, 14]. В пользу этого факта свидетельствуют также литературные дан- ные о том, что связывание меченого хлордекона с ЛПВП обеспечивает его преимущественное накопление в стероидогенных клетках надпочечников и семенников – органов, наиболее подверженных токсическому воздействию чужеродных соединений [15]. Наличие высокой радиоактивности в печени, как уже отмечалось, объясняется ведущей ролью этого органа в метаболизме ЛПВП и переносимых ими различных лигандов, в частности эфиров холестерина [16]. Следует отметить достаточно высокий уровень меченого актиномицина в почках, что подтверждается работами, в которых показана важнейшая роль почек в катаболизме ЛПВП и апоА-I как основного структурообразующего компонента данной фракции [17]. У крыс, по литературным данным, 39 % всего пула апоА-I катаболизирует в почках [18]. Таким образом, в работе представлен анализ распределения меченного тритием актиномицина Д между основными фракциями липопротеинового спектра плазмы крови крыс. По результатам препаративного ультрацентрифугирования более половины общего содержания меченого актино- таблица Поглощение меченного тритием актиномицина Д органами и тканями крыс через 30 мин после внутривенного введения в комплексе с ЛПвП (радиоактивность в имп/мин на 1 мг ткани) Органы и ткани Радиоактивность (имп/мин на 1 мг ткани) Печень 40,8 ± 9,5 Сердце 9,6 ± 1,1 Селезенка 2,3 ± 0,7 Почки 26,3 ± 3,8 Надпочечники 47,5 ± 9,5 Тимус 6,4 ± 1,3 Жировая ткань 6,8 ± 1,1 Примечание: в группе 5 животных. мицина Д находилось в составе ЛП-фракций и 40,3 % – во фракции инфранатанта. Среди ЛП-фракций основная часть метки была во фракции ЛПВП (48,8 %). Образование комплексов между частицами ЛПВП и меченым препаратом было подтверждено методом гель-хроматографии. Совпадение объёмов выхода фракции ЛПВП и актиномицина Д свидетельствовало о реальности образования таких комплексов. Комплексообразование было обратимым, поскольку введение в данную систему 500-кратного избытка немеченого препарата приводило к вытеснению радиоактивной метки из комплексов с ЛПВП. Получены основные физико-химические характеристики взаимодействия ЛПВП и аполипопротеина А-I с актиномицином Д. Константы ассоциации были порядка 105 М-1, а количество центров связывания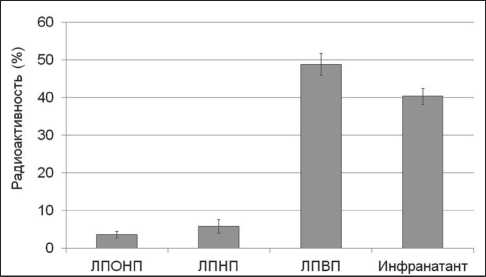
Список литературы Липопротеины высокой плотности плазмы крови как транспортная форма актиномицина Д
- Lacko A.G., Nair M., Prokai L., McConathy W.J. Prospects and challenges of the development of lipoprotein-based formulations for anti-cancer drugs. Expert Opin Drug Deliv. 2007; 4 (6): 665-675. DOI: 10.1517/17425247.4.6.665
- Glickson J.D., Lund-Katz S., Zhou R., Choi H., Chen I.W., Li H., Corbin I., Popov A.V., Cao W., Song L., Qi C., Marotta D., Nelson D.S., Chen J., Chance B., Zheng G. Lipoprotein nanoplatform for targeted delivery of diagnostic and therapeutic agents. Mol Imaging. 2008; 7 (2): 101-110.
- Lenz M., Miehe W.P., Vahrenwald F., Bruchelt G., Schweizer P., Girgert R. Cholesterol based antineoplastic strategies. Anticancer Res. 1997; 17 (2A): 1143-1146.
- Masquelier M., Tirzitis G., Peterson C.O., Palsson M., Amolins A., Plotniece M., Plotniece A., Makarova N., Vitols S.G. Plasma stability and cytotoxicity of lipophilic daunorubicin derivatives incorporated into low density lipoproteins. Eur J Med Chem. 2000; 35 (4): 429-438.
- Nikanjam M., Gibbs A.R., Hunt C.A., Budinger T.F., Forte T.M. Synthetic nano-LDL with paclitaxel oleate as a targeted drug delivery vehicle for glioblastoma multiforme. J Control Release. 2007; 124 (3): 163-171. DOI: 10.1016/j.jconrel.2007.09.007


