Литий как фактор сопряжения нарушений минерального и углеводного гомеостаза при злокачественных новообразованиях эпителиальных тканей
Автор: Ерлыкина Е.И., Обухова Л.М., Алясова А.В., Горшкова Т.Н., Французова В.П.
Журнал: Злокачественные опухоли @malignanttumors
Рубрика: Фундаментальная онкология и экспериментальная медицина
Статья в выпуске: 4 (11), 2014 года.
Бесплатный доступ
Работа выполнена за счет средств регионального гранта правительства Нижегородской области в сфере науки, технологий и техники за 2014 г.Влияние изменения направленности метаболизма углеводов и минерального обмена на малигнизацию клеток было наглядно показано в ряде работ. Целью данного исследования стал анализ молекулярных механизмов взаимосвязи углеводного и минерального гомеостаза с процессами канцерогенеза. Определяли параметры углеводного и минерального обменов крови у 73 больных злокачественными новообразованиями эпителиальных тканей и 31 практически здоровых лиц. При злокачественных новообразованиях эпителиальных тканей выявлено статистически значимое повышение уровней глюкозы и гликилированного гемоглобина на начальных стадиях заболевания при отсутствии такового при IV стадии заболевания. Статистически значимых отличий по уровням С-пептида и иммунореактивного инсулина в крови онкологических больных выявлено не было, хотя и наблюдалась тенденция к их повышению по сравнению с контрольной группой. При анализе содержания макроэлементов уже на начальных стадиях канцерогенеза обнаружено статистически значимое снижение уровня Na в плазме крови, не наблюдающееся при терминальной стадии. Концентрации K и Сl имеет тенденцию к повышению у онкологических больных, но различия этих показателей статистически не значимы. При злокачественных новообразованиях значимо повышается содержание Ca, Р, Mg. Анализ уровня микроэлементов в плазме крови показал снижение концентрации Cu, Li (в 2,5-5 раз), рост содержания Sr. Литий оказывает множественные эффекты на жизнедеятельность клеток, влияя на ряд элементов систем мессенджеров, а также являясь сопрягающим звеном между углеводным обменом и малигнизацией клеток. Нарушение минерального гомеостаза является значимым звеном в дезинтеграции метаболических процессов при канцерогенезе.
Злокачественные новообразования эпителиальных тканей, глюкоза, гликилированный гемоглобин, макроэлементы, микроэлементы, литий
Короткий адрес: https://sciup.org/14045512
IDR: 14045512
Текст научной статьи Литий как фактор сопряжения нарушений минерального и углеводного гомеостаза при злокачественных новообразованиях эпителиальных тканей
Влияние процессов метаболизма углеводов на малигнизацию клеток было наглядно показано в серии экспериментов с введением мышам канцерогена и назначении диеты, содержащей 65% глюкозы или 65% сахарозы. Установлено, что у экспериментальных животных злокачественные новообразования появлялись раньше, чем у контрольных, которым вводили только канцероген [1]. Кроме того, при онкогенезе зачастую наблюдается гиперфункция коры надпочечников вследствие стрессорной реакции на опухоль, что приводит к повышению уровня глюкокортикоидов, активирующих процессы глюконеогенеза [2].
В настоящее время доказана роль микроэлементов в процессах роста, дифференцировки, репарации, регенерации, апоптоза, некроза, выживаемости клеток и, как следствие, в патогенезе опухолевых заболеваний [3, 4]. Патогенез опухолевой трансформации, вызванной дисбалансом микроэлементов, окончательно неизвестен. По мнению ряда авторов [5, 6] именно он лежит в основе инициации и промоции опухолевой патологии не только через модуляцию метаболизма и репарации ядер-ной и митохондриальной ДНК, но и различных ферментативных и белковых молекул (включая лизосомальный аппарат), иммунных клеток и активности антиоксидантной системы. Предполагается, что один из возможных путей связан с участием микроэлементов в работе сигнальных путей в стволовых клетках. Так, литий ингибирует 3р киназу гликоген синтазы, являющейся центральным звеном сигнального
Фундаментальная онкология и экспериментальная медицина пути Wnt, нарушение работы которого провоцирует возникновение злокачественных новообразований. 3р киназа гликоген синтазы регулирует активность белка р53, отвечающего за остановку клеточного цикла или апоптоз [7]. Однако литературные данные о нарушении элементного гомеостаза плазмы крови при канцерогенезе достаточно противоречивы. Так, даже при оценке уровня содержания одного из микроэлементов — железа — показано, что у больных раком легкого наблюдается его уменьшение, а в крови у пациентов с болезнью Ходжкина — увеличение [8].
В связи с вышеизложенным, целью данного исследования стал анализ молекулярных механизмов взаимосвязи углеводного и минерального гомеостаза с процессами канцерогенеза.
Материалы и методы
Исследовалась плазма крови 73 больных, ранее не подвергавшихся противоопухолевому лечению: 46 мужчин (47–74 лет) и 27 женщин (34–67 лет). После оперативного вмешательства проводилось гистологическое исследование опухолевого материала методом иммуногистохимии. Анализ распределения больных по диагнозам и стадиям показал, что рак почки имел место у 16 человек (22%), рак мочевого пузыря — у 12 (16%), рак простаты — у 16 (22%), рак яичников — у 14 (19%), рак гортани — у 7 (10%), рак кишечника — у 3 (4%), рак тела матки — у 2 (3%), рак поджелудочной — у 2 (3%), рак желчного пузыря — у 1 (1%). I стадия установлена у 18% пациентов, II стадия — 18%, III стадия — 46%, IV стадия — 18%. Контролем служила плазма крови 31 практически здоровых человек: 12 мужчин (24–74 лет) и 19 женщин (25–65 лет).
Определение концентрации глюкозы, гли-килированного гемоглобина, макроэлементов (Na, K, P, Ca, Cl, Mg) проводили на анализаторе «КонеЛаб 20/20i» (Финляндия). Содержание С-пептида, иммунореактивного инсулина оценивали методом иммунохемилюминисцен-ции на анализаторе «Liaison» (Италия). Анализ уровня микроэлементов осуществляли методом атомно-эмиссионной спектрометрии с индуктивно связанной плазмой на спектрометре iСАР6300Duo (Thermo Scientific, США). Статистическую обработку полученных результа- тов проводили с помощью пакета программ BIOSTAT. При оценке массива данных биохимических показателей пациентов со злокачественными опухолями эпителиальных тканей по критерию Шапиро-Уилка нормальность распределения не была подтверждена, поэтому для оценки значимости различий с данными контрольной группы использовали методы непараметрической статистики: тесты Манна-Уитни и Колмогорова-Смирнова. Для анализа корреляционной связи данных двух выборок применяли корреляцию по Спирмену.
Результаты и выводы
При злокачественных новообразованиях эпителиальных тканей уже на начальных стадиях (I–III) выявлено статистически значимое повышение уровня глюкозы в крови в среднем на 16%. Однако на терминальных стадиях значимых различий по данному показателю не наблюдалось (табл. 1).
Концентрация глюкозы крови в исследуемой группе пациентов находилась на верхней границе нормы или превышала ее, что обусловило статистически достоверную взаимосвязь (r=0,513) опухолевого процесса с уровнем этого углевода.
Поскольку концентрация гликилированно-го гемоглобина отражает содержание глюкозы в крови в течение последних двух-трех месяцев, то соответственно повышение уровня данного показателя при I, II, III стадиях злокачественных новообразований подтверждает наличие нарушения углеводного обмена. Выявленные значимые корреляции наличия канцерогенеза с содержанием гликилированного гемоглобина (r=0,425) также свидетельствуют о связи нарушений углеводного обмена с малигнизацией клеток.
Однако на IV стадии злокачественных новообразований эпителиальных тканей происходит снижение уровней и глюкозы и гли-килированного гемоглобина в крови, что проявляется отсутствием значимых различий по данным параметрам с практически здоровыми людьми (табл. 1).
Опухолевые клетки обладают измененным метаболизмом, характеризующимся прежде всего увеличением транспорта глюкозы [9]. Такая активация процессов переноса глюкозы может
Литий как фактор сопряжения нарушений минерального и углеводного гомеостаза при злокачественных новообразованиях эпителиальных тканей
Таблица 1. Параметры углеводного обмена в плазме крови при злокачественных новообразованиях эпителиальных тканей
|
Исследованные группы |
Глюкоза, мМ/л |
Гликилированный гемоглобин,% |
С-пептид, нг/мл |
Иммунореактивный инсулин, мМед/мл |
|
|
Практически здоровые люди (контрольная группа) |
4,82±0,06 |
4,98±0,09 |
2,24±0,20 |
9,31±0,71 |
|
|
о Ю о s о о О |
I стадия |
5,56±0,22* ■ p=0,0001 ▲p=0,0006 |
5,49±0,28* ■ p=0,043 ▲ p=0,035 |
2,13±0,35 ■ p=0,988 ▲ p=0,688 |
9,16±1,90 ■ p=0,569 А p=0,8855 |
|
II стадия |
5,54±0,21* |
5,42±0,24* |
2,81±0,38 |
13,28±2,95 |
|
|
■ p=0,0015 |
■ p=0,042 |
■ p=0,177 |
■ p=0,0894 |
||
|
▲ p=0,0001 |
▲ p=0,038 |
А p=0,066 |
А p=0,0105 |
||
|
III стадия |
5,58±0,15* |
5,43±0,24* |
2,63±0,39 |
10,00±1,62 |
|
|
■ p=0,0001 |
■ p=0,119 |
■ p=0,549 |
■ p=0,7431 |
||
|
▲ p=0,0001 |
▲p=0,011 |
А p=0,355 |
А p=0,3223 |
||
|
IV стадия |
5,31±0,25 ■ p=0,154 ▲ p=0,231 |
5,25±0,24 ■ p=0,42 ▲ p=0,39 |
2,20±0,45 ■ p=0,923 А p=0,346 |
9,68±2,15 ■ p=0,6288 А p=0,539 |
|
-
■ — уровень значимости различий по тесту Манна-Уитни
-
▲ — уровень значимости различий по тесту Колмогорова-Смирнова
-
* — различия с показателями контрольной группы достоверны (р<0,05)
быть обусловлена в том числе и действием индуцируемого при гипоксии фактора (HIF-1) [10], повышение уровня которого наблюдается вследствие нарушения кровоснабжения ткани опухоли. Индуцибильные HIF приводят к активации потребления глюкозы в раковых клетках за счет активации транскрипции генов транспортеров глюкозы GLUT1 [11]. Для опухолевых клеток характерно преобладание в мембране ГЛЮТ-1 [12], имеющих высокое сродство к глюкозе.
Способность опухоли интенсивно захватывать глюкозу из крови связывают также с изменением активности трансфераз гексоз: резко активируется гексокиназа II [13]. Благодаря гексокиназе II с высоким сродством к глюкозе, раковая клетка приобретает способность «вылавливать» глюкозу из окружающей среды даже при низкой ее концентрации.
Метаболизм опухолевых клеток характеризуется также повышенной скоростью утилизации глюкозы за счет гликолиза, сопровождающегося ростом образования лактата [14]. Такая активация катаболизма глюкозы может быть обусловлена также наблюдающейся гипоксией опухоли и сопутствующим повыше- нием уровня индуцируемого при гипоксии фактора (HIF –1) [15]. Увеличение экспрессии HIF-1a приводит к повышению экспрессии генов, которые обеспечивают адаптацию клеток к гипоксии, не только стимулируя ангиогенез (гены эритропоэтина и сосудистого эндотелиального фактора роста), но и гликолитических ферментов, таких как гены альдолазы, енолазы, лактатдегидрогеназы [16].
Помимо процессов гликолиза, в опухолевых клетках происходит активация пентозо-фосфатного пути. Преобладающим в раковых клетках фетальным изоферментом данного пути является так называемый транскетолазно-подобный белок, специфичный для опухолевой ткани [17]. В итоге при активации пентозофосфатного пути усиливается синтез рибоз, необходимых для синтеза пуриновых и пиримидиновых оснований. Это служит материалом для репликации ДНК и синтеза РНК при делении злокачественных клеток. Важно отметить, что увеличение активности глюко-зо-6-фосфатдегидрогеназы и транскетолазы совпадает по времени с увеличением соотношения концентраций пентозомонофосфатов
Фундаментальная онкология и экспериментальная медицина
Таблица 2. Содержание макроэлементов в плазме крови больных со злокачественными новообразованиями эпителиальных тканей
|
Исследованные группы |
Na, мМ/мл |
K, мМ/мл |
Ca, мМ/мл |
Cl, мМ/мл |
Mg, мМ/мл |
P, мМ/мл |
|
|
Практически здоровые люди (контрольная группа) |
142,31±0,75 |
4,21±0,09 |
2,21±0,02 |
103,98±0,35 |
0,82±0,02 |
1,10±0,03 |
|
|
о Ю о s о о О |
I стадия |
137,93±1,67* ■ p=0,037 ▲ p=0,022 |
4,36±0,16 ■ p=0,576 ▲ p=0,725 |
2,51±0,20* ■ p=0,107 ▲ p=0,04 |
101,97±2,09 ■ p=0,6924 А p=0,227 |
0,89±0,06* ■ p=0,0485 А p=0,0083 |
1,24±0,03* ■p=0,0111 А p=0,0317 |
|
II стадия |
138,00±1,03* ■ p=0,003 ▲ p=0,04 |
4,28±0,14 ■ p=0,541 ▲ p=0,573 |
2,38±0,03* ■ p=0,004 А p=0,001 |
103,14±1,29 ■ p=0,063 А p=0,0681 |
0,98±0,07* ■ p=0,0125 Аp=0,011 |
1,22±0,02* ■ p=0,0268 А p=0,603 |
|
|
III стадия |
139,56±0,64* ■ p=0,016 ▲ p=0,065 |
4,36±0,11 ■ p=0,257 ▲ p=0,492 |
2,34±0,03* ■ p=0,012 А p=0,039 |
104,17±3,41 ■ p=0,385 А p=0,5863 |
1,27±0,08* ■ p=0,0473 А p=0,0317 |
1,27±0,09* ■ p=0,0331 А p=0,278 |
|
|
IV стадия |
140,12±0,99 ■ p=0,122 ▲ p=0,126 |
4,38±0,08* ■ p=0,153 ▲ p=0,386 |
2,49±0,11* ■ p=0,013 А p=0,014 |
104,20±1,51 ■ p=0,3798 А p=0,1794 |
1,79±0,50 ■p=0,6111 А p=0,3169 |
1,79±0,5* ■ p=0,0334 А p=0,1257 |
|
-
■ — уровень значимости различий по тесту Манна-Уитни
-
▲ — уровень значимости различий по тесту Колмогорова-Смирнова
* — различия с показателями контрольной группы достоверны (р<0,05)
к гексозомонофосфатам во время поздней G1 и S фаз, что позволяет предположить потенциальную роль пентозофосфатов в регуляции пролиферации [18]. Это позволяет сделать вывод о нарушениях углеводного обмена как об одном из возможных пусковых механизмов канцерогенеза.
Статистически значимых отличий по уровням С-пептида и иммунореактивного инсулина в крови онкологических больных выявлено не было, хотя и наблюдалась тенденция к их повышению по сравнению с контрольной группой (табл. 1). Такие результаты могут быть связаны с повреждением механизма трансдукции инсулинового сигнала, а также нарушением его метаболизма. Формирование инсу-линорезистентности может быть результатом нарушения функционирования рецепторов к инсулину, одной из возможных причин которого может быть окислительная модификация данного белка под действием активирующегося свободнорадикального окисления. Развитие бластоматозного процесса сопровождается повышением уровня супероксидного анион-ра-дикала и других активных форм кислорода, развитием в организме состояния окислительного стресса [19].
При анализе содержания макроэлементов уже на начальных стадиях канцерогенеза обнаружено статистически значимое снижение уровня Na в плазме крови. Однако при терминальных стадиях уровень натрия в крови значимо от практически здоровых людей не отличается (табл. 2).
Концентрации K и Сl имеет тенденцию к повышению у онкологических больных, но различия этих показателей статистически не значимы. По сравнению с показателями практически здоровых людей при злокачественных новообразованиях значимо повышается содержание Ca, Р, Mg (табл. 2).
Анализ уровня микроэлементов в плазме крови онкологических больных показал значимое снижение концентрации Cu (в среднем на 25%), Li (в 2,5–5 раз), рост содержания Sr (до 90%) (табл. 3).
Особый интерес представляют выявленные изменения концентрации Li. Литий оказывает множественные эффекты на жизнедеятельность клеток организма, опосредуя свое
Литий как фактор сопряжения нарушений минерального и углеводного гомеостаза при злокачественных новообразованиях эпителиальных тканей
Таблица 3. Содержание микроэлементов в плазме крови больных со злокачественными новообразованиями эпителиальных тканей
|
Исследованные группы |
Fe, мкг/мл |
Cu, мкг/мл |
Zn, мкг/мл |
Li, мкг/мл |
Ba, мкг/мл |
Sr, мкг/мл |
|
|
Практически здоровые люди (контрольная группа) |
1,24±0,04 |
1,36±0,08 |
0,88±0,09 |
0,005±0,0011 |
0,007±0,003 |
0,043±0,008 |
|
|
о кО S о о о |
I стадия |
1,95±0,19* ■ p=0,028 А p=0,035 |
1,02±0,07* ■ p=0,031 А p=0,038 |
0,74±0,14 ■ p=0,534 А p=0,191 |
0,002±0,0006* ■ p=0,001 А p=0,028 |
0,006±0,001 ■ p=0,998 А p=0,821 |
0,074±0,014* ■ p=0,041 А p=0,056 |
|
II стадия |
1,69±0,06* ■ p=0,007 Аp=0,011 |
1,06±0,08* ■ p=0,036 А p=0,049 |
0,49±0,05* ■ p=0,016 А p=0,041 |
0,002±0,0006* ■ p=0,026 А p=0,038 |
0,012±0,003 ■ p=0,081 А p=0,319 |
0,082±0,017* ■ p=0,001 А p=0,013 |
|
|
III стадия |
1,28±0,18 ■ p=0,513 А p=0,319 |
1,10±0,10* ■ p=0,049 А p=0,037 |
0,51±0,11* ■ p=0,034 А p=0,048 |
0,002±0,0007* ■ p=0,018 А p=0,041 |
0,005±0,002 ■ p=0,827 А p=0,976 |
0,061±0,03 ■ p=0,156 А p=0,423 |
|
|
IV стадия |
1,31±0,12 ■ p=0,909 А p=0,703 |
1,25±0,09 ■ p=0,139 А p=0,827 |
0,47±0,09* ■ p=0,023 p=0,038 |
0,001±0,0007* ■ p=0,004 А p=0,032 |
0,009±0,002 ■ p=0,494 А p=0,998 |
0,079±0,01* ■ p=0,029 А p=0,017 |
|
-
■ — уровень значимости различий по тесту Манна-Уитни
-
▲ — уровень значимости различий по тесту Колмогорова-Смирнова
-
* — различия с показателями контрольной группы достоверны (р<0,05)
влияние путем регулирования систем вторичных посредников и через различные сигнальные пути [20]. Литий влияет на ряд элементов систем мессенджеров: G-белки, протеинкина-зы, аденилатциклазы, инозитолтрифосфат, 3р киназу гликогенсинтазы [21] (рис.1).
По данным Suganthi M. с соавторами [23], в зависимости от концентрации литий может оказывать прямопротивоположное действие на апоптоз и пролиферацию клеток. Известно влияние солей лития на Wnt/р катенин сигнальный путь и также через изменение активности 3р киназы гликоген синтазы на активность белков, не входящих в состав пути Wnt, например опухолевого супрессора р53 [7].
Однако малигнизированные клетки более чувствительны к TRAIL-индуцированному апоптозу (рис.2) [24]. TRAIL (tumor necrosis factor-related apoptosis-inducing ligand) — цитокин семейства факторов некроза опухоли связывается с рецепторами клеточной смерти DR4 и DR5. При связывании лигандов они активируют каспазу-8, образуя индуцирующий смерть сигнальный комплекс, содержащий рецепторы, адаптер FADD (Fas-associated protein with death domain) и профермент каспазы-8 [25]. Активированная каспаза-8 высвобождается в цитоплазму и там инициирует протеазный каскад, активирующий эффекторные каспазы — в частности каспазу-3 [26]. Каспаза –3 инактиирует белок-ингибитор нуклеазы CAD (caspase-activated deoxyribonuclease), вызывая фрагментацию ДНК. Каспаза-8, кроме того, расщепляет цитозольный белок Bid, после чего он, превращаясь в активный белок tBid, активирует путем частичного расщепления другой проапоптозный белок — Вах. Тот, взаимодействуя с митохондриальным белком порином, образует во внешней мембране канал, по которому выходит цитохром с [27]. Цитохром с формирует комплекс с цитозольными белками Apaf-1, Smac/DIABLO и прокаспазой-9, приводя к образованию активной каспазы-9. Она в свою очередь активирует прокаспазы-3 и –7 [28].
В исследованиях Yan Lan с соавторми [29] была показана повышенная экспрессия рецепторов клеточной смерти, сопровождающаяся активацией каскада каспаз под действием солей лития.
Фундаментальная онкология и экспериментальная медицина
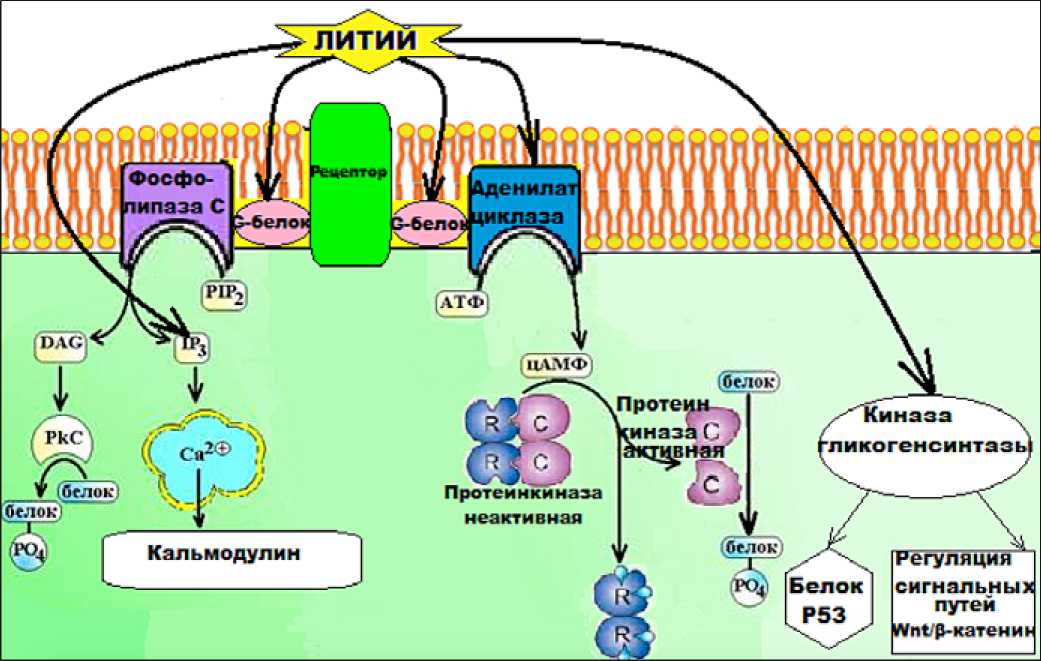
Рис.1. Механизм действия лития (модифицировано по Gould T. D. с соавторами, 2002 [22])
Li индуцирует
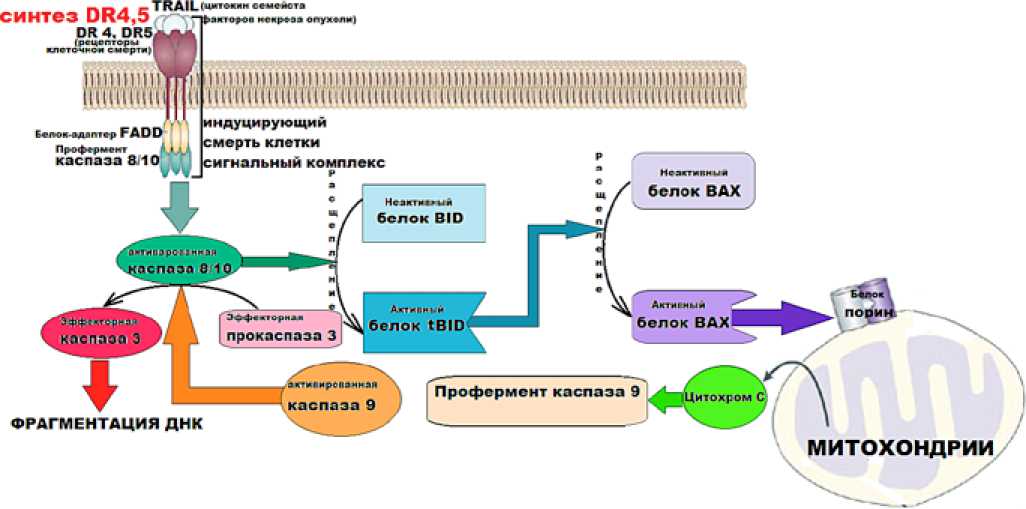
Рис.2. Схема влияния лития на TRAIL-индуцированный апоптоз малигнизированных клеток
Литий как фактор сопряжения нарушений минерального и углеводного гомеостаза при злокачественных новообразованиях эпителиальных тканей
Таким образом, обнаруженное в нашем исследовании снижение концентрации лития в плазме крови в несколько раз уже на начальных стадиях злокачественных новообразований может являться одним из патогенетических механизмов канцерогенеза. При недостатке данного микроэлемента возможна такая ситуация, при которой под действием ДНК-повре-ждающих агентов (активных форм кислорода или ионизирующей радиации) не будет развиваться апоптоз клетки с нарушенной ДНК по причине нарушения активности TRAIL-инду-цированного апоптоза. Принимая во внимание тот факт, что литий может модулировать активность ДНК-полимеразы [23], становится ясным, что недостаток данного микроэлемента
особенно в условиях активации свободнорадикального окисления может стать пусковым механизмом для малигнизации клеток.
С другой стороны, именно литий может оказаться тем сопрягающим элементом между процессами канцерогенеза и выявленным нарушением углеводного обмена, о чем свидетельствует способность этого металла опосредовано ингибировать высвобождение инсулина при повышении концентрации глюкозы [30].
Таким образом, нарушение минерального гомеостаза является значимым звеном в дезинтеграции метаболических процессов при канцерогенезе.
Список литературы Литий как фактор сопряжения нарушений минерального и углеводного гомеостаза при злокачественных новообразованиях эпителиальных тканей
- Hei T. K., Sudilovsky O. Effects of a high-sucrose diet on the development of enzyme-altered foci in chemical hepatocarcinogenesis in rats.-Cancer Res.,1985; 45 (6): 2700-2705
- Антонов В. Г., Козлов В. К. Патогенез онкологических заболеваний: иммунные и биохимические феномены и механизмы. Внеклеточные и клеточные механизмы общей иммунодепрессии и иммунной резистентности.-Цитокины и воспаление., 2004:. 3 (1): 8-19
- Khuri F. R. Lung cancer chemoprevention.-Semin. Surg. Oncol., 2000; 18 (2): 100-105
- Gresner P., Gromadzinska J., Jablonska E., Kaczmarski J., Wasowicz W. Expression of selenoprotein-coding genes SEPP1, SEP15 and hGPX1 in non-small cell Lung Cancer.-Lung Cancer., 2009; 65 (1): 34-40
- Snow E. T. Metal carcinogenesis: mechanistic implications.-Pharmacol Ther., 1992; 53 (1): 31-65
- Valko M., Rhodes C. J., Moncol J., Izakovic M., Mazur M. Free radicals, metals and antioxidants in oxidative stress-induced cancer.-Chem. Biol. Interact., 2006; 160 (1): 1-40
- Watcharasit P., Bijur G. N., Zmijewski J. W., Song L., Zmijewska A., Chen X., Johnson G. V., Jope R. S. Direct, activating interaction between glycogen synthase kinase-3beta and p53 after DNA damage.-Proc. Natl. Acad. Sci. U S A, 2002.-99 (12): 7951-7955
- Gehring L., Leonhardt P., Bigl H., Loser T. Serum trace elements in lung cancer-. Metal ions in Biology and Medicine, 1998; 5: 583-587
- Tran A., Pio B. S., Khatibi B., Czernin J., Phelps M. E., Silverman D. H. 18F-FDG PET for staging breast cancer in patients with inner-quadrant versus outer-quadrant tumors: comparison with long-term clinical outcome.-J Nucl Med, 2005; 46: 1455-1459
- Sutter C. H., Laughner E., Semenza G. L. Hypoxia-inducible factor 1alpha protein expression is controlled by oxygen-regulated ubiquitination that is disrupted by deletions and missense mutations.-Proc Natl Acad Sci USA. 2000; 97:4748-4753
- Iyer N. V., Kotch L. E., Agani F., Leung S. W., Laughner E., Wenger R. H., Gassmann M., Gearhart J. D., Lawler A. M., Yu A. Y., Semenza G. L. Cellular and developmental control of O2 of hypoxia-inducible factor 1 alpha.-Genes Dev., 1998; 12:149-162
- Young C. D., Lewis A. S., Rudolph M. C. et al. Modulation of glucose transporter 1 (GLUT1) expression levels alters mouse mammary tumor cell growth in vitro and in vivo.-PLoS One., 2011; 6 (8): e23205
- Fan Y., Zong W.-X. Hacking hexokinase halts tumor growth.-Cancer Biol Ther., 2008; 7 (7): 1136-1138
- Ferreira L. M. Cancer metabolism: The Warburg effect today.-Exp Mol Pathol., 2010; 89 (3): 372-380
- Semenza G. L., Roth P. H., Fang H.-M., Wang G. L. Transcriptional regulation of genes encoding glycolytic enzymes by hypoxia-inducible factor 1.-J Biol Chem., 1994; 269: 23757
- Semenza G. L., Jiang B.-H., Leung S. W., Passantino R., Concordet J.-P., Maire P., Giallongo A. Hypoxia response elements in the aldolase A, enolase 1, and lactate dehydrogenase A gene promoters contain essential binding sites for hypoxia-inducible factor 1.-J Biol Chem., 1996; 271: 32529-32537
- Zhang S., Yang J.-H., Guo C.-K., Cai P.-C. Gene silencing of TKTL1 by RNAi inhibits cell proliferation in human hepatoma cells.-Cancer Lett., 2007; 253: 108-114
- Vizan P., Alcarraz-Vizan G., Diaz-Moralli S. Modulation of pentose phosphate pathway during cell cycle progression in human colon adenocarcinoma cell line HT29.-Int J Cancer., 2009; 124 (12): 2789-2796
- Sanchez-Perez Y., Carrasco-Legleu C., Garcia-Cuellar C, et al. Oxidative stress in carcinogenesis. Correlation between lipid peroxidation and induction of preneoplastic lesions in rat hepatocarcinogenesis.-Cancer Lett., 2005: 217: 25-32
- Karlović D., Buljan D. Apoptosis -the potential pathophysiological mechanism in mood disorders modifiable by lithium salts.-Biochemia Medica, 2008; 18 (3): 291-310
- Williams R. S.B., Harwood A. J. Lithium therapy and signal transduction.-Trends in Pharmacological Sciences, 2000; 21 (2): 61-64
- Gould T. D., Chen G., Manji H. K. Mood stabilizer psychopharmacology.-Clin Neurosci Res, 2002; 2: 193-212
- Suganthi M., Sangeetha G., Gayathri G., Ravi Sankar B. Biphasic dose-dependent effect of lithium chloride on survival of human hormone-dependent breast cancer cells (MCF-7).-Biological Trace Element Research, 2012; 150 (1-3): 477-486
- Wu X., Lippman S. M. An intermittent approach for cancer chemoprevention.-Nature Reviews Cancer, 2011; 11 (12): 879-885
- Salvesen G. S., Dixit V. M. Caspase activation: the induced-proximity model.-Proc Natl Acad Sci USA, 1999; 96 (20): 10964-10967
- Hirata, H., Takahashi, A., Kobayashi, S., Yonehara, S., Sawai, H., Okazaki, T., Yamamoto, K., Sasada, M. Caspases are activated in a branched protease cascade and control distinct downstream processes in Fas-induced apoptosis.-J. Exp. J. Exp. Med., 1998; 187:587-600
- Skulachev V. P. Mitochondria in the programmed death phenomena; a principle of biology: «It is better to die than to be wrong».-IUBMB Life, 2000; 49: 365-373
- Kamata H., Hirata H. Redox regulation of cellular signaling. Cell Signal, 1999; 11: 1-14
- Lan Y., Liu X., Zhang R., Wang K., Wang Y., Hua Z.-C. Lithium enhances TRAIL-induced apoptosis in human lung carcinoma A549 cells.-Biometals, 2013; 26 (2): 241-254
- Fontela T, Garcia Hermida O, Gmez-Acebo J. Dihydroergotamine, but not naloxone, counteracts lithium as an inhibitor of glucose-induced insulin release in isolated rat islets in vitro.-Diabetologia, 1987; 30 (3): 183-187


