Локализация СD8-позитивных клеток лимфатических узлов в различные сроки после введения аллогенного костного мозга
Автор: Романов Виталий Олегович, Любовцева Любовь Алексеевна, Воробьева Ольга Васильевна, Романова Любовь Петровна
Журнал: Морфологические ведомости @morpholetter
Рубрика: Оригинальные исследования
Статья в выпуске: 1 т.30, 2022 года.
Бесплатный доступ
Иммунная система имеет важное значение в формировании адекватного иммунного ответа при подсадке аллогенного костного мозга. Цель исследования - изучение локализации СD8-позитивных клеток в лимфатических узлах на ранних этапах после введения суспензии клеток аллогенного костного мозга. Эксперименты проведены на 50 беспородных крысах-самцах. Животные были разделены на три группы: 1-я группа - интактные крысы (n=10), 2-я - контрольные животные (n=10), которым вводили 3 мл 0,85%раствора хлорида натрия; 3-я - опытные крысы (n=30), которым в хвостовую вену вводили один мл клеточной суспензии костного мозга, извлеченного из эпифиза бедренной кости другой крысы и смешанного с 2 мл 0,85% раствора натрия хлорида. Выведение животных из эксперимента проводилось через 40, 120 и 240 минут от начала эксперимента. Через 40 минут от начала пересадки аллогенного костного мозга в лимфатических узлах СD8+-лимфоциты определяются в расширенной субкапсулярной, паракортикальной зонах, около сосудов, в корковых синусах, мозговом веществе. Через 120 минут от начала пересадки увеличивается число лимфоидных узелков с разным числом CD8+-лимфоцитов и разной интенсивностью их окраски. Происходит размножение CD8+-лимфоцитов под капсулой в короне некоторых лимфоидных узелков, сосуды расширяются, происходит фрагментация мозговых тяжей мозгового вещества с появлением новых групп CD8+-лимфоцитов. Через 240 минут от начала введения аллогенного костного мозга небольшое число CD8+-лимфоцитов определяется в субкапсулярной зоне, в короне единичных лимфоидных узелков, по ходу лимфатических и кровеносных сосудов, группами - в мозговых тяжах. Наблюдается жировое перерождение мозгового вещества лимфатических узлов. Таким образом, по локализации и размножению CD8+ лимфоцитов в лимфатических узлах можно предположить, что распознавание антигенов аллогенного костного мозга происходит в субкапсулярной зоне, короне лимфоидных узелков, участках мозговых тяжей.
Костный мозг, аллогенная трансплантация, лимфатический узел, cd8 позитивные лимфоциты, крысы
Короткий адрес: https://sciup.org/143178620
IDR: 143178620
Текст научной статьи Локализация СD8-позитивных клеток лимфатических узлов в различные сроки после введения аллогенного костного мозга
Романов В.О., Любовцева Л.А., Воробьева О.В., Романова Л.П. Локализация СD8-позитивных клеток лимфатических узлов в различные сроки после введения аллогенного костного мозга. Морфологические ведомости. 2021;30(1):549. mn.2022.30(1).549
Romanov VO, Lubovtseva LA, Vorob’yova OV, Romanovа LP. The localization of CD8-positive cells of the lymph nodes cells in different times after the injection of the allogenic bone marrow. Morfologicheskie Vedomosti – Morphological newsletter. 2021;30(1):549. (1).549
Article received 17 April 2021
Article accepted 22 December 2021
Введение. На современном этапе иммунология прочно вошла в каждую врачебную специальность и требует достаточно большого объема новых знаний, которые необходимы для понимания механизмов регуляции иммунного ответа в нормальных и патологических условиях. Лимфатическая система участвует в опосредовании иммунитета, поскольку лимфатическое русло осуществляет приток антигенов в часть вторичных лимфоидных органов и образований афферентными лимфатическими путями [1]. Лимфатические узлы представляют собой место развития иммунного ответа, участок им-мунокооперативных взаимодействий [2–6]. На любые эндогенные и экзогенные воздействия лимфатические узлы динамично, лабильно реагируют изменением своих структурно-функциональных особенностей, поскольку они вместе с лимфатическими капиллярами, сосудами, стволами и протоками входят в состав иммунной системы [7–9]. CD8-антиген идентифицирован как маркер субпопуляции цитотоксических T-лимфоцитов [10-11]. Исследование временной динамики числа СD8-позитивных клеток (супрессоров) в лимфатических узлах может прояснить реакцию лимфатических узлов на введение клеточных антигенов. Подсадка аллогенного костного мозга (далее – КМ) может помочь в выявлении степени участия Т-клеточного звена иммунной системы в определенных зонах лимфатических узлов. Введение живого аллогенного антигена должно показать, как изменяется число клеток-супрессоров по мере развития реакции замедленного типа, в какие временные промежутки этот ответ максимален, когда заканчивается, и какими изменениями характеризуется при попадании в организм клеток разных популяций.
Целью исследования явилось изучение числа СD8-позитивных клеток лимфатических узлов на ранних временных этапах после введения аллогенного костного мозга.
Материалы и методы исследования. Эксперименты проведены на 50 беспородных крысах-самцах. Животные были разделены на три группы: 1-я группа – интактные крысы (n=10), 2-я – контрольные животные (n=10), которым вводили 3 мл 0,85% раствора хлорида натрия; 3-я – опытные крысы (n=30), которым в хвосто- вую вену вводили клеточную суспензию, состоящую из 1 мл костного мозга, извлеченного из эпифиза бедренной кости другой крысы и смешанного с 2 мл 0,85% раствора натрия хлорида. Выведение животных из эксперимента проводилось через 40, 120 и 240 минут от начала эксперимента под кетаминовым наркозом из расчета 4,4 мг/кг веса животного в соответствии с международными правилами проведения работ с экспериментальными животными [12]. Все действия осуществлялись с учетом требований «Правил проведения работ с использованием экспериментальных животных» [12]. На проведение исследования получено разрешение локального этического комитета медицинского факультета Чувашского государственного университета имени И.Н. Ульянова» (протокол № 5/8 от 18 июня 2015 г).
Для оценки иммунного ответа использовали иммуногистохимический метод трехэтапного непрямого иммунофер-ментного анализа с использованием первичных моноклональных антител к антигенному маркеру CD8 (клон 4B11) (Novo-castra Labaratoris Ltd, Великобритания). После депарафинирования и регидратации в этаноле нисходящей концентрации срезы лимфатического узла погружали в восстанавливающий цитратный буфер (рH=6,0). Затем проводили высокотемпературную обработку прогреванием на водяной бане при 90–95°С в течение 30 минут с целью демаскировки искомых антигенов в тканях. После ингибирования эндогенной пероксидазы 3%-м раствором перекиси водорода на метаноле в течение 30 минут с последующей промывкой 0,1М фосфатным буфером проводили иммуногистохимическую реакцию методом трехэтапного непрямого иммуноферментного анализа с использованием первичных моноклональных антител (далее - МКАТ) к антигенному маркеру CD8 в разведении 1:100, согласно рекомендации фирмы-изготовителя (Dako, Дания). Визуализацию первичных МКАТ, связавшихся с антигенами, проводили стандартным био-тин-стрептавидин-пероксидазным методом с использованием набора LSAB-2 (Labeled Streptavidin Biotin System
Peroxidase Dako, Дания). Для блока неспецифического связывания срезы инкубировались в течение 1 часа в 10% козьей сыворотке, после чего к ним были добавлены первичные антитела к белку CD8 на 18 часов при температуре 4°С. В качестве вторичных антител были использованы анти-видовые анти-иммуноглобулиновые био-тилированные антитела. Cрезы докрашивались гематоксилином. В каждой серии иммуногистохимических реакций выполнялось контрольное исследование c инкубированием нескольких срезов в отсутствии первичных антител. Специфичность экспрессии искомого антигена в опытных срезах лимфатического узла подтверждалась отсутствием ее в контрольных срезах, не обработанных пер- вичными антителами [13]. Достоверность различий оценивали по критерию разности долей. Различия между группами считались достоверными при p<0,05 [14].
Результаты исследования и обсуждение. У интактных животных CD8+-лимфоциты определяются в небольшом числе в паракортикальной зоне, единичные в краевых синусах, мозговых тяжах лимфатических узлов (рис. 1, табл. 1). При введении физиологического раствора число CD8+-лимфоцитов увеличивается до 40 минут (рис. 2). В последующие временные этапы их число остается на том же уровне. В связи с тем, что изменения в лимфатических узлах начинались с 30 минут включительно, экспериментальный материал забирали, начиная с 40 минут.
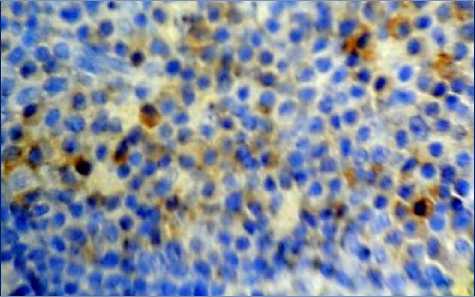
Рис. 1. Корковое вещество лимфатических узлов интактных животных. Иммуногистохимическая реакция с антителами к CD8. Окр. гематоксилином. Ув.: х400.
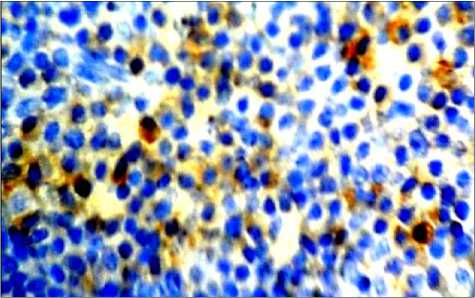
Рис. 2. Распределение CD8+ клеток в короне лимфоидного узелка через 40 минут после введения физиологического раствора. Иммуногистохимическая реакция. Окр. гематоксилином. Ув.: х400.
а
Рис. 3. Распределение CD8+ клеток в структурах лимфатических узлов через 40 минут после введения аллогенного костного мозга. Иммуногистохимическая реакция. Окр. гематоксилином. Ув.: а – х100; б - х400.
б
Через 40 минут после введения аллогенного КМ в корковом веществе лимфатических узлов происходит увеличение числа CD8+-лимфоцитов. Количество CD8+-лимфоцитов начинает увеличиваться в короне большинства лимфоидных узелков и в паракортикальной зоне, однако различия с интактными животными по этим показателям статистически не значимы
(табл. 1). Около лимфоидных узелков обнаруживаются расширенные краевые синусы с CD8+-лимфоцитами (рис. 3-а). В мозговом веществе наблюдается фрагментация мозговых тяжей с группами CD8+-лимфоцитами (рис. 3-а). CD8+-лимфоциты определяются около лимфатических и кровеносных сосудов (рис. 3-б).
Таблица 1
Содержание CD8+-лимфоцитов в структурах лимфатических узлов в процентах после пересадки аллогенного костного мозга
|
Наименование структур |
Животные интактные, n=10 |
экспериментальные, после трансплантации |
||
|
40 мин, n=10 |
2 часа, n=10 |
4 часа, n=10 |
||
|
Краевые синусы |
1,1 |
9,7 |
24,7 |
8,3 |
|
Мякотные шнуры |
1,1 |
4,4 |
17,4 |
15,2 |
|
Промежуточные синусы |
0,0 |
7,0 |
22,6 |
5,3 |
|
Лимфоидные узелки |
0,0 |
6,0 |
11,6 |
12,3 |
|
Паракортикальная зона |
4,6 |
8,8 |
64,7 */** |
1,2*** |
Примечание: * - результаты статистически достоверны по сравнению с интактными животными (р=0,0056); ** - по сравнению с группой «40 минут после начала эксперимента» (p=0,0092); *** - по сравнению с группой «2 часа после начала эксперимента (p=0,0037)
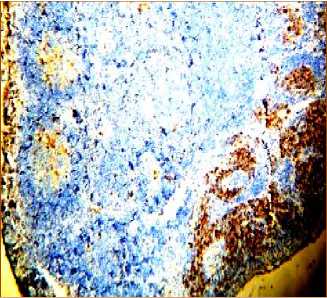
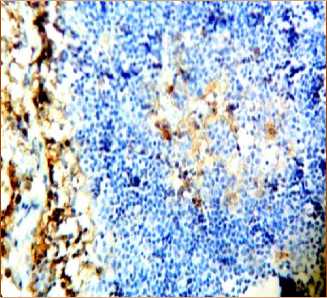
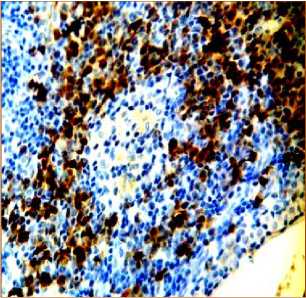
Через 120 минут после аллопере-садки КМ CD8+-лимфоциты определяются под капсулой в один-два слоя. Определяются 3 вида лимфоидных узелков с позитивными клетками: лимфоидные узелки, не имеющие CD8+-лимфоцитов, со средним числом CD8+-лимфоцитов, которые в небольшом числе локализуются во всех частях лимфоидных узелков и с большим числом CD8+-лимфоцитов, которые располагаются в короне (рис. 4а, 4б). В корковом веществе лимфатического узла лимфоидные узелки располагаются в один, два ряда (рис. 4а). Паракортикаль-ная зона с видимыми CD8+-лимфоцитами сокращается до полного отсутствия в части этой зоны (рис. 4а). В лимфоидных узелках, в их герминативном центре происходит «оголение стромы» (рис. 4в). В короне лимфоидных узелков число CD8+-лимфоцитов резко возрастает. В целом в паракортикальной зоне лимфатических узлов отмечается значительный статистически значимый рост числа CD8+-клеток, как по сравнению с аналогичным показателем интактных животных, так и по сравнению с группой в которой их число определялось на 40 минуте после начала эксперимента (табл. 1).
Наблюдается «оголение стромы» и расширение кровеносных сосудов в герминативном центре лимфоидных узелков. В мозговом веществе лимфатического узла появляются новые лимфоидные узелки, что может указывать на ускоренное размножение лимфоцитов, CD8+-лимфоциты в мозговых тяжах располагаются группами (рис. 4а).
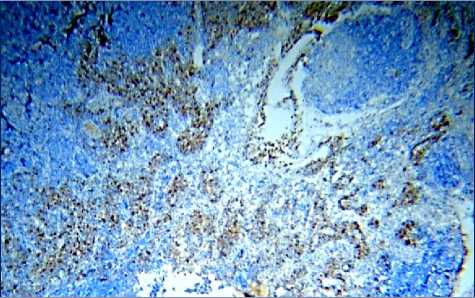
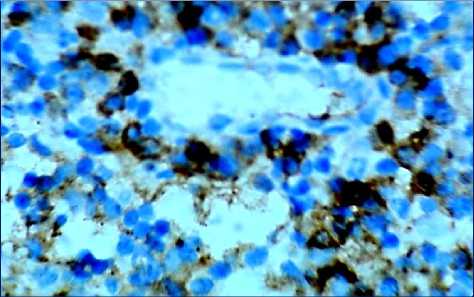
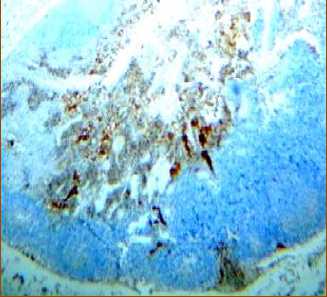
Через 240 минут после введения аллогенного КМ, лимфоциты, экспрессирующие CD8, располагаются неравномерно в очень небольшом числе и лишь в некоторых участках под капсулой, в короне некоторых лимфатических узелков, они также определяются в магистральных лимфатических сосудах и в корковых промежуточных синусах. В паракорти-кальной зоне их число достоверно снижается по сравнению с предыдущим этапом (рис. 5а, табл. 1).
Наибольшие изменения происходят в медуллярной зоне, где появляется множество адипоцитов (рис. 5б, 5в). Положительные CD8+-лимфоциты образуют группы в мозговых тяжах, иногда цепочки клеток, корковые синусы расширены, кровеносные сосуды полнокровны.
а
б
в
Рис. 4. Распределение CD8+-лимфоцитов в структурах лимфатических узлов через 120 минут после введения аллогенного костного мозга. Иммуногистохимическая реакция. Окр. гематоксилином. Ув.: х400.
а
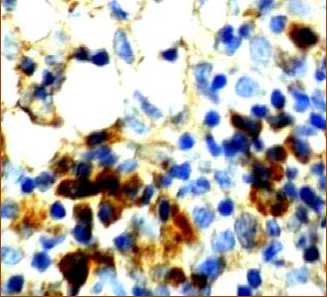
б
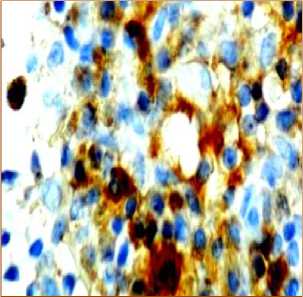
в
Рис. 5. Распределение CD8+-лимфоцитов в структурах лимфатических узлов через 240 минут после введения аллогенного костного мозга. Иммуногистохимическая реакция. Окр. гематоксилином. Ув.: х400.
Как известно, повышение CD8+-лимфоцитов приводит к угнетению иммунного ответа организма, что свидетельствует о недостаточности иммунитета, они тормозят выработку антител различных классов за счет задержки пролиферации и дифференцировки В-лимфоцитов, а также развитие гиперчувствительности замедленного типа [15-17]. В лимфатических узлах число CD8+-супрессоров небольшое, но уже в контроле через 30 минут от начала эксперимента их количество увеличивается в корковом веществе, в дальнейшем остается на том же уровне. При введении аллогенного КМ через 40 минут увеличивается число лимфоидных узелков, а в них CD8+-лимфоцитов. Аллогенный КМ резко подавляет иммунную реакцию, с одной стороны, увеличением числа CD8+-лимфоцитов и, очевидно, приводит к стимулирующему влиянию клеток-хелперов [18-19]. С другой сторо ны, наблюдается увеличение числа лимфоидных островков, расширение сосудов, синусов, в которых определяются CD8+-лимфоциты. Оголение стромы может указывать на то, что лимфатические узлы выбрасывают в кровь лимфоциты [4, 7, 20]. Такой рост числа CD8+-лимфоцитов продолжается до 120 минут эксперимента. При этом размножение этих клеток происходит под капсулой, в короне некоторых лимфоидных узелков, в паракорти-кальной зоне и в мозговых тяжах. Максимальная реакция по всем названным параметрам происходит до 120 минут эксперимента. Через 240 минут от начала введения аллогенного КМ число CD8+-лимфоцитов изменяется в корковом веществе и других функциональных зонах лимфатических узлов, наблюдается жировое перерождение мозгового вещества лимфатических узлов и отсутствие CD8+-лимфоцитов в корковом веществе органа.
Заключение. Таким образом, через 40 минут от начала пересадки аллогенного КМ в структурах лимфатических узлов крыс-реципиентов лимфоциты с CD8 маркером определяются в расширенной субкапсулярной, паракортикальной зонах, около сосудов, в корковых синусах, мозговых тяжах. Через 120 минут от начала пересадки аллогенного КМ увеличивается число лимфоидных узелков с разным числом CD8+- лимфоцитов и разной интенсивностью их окраски, происходит размножение клеток под капсулой, в короне некоторых лимфоидных узелков, сосуды остаются расширенными и наступает фрагментация мозговых тяжей с появлением новых групп CD8+-лимфоцитов. Можно предположить, что происходит выброс этих лимфоцитов в кровь, так как наблюдается «оголение стромы» во всех участках лимфатических узлов, в том числе и в герменативных центрах. Через 240 минут от начала введения аллогенного КМ в небольшом числе CD8+-лимфоциты определяются в субкапсулярной зоне, в короне единичных лимфоидных узелков, по ходу лимфатических и кровеносных сосудов, группами – в мозговых тяжах. Наблюдается жировое перерождение в мозговом веществе лимфатических узлов. В целом выявленная поэтапная динамика CD8+-клеток в лимфатических узлах после введения аллогенного костного мозга демонстрирует внутриорганную временную микротопографию процесса распознавания аллогенных белков у крыс-реципиентов и развитие ответной реакции.
Список литературы Локализация СD8-позитивных клеток лимфатических узлов в различные сроки после введения аллогенного костного мозга
- Petrenko VM. Limfaticheskaya sistema i organizatsiya immuniteta. Mezhdunarodnyy nauchnyy zhurnal «Innovatsionnaya nauka». 2017;9:68-69. In Russian
- Alitalo K, Tammela T, Petrova TV. Lymphangiogenesis in development and human disease. Nature. 2005;438(7070):946-53. DOI: 10.1038/nature04480
- Coico R, Sunshine G. Immunology: A Short Course. 7th Edition. Wiley: New Jersey, 2015. 432pp.
- Romanov VO, Lyubovtseva LA. Vliyanie geteroperesadki kostnogo mozga na struktury limfaticheskikh uzlov/ V kn.: Aktual'nye voprosy klinicheskoy meditsiny. Mater. mezhregion. nauchno-prakt. konf., posvyashch. 65-letiyu byudzhetnogo uchrezhdeniya Chuvashskoy Respubliki «Vtoraya gorodskaya bol'nitsa». Cheboksary: Izd-vo Chuvashskogo gos. un-ta, 2017.- S. 258-260. In Russian
- Shugaeva KYa, Nikolenko VN, Guseynov TS. Sovremennye predstavleniya o strukturno-funktsional'noy organizatsii limfaticheskoy sistemy v fiziologicheskikh usloviyakh i patologii. Nauchnyy zhurnal. Nauch-noe obozrenie. 2016;(1):37-40. In Russian
- Guseynov TS, Guseynova ST. Sravnitel'naya kharakteristika morfologii limfoidnykh uzelkov i limfatich-eskogo rusla podvzdoshnoy kishki pri degidratatsii v korrektsii perftoranom. Izvestiya vysshikh uchebnykh zavedeniy. Povolzhskiy region. Meditsinskie nauki. 2015;4 (36):14–19. In Russian
- Karkishchenko NN. Osnovy biomodelirovaniya. M.: Izd-vo VPK, 2005.-608s.
- Shugaeva KYa, Nikolenko VN, Guseynov TS. Sovremennye predstavleniya o strukturno-funktsional'noy organizatsii limfaticheskoy sistemy v fiziologicheskikh usloviyakh i pri patologii. Nauchnoe obozrenie. Meditsinskie nauki. 2016;(1):37-39. In Russian
- Abbas AK, Lichtman AH, Pillai S. Cellular and Molecular Immunology. 8th Edition. Wiley: New Jersey, 2014. 544pp.
- Shvedavchenko AI, Oganesyan MV, Rizaeva NA, Alieva FF. Anatomicheskie osobennosti limfatich-eskikh uzlov grudnoy polosti. Morfologiya. 2020;157(2-3):243. In Russian
- Karkishchenko NN. Rukovodstvo po laboratornym zhivotnym i al'ternativnym modelyam v biomed-itsinskikh tekhnologiyakh. M., 2010.- 358s. In Russian
- Dzhordzh LK, Kumar L, Rudbek L. Immunogistokhimicheskie metody: rukovodstvo. Per. s angl. pod red. G.A. Franka i P.G. Mal'kova. M., 2011.- 224s. In Russian
- Rebrova OYu. Statisticheskiy analiz meditsinskikh dannykh. Primenenie paketa prikladnykh programm STATISTICA. M.: Media Sfera, 2002.– 312s. In Russian
- Lyubovtseva LA, Vorob'yova OV, Lyubovtseva EV. Mikroanaliz neyromediatorov pri vvedenii chu-zherodnogo kostnogo mozga. Morfologicheskie vedomosti. 2015;23(3):41-45. In Russian
- Vorob'yova OV, Lyubovtseva LA. Vozdeystvie geterotransplantatsii na neyroaminy v strukturakh kost-nogo mozga. Morfologicheskie vedomosti. 2015:23(4):54-58. In Russian
- Vorob'yova OV, Lyubovtseva LA, Romanov VO, Romanova LP. Vliyanie autotranspantatsii kostnogo mozga na chislennuyu populyatsiyu triptazopozitivnykh tuchnykh kletok, stepen' sul'fatirovannosti geparina i soderzhanie gistamina. Vestnik eksperimental'noy biologii i meditsiny. 2020;170(2):258-263. In Russian. DOI: 10.1007/s10517-020-05047-6
- Stolbovskaya OV, Khayrullin RM, Kulikova TK, Snezhkina AV, Sadritdinova AF. Issledovanie vyazko-elasticheskikh svoystv tsitoplazmaticheskoy membrany limfotsitov krovi cheloveka metodom atomno-silovoy mikroskopii. Fundamental'nye issledovaniya. 2013;(4-5):1149-1152. In Russian
- Romanov VO, Lyubovtseva LA, Vorob'eva OV, Romanova LP. Vliyanie allotransplantatsii kostnogo mozga na neyromediatornye struktury limfaticheskikh uzlov. Zhurnal anatomii i gistopatologii. 2021;10(1):54-62. In Russian. DOI: 10.18499/2225-7357-2021-10-1-54-62
- Vorob'yova OV, Lyubovtseva LA, Bagryantseva ME i dr. Gistokhimicheskie issledovaniya kostnogo mozga pri geteroperesadke. Mezhdunarodnyy zhurnal prikladnykh i fundamental'nykh issledovaniy. 2016;(8)1:33-35. In Russian


