Локальная антибактериальная терапия в лечении пациентов со свищевой формой перипротезной инфекции коленного сустава
Автор: Пантелеев А.Н., Божкова С.А., Артюх В.А., Преображенский П.М.
Журнал: Кафедра травматологии и ортопедии @jkto
Рубрика: Оригинальное исследование
Статья в выпуске: 1 (59), 2025 года.
Бесплатный доступ
Обоснование: лечение пациентов со свищевой формой перипротезной инфекции характеризуются высокой частотой рецидива инфекционного процесса. Известно, что одним из возможных методов улучшения результатов лечения данной категории пациентов может быть локальная антибактериальная терапия. Цель исследования: оценить эффективность лечения перипротезной инфекции коленного сустава при двухэтапной санации с применением оригинального метода локальной антибактериальной терапии.
Короткий адрес: https://sciup.org/142244701
IDR: 142244701 | УДК: 617.3 | DOI: 10.17238/2226-2016-2024-1-32-41
Текст научной статьи Локальная антибактериальная терапия в лечении пациентов со свищевой формой перипротезной инфекции коленного сустава
THE DEPARTMENT OF TRAUMATOLOGY AND ORTHOPEDICS
Эндопротезирование (ЭП) коленного сустава (КС) продолжает оставаться единственным методом лечения терминальных стадий гонартроза , возвращающим большинству пациентов подвижность в суставе, снижение или полное купирование болевого синдрома, что существенно улучшает их качество жизни [1]. Ежегодный рост числа ЭП во всем мире свидетельствует об эффективности данного метода лечения [2-6]. Послеоперационные инфекционные осложнения являются наиболее частыми причинами ревизионных вмешательств, а в условиях неуклонного ежегодного роста числа первичных ЭП [2, 7] увеличение количества пациентов с перипротезной инфекцией (ППИ) создает колоссальную финансовую нагрузку на систему здравоохранения [8-9].
«Золотым стандартом» в лечении ППИ КС является двухэтапное реэндопротезирование [10] с созданием локального депо антимикробного препарата на этапе санации. В качестве носителя антибиотиков используют цементные спейсеры из костного цемента на основе полиметилметакрилата, однако они обладают рядом нежелательных характеристик. Несмотря на то, что спейсер создает высокую локальную концентрацию антибиотиков в 100-1000 раз превышающую минимальную ингибирующую концентрацию (МИК) для планктонных форм патогена в первые дни после имплантации [11], уже через три дня концентрация снижается до субтерапевтической [12-13]. При этом известно, что для эрадикации сессильных форм патогенных микроорганизмов в составе биопленки необходимы концентрации антимикробных препаратов в сотни раз превышающие МИК для планктонных форм тех же бактерий [14] .
В попытках устранения вышеперечисленных недостатков появляется все больше научных публикаций, посвященных разработке методов предупреждения рецидива при помощи альтернативных носителей антимикробных препаратов. Одной из перспективных методик, на наш взгляд, является локальное применение гелевой формы антимикробного препарата для создания в инфицированных тканях его эффективных в отношении микробных биопленок концентраций, не оказывая при этом системного токсического воздействия.
Цель
Оценить эффективность лечения перипротезной инфекции коленного сустава при двухэтапной санации с применением оригинального метода локальной антибактериальной терапии.
Материалы и методы
Тип исследования – сравнительное одноцентровое исследование. Проанализированы результаты лечения 46 пациентов со свищевой формой ППИ коленного сустава, поступивших для двухэтапной санации в клинику НМИЦ ТО им. Р.Р. Вредена за период 2014-2018 гг. (ретроспективная группа) и 2020–2022 гг. (проспективная группа). Для достижения однородности групп сравнения в исследование включали только пациентов с впервые выявленной свищевой формой ППИ после первичного ЭП КС с отсутствием в анамнезе других операций на КС, в том числе любых попыток санирующих вмешательств после манифестации инфекции. Согласно перечисленным критериям в проспективную группу (группа 1) было включено 16 человек, в ретроспективную (группа 2) – 30 пациентов (Рисунок 1). Характеристика пациентов, включенных в исследование, представлена в таблице 1.
С целью выявления ППИ КС у исследуемой когорты пациентов использовали алгоритм EBJIS21 [15]. На предоперационном этапе всем пациентам проводили стандартный скрининг, включающий осмотр, клинический анализ крови, СОЭ, уровень сывороточного СРБ, микробиологическое исследование (МБИ) аспирата из полости КС. Полученные интраоперационно образцы биоматериалов (аспират, компоненты спейсера или эндопротеза, не менее 5-ти тканевых биоптатов) также отправляли в лабораторию для МБИ.
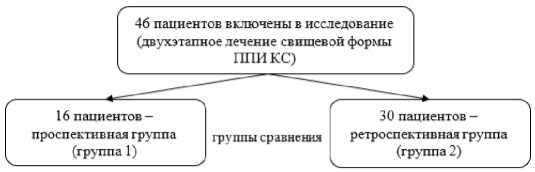
Рисунок 1 – Блок-схема дизайна исследования
Таблица 1
Характеристика групп сравнения
|
Параметр |
Группа 1 (проспективная) |
Группа 2 (ретроспективная) |
|
Количество пациентов |
16 |
30 |
|
Возраст, лет (МКИ) |
68 (60,5-73) |
61,3 (56,5-67,8) |
|
Пол |
||
|
мужской |
3 |
14 |
|
женский |
13 |
16 |
|
Средние сроки пребывания пациента в стационаре, дней (МКИ) |
14 (11-17,8) |
25 (19-28) |
|
Средние сроки наблюдения, месяцев (МКИ) |
33 (23-44) |
95 (69-126) |
Всем пациентам, включенным в исследование, было выполнено двухэтапное реэндопротезирование КС. Пациентам проспективной группы (группа 1) дополнительно проводили локальную антибактериальную терапию на этапе санации, состоящую из пролонгированного до 3-х суток после операции внутрисуставного введения оригинальной антимикробной композиции по запатентованной методике [16].
Способ заключается в интраартикулярной установке двухканального венозного катетера по методике Сельдингера перед ушиванием раны через отдельный прокол в неповрежденных мягких тканях, на расстоянии до 10 см от хирургического доступа. После послойного шва ран с помощью стерильного одноразового шприца выполняли эвакуацию скопившейся крови из сустава через установленный двухканальный венозный катетер, далее вводили антимикробное средство для профилактики имплантат-ассоциированной инфекции [17] в количестве, соответствующем удаленному объёму крови, но не превышающего суточную дозировки антибиотиков (20 мл), порты катетера закрывали заглушками. Описанную процедуру эвакуации гематомы и введения антимикробной композиции производили на протяжении 3-х суток после операции в условиях перевязочной после удаления асептической повязки и обработки ран растворами антисептиков. Второй канал использовали в случае нарушения проходимости другого канала катетера. По истечении 3-х суток в условиях перевязочной после удаления асептической повязки и обработки ран растворами антисептиков удаляли катетер, повторно производили обработку ран растворами антисептиков и накладывали асептическую повязку.
Оценку исходов лечения пациентов проводили в соответствии с модифицированными критериями Delphi [18] по результатам осмотра пациента или при помощи средств телекоммуникаций. Исход лечения рассматривали в двух вариантах – успех и неудача. Критериями неудачи лечения считали: 1) любые клинико-лабораторные признаки ППИ и клинико-рентгенологические проявления нестабильности компонентов эндопротеза в течение всего периода наблюдения за пациентами; 2) любые хирургические вмешательства после ревизионного ЭП КС, а также между этапами лечения ППИ; 3) летальный исход по любым причинам. При отсутствии всего вышеперечисленного исход лечения считали успешным.
Функциональные результаты оценивали при помощи русскоязычной версии опросника Oxford knee score (OKS) [19] у пациентов, завершивших этапное лечение ППИ в среднем через 2 года после реэндопротезирования. Результаты опроса интерпретировали по методике, описанной Kalairajah с со-авт. [20].
Статистический анализ
Данные о включаемых в исследование пациентах вносили в электронную базу Microsoft Excel. Статистический анализ проводили с использованием программы StatTech v. 3.0.6 (ООО «Статтех», Россия). Количественные данные представляли с помощью медианы (Me) и межквартильного интервала (МКИ). Категориальные данные описывали в виде абсолютных значений и процентных долей. Сравнение двух групп по количественному показателю, имеющему нормальное распределение, при условии равенства дисперсий выполняли с помощью t-критерия Стьюдента. Сравнение двух групп по количественному показателю, распределение которого отличалось от нормального, выполняли с помощью U-критерия Манна – Уитни. Сравнение процентных долей при анализе четырехпольных таблиц сопряженности выполняли с помощью точного критерия Фишера (при значениях ожидаемого явления менее 10) или критерия хи-квадрат Пирсона (при значениях ожидаемого явления 11 и более). Результаты считали статистически значимыми при значениях p < 0,05.
Результаты
На момент госпитализации пациентов в стационар для этапа санации медианы уровней маркеров воспаления крови были сопоставимы ( p >0,05) (Таблица 2).
Таблица 2
Уровни маркеров воспаления крови при госпитализации
|
Показатель |
Группа 1 (проспективная) Ме МКИ |
Группа 2 (ретроспективная) |
p |
|
|
Ме |
МКИ |
|||
|
СОЭ, мм/ч |
41,5 23,2-73 |
48,5 |
28,2-70,5 |
>0,05 |
|
СРБ, мг/л |
23,4 13-80,1 |
33,7 |
18,7-48,3 |
>0,05 |
Аспират из полости КС до операции был получен в 43,5% случаев (n=20/46), в том числе в группе 1 в 62,5% случаев (n=10/16), в группе 2 – в 33,3% случаев (n=10/30) (p<0,05). При наличии аспирата рост в нем микроорганизмов выявлен в 80% случаев в группе 1 (n=8/10) (Рисунок 2) и во всех случаях в группе 2 (n=10/10) (p>0,05) (Рисунок 3).

Рисунок 2 – Доля получения аспирата для МБИ в проспективной группе (группа 1)
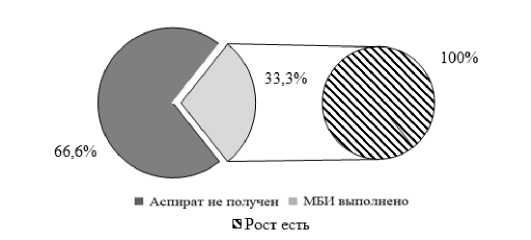
Рисунок 3 – Доля получения аспирата для МБИ в ретроспективной группе (группа 2)
По результатам МБИ дооперационного аспирата в обеих группах чаще выделяли коагулазонегативных стафилококков (КНС), доля выделения которых составила 24,9% и 23,4% в группе 1 и 2 соответственно. Из интраоперационного биоматериала абсолютно во всех случаях были выделены диагностически значимые микроорганизмы. Таким образом, в структуре возбудителей инфекции в группе 1 лидировали энтерококки и золотистый стафилококк, а в группе 2 – золотистые и эпидермальные стафилококки (Рисунок 4). При этом, доля резистентных к метициллину штаммов S.aureus в группе
1 составила 42,9%, в группе 2 – 9,1%. Доля резистентных к метициллину штаммов S.epidermidis – 66,6% и 77,8% в группе 1 и 2 соответственно.
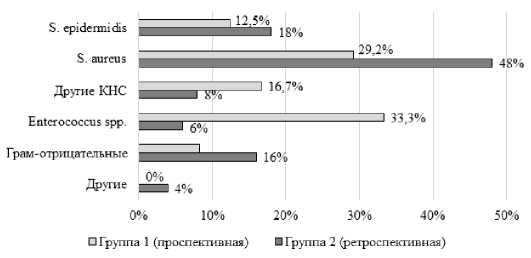
Рисунок 4 – Структура возбудителей ППИ, выделенных на этапе санации из всех видов биоматериалов от пациентов групп сравнения
Средняя продолжительность санирующей операции в группе 1 составила 136 минут (МКИ 176,25-228,75), что несмотря на необходимость дополнительных манипуляций для установки катетера оказалось значимо меньше, чем в группе сравнения – 201 минута (МКИ 110-170) (p<0,05). Медиана кровопотери также была значимо меньше в группе 1, чем в группе 2, составив 300 мл и 800 мл соответственно (МКИ 237,5-500 и 600-1075 соответственно) (p<0,05), ровно как и скорость интраоперационной кровопотери – 2,5 мл/мин в группе 1 (МКИ 1,7–3,2) и 4,2 мл/мин (МКИ 3,2–5,8) в группе 2 (p<0,05).
Показанием к выписке пациентов на амбулаторное долечивание после этапа санации являлась положительная клиниколабораторная динамика, которая была сопоставима в группах сравнения (Таблица 3).
Таблица 3
Характеристика лабораторных показателей пациентов после санации
|
Показатель |
Группа 1 (проспективная) |
Группа 2 (ретроспективная) |
p |
||
|
Ме |
МКИ |
Ме |
МКИ |
||
|
СОЭ, мм/ч |
41,5 |
30,5-52 |
41,5 |
32-52 |
>0,05 |
|
СРБ, мг/л |
22,3 |
15,1-38 |
18,9 |
15,2-37 |
>0,05 |
|
Лейкоциты, 10^9/л |
6,6 |
5,6-8,1 |
6,25 |
5,35-7,9 |
>0,05 |
|
Гемоглобин, г/л |
94,5 |
91-112 |
91 |
88-105 |
>0,05 |
|
Общий белок, г/л |
61,7 |
55,4-67,1 |
63,7 |
56,1-66,9 |
>0,05 |
Эффективность этапа санации составила 87,5% и 76,7% в группах 1 и 2 соответственно. В 2-х случаях в группе 1 развился рецидив после санирующего этапа. В группе 2 рецидив после санации выявлен в 5-ти случаях, еще в 2-х случаях зарегистрирован летальный исход.
Среди пациентов, успешно прошедших этап санации, реэндопротезирование КС завершилось успешно в 92,7% случаев (n=13/14) в группе 1 и в 78,3% случаев (18/23) в группе 2, в остальных случаях был выявлен рецидив инфекции после выполненного реэндопротезирования . Все зарегистрированные случаи рецидива ППИ были успешно пролечены повторно методом двухэтапного реэндопротезирования , в 4-х случаях было принято решение о выполнении артродезирования КС.
В целом, по результатам наблюдения за пациентами купирование инфекционного процесса было достигнуто в 70,4% случаев (n=31/44). Доля случаев рецидива инфекции составила 18,8% (n=3/16) в группе 1 ( проспективной ), что вдвое меньше, чем в группе сравнения – 35,7% (n=10/28) (р<0,05).
Функциональные результаты по шкале Oxford knee score (OKS) были получены от всех включенных в исследование пациентов проспективной группы и от 19 пациентов ретроспективной группы , завершивших этапное лечение ППИ, в среднем через 2 года после операции. Баллы были разделены на группы, как описано Kalairajah с соавт .[19], и представлены в таблице 4.
Таблица 3
Функциональные результаты пациентов, завершивших этапное лечение ППИ, по шкале OKS
|
Результаты удовлетворенности пациентов |
Пациенты, n (%) |
p |
|
|
Группа 1 |
Группа 2 |
||
|
Плохие (≤ 27 баллов) |
0 (0) |
0 (0) |
>0.05 |
|
Удовлетворительные (28 - 33 баллов) |
2 (12,5) |
6 (31,6) |
>0.05 |
|
Хорошие (34 - 41 баллов) |
9 (56,25) |
8 (42,1) |
>0.05 |
|
Отличные (42 - 48 баллов) |
5 (31,25) |
5 (26,3) |
>0.05 |
Обсуждение
После публикации ретроспективного исследования Garvin с соавт. (1995) [21], двухэтапное реэндопротезирование принято считать «золотым стандартом» в лечении ППИ. Современные исследования демонстрируют несколько меньшую эффективность данного метода лечения, чем сообщалось ранее – доля рецидивов может достигать от 30 до 50% [22-24].
Формирование свищевого хода является достоверным критерием ППИ [15, 25] и встречается почту у трети пациентов с выявленным инфекционным процессом [26-27]. До сих пор нет единого мнения о причинах столь высокого влияния свищевого хода на риск рецидива. C. Xu с соавт. (2019) и E.J. McPherson с соавт. (2002) предполагают, что причиной является плохое состояние окружающих мягких тканей и нарушение герметичности капсулы сустава из-за его сообщения с кожей [28-29]. H. Xu с соавт. (2024) сообщают о том, что наличие свища характеризует высокую интенсивность развития локальной воспалительной реакции, что негативно влияет на защитные и регенераторные способности окружающих его тканей [30]. Кроме того, свищевой ход является признаком длительно существующей инфекции с вероятным вовлечением в инфекционный процесс костной ткани, что затрудняет эрадикацию возбудителя [26]. Характер воспалительной реакции при наличии свища связан, прежде всего, с более агрессивным течением инфекционного процесса, что приводит к значимому снижению эффективности этапного лечения ППИ [26, 28, 30-34]. Так, например, Q. Wang с соавт. (2022) сообщают, что свищевой ход является независимым фактором риска неудачи санации (ОР 5,117, 95%ДИ 1,199-21,828; p=0,027) [33]. Преображенский П.М. с со-авт. (2020) также выявили негативное влияние свищевого хода, статистически значимо снижающего эффективности как этапа санации, так и этапа реэндопротезирования, при этом общая эффективность двухэтапного лечения свищевой формы ППИ снижается почти в 2 раза в сравнении с результатами лечения несвищевой формой инфекции [31]. Настоящее исследование демонстрирует эффективность «стандартного» двухэтапного реэндопротезирования в лечении свищевой формы ППИ, сопоставимую с результатами ранее проводимых исследований — доля рецидивов составила 35,7% (группа 2, ретроспективная).
Наиболее часто выделяемыми возбудителями ППИ при свищевой форме инфекции являются золотистые стафилококки и другие коагулазонегативные стафилококки, являющиеся этиологическими микроорганизмами более 50% всех случаев [27, 34-37], а также энтерококки и грамотрицательные микроорганизмы, что сопоставимо с результатами нашего исследования.
Метод локальной антибактериальной терапии, заключающийся в пролонгированном введении антимикробных препаратов известен с 1991 года, когда Davenport с соавт. [37] и Perry с соавт. [38] опубликовали результаты собственных исследований, в которых антимикробный препарат вводили интраартикулярно на протяжении нескольких суток при помощи специальной помпы. В современных научных исследованиях с целью доставки препарата в сустав наибольшую популярность получил двухпросветный сосудистый катетер Хикмана (HICKMAN®) [39-44]. Данный тип катетера имеет фиброзную манжету, которую подшивают к коже в несколько вдавленном положении, что облегчает врастание фиброзной ткани и, тем самым, эффективно герметизируя канал в мягких тканях [41]. Кроме того, наличие двух просветов позволяет продолжить инфузию антибиотика при выходе одного из каналов из строя.
На сегодняшний день использование дренажей после ЭП не рекомендуется [25, 45]. Несмотря на то, что нет статистически значимой разницы в риске развития ППИ вне зависимости от того, выполнялось ли дренирование после первичного ЭП или нет [46], сохраняется тенденция к большей послеоперационной кровопотере по дренажу, снижению уровня гемоглобина и увеличению частоты требуемых послеоперационных гемотрансфузий [47]. Учитывая эти недостатки, была предложена модифицированная тактика периоперационного ведения данной категории пациентов, заключающаяся в отложенном старте тромбопрофилактики и коротком сроке дренирования. Согласно полученным результатам, метод позволяет снизить объем дренажной и суммарной кровопотери, уменьшить объем перелитых компонентов крови и не влияет на риск рецидива ППИ [48]. Использование сосудистых катетеров, установленных интраартикулярно на трое суток после первичного ЭП также не оказывает статистически значимого влияния на риск возникновения ППИ [49]. В условиях же наличия инфекционного процесса санирующие оперативные вмешательства, как правило, требуют установки дренажей, а вопрос возможности отказа от дренирования сустава или сокращения его сроков при санации в настоящее время мало изучен.
Гидрогели в настоящее время рассматривают как перспективные носители антимикробных препаратов. В зависимости от используемых в их составе полимеров можно изменять время деградации геля и кинетику высвобождения препаратов [50-51]. Кроме того, повышенная вязкость гелевых форм позволяет полностью покрыть поверхность имплантатов любой формы и заполнить «мертвые» пространства (пустоты) между имплантатом и окружающими его тканями. Однако, в ряде исследований применяли для локальной терапии водные растворы ванкомицина и имипенема, а также другие препараты. При этом концентрация вводимых антимикробных препаратов была гетерогенной, в большинстве исследований инфузию начинали в первые 48 часов после операции, а средняя ее продолжительность составляла 19 дней. Несмотря на то, что рутинное интраартикулярное введение антибиотиков при лечении ППИ активно обсуждается профессиональным сообществом специалистов, до настоящего момента отсутствует стандартизированный протокол локальной АБТ [25].
Научные публикации, содержащие данные об эффективности метода локальной АБТ при двухэтапном лечении ППИ, за исключением эффективности костного цемента с антибиотиками, немногочисленны [38, 42], однако демонстрируют эффективность метода, доля рецидива при котором составляет 21,1%. Однако, опять же, протоколы лечения не стандартизированы и во всех случаях гетерогенны. Так, например, Gillard-Campbell с соавт. (2021) [42] применяли локальную инфузию раствора ванкомицина и цефазолина с физиологическим раствором, вводимыми на протяжении 6-ти недель после этапа санации без назначения системной АБТ. В данном исследовании доля успешных исходов двухэтапного лечения ППИ составила 80%.
С целью устранения недостатков водных форм антимикробных средств были предложены их гелевые формы. Одним из прототипов геля, использованного нами с текущем исследовании, является гидрогель DAC (The Defensive Antibacterial Coating, защитное антимикробное покрытие) [52]. Данный гель продемонстрировал способность удерживать несколько антибактериальных средств в концентрациях от 2% до 10% и высвобождать их локально в течение 72 часов [53]. C. Romano с соавт. (2016) в своем исследовании продемонстрировали способность геля снижать частоту послеоперационнх инфекционных осложнений с 6% до 0,6% при его применении во время первичного и ревизионного эндопротезирования (p=0.003) [54]. Также гель продемонстрировал эффективность при двухэтапном бесцементном реэндопротезировании тазобедренного сустава – в группе пациентов, у которых был применен гель, не было выявлено случаев ППИ при среднем сроке наблюдения 2,7 лет, в сравнении с контрольной группой, где за период наблюдения были выявлены 4 случая рецидива инфекции [55]. Предлагаемый нами оригинальный метод локальной АБТ с инфузией антимикробной гелевой композиции (патент RU 2757263 C1) [16] в течение первых 3-х суток после этапа санации позволил повысить эффективность двухэтапного лечения свищевой формы ППИ у данной когорты пациентов более чем на 20% (с 64,3% в группе 2, до 81,2% в группе 1).
Известно, что длительность операции влияет на риск развития ППИ [25]. Продолжительность операции свыше 120 минут является независимым фактором риска инфекционных осложнений [56]. Полученные нами данные о значимо меньшей длительности операции и скорости кровопотери в проспективной группе, возможно, оказали влияние на результаты данного исследования, что требует проведения исследований с учетом влияния интраоперационного времени на результаты лечения пациентов.
Проведенная нами оценка удовлетворенности пациентов функциональным состоянием оперированного сустава показала, что почти 80% пациентов имеют хорошие и отличные функциональные результаты. В целом, результаты нашего исследования демонстрируют сопоставимые результаты с точки зрения удовлетворенности пациентов, частоты рецидивов инфекции и повторных вмешательств по сравнению с существующей современной литературой, демонстрируя безопасность и эффективность предлагаемого метода лечение ППИ. Сильные стороны исследования включают проспективный сбор данных, наличие группы сравнения, которой было выполнено двухэтапное реэндопротезирование КС без локальной АБТ и наблюдение за пациентами сроком до трех лет.
Заключение
Предложенный метод локальной антибактериальной терапии позволил повысить эффективность двухэтапного лечения свищевой формы перипротезной инфекции за счет снижения доли рецидивов инфекционного процесса более, чем в 2 раза. Положительный результат лечения позволяет рекомендовать предложенную схему для более широкого клинического применения, однако, для возможности рутинного применения необходимы проспективные рандомизированные контролируемые исследования. Дальнейшее изучение методик лечения
ППИ, при которой местные и системные антибиотики работают синергически, в проспективных рандомизированных контролируемых исследованиях с хорошо сформулированным протоколом лечения и долгосрочным наблюдением за пациентами имеет важное значение для получения доказательств эффективности, безопасности и экономической эффективности предлагаемого метода, что может способствовать его включению в клинические рекомендации лечения ППИ.


