Локальная гипертермия в комбинированном лечении местнораспространённых сарком мягких тканей
Автор: Зубарев Алексей Леонидович, Курильчик Александр Александрович, Курпешев Оразахмет Керимбаевич, Стародубцев Алексей Леонидович, Иванов Вячеслав Евгеньевич
Журнал: Сибирский онкологический журнал @siboncoj
Рубрика: Клинические исследования
Статья в выпуске: 3 (69), 2015 года.
Бесплатный доступ
В МРНЦ было пролечено 183 больных местнораспространёнными саркомами мягких тканей. Больные были распределены в группы по виду лечения. В первую группу были включены 107 пациентов, которым провели предоперационную термохимиолучевую терапию (ТХЛТ) и хирургическое вмешательство. Вторую группу составили 76 пациентов, получивших химиолучевую терапию (ХЛТ) с последующей операцией. Показатели пятилетней безрецидивной, безметастатической и общей выживаемости оказались выше в группе с ТХЛТ (93, 69 и 84 %) в сравнении с группой ХЛТ (78, 56 и 68 %). Применение локальной гипертермии не увеличило число послеоперационных осложнений.
Саркомы мягких тканей, комбинированное лечение, локальная гипертермия, термохимиолучевая терапия, химиолучевая терапия
Короткий адрес: https://sciup.org/14056544
IDR: 14056544 | УДК: 616-006.3.04-059-08:615.832:612.57
Текст научной статьи Локальная гипертермия в комбинированном лечении местнораспространённых сарком мягких тканей
Саркомы мягких тканей (СМТ) – злокачественные новообразования, происходящие из мезенхимальных клеток и составляющие около 1 % от всех злокачественных опухолей у взрослых. Мезенхимальные клетки могут дифференцироваться в различные типы тканей, поэтому в настоящее время насчитывается более 50 морфологических форм сарком мягких тканей [18]. В США каждый год регистрируется до 11 000 новых случаев сарком мягких тканей [14], и около половины таких пациентов умирает. Наиболее часто [1, 10] встречаются недифференцированная / неклассифицируемая саркома (26 %), липосаркома (15 %), лейомиосаркома (12 %), синовиальная саркома (10 %) и нейрогенные опухоли (6 %). Симптомы СМТ неспецифичны и различаются в зависимости от размера и локализации опухоли. Опухоли чаще всего проявляются в виде безболезненной, постепенно нарастающей массы, а клинические проявления, как правило, возникают вследствие увеличения давления на соседние органы и ткани и зависят от локализации опухоли. Наиболее часто (38 %) поражаются мягкие ткани конечностей [1, 10], забрюшинные опухоли составляют 26 %, поражения мягких тканей туловища – до 8 %. Морфологическая верификация заболевания путём выполнения либо трепан-биопсии под ультрасонографическим или рентгенографическим контролем, либо открытой биопсии является обязательной процедурой с установлением гистологического типа, степени злокачественности опухоли, с применением иммуногистохимического исследования, а для некоторых морфологических форм – с проведением молекулярно-генетического исследования. Нерешённость многих проблем в лечении СМТ, таких как высокая частота локального рецидивирования
и отдалённого метастазирования, отсутствие чётких стандартов лечения этого заболевания, заставляет искать новые подходы и методы терапии этого заболевания [8, 9, 20]. В настоящее время лечение больных СМТ должно быть мультимодальным, с обязательным хирургическим этапом и обсуждаться на консилиуме специалистов, включающем патоморфолога, лучевого терапевта, химиотерапевта и хирурга.
На последнем Европейском конгрессе ESMO в 2014 г. в Амстердаме [4] приняты основные рекомендации для лечения СМТ:
– широкое иссечение с последующей лучевой терапией является стандартом лечения высокозлокачественных (G2-G3), глубоких сарком мягких тканей, больше 5 см;
– возможно проведение неоадъювантной лучевой терапии, особенно в комбинации с химиотерапией, РОД 1,8–2 Гр до СОД 50 Гр и последующей операцией;
– применение новых технологий в лучевой терапии (IMRT и IGRT) позволяет значительно снизить количество послеоперационных осложнений.
Теоретической основой предоперационной тер-мохимиолучевой терапии (ТХЛТ) СМТ является «стерилизация» псевдокапсулы опухоли, девите-лизация анаплазированых клеток, что позволяет выполнить оперативное вмешательство с высокой степенью абластичности. Локальная гипертермия (ЛГТ) не только усиливает повреждающий эффект лучевой терапии, но и приводит к непосредственному термическому повреждению клеток опухоли. Комбинация противоопухолевых препаратов с ЛГТ (термохимиотерапия (ТХТ)) и/или лучевая терапия (термохимиолучевая терапия) – новая клиническая стратегия в лечении сарком мягких тканей [2, 3, 12,
13, 20]. Локальная гипертермия даёт химиосенсибилизирующий эффект [5, 11, 15, 17].
Однако, несмотря на обнадёживающие результаты ТЛТ и ТХЛТ, в настоящее время не решены вопросы оптимального сочетания гипертермии с лучевой и химиотерапией, а успехи в лечении локального опухолевого процесса при саркомах мягких тканей путем внедрения новых способов оперативного вмешательства, лучевой терапии, электромагнитной терапии не отразились на общей и безметастатической пятилетней выживаемости больных [1]. Для улучшения этих показателей у больных первичными высокозлокачественными местнораспространёнными и рецидивными саркомами мягких тканей стали активно применять схемы полихимиотерапии (ПХТ), содержащие доксорубицин и холоксан (AI), гемзар, таксотер, трабектидин, пазопаниб в зависимости от гистологического типа опухоли. Анализ работ отечественных и зарубежных авторов показал, что улучшение результатов лечения СМТ удаётся получить, используя комбинированный или комплексный методы лечения, включающие различные комбинации лучевого, хирургического лечения, химиотерапии и локальной гипертермии. В начале 2015 г. опубликованы данные исследований, проведенных в США и Европе, посвящённых предоперационной лучевой терапии с применением новых технологий и аппаратов для радиотерапии, которые позволяют значительно снизить послеоперационные и послелучевые осложнения, как ранние, так и поздние, в сравнении с литературными данными 1998–2005 гг. [7, 19]. При этом показатели без-рецидивной, общей и безметастатической выживаемости в ряде исследований выше, чем в ранее опубликованных работах.
Материал и методы. В МРНЦ с 2000 по 2014 г. было пролечено 183 больных СМТ в возрасте от 19 до 76 лет (медиана 50,2 года). Диагноз был установлен на основании клинико-рентгенологических данных, УЗИ, рентгеновской КТ, МРТ, данных гистологического с имунногистохимическим и, при необходимости, молекулярно-генетическим исследованием. Наиболее часто встречались (рис. 1) липосаркома (21,5 %), недифференцированная саркома (21 %), синовиальная саркома (15 %) и
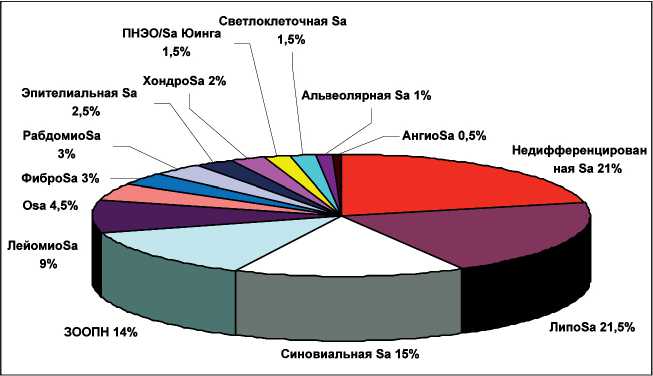
Рис. 1. Морфологические формы СМТ злокачественная опухоль из оболочек периферических нервов (14 %).
У 146 больных (80 %) опухоли поражали мягкие ткани конечностей, в 20 % случаев – локализовались на туловище. Размеры опухоли у 97 % больных были более 5 см, у ряда больных достигали 26–32 см (М – 10,8 см). Стадия IIA была диагностирована у 5 % больных, IIB – у 31 %, III– IV стадии – более чем у 64 % (табл. 2). Больные со степенью злокачественности G1 не включались в исследование. У 122 пациентов (67 %) установлена степень злокачественности G3 и у 33 % – G2. Рецидивные опухоли составили 30 % от всех опухолей. По виду предоперационного комбинированного лечения больные были распределены в две группы комплексного лечения, которые были сопоставимы по возрасту, полу и по локализации опухоли.
В первую группу были включены 107 больных, которым на предоперационном этапе проводилась термохимиолучевая терапия, которая включала 3 неоадъювантных и 3 адъювантных курса полихимиотерапии (ПХТ) в зависимости от морфологической формы опухоли по схемам: HD-AI (холоксан CД – 7,5–10 г/м2 1–3-й или 1–4-й дни; доксорубицин СД – 60–75 мг/м2 в течение 72 ч); MAID; монотерапию доксорубицином СД – 75 мг/м2 в течение 72 ч или холоксаном – СД 7,5 г/м2 в течение 72 ч и т. д. Смена схем ПХТ проводилась при прогрессировании или при лечебном патоморфозе опухоли меньше II степени. Предоперационная дистанционная лучевая терапия проводилась на аппаратах Ускоритель SL-75, Ускоритель SL-20, Терабалт, Electa по методике ускоренного фрак-
Таблица 1
распределение больных в группах
|
Группы больных |
Пол |
Возраст, медиана |
Локализация |
Стадия |
G |
||||||
|
Муж |
Жен |
Конечности |
Туловище |
IIA |
IIB |
III |
IV |
G 2 |
G 3 |
||
|
I группа (n=107) |
57 (53 %) |
50 (47 %) |
М=50,5 |
87 (81 %) |
20 (19 %) |
6 (5 %) |
35 (33 %) |
59 (55 %) |
7 (7 %) |
37 (35 %) |
70 (65 %) |
|
66 (62 %) |
|||||||||||
|
II группа (n=76) |
34 (45 %) |
42 (55 %) |
М=49,8 |
59 (78 %) |
17 (22 %) |
4 (5 %) |
21 (28 %) |
41 (54 %) |
10 (13 %) |
24 (32 %) |
52 (68 %) |
|
51 (67 %) |
|||||||||||
Примечание: в I группе 33 больным проведена интраоперационная ЛТ в разовой дозе 10–15 Гр; во II группе 31 больному проведена интраоперационная ЛТ в разовой дозе 10–15 Гр.
1-й этап
Неоадъювантная ПХТ (3 курса с учётом морфологического диагноза) + предоперационная ДЛТ (ускоренное облучение до изоэффективной СОД 40–42 Гр) + локальная гипертермия (6 сеансов) 2-й этап
Операция, при R1 + интраоперационная ЛТ (СОД 10–15 Гр) или послеоперационная ЛТ (РОД 1,8–2 Гр, СОД 20 Гр) до общей изоэффективной СОД 60–65 Гр 3-й этап
Адьювантная ПХТ (3 курса с учётом лечебного патоморфоза)
Рис. 2. Алгоритм лечения высокозлокачественных местнораспространённых и рецидивных СМТ ционирования, разовой очаговой дозой по 3 Гр 2 раза в день с интервалом 4 ч между сеансами, 3 раза в неделю до суммарной очаговой дозы 30 Гр (изоэффективная СОД 42 Гр, ВДФ – 69). Локальная электромагнитная гипертермия проводилась в двух режимах, в связи с чем были сформированы две подгруппы больных в рамках I группы для изучения особенностей лечебного патоморфоза и анализа ответа опухоли на предоперационную ТХЛТ по системе RECIST. В первой подгруппе 74 больным проводили 6 сеансов ЛГТ – по одному с курсом ПХТ до ЛТ и курсом ПХТ после ЛТ; 4 сеанса ЛГТ с курсом ЛТ, начиная со 2-го дня облучения перед 2-й дневной фракцией облучения (табл. 3). Во вторую подгруппу включены 33 пациента, которым проводили 4 сеанса ЛГТ только с курсом ЛТ по аналогичной методике (табл. 3).
УВЧ-гипертермию проводили с помощью ёмкостных или индуктивных аппликаторов от установок «Супертерм-ЭП-40» (40, 68 МГц, мощ- ность 350 ± 100 Вт) или «Яхта-5» (40, 68 МГц). СВЧ-гипертермию осуществляли на установке «Яхта-3» (915 МГц) с помощью контактных наружных аппликаторов. Во время сеансов гипертермии температуру в опухоли контролировали одним или двумя 2–3-элементными оптико-волоконными термодатчиками в различных точках опухоли с тем, чтобы выбрать наиболее оптимальные параметры нагревания. Минимальный уровень температуры в опухоли колебался в пределах 41–41,6°С, максимальный – 43–44,7°C с продолжительностью воздействия от 40 до 80 мин. Постоянно во время сеанса осуществлялся мониторинг состояния больного. При резком усилении ощущения жжения проводилась коррекция параметров. При уменьшении температуры нагревания увеличивалось время сеанса ЛГТ. Ниже 41°С температуру не снижали. Если это происходило, больной снимался с курса лечения ЛГТ. Оперативное вмешательство (ОП) проводилось через 3–4 нед после 3-го курса ПХТ
Таблица 2
Применение локальной гипертермии в предоперационном комбинированном лечении с химиотерапией и лучевой терапией (I группа)
|
Группы больных |
Метод лечения |
1-я нед |
2-я нед |
3-я нед |
4-я нед |
7-я нед |
10– 12 нед |
|||||||||||
|
1-й д. |
2-й д. |
3-й д. |
4-й д. |
5-й д. |
1-й д. |
3-й д. |
5-й д. |
1-й д. |
3-й д. |
5-й д. |
1-й д. |
2-й д. |
3-й д. |
4-й д. |
||||
|
1-я подгруппа, ТХЛТ + ОП (n=74) |
ПХТ |
+ |
+ |
+ |
+ |
+ |
+ |
+ |
+ |
+ |
||||||||
|
ЛГТ, 4 сеанса |
+ |
+ |
+ |
+ |
||||||||||||||
|
ЛТ |
+ |
+ |
+ |
+ |
+ |
|||||||||||||
|
ОП |
+ |
|||||||||||||||||
|
2-я подгруппа, ТХЛТ + ОП (n=33) |
ПХТ |
+ |
+ |
+ |
+ |
+ |
+ |
+ |
+ |
+ |
||||||||
|
ЛГТ, 6 сеансов |
+ |
+ |
+ |
+ |
+ |
+ |
||||||||||||
|
ЛТ |
+ |
+ |
+ |
+ |
+ |
|||||||||||||
|
ОП |
+ |
|||||||||||||||||
Примечание: ТХЛТ – термохимиолучевая терапия; ПХТ – полихимиотерпия; ЛГТ – локальная гипертермия; ЛТ – лучевая терапия; ОП – операция.
Таблица 3
анализ ответа опухоли на лечение по критериям rEcIst
|
Группы больных |
Частичный ответ |
Полный ответ |
Стабилизация |
Прогрессирование |
|
|
I группа (n=107) |
1-я подгруппа (n=74) |
37 (50 %) |
2 (3 %) |
35 (47 %) |
- |
|
39 (53 %) |
|||||
|
2-я подгруппа (n=33) |
5 (15 %) |
- |
28 (85 %) |
- |
|
|
II группа (n=76) |
6 (9 %) |
1 (1 %) |
68 (89 %) |
1 (1 %) |
|
|
7 (10 %) |
|||||
Таблица 4
анализ лечебного патоморфоза опухолей
Вторую группу составили больные, которым на предоперационном этапе проводили химиолучевое лечение по аналогичным методикам ЛТ и схемам ПХТ, как и в первой группе. Хирургическое лечение выполняли также через 3–4 нед после 3-го курса ПХТ с соблюдением стандартных принципов футлярности и зональности, исследованием на злокачественные клетки краёв иссечения и определением лечебного патоморфоза опухоли.
Статистическая обработка результатов исследования проводилась методом компьютерного анализа при помощи статистической программы GraphPad InStart. Значимыми считались различия с вероятностью ошибки не более 5 % (р<0,05).
Результаты исследования. Перед оперативным вмешательством в группах проводился анализ результатов ответа опухоли на предоперационное комбинированное лечение (табл. 4) по критериям оценки ответа [16] на лечение солидных опухолей (Response Evaluation Criteria in Solid Tumors – RECIST). При этом выяснилось, что во второй группе с ХЛТ на предоперационном этапе и второй подгруппе I группы с ТХЛТ, где больным проводилось 4 сеанса ЛГТ только с ЛТ, у подавляющего числа пациентов удалось добиться только стабилизации процесса (89 и 85 %). Тогда как в первой подгруппе, где проводилось 6 сеансов ЛГТ вместе с ПХТ и ЛТ, более чем у половины больных (53 %) был отмечен частичный ответ опухоли, т. е. уменьшение опухоли на 30 и более процентов, а у 2 больных получен полный ответ, который был подтверждён морфологически после последующего оперативного вмешательства.
У всех больных в группах и подгруппах был определён лечебный патоморфоз [6] опухоли (табл. 5). В I группе c ТХЛТ в целом и отдельно по подгруппам выраженный лечебный патоморфоз (III–IV степень) был получен значительно выше (86–88 %), чем во II группе (38 %), что подтверждает важную роль ЛГТ в реализации лечебных эффектов и повреждении опухоли на предоперационном этапе.
По таблицам дожития Каплана – Мейера были рассчитаны и проанализированы показатели пятилетней безрецидивной, безметастатической и общей выживаемости. Пятилетняя безметастати-ческая выживаемость в I группе составила 69 % в сравнении с II группой – 56,5 %. Достоверными оказались различия только в 1-й год наблюдения (93 и 79 %; p=0,01). При анализе безрецидивной выживаемости в группе с ТХЛТ (I) были зарегистрированы достоверно лучшие (p<0,01) показатели как пятилетние (93 и 78 % соответственно), так и во все предыдущие годы наблюдения. Местные рецидивы у большинства больных возникали в течение первого (50–57 %) и второго (21–36 %) годов наблюдения после проведенного лечения, что соответствует данным литературы, по которым большинство рецидивов заболевания (до 80 %) как местных, так и в виде отдалённого метастазирования развиваются в течение первых 2 лет после лечения. Результаты пятилетней общей выживаемости в I группе оказались также выше – 84 %, чем во второй группе – 68 % (p=0,05).
Ранние и поздние лучевые реакции так же, как и ранние и поздние послеоперационные осложнения, достоверно в группах не отличались. Мы не наблюдали в отдалённом периоде послелучевого фиброза выше 2-й степени и переломов костей. Развитие нейропатии в послеоперационном периоде в большей степени было связано с вынужденной резекцией нерва во время оперативного вмешательства.
Заключение. Применение ЛГТ в комбинированном предоперационном лечении СМТ позволяет добиваться высоких показателей лечебного патоморфоза опухоли, а при сочетании с ПХТ и ЛТ (6 сеансов) удаётся получить частичный ответ опухоли перед операцией более чем у половины пациентов (53 %). Эти результаты обусловили достоверно лучшие показатели безрецидивной выживаемости (93 %) в группе с ТХЛТ по сравнению с ХЛТ (78 %). Применение ЛГТ в комбинированном предоперационном лечении не увеличивает частоту послелучевых и послеоперационных осложнений по сравнению с неоадъювантной хи-миолучевой терапией.
Список литературы Локальная гипертермия в комбинированном лечении местнораспространённых сарком мягких тканей
- Алиев М.Д., Мехтиева Н.И., Бохян Б.Ю. Факторы прогноза сарком мягких тканей//Вопросы онкологии. 2005. Т. 51, № 3. С. 288-299
- Иванов С.М., Ткачёв С.И. Терморадиохимиотерапия неоперабельных сарком мягких тканей//Вопросы онкологии. 2005. Т. 51, № 3. С. 350-354
- убарев А.Л., Курильчик А.А., Курпешев О.К. Комбинированное лечение местно-распространённых сарком мягких тканей//Материалы V съезда онкологов и радиологов Республики Казахстан с международным участием. Алматы, 2014. С. 131
- Christopher D.M., Fletcher J.B. The ESMO/European Sarcoma Network Working Group//Ann. Oncol. 2014. Vol. 25. Supl. 3. iii. 113-123
- Fiegl M., Schlemmer M., Wendtner C.M., Abdel-Rahman S., Fahn W., Issels R.D. Ifosfamide, carboplatin and etoposide (ICE) as second-line regimen alone and in combination with regional hyperthermia is active in chemo-pre-treated advanced soft tissue sarcoma of adults//Int. J. Hyperthermia. 2004. Vol. 20 (6). P. 661-670
- Fletcher Ch.D.M., Unni K.K., Mertens F. (eds.) World Health Organization Classification of Tumors. Pathology and Genetics of Tumors of Soft Tissue and Bone. Lyon: IARS press, 2002. P. 264-270
- Green C.M., Nguyen N., Wylie J., Choudhury A., Gregory J.J. The treatment of periarticular soft tissue sarcoma following neo-adjuvant radiotherapy: a cohort study//World J. Surg. Oncol. 2015. Vol. 13 (1). P. 108 DOI: 10.1186/s12957-015-0515-8
- Griffin A., Yami A.A., O’Sullivan B., Ferguson P. Positive surgical margins in soft tissue sarcoma treated with preoperative radiation: Is a postoperative boost necessary?//14th International Symposium on Limb Salvage, Proceedings. Hamburg, 2007. P. 63-64
- Hall K.S., Eriksson M. SSG XX-A Scandinavian Sarcoma Group (SSG) treatment protocol for adult patients with non-metastatic high-risk soft tissue sarcoma (STS) of the extremities and trunk wall//14th International Symposium on Limb Salvage, Proceedings. Hamburg, 2007. P. 33
- Holland J.F., Frei E. Cancer Medicine 6//BC Decker Inc. London, 2003. 2699 p
- Issels R.D., Lindner L.H., Verweij J., Wust P., Reichardt P., Schem B.C., Abdel-Rahman S., Daugaard S., Salat C., Wendtner C.M., Vujaskovic Z., Wessalowski R., Jauch K.W., Dürr H.R., Ploner F., Baur-Melnyk A., Mansmann U., Hiddemann W., Blay J.Y., Hohenberger P. Neo-adjuvantchemotherapy alone or with regional hyperthermia for localised high-risk soft-tissue sarcoma: a randomized phase 3 multicentre study//Lancet Oncol.2010. Vol. 11 (6). P. 561-670 DOI: 10.1016/S1470-2045(10)70071-1
- Kurpeshev O.K., Zubarev A.L. Thermoradiation therapy for soft tissues sarcoma//22nd Annual Meeting of the European Society for Hyperthermic Oncology. Graser Congress, Gras, Austria. 2005. P. 74-75
- Lindner L.H., Issels R.D. Hyperthermia in soft tissue Sarcoma Current Treatment Options in Oncology//Curr. Treat. Options Oncol.2011 Vol. 12 (1). P. 12-20 DOI: 10.1007/s11864-011-0144-6
- Pisters P.W.T., Weiss M., Maki R. Cancer management. 2011. 14th edn. Soft-Tissue Sarcomas
- Romanowski R., Schött C., Issels R., Klingebiel T., Treuner J., Jürgens H., Göbel U., Goldschmitt-Wuttge B., Feldmann H., Haas R. Regional hyperthermia with systemic chemotherapy in children and adolescents: feasibility and clinical followup of 34 intensively pretreated patients with prognostically unfavorable tumor diseases//Klin. Padiatr. 1993. Vol. 205 (4). P. 249-256
- Therasse P., Arbuck S.G., Eisenhauer E.A., Wanders J., Kaplan R.S., Rubinstein L., Verweij J., Van Glabbeke M., van Oosterom A.T., Christian M.C., Gwyther S.G. New guidelines to evaluate the response to treatment in solid tumors//J. Natl. Cancer Inst. 2000. Vol. 92 (3). P. 205-216
- Wang D., Zhang Q., Eisenberg B.L., Kane J.M., Li X.A., Lucas D., Petersen I.A., DeLaney T.F., Freeman C.R., Finkelstein S.E., Hitch-cock Y.J., Bedi M., Singh A.K., Dundas G., Kirsch D.G. Significant Reduction of Late Toxicities in Patients With Extremity Sarcoma Treated With Image Guided Radiation Therapy to a Reduced Target Volume: Results of Radiation Therapy Oncology Group RTOG-0630 Trial//J. Clin. Oncol.2015 Feb 9. pii: JCO.2014.58.5828.
- Wessalowski R., Schneider D.T., Mils O., Hannen M., Calaminus G., Engelbrecht V., Pape H., Willers R., Engert J., Harms D., Göbel U. An approach for cure: PEI-chemotherapy and regional deep hyperthermia in children and adolescents with unresectable malignant tumors//Klin. Padiatr. 2003. Vol. 215 (6). P. 303-309
- WHO Classification of Tumours. of Soft Tissue and Bone/Eds. C.D.M. Fletcher et al. Lyon: IARC Press, 2013
- van der Zee J., Vujaskovic Z., Kondo M., Sugahara T. The Kadota Fund International Forum 2004 -clinical group consensus//Int. J. Hyperthermia. 2008. Vol. 24 (2). P. 111-122


