Локальная химическая абляция миокарда трансвенозным доступом: результаты экспериментального исследования
Автор: Сергеевичев Д.С., Цыденова А.Ю., Мурашов И.С., Фоменко В.В., Кузнецова Е.В., Назаров В.М., Романов А.Б.
Журнал: Патология кровообращения и кардиохирургия @journal-meshalkin
Рубрика: Экспериментальные статьи
Статья в выпуске: 4 т.29, 2025 года.
Бесплатный доступ
Актуальность. Желудочковые тахикардии, особенно у пациентов со структурной патологией сердца, представляют жизнеугрожающую проблему. Стандартные методы, такие как радиочастотная абляция, часто неэффективны против глубоких или эпикардиальных аритмогенных очагов, а трансартериальная химическая абляция этанолом недостаточно селективна и сопряжена с риском обширного повреждения миокарда. В качестве альтернативы рассматривается ретроградный трансвенозный доступ для химической абляции миокарда, использующий высокую проницаемость стенок коронарных вен. Цель. Оценить эффективность и безопасность создания локальной химической абляции миокарда с помощью селективной инъекции композиции алифатических VVF34 в изолированный сегмент коронарной вены. Методы. Исследование выполнено на мини-свиньях (n = 4). С использованием «мультибаллонной» техники окклюзии изолировали целевой сегмент коронарной вены, после чего вводили 1 мл композиции VVF34. Через 1 и 3 месяца проводили гистологический анализ миокарда для оценки формирования фиброза. Результаты. Процедура успешно выполнена всем животным без интраи послеоперационных осложнений. Гистологический анализ подтвердил формирование четко ограниченных очагов фиброза в миокарде, прилегающем к месту инъекции. Через 1 месяц наблюдались активная воспалительная реакция и начальное фиброзное перерождение, а через 3 месяца – формирование зрелых, гомогенных участков склероза без значительной воспалительной инфильтрации. Заключение. Метод трансвенозной химической абляции миокарда композицией VVF34 с баллонной изоляцией венозного сегмента доказал свою эффективность и безопасность в эксперименте. Данный подход позволяет создавать контролируемые зоны фиброза, является перспективным для высокоселективного воздействия на глубокие и эпикардиальные аритмогенные субстраты, недоступные для радиочастотной абляции, и открывает новые возможности для лечения резистентных аритмий.
Желудочковые тахикардии, коронарные вены, мультибаллонная техника, химическая абляция, экспериментальная кардиология, VVF34
Короткий адрес: https://sciup.org/142246838
IDR: 142246838 | DOI: 10.21688/1681-3472-2025-4-25-32
Текст научной статьи Локальная химическая абляция миокарда трансвенозным доступом: результаты экспериментального исследования
Patologiya krovoobrashcheniya i kardiokhirurgiya = Circulation Pathology and Cardiac Surgery. 2025;29(4):25-32. (In Russ.)
D.S. Sergeevichev,
A.Yu. Tsydenova,
I.S. Murashov,
V.V. Fomenko,
E.V. Kuznetsova,
V.M. Nazarov,
A.B. Romanov,
Background: Ventricular tachycardia, especially in patients with structural heart disease, is a life-threatening condition. Standard methods, such as radiofrequency ablation, are often ineffective against deep or epicardial arrhythmogenic foci, and transarterial chemical ablation with ethanol is insufficiently selective and riskbearing for extensive myocardial damage. A retrograde transvenous approach for myocardial chemical ablation, exploiting the high permeability of coronary vein walls, is being considered as an alternative.
Objective: The study was aimed to assess the efficacy and safety on formation of local myocardial chemical ablation using selective injection of an aliphatic VVF34 composition into an isolated coronary vein segment.
Methods: The study was performed on minipigs ( n = 4). The target segment of the coronary vein was isolated using a multi-balloon occlusion technique, followed by the injection of 1 ml of the VVF34 composition. Histological examinations of the myocardium were performed at 1 and 3 months after intervention to assess fibrosis formation.
Results: The procedure was successfully completed in all animals without intra- or postoperative complications. Histological analysis confirmed the formation of sharply marginated fibrosis foci in the myocardium adjacent to the injection site. The active inflammatory reaction and initial fibrotic degeneration were revealed at 1 month after injection, and the formation of mature homogeneous areas of sclerosis without significant inflammatory infiltration was identified 3 months later.
Conclusion: The transvenous chemical myocardial ablation with VVF34 composition using balloon isolation of venous segment has proven its efficacy and safety in the experiment. This approach enables to create controlled zones of fibrosis and is promising for highly selective targeting of deep and epicardial arrhythmogenic origins inaccessible to radiofrequency ablation, opening new possibilities for the treatment of resistant arrhythmias.
Введение
Желудочковые тахикардии и другие фокальные аритмии остаются серьезной клинической проблемой, ассоциированной с высокой заболеваемостью и смертностью, особенно у пациентов со структурной патологией сердца [1; 2]. Несмотря на значительный прогресс, современные методы лечения, в первую очередь катетерная радиочастотная абляция (РЧА), имеют существенные ограничения. Эффективность РЧА снижается при тахикардиях, источник которых расположен в глубоких слоях миокарда, в эпикардиальном пространстве или в зонах грубого рубца, где передача тепловой энергии недостаточна для создания трансмурального поражения. Кроме того, процедура РЧА сопряжена с рисками таких осложнений, как перфорация сердца, тромбоэмболия, повреждение клапанного аппарата или коронарных артерий [3; 4].
В качестве альтернативы для лечения резистентных аритмий может использоваться методика транскоронарной химической абляции этанолом. Для этого под контролем ангиографии этанол вводится в ветвь коронарной артерии, питающую аритмогенный субстрат, что вызывает артериальный тромбоз и инфаркт миокарда. Однако данный метод имеет серьезные недостатки, главный из которых – отсутствие возможности точного контроля зоны некроза, что может привести к обширному повреждению здорового миокарда и острой сердечной недостаточности [5]. По этой причине наибольшее распространение данный метод получил при лечении гипертрофической кардиомиопатии, когда требования к селективности поражаемой области существенно ниже [6].
Но точное и контролируемое воздействие на арит-могенный субстрат может быть достигнуто не только через артериальную, но и через венозную сосудистую сеть сердца. Известно, что коронарные вены анатомически тесно связаны с миокардом, а их стенка, в отличие от артериальной, более проницаема. Эта особенность нашла свое практическое подтверждение в работах по ретроградной трансвенозной абляции сердца. Наибольшим опытом в клиническом применении этого метода при лечении желудочковых нарушений сердечного ритма обладает команда под руководством M. Valderrábano [7; 8].
Целью нашего экспериментального исследования являлась оценка эффективности создания локального склеротического поражения миокарда путем селективной инъекции в просвет коронарной вены композиции для химической абляции тканей VVF34 [9]. Ранее ФГБУ «НМИЦ им. ак. Е.Н. Мешалкина» Минздрава России был выполнен весь ряд доклинических испытаний VVF34, показавший безопасность применения композиции и эффективность ее использования при лечении аритмий. В ходе доклинических испытаний был использован метод эндомиокардиального введения VVF34 с помощью специального эндоваскулярного инъекционного катетера. В результате миокард в области инъекции замещался четко ограниченным участком фиброзной ткани.
В настоящем исследовании применялась «мульти-баллонная» техника с использованием нескольких баллонных катетеров [7; 10–12]. Она позволяет временно окклюзировать вену проксимальнее и дистальнее места инъекции, изолируя целевой сегмент; создавать условия для проникновения склерозирующего агента через стенку вены непосредственно в прилегающий миокард; предотвращать системную диссе-минацию VVF34, минимизируя побочные эффекты и обеспечивая высокую локальность воздействия. Использованный подход открывает перспективы для абляции аритмогенных очагов, расположенных эпи-кардиально, в непосредственной близости от коронарных вен, тем самым расширяя арсенал клинических подходов к лечению желудочковых нарушений сердечного ритма.
Методы
Склерозирующая композиция для химической абляции
Композиция VVF34 изготовлена в НИОХ СО РАН (Новосибирск) по лабораторному регламенту, разработанному ФГБУ «НМИЦ им. ак. Е.Н. Мешалкина» Минздрава России при выполнении государственного контракта от 14 августа 2017 г. № 14.N08.11.0169 в рамках Федеральной целевой программы «Развитие фармацевтической и медицинской промышленности Российской Федерации на период до 2020 года и дальнейшую перспективу».
Композиция VVF34 представляет собой лекарственную форму – раствор для парентерального применения, стерильный, апирогенный. Фасуется в 10 мл флаконы из светлого стекла с укупоркой резиновыми пробками под обкатку алюминиевым колпачком. Содержимое флаконов: прозрачная, слегка желтоватая подвижная жидкость с характерным спиртовым запахом. Состав: этанол, дисульфирам, изобутанол [9].
Экспериментальные животные и биоэтический аспект
Экспериментальные исследования выполнены на мини-свиньях минисибс селекции ИЦиГ СО РАН ( n = 4, масса 45–55 кг) согласно этическим нормам, регламентирующим эксперименты на животных и в соответствии с международными и российскими нормативны-
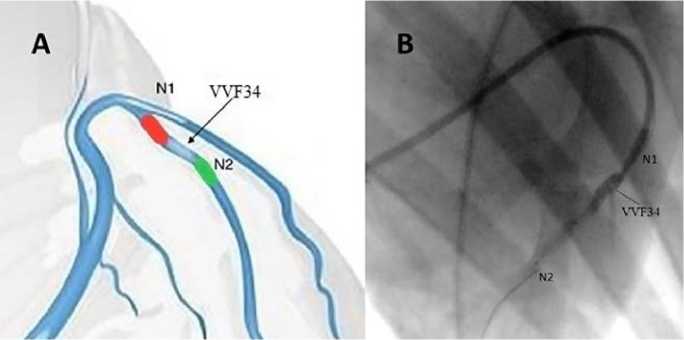
Рис. 1. Схема расположения баллонов в ходе эксперимента (А) и контрольная флюорограмма (B) в момент инъекции VVF34:
N1 – проксимальный баллон; N2 – дистальный баллон;
VVF34 – область введения склерозирующей композиции
ми правовыми документами (Европейская конвенция о защите позвоночных животных, используемых для экспериментов или в иных научных целях: EST № 123 от 18 марта 1986 г., Страсбург; Приказ Минздрава России от 18 мая 2021 г. № 464н «Об утверждении Правил проведения лабораторных исследований»; ГОСТ 33044– 2014 «Межгосударственный стандарт. Принципы надлежащей лабораторной практики»). Исследование также было одобрено локальной биоэтической комиссией ФГБУ «НМИЦ им. ак. Е.Н. Мешалкина» Минздрава России (протокол № 2 от 30 июня 2025 г.).
Подготовка животных и анестезия
За 12 ч до операции животное переводили на голодную диету со свободным доступом к воде. В день операции после седации телазолом (7–10 мг/кг, в/м) и перемещения в предоперационную животным проводили санитарную обработку операционного поля, а в ушную вену устанавливали периферический катетер подходящего диаметра. Затем мини-свиней переносили на операционный стол и закрепляли в положении «на спине».
Оперативные вмешательства у животных проводили в условиях специализированной ветеринарной операционной под общим наркозом, с соблюдением правил асептики и антисептики. После миорелаксации (пропофол 4–6 мг/кг + рокуроний 0,8–1,0 мг/кг, в/в), животное интубировали эндотрахеальной трубкой № 8 и переводили на искусственную вентиляцию легких аппаратом Fabius (Draeger, Германия) газовоздушной смесью кислород-воздух (1:1) с добавлением 3–4 % (по объему) севофлюрана. ЭКГ-датчики крепили таким образом, чтобы не препятствовать нормальному обзору при рентгеноскопических исследованиях. Пульсоксиметрический датчик крепили на хвост или за язык. Через катетер, установленный пункционным способом в бедренную вену, собрали показатели периферического артериального давления.
Вышеперечисленные витальные параметры визуализировали в реальном времени с помощью монитора V26E (Philips, Германия). Поддержку кровообращения на всем протяжении операции осуществляли внутривенным введением кристаллоидного раствора Стерофундин (B.Braun, Россия). Объем инфузии определялся ветеринарным врачом согласно массо-ростовым параметрам животного и данным объективного мониторинга.
Эндоваскулярный хирургический этап
Животным в наружную яремную вену надключичным доступом на некотором расстоянии устанавливали два интродьюсера диаметром 8 Fr (проксимальный и дистальный). Через проксимальный интродьюсер с помощью направляющего катетера 7 Fr селективно катетеризировали коронарный синус баллонным катетером Свана – Ганца 4 Fr. После раздувания расположенного на кончике катетера баллона введением раствора контрастного вещества с 0,9 % раствором натрия хлорида (1:1) выполняли контрастирование коронарного синуса и приносящих сосудов. На основании полученных флюорограмм выбирали целевую вену для введения VVF34.
Под контролем рентгеноскопии в выбранную коронарную вену на гидрофильном проводнике 0,014 дюйма проводили баллонный катетер («дистальный баллон»). Затем через дистальный интродьюсер аналогичным образом устанавливали второй катетер («проксимальный баллон») (рис. 1).
В качестве баллонных катетеров использовали либо 2-просветные проводниковые баллонные катетеры для коронарной ангиопластики размером 3,5 × 15,0 мм типа Euphora (Medtronic, США), либо педиатрические 2-просветные катетеры Свана – Ганца 4 Fr.
После позиционирования катетеров выполняли раздувание дистального баллона, а через проксимальный баллон в просвет вены вводили контраст-
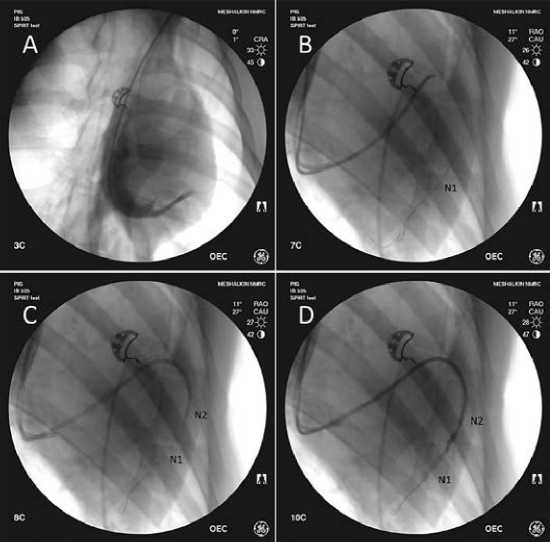
Рис. 2. Этапы установки баллонных катетеров, данные флюороскопии:
А – катетеризация и контрастирование коронарного синуса;
B – проведение баллона N2 в дистальный сегмент вены на проводнике;
C – установка баллона N1;
D – контрольное контрастирование через баллон N1 для контроля рефлюкса;
N1 – дистальный баллонный катетер;
N2 – проксимальный баллонный катетер
ное вещество для контроля прекращения кровотока. Достигнув полной обтурации вены, проксимальный баллон располагали на расстоянии 1–2 см от дистального баллона, раздували его и вводили 1 мл VVF34. Через 10 мин экспозиции баллоны сдували и удаляли вместе с интродьюсером, завершая операцию. После выполнения гемостаза и пробуждения животных перемещали в вольер для наблюдения. Через 1 или 3 месяца наблюдения мини-свиней подвергали эвтаназии и забирали материалы для гистологических исследований.
Гистологические исследования
Фрагменты миокарда с коронарными венами в предполагаемой области инъекции фиксировались 20-кратным избытком (по объему) 10 % забуферен-ного формалина (Биовитрум, Россия) в течение 48 ч. Затем материал подвергался гистологической проводке и заливке в парафиновые блоки по общепринятой методике. Из парафиновых блоков на ротационном микротоме HM340E (Microm, Германия) готовились срезы толщиной 5 мкм, которые окрашивались гематоксилином и эозином и по Ван Гизону (наборами реагентов Биовитрум, Россия) согласно рекомендациям производителя и заключались под покровные стекла в монтирующей среде BioMount (Биовитрум, Россия). Гистологический анализ выполнялся с помощью микроскопа Axioskop 40FL (Carl Zeiss, Германия), оснащенного цветной фотокамерой ADF Pro 08 и программным обеспечением ADF ImageCapture (ADF Optics, Китай).
Результаты
Клинические результаты операции
В ходе эксперимента все животные благополучно перенесли процедуру химической абляции миокарда без интраоперационных осложнений. В послеоперационном периоде не было зарегистрировано значимых изменений в общем состоянии, поведенческих реакциях или показателях жизненно важных функций. Клинический мониторинг в течение периода наблюдения не выявил местных воспалительных реакций, системных побочных эффектов или иных нежелательных явлений, связанных с применением композиции VVF34 и «мультибаллонной» техники.
Особенности процедуры
Процедуры были выполнены четырем экспериментальным животным. Первоначально для катетеризации венозного синуса планировали использовать проводниковые (over-the-wire, OTW) баллонные катетеры для коронарной ангиопластики. Но стенка венозного сосуда сердца мини-свиней более тонкая и податливая, чем у коронарной артерии, поэтому удобнее использовать катетеры с мягкими баллонами из силикона, а не проводниковые баллоны для коронарной ангиопластики, выполненные из более жестких PEBAX, нейлона или полиэтилентерефталата (рис. 2).
Выбор катетеров Свана – Ганца с мягкими силиконовыми баллонами обусловлен их способностью легко адаптироваться к геометрии венозного русла, ми-
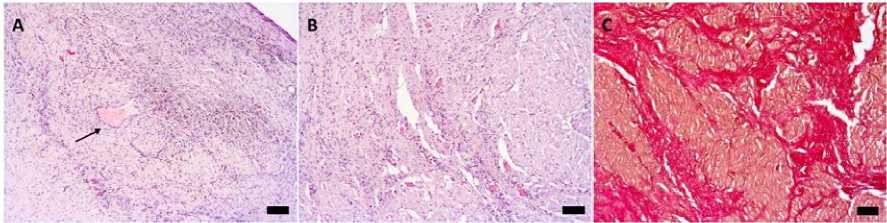
Рис. 3. Последствия склерозирования миокарда через 1 месяц после инъекции VVF34, окраска гематоксилином и эозином (А, B), по Ван Гизону (C), размерная линейка – 200 мкм: А – участок склероза в эпикарде по ходу вены (стрелка) и склерозированный нервный ствол; B – участок склероза с лимфоидной инфильтрацией и капиллярами de novo; C – крупноочаговый заместительный кардиосклероз
нимизируя риск травматизации стенки сосуда. Кроме того, эластичность силикона позволяет равномерно распределять давление при раздувании, что особенно важно при работе с тонкими венозными структурами.
Для обеспечения точной локализации инъекции применялась методика «мультибаллонной» окклюзии – проксимальный и дистальный баллоны фланкировали целевой сегмент вены, создавая замкнутое пространство для введения склерозирующей композиции VVF34. Такой подход позволил исключить системное распространение препарата и добиться строго локального воздействия на подлежащий миокард.
Морфогистологические находки
В исследуемых срезах левого предсердия и левого желудочка животных после 1 месяца наблюдения обнаружена диффузная воспалительная инфильтрация эпикарда с очаговой пролиферацией мезотелия. Встречаются участки фиброзного перерождения миокарда с большим количеством новообразованных сосудов, гранулы гемосидерина, скопления лимфоцитов и макрофагов. Отмечается большое количество нервных ганглиев и стволов, часть из которых «замурованы» в фиброзную ткань, часть с заместительным скле- розом. Эпикардиальные вены с очаговым утолщением интимы за счет плотной фиброзной ткани (рис. 3).
В миокарде отмечается диффузная лимфоидная инфильтрация, распространяющаяся вплоть до эндокарда, местами в виде отдельных клеток, местами с формированием скоплений (в основном в прилежащих к интрамуральным венам участках). Встречаются различной величины очаги заместительного кардиосклероза, распространяющиеся по ходу сосудов, с наибольшей распространенностью по ходу внутримио-кардиальных вен.
Через 3 месяца в исследуемых срезах воспалительная инфильтрация эпикарда и пролиферация мезотелия переходила от диффузной к очаговой форме. Размер участков фиброзного перерождения увеличивался, отдельные очаги «сливались» вместе, сохранялось большое количество новообразованных сосудов, число лимфоцитов и макрофагов снижалось. Нервные ганглии и стволы были склерозированы или «замурованы» в фиброзную ткань. Стенки эпикардиальных вен утолщались за счет формирования плотной фиброзной ткани (рис. 4).
В контрольных материалах, полученных из областей миокарда не подвергавшихся химической абля-
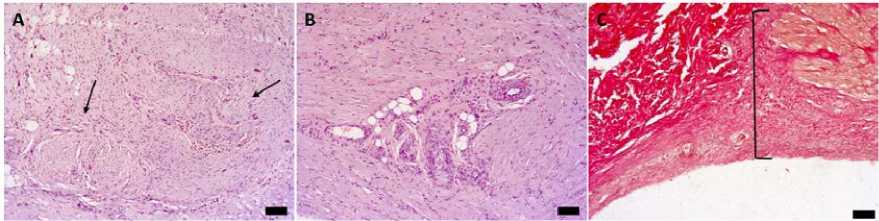
Рис. 4. Фиброз миокарда через 3 месяца после инъекции VVF34, окраска гематоксилином и эозином (А, B), по Ван Гизону (C), размерная линейка – 200 мкм: А – склероз в эпикарде по ходу вены (стрелки);
B – периваскулярный склероз в миокарде левого желудочка; C – гомогенный заместительный кардиосклероз (скобка)
ции, в исследуемых срезах левого предсердия и левого желудочка воспалительной реакции и изменений структуры венозных стенок не обнаружено. Граница с перикардом четкая, внутримиокардиальные сосуды и соединительнотканные септы нормального строения, миокард отличается неравномерным отеком, эндокард тонкий, равномерный по толщине (данные не приведены).
Обсуждение
Проведенное экспериментальное исследование подтверждает принципиальную возможность осуществления химической абляции миокарда путем доставки склерозирующей композиции в изолированный баллонами сегмент коронарной вены сердца. Полученные данные подтверждают первоначальную гипотезу о том, что VVF34 способен диффундировать через стенку вены и вызывать фиброзное перерождение прилегающего миокарда, что отлично коррелирует с результатами, полученными ранее при проведении основной массы доклинических испытаний.
Основной предполагаемый механизм воздействия заключается в комбинации нескольких факторов. Во-первых, основной компонент VVF34 – этанол, известный дегидратирующий и денатурирующий агент – вызывает коагуляцию белков и фиброз клеток эндотелия и гладкой мускулатуры венозной стенки, повышая ее проницаемость [13]. Во-вторых, дальнейшая диффузия компонентов VVF34 в интерстиций миокарда приводит как прямому, так и к непрямому цитотоксическому действию на кардиомиоциты предельными спиртами и продуктами их метаболизма.
Окклюзия участка вены баллонными катетерами является важным элементом методики, так как не только предотвращает вымывание VVF34 в системный кровоток, но и создает временный стаз, способствуя более длительному контакту склерозирующей композиции со стенкой сосуда и ее более глубокому проникновению в миокард [14].
Предлагаемый метод занимает промежуточное положение между эндокардиальной/эпикардиальной РЧА и трансартериальной химической абляцией, потенциально сочетая преимущества обоих подходов. В отличие от РЧА, эффективность которой ограничена глубиной проникновения энергии, диффузия компонентов VVF34 не зависит от теплопроводности ткани и может воздействовать на глубокие и эпикардиальные субстраты, недоступные для стандартного катетера. По сравнению с трансартериальной химической абляцией трансвенозный подход обеспечивает несравненно более высокую селективность. Поражение формируется не в бассейне артерии, который может быть обширным, а строго в зоне, прилегающей к вене, что минимизирует объем некротизированной ткани и снижает риск нарушения глобальной сократительной функции сердца.
Наиболее очевидным применением данной методики является лечение желудочковых тахикардий, аритмогенный субстрат которых (постинфарктные рубцы, фиброз при кардиомиопатиях) локализован в области прохождения коронарных вен, таких как большая вена сердца или ее ветви. Кроме того, метод может оказаться высокоэффективным для абляции фокусов предсердных тахикардий или изолированных желудочковых экстрасистол, источник которых находится вблизи венозных синусов. Важным преимуществом является возможность интеграции методики в стандартные процедуры электрoфизиологического картирования и катетерной абляции.
Основным ограничением настоящего исследования является его экспериментальный характер и необходимость проведения расширенных исследований на крупных животных моделях с хронической сердечной недостаточностью и индуцированной аритмией для оценки не только эффективности абляции, но и долгосрочной безопасности. Требуется тщательное изучение оптимальной концентрации и объема VVF34, времени экспозиции, а также оценка потенциального риска повреждения самих коронарных вен (флебосклероз, тромбоз) и соседних анатомических структур, в частности коронарных артерий, проходящих рядом с венами. Необходимы исследования по визуализации зоны поражения с помощью МРТ с контрастным усилением для точного соотнесения объема абляции с арит-могенной зоной.
Заключение
Продемонстрированная химическая абляция миокарда композицией VVF34 с применением метода трансвенозной доставки баллонными катетерами представляет собой перспективный, высокоселективный и минимально инвазивный подход к лечению резистентных сердечных аритмий. Полученные результаты обосновывают перспективность данного метода и необходимость дальнейших доклинических и клинических исследований для внедрения этой методики в арсенал современной интервенционной кардиологии и аритмологии.


