Локальные свойства электронной плотности и раман-спектры комплексов молекулярного йода
Автор: Булатова Люция Марсельевна, Юшина Ирина Дмитриевна, Барташевич Екатерина Владимировна
Журнал: Вестник Южно-Уральского государственного университета. Серия: Химия @vestnik-susu-chemistry
Рубрика: Неорганическая химия
Статья в выпуске: 4 т.6, 2014 года.
Бесплатный доступ
Для молекулярных комплексов, содержащих тиокарбонильную группу, участвующую в галогенной связи S…I-I, выполнен теоретический квантово-топологический анализ электронной плотности с позиций теории QTAIM и проведен расчет Раман-активных волновых чисел. Обнаружено, что колебание, отвечающее галогенной связи S…I, носит составной характер. Установлена количественная взаимосвязь между волновыми числами, соответствующими валентным колебаниям связей I-I в комплексах, и электронной плотностью и плотностью кинетической энергии электронов в критических точках связей I-I.
Галогенные связи, молекулярные комплексы йода, раман-спектроскопия, электронная плотность
Короткий адрес: https://sciup.org/147160297
IDR: 147160297 | УДК: 541.65,
Текст научной статьи Локальные свойства электронной плотности и раман-спектры комплексов молекулярного йода
Комплексы молекулярного йода с органическими лигандами отличаются структурным многообразием и имеют широкое практическое применение [1]. Соединения молекулярного йода, олиго- и полийодиды представляют немалый интерес при разработке новых материалов, обладающих пластичностью [2], низкотемпературными проводящими свойствами [3].Комплексы йода с органическими лигандами, такими как тетратиофульвален, феназин, представляют повышенный интерес как органические полупроводники с интересными оптическими и магнитными свойствами [4]. Неоспоримым преимуществом медицинских препаратов молекулярного йода является широчайший спектр их противомикробного действия, а также отсутствие развития резистентности микроорганизмов к элементарному йоду [5]. Комплексы йода могут выступать как интермедиаты в реакции циклизации, а молекулярный йод в них может быть связан с центрами, выступающими донорами электронов. Электронная структура таких интермедиатов может служить полезным источником химической информации, объясняющей предпочтительность направлений реакции. Отличительной особенностью межмолекулярных взаимодействий с участием йода и других галогенов является их способность образовывать направленные галогенные связи.
Галогенная связь представляет огромный интерес в области фундаментальных исследований. Она формируется между атомами – донорами электронов: азотом, кислородом, серой и атомами галогенов. Простое и исчерпывающее определение галогенной связи как нековалентного взаимодействия, в котором атом галогена выступает акцептором электронной плотности, дано в [6].
Свойства галогенных связей с успехом могут изучаться с позиций QTAIM (квантовой теории атомов в молекулах) [7]. Данный подход включает топологический анализ функции электронной плотности ρ( r ), полученной с помощью квантово-химических расчетов или в ходе прецизионного дифракционного эксперимента.
Объектами исследования в данной работе являются электронные характеристики ковалентной связи I–I в молекулярных комплексах йода с гетероциклами, содержащими тиокарбонильную группу [8–17]. Также мы рассмотрим электронные и структурные изменения, которые происходят при вовлечении молекулы йода в галогенную связь S…I [18–19] с тиокарбонильной серой, находящейся в составе гетероцикла.
Спектроскопия комбинационного рассеяния, или Раман-спектроскопия [20–21] позволяет исследовать колебательные и вращательные переходы. Поскольку правила отбора отличаются от принятых в ИК-спектроскопии, информация, получаемая с помощью Раман-спектров, часто бывает полезной при оценке структурных данных. Слабые аддукты молекулярного йода обычно бывают представлены только одним пиком в Раман-спектре в диапазоне значений 160–180 см–1 [22]. При этом наблюдаемые волновые числа могут мало отличаться от значений, зафиксированных для асимметричных трийодид-анионов [11]. Кроме того, группы Sе…I–I, S…I– I и I–…I–I дают очень похожие Раман-спектры. Этот факт может приводить к путанице при идентификации трийодид-аниона в присутствии нейтрального продукта присоединения и наоборот. Таким образом, задача отнесения Раман-активных колебаний и идентификации относительно сильных галогенных связей С=S…I–I по данным Раман-спектров в комплексах галогенов, содержащих тиокарбонильную группу, остается актуальной задачей.
Целью данной работы явилось исследование взаимосвязи между Раман-активными колебаниями в молекулярных комплексах йода и гетероциклов с тиокарбонильной группой и расчетными характеристиками электронной плотности в области ковалентных I–I и галогенных связей S…I. Для достижения цели были поставлены следующие задачи: выполнить моделирование геометрии молекулярных комплексов с галогенными связями, произвести расчет Раман-активных волновых чисел; выполнить квантово-топологический анализ электронной плотности; исследовать взаимосвязь между спектральными данными и вычисленными локальными свойствами электронной плотности в критических точках связей I–I и S…I.
Расчетная часть
Была сформирована выборка молекулярных комплексов йода с тиокарбонильными гетероциклами из кристаллографической базы данных CSD V.5.33 [23]. Обязательным условием отбора комплексов выступало наличие галогенной связи С=S…I–I, которая характеризуется определенными геометрическими параметрами [24]. Для ряда выбранных кристаллических соединений, имеющих описанные в литературе значения экспериментально установленных Раман-активных волновых чисел для связей I–I, было проведено моделирование молекулярных комплексов с галогенными связями.
Оптимизация геометрии комплексов с йодом производилась методом Кона-Шэма в приближении B3LYP/6-311G**с помощью программного пакета Firefly 8.0.0 [25]. Провели вычисления мод колебаний, активных в Pаман-спектре, и соответствующих им волновых чисел. Для этого использовали полученную равновесную геометрию комплексов. С помощью программы Chemcraft [26] произвели визуализацию направлений атомных смещений для Раман-активных колебаний связей с участием серы и йода.
В том же приближении, в котором производилась оптимизация геометрии, для всех рассматриваемых структур комплексов были выполнены расчеты волновых функций, которые использовались для вычисления квантово-топологических характеристик электронной плотности (см. таблицу), согласно теории Бейдера QTAIM [27]. Для этой процедуры использовали программу Multiwfn 2.3 [ 28].
Обсуждение результатов
В молекулярных комплексах йода с серосодержащими гетероциклами (рис. 1, а) обнаруживаются критические точки электронной плотности (ВСР), характеризующие межмолекулярные взаимодействия в области галогенных связей S…I, а также контактов I…H, которые определяются как взаимодействия по типу закрытых электронных оболочек. На рис. 1, б проиллюстрировано кратное для йода химическое взаимодействие S…I…H, где йод выступает как акцептором (S…I), так и донором электронов (I…H). Кроме того, в ряду рассматриваемых нами соединений встречаются комплексы с бифуркатными [29] галогенными связями S…I…S: S,S-(1-сульфанил)-1,3-дитиол-4,5-диил)-дибензокарботионат·2I2,2-тио-1,3-дитиол-4-карбоновая кислота·I2, 1,3-дитиол-2-тион·I2, тиомочевина·I2, бензотиазол-2-тион·I2, дитиолдитион·I2, 5-метил-1,3,4-тиодиазолиден-2(3Н)сульфонил·2I2, N-метилбензо-тиазол-2-тион·I2, N- метилдиазолиден-2-тион·I2. Такое разнообразие структур комплексов позволяет нам наблюдать варьирующуюся прочность взаимодействий S…I в значимом диапазоне. В свою очередь, прочность галогенной связи сказывается непосредственно на изменении длины ковалентной связи I–I в комплексе. В результате мы наблюдаем (см. таблицу) слабые смещения полосы валентных колебаний йода в комплексах по сравнению с колебанием в чистом веществе кристаллического йода (180 см–1) [30]. Такая картина характерна как для экспериментальных, так и для модельных спектров комбинационного рассеяния. Наибольшее отклонение рассчитанных значений волновых чисел от экспериментально наблюдаемых [8, 11, 13–18] не превышает 14 см–1 по абсолютной величине. Коэффициент корреляции между экспериментальными и расчетными волновыми числами для связей I–I в комплексах составляет 0,95.
Расчетные и экспериментальные характеристики связи I–I
|
Соединение |
ρ( r b ), ат. ед . |
g( r b ), ат. ед. |
Расчётные волновые числа υ сalc |
Экспериментальные волновые числа υ exp |
Дополнительные сведения о кристаллической структуре |
Лите ра-тура |
|
Бензимидазол-2-тион·I 2 |
0, 058 |
0,014 |
164,6 |
160,5 |
Присутствует I 3 – |
[8] |
|
S,S-(1-сульфанил)-1,3-дитиол-4,5-диил)-ди-бензокарботионат·2I 2 *) |
0, 060 |
0,016 |
169,4 |
177,0 |
– |
[9] |
|
2-Тио-1,3-дитиол-4-карбоновая кислота·I 2 |
0, 062 |
0,017 |
174,4 |
– |
Присутствует I 2 |
[10] |
|
1,3-Дитиол-2-тион·I 2 |
0, 061 |
0,017 |
172,9 |
180,0 |
– |
[11] |
|
Тиомочевина·I 2 |
0, 057 |
0,014 |
162,4 |
– |
Присутствует I 2 |
[12] |
|
Бензотиазол-2-тион·I 2 |
0, 060 |
0,016 |
170,9 |
172,8 |
– |
[13] |
|
Дитиолдитион·I 2 |
0, 061 |
0,016 |
172,0 |
– |
– |
[14] |
|
5-Метил-1,3,4-тиодиазолиден-2(3Н)сульфонил·2I2*) |
0, 055 |
0,013 |
152,7 |
167,9 |
– |
[15] |
|
N-Метилбензотиазол-2-тион·I2 |
0, 060 |
0,016 |
169,9 |
160,5 |
– |
[16] |
|
N-Mетилдиазолиден-2-тион·I2 |
0, 060 |
0,016 |
168,9 |
157,6 |
– |
[17] |
|
6-Пропилтиоурацил ·I2 |
0, 058 |
0,015 |
166,1 |
153,0 |
– |
[18] |
|
2-(3Н)- Tиобензоксазол·2I2*) |
0, 052 |
0,012 |
176,1 |
179,0 |
Присутствует I2 |
[19] |
П рим е ча ние . * ) Р а с че тные да н ные прив еде ны для связи, непосредственно входящей во фрагмент С=S…I–I.
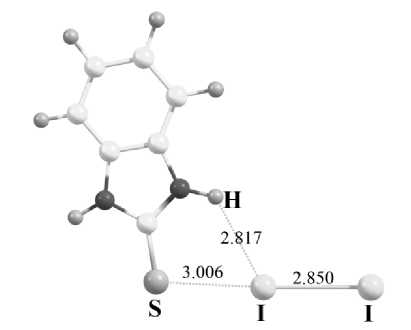
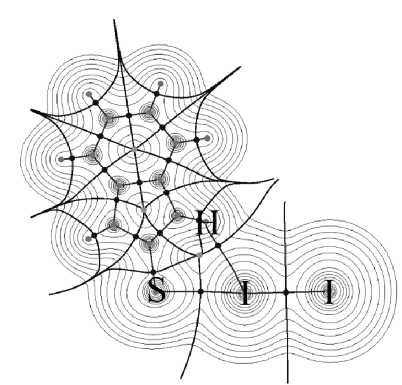
б)
Рис. 1. а) Молекулярный комплекс бензимидазол-2-тиона с йодом, где наблюдаются галогенная связь S…I и межмолекулярное взаимодействие I…H; б) Распределение электронной плотности для комплекса бензимидазол-2-тиона с йодом
a)
Как известно [24], для связей S…I нет систематизированных данных о характеристиках Раман-активных колебаний, что связано со сложностью отнесения частот в соответствующем диапазоне. Мы убедились, что в исследуемых комплексах колебания связи S…I носят составной характер. Для соединений нашей выборки в расчетных спектрах наблюдаются три Раман-активных колебания, которые укладываются в следующие диапазоны частот. Первый диапазон составляет от 48 до 98 см–1, второй от 102 до 188 см–1, третий от 216 до 359 см–1. Например, для комплекса N-метилбензотиазол-2-тион·I 2 мы наблюдаем три Раман-активных колебания, моды которых показаны на рис. 2. Волновые числа80,2 см–1 и243,3 см–1 соответствуют растяжению и сокращению связи S…I под некоторым углом. При 308,6 см–1 молекула йода остается зафиксированной, но изменяется величина угла S–I–S в молекуле гетероцикла, при этом изменяется расстояние S…I (рис. 2, в).
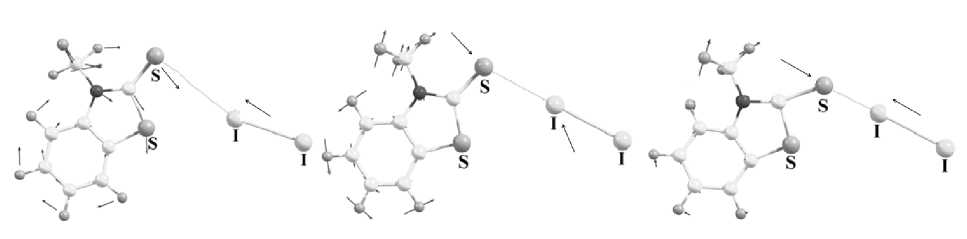
а)
б)
в)
Рис. 2. Направления мод колебаний связи S…I, соответствующих волновым числам: a) 80,2 см–1; б) 243,3 см–1; в) 308,6 см–1 для комплекса N-метилбензотиазол-2-тион · I 2
Таким образом, поскольку отнесение колебаний S…I невозможно произвести однозначно даже для расчетных Раман-спектров, мы сосредоточились на описании характеристик связи I–I, которая испытывает на себе непосредственное влияние галогенной связи в молекулярных комплексах.
Проведен анализ взаимосвязи между спектральными характеристиками нековалентных взаимодействий S…I–I и топологическими свойствами электронной плотности, отражающими прочность связывания молекулы йода в комплексах. Поскольку электронная плотность – это физическая величина, имеющая некоторое значение в каждой точке пространства и представляющая скалярное поле [9, 27], то топологические свойства такого поля рассматривают в терминах его седловых точек. Мы сосредоточились на свойствах критических точек электронной плотности (3, –1), определяющих связывающие взаимодействия [9, 27].
Нами была обнаружена количественная взаимосвязь между рассчитанными Раман-активными волновыми числами υ сalc и электронной плотностью ρ( r b ) (рис. 3, б) и плотностью кинетическойg ( r b) энергии электронов (рис. 3, а) в критических точках связей I–I. Линейная зависимость этих величин отражена в уравнениях:
υ сalc = –0,0006 + 0,0779 g( r b ); (1)
υ сalc = 0,0001 + 0,0122 ρ(rb). (2)
Параметры в уравнениях (1), (2) определены для случая, когда отклик и фактор выражены в атомных единицах энергии.
Сравнительно низкие значения расчетных волновых чисел υ сalc и электронной плотности ρ ( r b ) в критических точках связей I–I наблюдаются у таких комплексов, как тиомочевина·I 2 , 6-пропилтиоурацил·I2, бензимидазол-2-тион·I2, высокие значения характерны для 2-тиоксо-1,3-дитиол-4-карбоновая кислота·I2, 1,3-дитиолан-2-тион·I2, дитиолодитиол·I2. Для этих соединений мы наблюдаем кратное химическое взаимодействие S…I…H, а для соединений со сравнительно высокими значениями вычисленных волновых чисел (выше 170 см–1) – бифуркатные галогенные связи S…I…S.
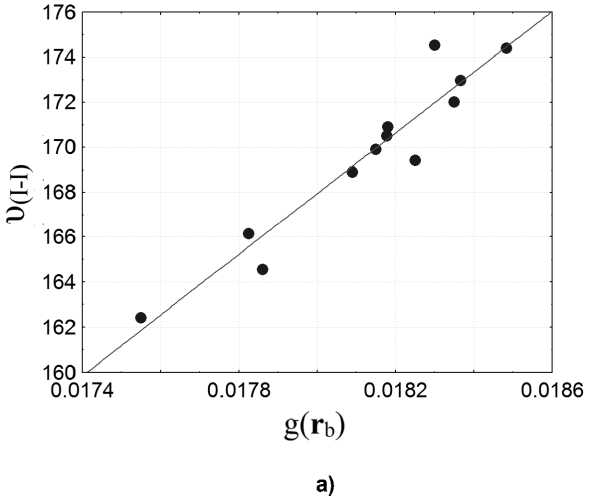
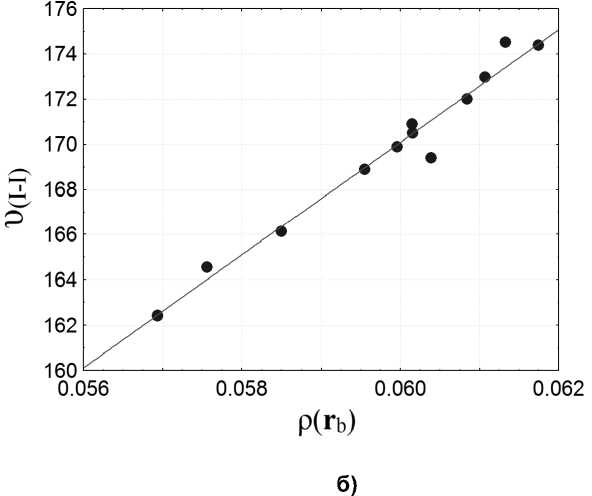
Рис. 3. а) Взаимосвязь между рассчитанными Раман-активными волновыми числами(см–1) и плотностью кинетической энергии электронов в критических точках связей I–I(ат. ед.);
б) линейная зависимость между рассчитанными Раман-активными волновыми числами (см–1) и электронной плотностью в критических точках связей I–I (ат. ед.)
При сравнении прочности комплексов, образованных с помощью ординарных, кратных и бифуркатных галогенных связей, оказывается, что комплексы с обычной ординарной галогенной связьюS…I в целом более прочные, чем комплексы с бифуркатными взаимодействиями атома галогена с атомами серы S…I…S. Данное наблюдение согласуется с результатами, обобщенными в работе [29]. Если оценивать смещение волновых чисел для валентных колебаний связи I–I относительно экспериментально наблюдаемой полосы для кристаллического йода, то оказывается, что кратные химические взаимодействия прочнее бифуркатных галогенных связей, при этом происходит большее смещение в сторону меньших волновых чисел. Таким образом, при изучении экспериментальных Раман-спектров новых соединений молекулярного йода становится возможным использовать предложенные уравнения (1, 2) для прогноза направления и величины смещения валентных колебаний связи I–I, что позволяет облегчить процедуру отнесения колебаний в данном диапазоне спектра.
Заключение
Согласно расчетным данным, Раман-активное колебание галогенной связи S…I в молекулярных комплексах йода с тиокарбонильными соединениями носит составной характер, в котором участвуют другие атомы гетероциклической системы. Это колебание может быть представлено тремя наборами волновых чисел в диапазоне от 48 до 359 см–1.
Для ковалентных связей I–I сравнение расчетных волновых чисел (В3LYP/6-311G**) с экспериментальными спектральными данными показало, что они воспроизводятся с хорошей точностью:|υ сalc – υ ехр | не превышает 14 см–1.
Обнаруженная линейная зависимость между Раман-активными волновыми числами и плотностью кинетической g( r b ) энергии электронов в критических точках связей I–I может быть полезна для количественной оценки спектральных характеристик, а также в процедурах отнесения экспериментально наблюдаемых полос в Раман-спектрах.
Работа выполнена при финансовой поддержке гранта Министерства образования и науки Российской Федерации ГЗ 729, на суперкомпьютере «ТОРНАДО», ЮУрГУ.
Список литературы Локальные свойства электронной плотности и раман-спектры комплексов молекулярного йода
- Kupper, F.C. Iodine, with Its Characteristic Purple Vapours, has Myriad Applications -From the Familiar Disinfectant to Innovative Solar Cells/F.C. Kupper, M.C. Feiters, B. Olofsson//Angew. Chem. Int. Ed. -2011. -P. 50
- Mukherjeea, A. Halogen Bonds in Some Dihalogenated Phenols: Applications to Crystal Engineering/A. Mukherjeea, G.R. Desirajua//IUCrJ. -2014. -Vol. 1. -P. 49.
- Rimma, P. Molecular Conductors and Superconductors Based on Trihalides of BEDT-TTF and Some of Its Analogues/P. Rimma, B. Yagubskii//Chem. Rev. -2004. -Vol. 104. -P. 5347-5378.
- Wu, P. Crystal Structure and Physical Properties of (TTM-TTF)-I2,/P. Wu, T. Mori, T. Enoki//Bull. Chem. Soc. Jpn. -1986. -Vol. 59. -P. 127-132.
- Berkelman, R.L. Increased Bactericidal Activity of Dilute Preparations of Povidone-iodine Solutions/R.L. Berkelman, B.W. Holland, R.L. Anderson//Journal of clinical microbiology. -1982. -Vol. 15, no. 4. -P. 635-639.
- Using Molecular Modelling to Study Interactions Between Molecules with Biological Activity/I. Alkorta, I.F. Blanco, P.M. Deya//Theor. Chem. Acc. -2010. -P. 126.
- Бейдер, Р. Атомы в молекулах. Квантовая теория/Р. Бейдер. -М.: Мир, 2001. -532 с.
- Ghada, J. Synthesis, Structural Characterization, and Computational Studies of Novel Diiodine Adducts with the Heterocyclic Thioamides/J. Ghada//Chem. Phys. Lett. -2005. -Vol. 44. -Р. 8617-8627.
- Annalisa, M. Structural and DFT Studies of Dibromine and Diiodine Adducts of a Sulfur-Rich Thiocarbonyl Donor/M. Annalisa//Chem. Phys. Lett. -2012. -Р. 2373-2380.
- Peter, J. Self-assembly of Halogen Adducts of Ester and Carboxylic Acid Functionalised 1,3-dithiole-2-thiones/J. Peter//Chem. Phys. Lett. -2006. -Р. 989-995.
- Massimiliano, A. Reactions Between Chalcogen Donors and Dihalogens Interalogens: Typology of Products and Their Characterization by FT-Raman Spectroscopy/A. Massimiliano, M. Carla Aragoni//Chem. Phys. Lett. -2006. -Р. 134.
- Constantinos, D. Synthesis and Characterization of (PTU)I2 (PTU. 6-n-propyl-2-thiouracil) and (CMBZT)I2 (CMBZT. 5-chloro-2 mercaptobenzothiazole)/D. Constantinos//Chem. Phys. Lett. -2003. -Р. 1635-1640.
- Philip, D. B. Further Structural Motifs from the Reactions of Thioamides with Diiodine and the Interhalogens Iodine Monobromide/D. B. Philip//Chem. Phys. Lett. -2000. -Р. 3106-3112.
- Vasiliki, D. Synthesis, Spectroscopic and Structural Characterization of Novel Diiodine Adducts with the Heterocyclic Thioamides/D. Vasiliki, K. Sotiris//Chem. Phys. Lett. -2002. -Р. 1718-1728.
- Lu, F. L. New Preparation of 5-(Alkylthio)-1,2-dithiole-3-thiones and a Highly Functionalized 1,3-Dithiole-2-thione/F. L. Lu, M. Keshavarz-K//Chem. Phys. Lett. -1967. -Vol. 100. -Р. 1413.
- Tamilselvi, A. Interaction of Heterocyclic Thiols-thiones Eliminated from Cephalosporins with Iodine and its Biological Implications/A. Tamilselvi, M. Govindasamy//Chem. Phys. Lett. -2010. -Р. 3692-3697.
- Cristiani, F. Charge Transfer Complexes оf Benzoxazole-2(3h)-Thione and Benzoxazole-2(3h)-Selone With Diiodine: X-Ray Crystal Structure Of Benzoxazole-2(3h)-ThioneBis(Diiodine)/F. Cristiani, F. A. Devillanova//Chem. Phys. Lett. -1995. -Р. 2937-2943.
- Definition of the Halogen Bond (IUPAC Recommendation 2013)/G.R. Desiraju, P.S. Ho, L. Kloo//Pure Appl. Chem. -2013. -Vol. 85. -P. 1711.
- Metrangolo, P. Halogen Bonding in Anion Coordination and Anion-templated Assembly/P. Metrangolo, G. Resnati//Science. -2008. -Vol. 321. -P. 918.
- Драго, Р. Физические методы в химии/Р. Драго. -М.: Мир, 1981. -424 с.
- Колесов, В.П. Основы термохимии/В.П. Колесов. -М.: Изд-во МГУ, 1996. -152 с.
- Deplano, P. Structural and Raman Spectroscopic Studies as Complementary Tools in Elucidating the Nature of the Bonding in Polyiodides and in Donor-I2 Adducts. Coordination Chemistry Reviews/P. Deplano. -1999. -P. 71-95.
- Cambridge Structural Database. Version 5.35. University of Cambridge, UK. -http://www.ccdc.cam.ac.uk/pages/Home.aspx
- Metrangolo, P.Azobenzene-based Difunctional Halogen-bond Donor: Towards the Engineering of Photoresponsive Co-crystals/P.Metrangolo, G.Resnati//IUCrJ. -2014. -P. 5-7.
- Granovsky, Alex A. Firefly version 8.0. http://classic.chem/msu.su/gran/gamess/index.html
- Г. Журко, Д. Журко. Программа Chemcraft. -www.chemcraftprog.com
- Цирельсон, В.Г. Квантовая химия. Молекулы, молекулярные системы и твердые тела: учебное пособие для вузов/В.Г. Цирельсон. -М.: БИНОМ. Лаборатория знаний, 2010. -496 с.
- Lu, T. Multiwfn: a multifunctional wavefunction analyzer/T. Lu, F. Chen//Journal of Computational Chemistry. -2012. -Vol. 33. -P. 580-592.
- Барташевич, Е.В. Взаимное влияние нековалентных взаимодействий в комплексах и кристаллах с галогенными связями/Е.В. Барташевич, В.Г Цирельсон//Успехи химии. -2014. -12 c.
- Daga, V. Synthesis, Spectroscopic and Structural Characterization of Hovel Diiodine Adducts with the Heterocyclic Thioamides, Thiazolidine-2-thione (tzdtH), Benzothiazole-2-thione (bztzdtH) and Benzimidazole-2-thione (bzimtH)/V. Daga, S.K Hadjikakou, N. Hadjiliadis, M. Kubicki, I.S. Butler. -European Journal of Inorganic Chemistry. -2002. -Vol. 7. -P. 1718-1728.


