Лучевая терапия локализованного рака гортани в режиме гиперфракционирования с равномерным дроблением дневной дозы
Автор: Семенов А.В., Гордон К.Б., Рожнов В.А., Гулидов И.А., Гоголин Д.В., Раджапова М.У., Медведева К.Е.
Рубрика: Научные статьи
Статья в выпуске: 1 т.31, 2022 года.
Бесплатный доступ
Целью исследования послужила оценка явлений ранней и поздней токсичности, непосредственных и отдалённых результатов лечения пациентов с локализованным раком гортани, получивших радикальный курс конформной лучевой терапии в режиме гиперфракционирования с равномерным дроблением дневной дозы 1+1 Гр до СОД 64-66 Гр в самостоятельном варианте. Материал представлен результатами лечения 62 пациентов с впервые выявленным, гистологически верифицированным диагнозом плоскоклеточного рака гортани T1-2N0M0. Запланированную дозу лучевой терапии получили 62 пациента. Мукозит 3 степени развился у 30 (48,3%) пациентов. У 32 (51,7%) пациентов был зарегистрирован мукозит 1-2 степени. При внутригрупповом анализе обнаружены различия в уровне ранней токсичности в зависимости от T-стадии заболевания, обусловленные объёмом облучения на первом этапе лучевой терапии (p=0,03). Кожная токсичность у 60 (96,8%) пациентов была ограничена 1-2 степенью. Влажный эпидермит зарегистрирован у 2 (3,2%) пациентов. Средний срок наблюдения за группой составил 4,4±2,3 года. Показатели общей 1-летней выживаемости составили 96,7±3,4%, 2-летней - 93,0±3,8%, 3-летней - 90,9±4,2%. Локальный и/или регионарный рецидив за весь срок наблюдения зарегистрирован у 15 (24,1%) пациентов. Уровень 1-летнего локорегионарного контроля составил 83,3±4,5%, 2-летнего - 81,4±5,7%, 3-летнего - 79,1±6,4%. Распространение опухоли на подскладочное пространство (p=0,07) и изначальный опухолевый процесс T2 (p=0,12) выделены как основные факторы, ухудшающие прогноз лечения. Поздние осложнения лучевой терапии зарегистрированы у 5 (8,0%) пациентов. Поздняя ксеростомия 2 степени через 12 месяцев после завершения лечения отмечалась у 17 (27,4%) пациентов. Все случаи поздней ксеростомии отмечались при включении в профилактический объём облучения интактных групп лимфоколлекторов шеи. Полученные данные свидетельствуют об удовлетворительной переносимости лучевой терапии в режиме гиперфракционирования. Для пациентов с относительно неблагоприятным прогнозом должны быть предложены более агрессивные варианты лечения.
Лучевая терапия, опухоли головы и шеи, гиперфракционирование, нетрадиционное фракционирование, результаты лечения, токсичность лучевой терапии, качество жизни больных, конформная лучевая терапия, мукозит, ксеростомия
Короткий адрес: https://sciup.org/170193945
IDR: 170193945 | УДК: 616.22-006.6-085.849.12
Текст научной статьи Лучевая терапия локализованного рака гортани в режиме гиперфракционирования с равномерным дроблением дневной дозы
Рак гортани – это наиболее распространённая локализация в группе злокачественных новообразований органов головы и шеи. В структуре онкологической заболеваемости рак гортани составляет 2,3% от общего числа онкологических больных. Среди мужского населения данная патология в России занимает 11 место. Риск возникновения опухоли кратно возрастает в трудоспособном возрасте 50-59 лет, что обуславливает социальную и экономическую значимость подбора оптимальной стратегии лечения для данной группы больных [1, 2].
T1-2N0M0 опухоли гортани имеют малый размер, показатели α/β=10 и, как следствие, высокую чувствительность к ионизирующему излучению, что обуславливает равноценность применяемых методов лечения: хирургической резекции опухоли и радикальной дистанционной лучевой терапии (ЛТ) [2-4]. Однако, несмотря на возможность сохранения функциональной
Семенов А.В.* – м.н.с.; Гордон К.Б. – с.н.с., к.м.н.; Рожнов В.А. – с.н.с., д.м.н.; Гулидов И.А. – зав. отд., д.м.н., проф.; Гоголин Д.В. – с.н.с., к.м.н.; Раджапова М.У. – в.н.с., к.м.н.; Медведева К.Е. – м.н.с. МРНЦ им. А.Ф. Цыба – филиал ФГБУ «НМИЦ радиологии» Минздрава России.
целостности гортани и сопоставимые с хирургическим лечением показатели общей и безреци-дивной выживаемости, стандартная схема радикальной ЛТ обладает рядом недостатков.
С увеличением степени распространённости опухоли ЛТ значительно теряет в эффективности: так, при T1 опухолях 5-летний уровень локорегионарного контроля достигает показателей 85-94%, а при T2 опухолях снижается до 70-85% [5-7].
Наиболее часто применяемые методы преодоления радиорезистентности (эскалация суммарной дозы к опухоли, проведение одновременной химиолучевой терапии, применение ускоренных режимов фракционирования) либо требуют высокого уровня технической оснащённости отделения клиники с применением наиболее современных методик лечения (IMRT, VMAT), либо неизбежно приводят к увеличению частоты и степени выраженности ранних лучевых реакций и нежелательных постлучевых осложнений. По данным Nakajima et al. [8] ЛТ локализованного рака гортани позволяет достигнуть 89% 3-летнего локорегионарного контроля. Однако за счёт явлений поздней токсичности 3-4 степени (отёк гортани, некроз хряща) сохранение органа в первые годы наблюдения возможно лишь у 82% больных.
Одновременно с этим имеется широкая доказательная база эффективности режимов гиперфракционирования для плоскоклеточного рака головы и шеи. В обновлённом мета-анализе MARCH от 2017 г. с включением 11423 пациентов, получивших разнофракционную ЛТ с двухмерным планированием в период с 1970 по 2010 гг., было установлено преимущество в 8,1% в отношении общей 5-летней выживаемости для режима гиперфракционирования в сравнении с конвенциональным режимом. В то же время преимущество нетрадиционных режимов фракционирования нивелировалось добавлением к стандартной схеме лучевого лечения симультанной химиотерапии (p=0,009) [9]. При этом прямые показания к применению комбинированного подхода в лечении локализованного рака гортани, согласно современным клиническим рекомендациям, отсутствуют [4]. Следовательно, изучение эффективности и безопасности нетрадиционных режимов фракционирования, и, в особенности режима гиперфракционирования, в свете современных методик конформной ЛТ для данной группы больных является перспективным направлением.
Несмотря на многочисленность зарубежных исследований и схожесть полученных результатов, особенно в отношении разнофракционной ЛТ, число исследований, посвящённых изучению режимов гиперфракционирования в лечении локализованного рака гортани невелико, а выборки немногочисленны. Целью настоящего исследования послужила оценка явлений ранней и поздней токсичности, непосредственных и отдалённых результатов лечения пациентов с локализованным раком гортани, получивших радикальный курс конформной ЛТ в режиме гиперфракционирования с равномерным дроблением дневной дозы.
Материалы и методы
Исследование проведено в соответствии с Хельсинкской декларацией (2013) и одобрено Этическим комитетом МРНЦ им. А.Ф. Цыба. От каждого пациента получено информированное согласие на лечение. Проведён ретроспективный анализ результатов лечения пациентов с ранним плоскоклеточным раком гортани (T1-2N0M0), получивших радикальный курс дистанционной ЛТ в режиме гиперфракционирования с равномерным дроблением дневной дозы (n=62). У всех 62 пациентов до начала лечения было получено морфологическое подтверждение диагноза плоскоклеточного рака гортани (табл. 1). Соотношение мужчин и женщин составило 11,4:1. Возраст пациентов составил от 34 до 82 лет, средний возраст – 61,4±12,2 лет. Средняя оценка общего состояния больного по шкале Карновского составила 90 баллов.
Таблица 1 Распределение больных в исследуемой группе по стадиям и локализации опухолевого процесса
|
Распространённость |
Режим гиперфракционирования |
Локализация (отдел гортани) |
|
I (T1N0) |
19 (30,6%) |
Вестибулярный – 19 (100%) |
|
II (T2N0) |
43 (69,4%) |
Вестибулярный – 23 (53,4%) Вестибулярный+подскладочный – 14 (32,7%) Подскладочный – 6 (13,9%) |
|
Всего |
62 |
Объём облучения выбирали согласно современным клиническим рекомендациям и стадии опухолевого процесса. У пациентов с T1N0M0 опухолями в объём облучения включали опухоль гортани с необходимыми отступами на клинический и планируемый объём мишени с подведением к объёму радикальной дозы. У пациентов с T2N0M0 опухолями гортани лечение проводилось в два этапа: на первом этапе облучению подвергалась первичная опухоль с включением интактных лимфоколлекторов шеи II, III, IVa групп, VI группы при распространении в подскладочное пространство. На втором этапе объём облучения сокращался до первичной опухоли с отступами на CTV и PTV [10].
Сеансы облучения проводили на аппарате Electa Synergy-s. Пример планирования представлен на рис. 1.
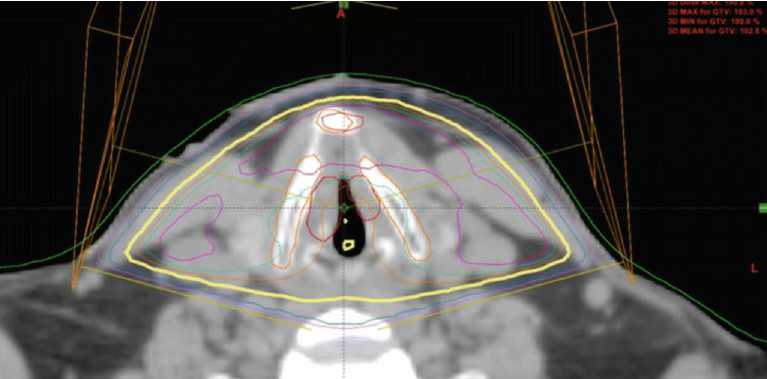
Рис. 1. Пациент К. Рак гортани T1N0M0. Пример дозиметрического плана с использованием клиньев, многолепесткового коллиматора.
Лучевая терапия проводилась в режиме гиперфракционирования с равномерным дроблением дневной дозы. РОД составляла 1+1 Гр с 5-6-часовым интервалом между фракциями. Облучение интактных групп лимфоколлекторов шеи проводилось до СОД 40-50 Гр (медианная СОД 46 Гр). СОД на первичную опухоль составила от 64 до 66 Гр (медианная СОД 66 Гр).
Были использованы методики конформного облучения (3DCRT), трёхмерного планирования, трёхмерной визуализации мишени. Верификацию положения пациента в процессе лечения проводили еженедельно. Оценку степени регресса опухоли проводили по шкале RECIST 1.1 через 3 мес. после окончания курса ЛТ на основании данных ларингоскопии, выполнения ультразвукового исследования лимфоузлов шеи, при необходимости – компьютерной томографии и позитронно-эмиссионной томографии с 18F-фтордезоксиглюкозой. Последующие контрольные исследования выполняли раз в 3 мес. в течение первого года, далее – 1 раз в 6 мес.
В исследовании оценивали показатели ранней токсичности лечения, его переносимости, показатели общей выживаемости и локорегионарного контроля в зависимости от применяемого режима ЛТ и степени распространённости опухолевого процесса. Кумулятивную общую и безре-цидивную выживаемость оценивали по методу Каплана-Майера, исследуемые группы сопоставлялись по long-rank test. Зависимость времени дожития от независимых переменных оценивали с применением регрессионного анализа Кокса.
Результаты
Средний срок наблюдения за группой составил 4,4±2,3 года, медиана наблюдения – 4 года. 100% пациентов получили запланированную дозу лучевой терапии. Ранние лучевые реакции в процессе лечения развились у 100% пациентов. Мукозиты 3 степени по шкале RTOG/EORTC развились у 30 (48,3%) пациентов. У 32 (51,7%) пациентов был зарегистрирован мукозит 1-2 степени. При внутригрупповом анализе обращают на себя внимание различия в уровне ранней токсичности в зависимости от T-стадии заболевания. В группе пациентов с T1-опухолями доля мукозитов 3 степени составила 26,3% (4 пациента), у пациентов с T2-опухолями – 58,1% (25 пациентов), p=0,03. Кожная токсичность у 60 (96,8%) пациентов была ограничена 1-2 степенью. Влажный эпидермит зарегистрирован у 2 (3,2%) пациентов.
Непосредственные результаты лечения оценивали через 3 мес. после завершения курса ЛТ. Остаточная опухоль или продолженный рост к моменту первого контрольного обследования были диагностированы у 7 (11,2%) пациентов, признаки отдалённого метастазирования в сочетании с остаточной опухолью – у 1 (1,6%) пациента. Показатели общей 1-летней выживаемости составили 96,7±3,4%, 2-летней – 93,0±3,8%, 3-летней – 90,9±4,2% (рис. 1). Локальный и/или регионарный рецидив за весь срок наблюдения зарегистрирован у 15 (24,1%) пациентов. Уровень 1-летнего локорегионарного контроля составил 83,3±4,5%, 2-летнего – 81,4±5,7%, 3-летнего – 79,1±6,4% (рис. 2).
Проведён анализ неудач лечения. У 3 (4,8%) пациентов в процессе динамического наблюдения развился локальный рецидив в сочетании с регионарными метастазами, у 11 (11,7%) пациентов – изолированный локальный рецидив, у 1 (1,6%) пациента – локальный рецидив опухоли с отдалёнными метастазами в лёгких. Уровень 3-летней общей выживаемости с сохранением функциональной целостности гортани составил 80,6±5,6%.
Проведён внутригрупповой анализ факторов, влияющих на эффективность ЛТ. Худшие показатели локорегионарного контроля зарегистрированы в группе пациентов с T2-опухолями (p=0,12), распространением опухоли на подскладочное пространство (p=0,07) (рис. 2, 3).
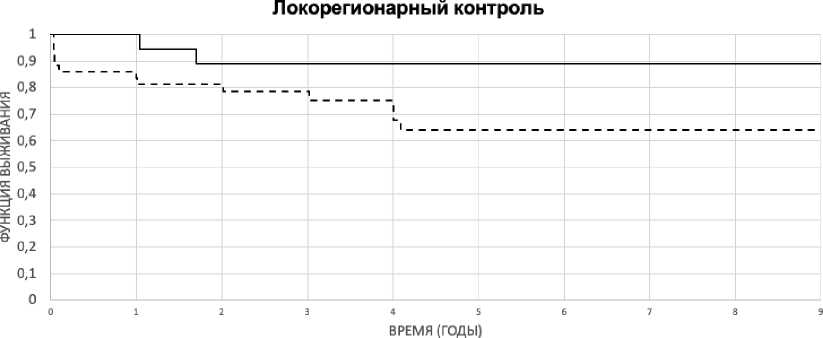
----Т1---Т2 Р=0,12
Рис. 2. Показатели локорегионарного контроля в зависимости от степени распространённости опухолевого процесса (p=0,12).
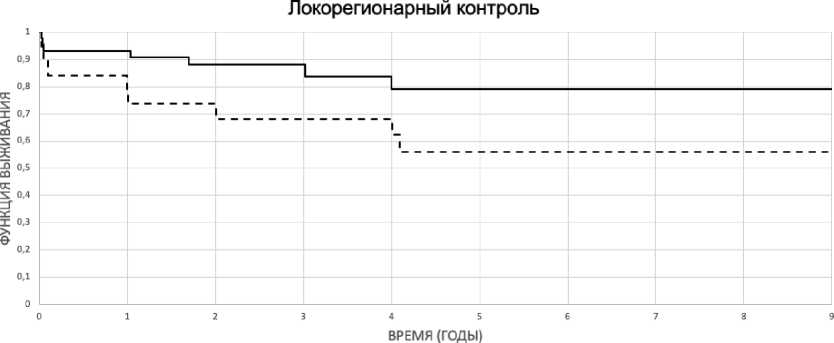
---подскладочное распространение - нет — -подскладочное распространение - есть Р=0,07
Рис. 3. Показатели локорегионарного контроля в зависимости от распространения опухоли на подскладочное пространство гортани (p=0,07).
Поздние осложнения ЛТ 3-4 степени зарегистрированы у 5 (8,0%) пациентов. У 1 пациента диагностирована лучевая язва, у 3 пациентов – хондроперихондрит гортани, у 1 пациента – выраженный фиброз кожных покровов. Поздняя клинически значимая ксеростомия, затрудняющая приём твёрдой пищи без дополнительной жидкости, через 12 мес. после завершения лечения отмечалась у 17 (27,4%) пациентов. Все случаи поздней ксеростомии зарегистрированы в группе пациентов с T2-опухолями, с облучением интактных групп лимфоколлекторов шеи на первом этапе лучевой терапии.
Обсуждение
Несмотря на наличие результатов крупных рандомизированных исследований, доказывающих преимущество нетрадиционных режимов фракционирования над конвенциональными курсами ЛТ для опухолей головы и шеи, клинический интерес к ним, и в особенности к режимам гиперфракционирования, остаётся на довольно низком уровне. При этом продолжают выходить научные работы и клинические рекомендации по применению режимов ускоренного облучения и гиперфракционирования, доказывающие перспективность направления [11-13].
Результаты нашего исследования демонстрируют, что применение ЛТ в режиме гиперфракционирования, даже при некоторой деэскалации суммарной биологически эффективной дозы относительно конвенционального режима, является эффективным методом лечения пациентов с локализованным раком гортани, а профиль токсичности выбранного режима и достигнутые показатели общей и безрецидивной выживаемости сопоставимы с международным и отечественным клиническим опытом.
Ввиду равноценности радикальной ЛТ и хирургического лечения для раннего рака гортани наиболее актуальной проблемой остаётся определение прогностических факторов, влияющих на качество жизни больных. В проведённом исследовании сохранения функциональной целостности гортани удалость достичь для 80,6% больных. При этом локальные рецидивы, приводящие к ларингэктомии, значительно чаще развивались у пациентов с T2-опухолями с распространением в подкладочное пространство. Сохранение органа при локализованном процессе является приоритетом, поэтому для данной группы пациентов требуются более интенсивные схемы лечения с подведением большей суммарной дозы или сочетанием ЛТ с симультанной/индукционной химиотерапией.
Проведённый статистический анализ указывает на двукратное увеличение частоты мукозитов 3 степени у пациентов с T2-опухолями. Однако данные различия обусловлены в первую очередь не размером и локализацией опухолевого образования, а объёмом облучённых тканей на первом этапе лечения. Средний объём PTV_1 для пациентов с T1-опухолями составил 40,7 см3, для пациентов с T2-опухолями – 221 см3.
Важной проблемой конформной ЛТ без модуляции интенсивности остаётся высокая лучевая нагрузка на слюнные железы. В нашей работе поздняя ксеростомия зарегистрирована исключительно у пациентов с включением профилактического объёма лимфоколлекторов шеи II-IVa(VI) групп. Частота встречаемости клинически значимой ксеростомии в ней составила 39,5%. В работе Nguyen et al. продемонстрировано двукратное преимущество IMRT над стандартной конформной терапией (53% против 26%) при билатеральном облучении лимфоколлек-торов шеи [14]. В исследовании Lamberecht et al. вместе со снижением частоты ранних мукозитов 3 степени и выше проведение ЛТ с модуляцией интенсивности снижало частоту поздней ксеростомии 2+ степени с 68% до 23% [15]. Данные указывают на необходимость технического совершенствования методов облучения с целью повышения качества жизни больных.
Заключение
Лучевая терапия локализованного рака гортани в режиме гиперфракционирования с равномерным дроблением дневной дозы 1+1 Гр в самостоятельном варианте является эффективным методом с приемлемым уровнем ранней токсичности лечения. Полученные результаты в отношении показателей общей и безрецидивной выживаемости сопоставимы с общемировыми данными. 100% пациентов, получивших лечение, перенесли его, получив запланированную дозу. Пациенты с распространением опухоли на подскладочное пространство имеют менее благоприятный прогноз. Следовательно, для них могут быть предложены более интенсивные схемы лучевой терапии с увеличением суммарной очаговой дозы или добавления симультанной/индукци-онной химиотерапии.


