Лучевая терапия нерезектабельного рака гортани
Автор: Гордон Константин Борисович, Гулидов Игорь Александрович, Рожнов Виталий Анатольевич, Андреев Вячеслав Георгиевич, Подлесных Наталья Ивановна, Панкратов Владимир Александрович
Журнал: Сибирский онкологический журнал @siboncoj
Рубрика: Опыт работы онкологических учреждений
Статья в выпуске: 3 (75), 2016 года.
Бесплатный доступ
Представлены результаты лучевого лечения нерезектабельного плоскоклеточного рака гортани. Проанализированы методики самостоятельной лучевой терапии и одновременного химиолучевого лечения, а также влияние изменения режима фракционирования на результаты лечения в целом. Исходя из полученных данных, можно сделать вывод, что между методами только лучевой и химиолучевой терапии нет достоверных различий в показателях как общей выживаемости, так и локорегионарного контроля (p
Нерезектабельный рак гортани, лучевая терапия, химиолучевая терапия, гиперфракционирование
Короткий адрес: https://sciup.org/140253942
IDR: 140253942 | УДК: 616-006.61 | DOI: 10.21294/1814-4861-2016-15-3-72-77
Текст научной статьи Лучевая терапия нерезектабельного рака гортани
Повышение эффективности лечения пациентов с нерезектабельными формами рака гортани является сложной и актуальной проблемой современной клинической онкологии. Количество пациентов с запущенными формами рака гортани в России за последние 10 лет выросло и достигает 17 % [4]. Чаще всего этой группе больных предлагается только паллиативное лечение, в частности химиотерапия [5]. Однако опыт отечественных и зарубежных исследователей свидетельствует о высокой эффективности ионизирующего излучения на опухоли гортани [1, 6, 7, 10].
Целью исследования являлась сравнительная оценка эффективности самостоятельной лучевой терапии (ЛТ) и лучевого лечения с одновременной радиосенсибилизирующей химиотерапией, а также оценка эффективности лечения в зависимости от использованного режима фракционирования ЛТ.
Материал и методы
В исследование включен 151 больной с морфологически верифицированным плоскоклеточным раком гортани, получавшие лучевую терапию в качестве основного метода лечения в клинике МРНЦ с 1980 по 2013 г. При этом 75 (49,7 %) пациентам проведен курс самостоятельной лучевой терапии, 76 (50,3 %) - одновременное химиолу-чевое лечение.
В Центре используются следующие критерии нерезектабельности: прорастание опухолью магистрального шейного сосудисто-нервного пучка, сосцевидного отростка, основания черепа или шей- ных позвонков, определяемое как при визуальном осмотре пациента, так и с помощью лучевых методов диагностики. Нерезектабельность опухоли по первичному очагу (T4bN1-3) была зарегистрирована у 105 (69,5 %) пациентов, нерезектабельные метастазы в регионарные лимфоколлекторы (T1-4N3) - у 18 (12,0 %) больных, нерезектабельность опухоли в связи с распространенностью T4bN3 - у 28 (18,5 %) пациентов.
В исследовании было использовано несколько режимов фракционирования лучевой терапии. У 71 (47,0 %) больного лучевая терапия проводилась в режиме традиционного (конвенционального) фракционирования, РОД 2,0 Гр, суммарная очаговая доза варьировалась от 50 до 60 Гр. У 43 (28,5 %) пациентов облучение проводилось по схеме гиперфракционирования. Дневная доза облучения подводилась дважды с 4–5-часовым перерывом (1 + 1 Гр), СОД составляла 50–60 Гр. Третью группу составили 37 (24,5 %) пациентов, получивших ЛТ в режиме условно-динамического фракционирования, когда 2 раза в неделю подводили 5 Гр до СОД 20 Гр, затем ежедневно, методом традиционного фракционирования – по 2 Гр до СОД 52 Гр.
Лечение проводилось на гамма-терапевтических установках с источником 60Co (АГАТ-Р, АГАТ-М, РОКУС-АМ, TERABALT), а также на линейных ускорителях (PHILIPS SL-20, PHILIPS SL-75). В поле облучения включались первичная опухоль и регионарные лимфоколлекторы шеи II–IV уровня при N 0 , II-V уровня при N + . Лучевая нагрузка на органы риска определялась согласно международным
Схемы и режимы радиосенсибилизирующей полихимиотерапии подбирались индивидуально, исходя из клинической ситуации и соматического состояния пациента. Использовались препараты платины (цисплатин, карбоплатин), 5-фторурацил, циклофосфан, винкристин и блеомицин. Большинство (61,8 %) пациентов получили курс радиосенсибилизирующей химиотерапии по схеме, включающей препараты винкристин, цисплатин, циклофосфан и блеомицин.
Изучены одно-, трех- и пятилетняя общая выживаемость и локорегионарный контроль, а также непосредственная эффективность лечения больных нерезектабельным раком гортани, получивших курс лучевого лечения и ЛТ на фоне одновременной химиотерапии. Анализ выживаемости произведен по методу Каплана – Майера, статистическую достоверность кривых выживаемости и локорегионарного контроля сравнивали по критерию лог-ранк. Оценка степени регрессии производилась согласно рекомендациям RECIST 1.1.
Результаты исследования
В группе больных, получавших только лучевое лечение, объективный ответ опухоли был достигнут в 47 (62,7 ± 5,6 %) случаях. При этом у 18 пациентов отмечена частичная регрессия, у 29 – полный ответ на лечение. При химиолучевой терапии непосредственная эффективность лечения была выше – объективный ответ зарегистрирован в 55 (72,4 ± 5,1 %) случаях, однако данные различия статистически не значимы (p<0,3). Частичная регрессия была достигнута в 22 случаях, полный ответ – у 33 пациентов.
Исходя из полученных данных, можно сделать вывод, что между методами только лучевой и хи-миолучевой терапии нет достоверных различий в показателях как общей выживаемости, так и локорегионарного контроля (p<0,8) (рис. 1). Тем не менее стоит отметить, что объективный ответ опухоли на лечение несколько выше в группе одновременного химиолучевого лечения. Переносимость лечения больными была незначительно хуже при лечении на фоне одновременной полихимиотерапии (таблица). Оценивалась максимальная выраженность лучевых реакций по совокупности двух этапов лечения.
Поскольку при применении лекарственной радиомодификации не наблюдалось преимуществ в показателях общей выживаемости и локорегионар-ного контроля, а группы были сопоставимы по локализации, степени распространенности опухоли, половому и возрастному составу пациентов, было решено оценить эффективность пространственновременной оптимизации ЛТ, т.е. при изменении режимов фракционирования. Критериями оценки также являлись показатели общей выживаемости, локорегионарный контроль и непосредственная эффективность лечения, оцениваемая через 1–1,5 мес после его окончания.
Объективный ответ опухоли в группе традиционного фракционирования достигнут у 46 (64,8 ± 5,7 %) пациентов. При этом частичная и полная регрессия образования отмечена в половине наблюдений (у 23 человек соответственно). При гиперфракционировании объективный ответ получен в 30 (69,8 ± 7,0 %) случаях, у 8 пациентов зарегистрирован частичный ответ, у 22 человек – полная регрессия новообразования. При облучении в режиме условно-динамического фракционирования объективный ответ наблюдался у 26 (70,3 ± 7,6 %) больных, из них частичная регрессия выявлена у 9, полная – у 15 пациентов.
При статистическом анализе выживаемости методом Каплана – Майера (рис. 2) отмечена тенденция к улучшению показателей общей выживаемости (p<0,1), а также достоверные данные об увеличении частоты локорегионарного контроля (p<0,05) при использовании режима гиперфракционирования. Различий в непосредственной эффективности лечения при различных режимах фракционирования не выявлено.
Обсуждение
Одной из основных проблем при изучении данной группы пациентов является определение критериев нерезектабельности, которые не стандартизованы и значительно разнятся в зависимости от принятых тактик лечения, а также в различных лечебных учреждениях [11, 17]. Дополнительными неопределенными критериями неоперабельности являются возраст больного, общее соматическое состояние, наличие сопутствующих заболеваний, согласие пациента на операцию. Данные обстоятельства затрудняют интерпретацию литературных данных.
Достижения современной радиобиологии предоставляют широкие возможности для по-
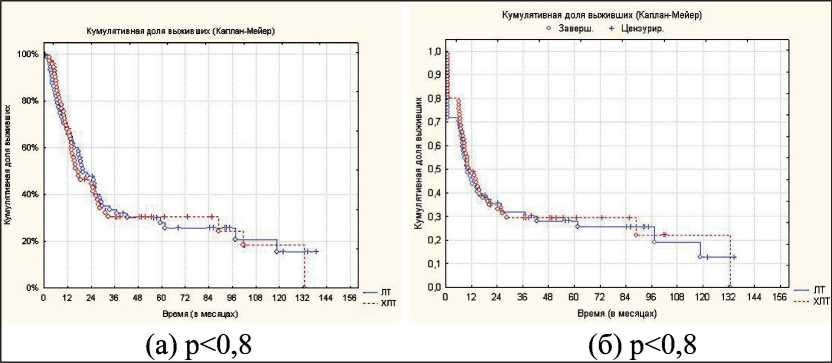
Рис. 1. Показатели общей выживаемости (а) и локорегионарного контроля (б) при лучевой и химиолучевой терапии больных с нерезектабельным раком гортани
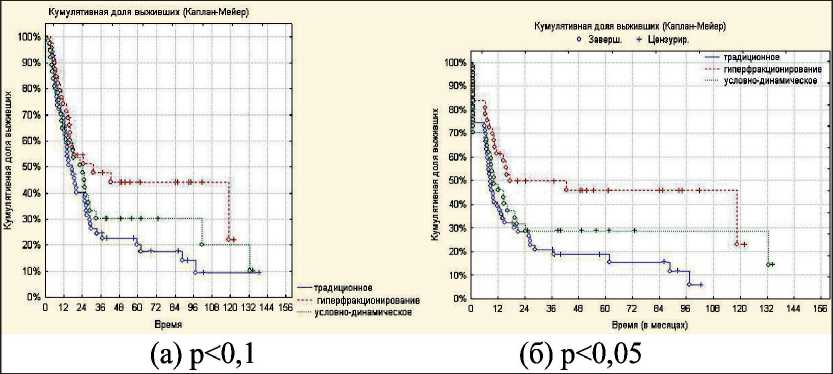
Рис. 2. Показатели общей выживаемости (а) и локорегионарного контроля (б) в зависимости от режима фракционирования при лучевой терапии больных с нерезектабельным раком гортани
вышения эффективности локального лучевого лечения с помощью радиомодификации, одним из которых является пространственно-временная оптимизация облучения – измененные режимы фракционирования, зарекомендовавшие себя при лечении опухолей различной локализации [2, 3]. Проблема перерыва ЛТ при лечении плоскоклеточных опухолей органов головы и шеи является крайне сложной и дискутабельной. Считается, что он увеличивает вероятность рецидива заболевания – от 0,6 до 2 % на каждый день перерыва свыше трех-пяти дней [15]. Тем не менее одними из ключевых факторов развития острых и поздних лучевых реакций являются объем опухолевого поражения и нерезектабельность новообразования [9, 12, 14]. Как следствие, использование сплит-курсов при ЛТ нерезектабельных опухолей органов головы и шеи является допустимой методикой, позволяющей улучшить переносимость лечения и снизить вероятность развития тяжелых осложнений, а также подвести большую дозу на опухоль [8, 13, 16].
Полученные данные показывают, что проведение одновременной полихимиотерапии больным при ЛТ нерезектабельных опухолей гортани не приносит ожидаемых результатов. Применение цитостатиков ухудшает переносимость лечения, снижая качество жизни этой тяжелой группы больных. Стоит отметить, что при проведении одновременной химиолучевой терапии несколько выше непосредственный ответ опухоли. Это свидетельствует о необходимости дальнейшего изучения данного вопроса, при использовании иных схем лекарственной радиосенсибилизации.
Использование режима гиперфракционирования ЛТ позволяет добиться полного излечения пациентов в 43 % случаев. Следует отметить экономическую целесообразность данной методики по сравнению с химиолучевым лечением, поскольку не требуется проведение дорогостоящей полихимиотерапии и сопроводительной терапии. Кроме того, самостоятельная лучевая терапия не требует обязательной госпитализации пациента, возможно ее проведение в амбулаторных условиях.
Таким образом, проведенное исследование свидетельствует об эффективности пространственновременной оптимизации лучевой терапии за счет использования нетрадиционных режимов фракционирования. Необходима дальнейшая разработка средств и методов повышения радиочувствительности нерезектабельного рака гортани.
Список литературы Лучевая терапия нерезектабельного рака гортани
- Андреев В.Г., Мардынский Ю.С. Лучевое и комбинированное лечение рака гортани. М., 1998. 116 с
- Гоголин Д.В., Мардынский Ю.С., Гулидов И.А. Результаты применения режима ускоренного гиперфракционирования в лечении немелкоклеточного рака легкого//Сборник работ «Невского радиологического форума». СПб., 2011. С. 55-56
- Гуменецкая Ю.В. Нетрадиционные режимы фракционирования при проведении дистанционной лучевой терапии у больных мышечно-инвазивным раком мочевого пузыря (обзор литературы)//Сибирский онкологический журнал. 2012. № 4. С. 63-69
- Каприн А.Д., Старинский В.В., Петрова Г.В. Злокачественные новообразования в России в 2012 году (заболеваемость и смертность). М., 2014. 250 с
- Мухамедов М.Р., Черемисина О.В., Чойнзонов Е.Л., Кульба-кин Д.Е., Балацкая Л.Н., Васильев Н.В., Гюнтер В.Э. Современный взгляд на комплексный подход к диагностике, лечению и реабилитации больных раком гортани//Российская оториноларингология. 2012. № 3. С. 78-84
- Пачес А.И. Опухоли головы и шеи. М., 2000. С. 346-379
- Рожнов В.А., Андреев В.Г., Гулидов И.А., Панкратов В.А., Барышев В.В., Буякова М.Е., Вдовина С.Н. Паллиативное лечение больных с неоперабельным рецидивным раком гортани//Сибирский онкологический журнал. 2008. № 3. С. 29-33
- Adelstein D., Li Y., Adams G.L., Wagner H.Jr., Kish J.A., Ensley J.F., Schuller D.E., Forastiere A.A. An Intergroup Phase III Comparison of Standard Radiation Therapy and Two Schedules of Concurrent Chemoradiotherapy in Patients With Unresectable Squamous Cell Head and Neck Cancer//J. Clin. Oncol. 2003. Vol. 21 (1). P. 92-98
- Denaro N., Russi E.G., Merlano M.C. Strategies for non-resectable head and neck cancer//Curr. Treat. Options Oncol. 2013. Vol. 14 (4). P. 492-504 DOI: 10.1007/s11864-013-0260-6
- Forastiere A.A., Zhang Q., Weber R.S., Maor M.H., Goepfert H., Pajak T.F., Morrison W., Glisson B., Trotti A., Ridge J.A., Thorstad W., Wagner H., Ensley J.F., Cooper J.S. Long-term results of RTOG 91-11: a comparison of three non surgical treatment strategies to preserve the larynx in patients with locally advanced larynx cancer//J. Clin. Oncol. 2013. Vol. 31 (7). P. 845-852 DOI: 10.1200/JCO.2012.43.6097
- Fu K.K., Pajak T.F., Trotti A., Jones C.U., Spencer S.A., Phillips T.L., Garden A.S., Ridge J.A., Cooper J.S., Ang K.K. A Radiation Therapy Oncology Group (RTOG) phase III randomized study to compare hyper-fractionation and two variants of accelerated fractionation to standard fractionation radiotherapy for head and neck squamous cell carcinomas: First report of RTOG 9003//Int. J. Radiat. Oncol. Biol. Phys. 2000. Vol. 48 (1). P. 7-16
- Mouw K.W., Haraf D.J., Stenson K.M., Cohen E.E., Xi X., Witt M.E., List M., Blair E.A., Vokes E.E., Salama J.K. Factors associated with long-term speech and swallowing outcomes after chemoradiotherapy for locally advanced head and neck cancer//Arch. Otolaryngol. Head Neck Surg. 2010. Vol. 136 (12). P. 1226-1234 DOI: 10.1001/archoto.2010.218
- Rosen F. Unresectable, Locoregionally Advanced Head and Neck Cancer Head and Neck Cancer//Cancer Treat. Res. 2003. Vol. 114. P. 249-273
- Russi E., Corvo R., Merlotti A., Alterio D., Franco P., Pergolizzi S., De Sanctis V., Ruo Redda M.G., Ricardi U., Paiar F., Bonomo P., Merla-no M.C., Zurlo V., Chiesa F., Sanguineti G., Bernier J. Swallowing dysfunction in head and neck cancer patients treated by radiotherapy: review and recommendations of the supportive task group of the Italian Association of Radiation Oncology//Cancer Treat. Rev. 2012. Vol. 38 (8). P. 1033-1049 DOI: 10.1016/j.ctrv.2012.04.002
- Russo G., Haddad R., Posner M., Machtay M. Radiation treatment breaks and ulcerative mucositis in head and neck cancer//Oncologist. 2008. Vol. 13 (8). P. 886-898 DOI: 10.1634/theoncologist.2008-0024
- Volling P., Staar S., Eckel H., Stennert E., Achterrath W., Muller R. Accelerated split-course radiation and simultaneous chemotherapy in patients with unresectable head and neck-cancer//Int. J. Oncol. 1994. Vol. 4 (1). P. 143-149
- Yousem D.M., Gad K., Tufano R.P. Resectability issues with head and neck cancer//AJNR. Am. J. Neuroradiol. 2006. Vol. 27 (10). P. 2024-2036
- Fu K.K., Pajak T.F., Trotti A., Jones C.U., Spencer S.A., Phillips T.L., Garden A.S., Ridge J.A., Cooper J.S., Ang K.K. A Radiation Therapy Oncology Group (RTOG) phase III randomized study to compare hyper-fractionation and two variants of accelerated fractionation to standard fractionation radiotherapy for head and neck squamous cell carcinomas: First report of RTOG 9003//Int. J. Radiat. Oncol. Biol. Phys. 2000. Vol. 48 (1). P. 7-16
- Mouw K.W., Haraf D.J., Stenson K.M., Cohen E.E., Xi X., Witt M.E., List M., Blair E.A., Vokes E.E., Salama J.K. Factors associated with long-term speech and swallowing outcomes after chemoradiotherapy for locally advanced head and neck cancer//Arch. Otolaryngol. Head Neck Surg. 2010. Vol. 136 (12). P. 1226-1234 DOI: 10.1001/archoto.2010.218
- Rosen F. Unresectable, Locoregionally Advanced Head and Neck Cancer Head and Neck Cancer//Cancer Treat. Res. 2003. Vol. 114. P. 249-273
- Russi E., Corvo R., Merlotti A., Alterio D., Franco P., Pergolizzi S., De Sanctis V., Ruo Redda M.G., Ricardi U., Paiar F., Bonomo P., Merla-no M.C., Zurlo V., Chiesa F., Sanguineti G., Bernier J. Swallowing dysfunction in head and neck cancer patients treated by radiotherapy: review and recommendations of the supportive task group of the Italian Association of Radiation Oncology//Cancer Treat. Rev. 2012. Vol. 38 (8). P. 1033-1049 DOI: 10.1016/j.ctrv.2012.04.002
- Russo G., Haddad R., Posner M., Machtay M. Radiation treatment breaks and ulcerative mucositis in head and neck cancer//Oncologist. 2008. Vol. 13 (8). P. 886-898 DOI: 10.1634/theoncologist.2008-0024
- Volling P., Staar S., Eckel H., Stennert E., Achterrath W., Muller R. Accelerated split-course radiation and simultaneous chemotherapy in patients with unresectable head and neck-cancer//Int. J. Oncol. 1994. Vol. 4 (1). P. 143-149
- Yousem D.M., Gad K., Tufano R.P. Resectability issues with head and neck cancer//AJNR. Am. J. Neuroradiol. 2006. Vol. 27 (10). P. 2024-2036


