Лучевая терапия в паллиативном лечении распространённого мелкоклеточного рака лёгкого
Автор: Иванова И.Н., Гулидов И.А., Мардынский Ю.С., Золотков А.Г., Гоголин Д.В., Рагулин Ю.А., Курсова Л.В.
Рубрика: Научные статьи
Статья в выпуске: 2 т.22, 2013 года.
Бесплатный доступ
Цель данного исследования – сравнительная оценка нетрадиционных лучевых методов лечения распространённого мелкоклеточного рака лёгкого (МРЛ). Материалом для исследования послужили данные о лечении 108 пациентов с верифицированным диагнозом МРЛ, которые были разделены на 3 группы в зависимости от выбранного режима фракционирования дозы облучения. В результате удалось оценить переносимость различных методик лучевой терапии и отдалённые результаты лечения, а также выявить преимущества метода ускоренного гиперфракционирования.
Мелкоклеточный рак лёгкого, ускоренное гиперфракционирование, химиолучевая терапия, ранние и поздние осложнения
Короткий адрес: https://sciup.org/170170112
IDR: 170170112
Текст научной статьи Лучевая терапия в паллиативном лечении распространённого мелкоклеточного рака лёгкого
В нашей стране ежегодно регистрируется более 50 тыс. больных раком лёгкого. Если в 70-90-х годах прошлого столетия мелкоклеточный рак лёгкого (МРЛ) выявлялся у 25-30 % всех больных этой нозологией, то в последние годы он встречается у 15-20 % пациентов, что составляет 13000-15000 человек в год [1, 5]. МРЛ относится к наиболее злокачественно протекающим опухолям, которые характеризуются коротким анамнезом, быстрым течением, ранним метастазированием [3, 4, 8, 10]. Более чем у половины больных заболевание выявляют в III и IV клинических стадиях [5, 7]. В таких случаях роль лучевой терапии (ЛТ) имеет большое значение, особенно в плане оказания паллиативного пособия, целью которого является купирование местных симптомов заболевания и улучшение качества жизни пациентов. При распространённом МРЛ обычно проводится химиотерапия (ХТ), 4-6 курсов, а также ЛТ – на отдельные очаги поражения [11, 12].
При проведении паллиативных курсов ЛТ в большинстве онкологических учреждений применяют традиционное фракционирование дозы. Данная методика в основном базируется на эмпирической оценке и удобстве её применения, но с современных позиций не полностью соответствует радиобиологическим характеристикам опухоли. В последние годы установлено, что в культуре клеток МРЛ имеет место низкая способность к восстановлению сублетальных повреждений, которая делает клетки новообразования чувствительными к ЛТ в режиме гиперфракционирования, используя дозы облучения менее традиционных 2 Гр за фракцию [3, 4, 6]. Оптимальное фракционирование должно быть вариабельным в зависимости от особенностей клеточной кинетики опухолей, конкретных клинических вариантов и задач, стоящих перед ЛТ. При этом ускоренные курсы имеют преимущество перед традиционными в связи со свойствен- Иванова И . Н.* – врач - радиолог , к . м . н .; Гулидов И . А . – зав . отделением , д . м . н ., профессор ; Мардынский Ю . С. – зав . отделом , чл .- корр . РАМН , профессор ; Золотков А . Г. – гл . научн . сотр ., д . м . н ., профессор ; Гоголин Д . В . – врач - радиолог ; Рагулин Ю . А. – зав . отделением , к . м . н .; Курсова Л . В . – вед . научн . сотр ., к . м . н . ФГБУ МРНЦ Минздрава России .
ной МРЛ значительной величиной пролиферативного пула, короткому времени удвоения опухоли, высокой способности к репопуляции и гетерогенности новообразования [4, 12].
В литературе имеются данные о применении некоторых вариантов нетрадиционного фракционирования в паллиативной ЛТ больных МРЛ, в частности, ускоренного гиперфракционирования [2, 3, 9, 10]. Разработка новых и совершенствование существующих методов паллиативного лечения для данной категории больных является актуальной задачей.
Цель исследования. Проведение сравнительной оценки эффективности паллиативных курсов ЛТ, проведённых больным метастатическим МРЛ по методике ускоренного гиперфракционирования, среднего и крупного фракционирования дозы ионизирующего излучения.
Материалы и методы
За период с 1997 по 2010 гг. в клинике МРНЦ пролечено 108 пациентов с распространённым МРЛ. В результате ретроспективного анализа они были разделены на 3 группы: 39 человек, 35 и 34 пациента, сходного половозрастного состава. Из 108 человек пролечено 93 мужчины и 15 женщин (7 в 1-ой группе и по 4 – во 2-ой и 3-ей). Средний возраст по группам составляет: в 1-ой группе 52,6±11; во 2-ой – 53,8±9; в 3-ей группе – 52±8 лет.
Дистанционную лучевую терапию (ДЛТ) на первичный очаг проводили по следующим схемам:
-
- группа 1 (39 больных) – методика ускоренного гиперфракционирования с неравномерным дроблением дневной дозы 1 + 1,5 Гр с интервалом 5-6 часов между фракциями до суммарной очаговой дозы (СОД) 45-50 Гр;
-
- группа 2 (35 больных) – паллиативный курс в разовой очаговой дозе (РОД) 3 Гр (среднее фракционирование) до суммарной очаговой дозы 39-42 Гр;
-
- группа 3 (34 больных) – симптоматический курс ДЛТ 8 Гр однократно по поводу костных метастазов опухоли.
Пациенты 1-ой и 2-ой групп получили паллиативный курс ДЛТ на опухоль в лёгком и регионарные лимфоколлекторы, некоторым из них впоследствии проводили симптоматические курсы ДЛТ на метастазы в различные органы. Пациентам 3-ей группы осуществили только симптоматические курсы ДЛТ на метастазы в кости скелета. Данная группа служила контрольной с точки зрения выживаемости, поскольку облучения опухолевого очага в лёгком и регионарных коллекторах не проводилось. В сочетании с лучевой терапией всем пациентам проводили химиотерапию, 4-6 курсов цисплатином и этопозидом (схема ЕР: этопозид 120 мг/м2 в/в в 1-ый, 3-ий и 5-ый день, цисплатин 80 мг/м2 в/в в 1-ый день) с интервалом между циклами 21 день, а пациентам с метастазами в кости скелета назначали также золендроновую кислоту или её аналоги.
Клиническую эффективность ДЛТ (в процессе её проведения и сразу после окончания) оценивали по регрессии опухоли в 1-ой и 2-ой группах. В 3-ей группе – по купированию местных симптомов заболевания (боли), уменьшению размеров мягкотканого компонента. После окончания лечения больные находились под наблюдением: контрольные осмотры проводили каж- дые 3 месяца в течение первого года, через 6 месяцев на втором году и в последующем. Объективная оценка регрессии опухоли проводилась на основании рекомендаций ВОЗ.
Для сравнительной оценки общей выживаемости по группам был использован актуриаль-ный метод Каплана-Мейера. Статистическая значимость различий определялась тестом Геха-на-Вилкоксона и критерием χ2.
Результаты и обсуждение
В 1-ой группе удалось получить эффект от химиолучевого лечения в 87,2 % случаев (у 34 пациентов), что проявлялось уменьшением размеров опухоли на 50 % и более.
Во 2-ой группе клинически значимый эффект был получен в 77,1 % случаев (у 27 человек) (табл. 1).
Таблица 1
Сравнительная оценка степени регрессии опухоли после проведённого лечения в зависимости от методики ДЛТ , абс . ч . (%)
|
Степень регрессии |
Группа 1 (N=39) 1 |
Группа 2 (N=35) |
|
Через 3 месяца после окончания курса ДЛТ |
||
|
Стабилизация Регрессия >50 % Полная регрессия Прогрессирование |
3 (7,7) 31 (79,5) 3 (7,7) 2 (5,1) |
6 (17,1) 25 (71,4) 2 (5,7) 2 (5,7) |
|
Через 6 месяцев после окончания курса ДЛТ |
||
|
Степень регрессии |
Группа 1 (N=35) |
Группа 2 (N=25) |
|
Стабилизация Регрессия >50 % Полная регрессия Прогрессирование |
2 (5,7) 29 (82,9) 1 (2,9) 3 (8,6) |
3 (12,0) 17 (68,0) 1 (4,0) 3 (12,0) |
Противоболевой эффект от лечения в 3-ей группе был достигнут в 58,8 % случаев (у 20 человек), что проявлялось уменьшением боли, снижением потребности в анальгетиках, отказом от них, в том числе и от наркотических, – у 6 человек (17,6 %). Через 3 месяца снижение боли отмечали уже 26 пациентов (76,5 %).
Во всех трёх группах не наблюдалось лучевых реакций III степени по шкале RTOG/EORTC (Late Radiation Morbidity Scoring Scheme), рекомендованной для клинических исследований. Химиолучевые реакции, в частности, снижение показателей крови (лейкоциты и тромбоциты) были купированы симптоматической терапией в процессе лечения и не требовали перерыва курса лучевой терапии.
Эзофагит I степени был выявлен у 29 человек 1-ой группы (74,4 %) и 27 (77,1 %) – 2-ой. Явления эзофагита были купированы назначением антацидов, спазмолитиков и смеси растительных масел без перерыва в лучевом лечении.
Пульмонит I-II степени наблюдался у 6 человек (15,4 %) 1-ой группы и 22,9 % (8 человек) – 2-ой. Перикардит I степени был выявлен у 4 человек (10,3 %) 1-ой группы и у 6 пациентов (17,1 %) – 2-ой (р=0,0001, критерий χ2). Таким образом, выявлено статистически значимое различие в количестве лучевых перикардитов. Развитие ранних лучевых повреждений лёгких и перикарда требовало дезинтоксикации, назначения противовоспалительных, кардиотропных, диуретических, бронхо-муколитических средств и, в ряде случаев, перерыва в курсе лучевой терапии на 5-7 дней.
Через 6 месяцев в первой группе, где применяли ускоренное гиперфракционирование, выявлено достоверно меньше (р=0,035, критерий χ2) случаев прогрессирования заболевания, чем в каждой из двух других групп, между которыми существенных отличий не выявлено: 33,3 % (13 человек из 39) против 48,6 % (17 человек из 35) и 52,9 % (18 человек из 34) – во 2-ой и 3-ей группах. Через год у большинства оставшихся в живых пациентов всех групп было выявлено прогрессирование заболевания.
Медиана выживаемости в 1-ой группе составила 13 месяцев, во 2-ой и 3-ей группах – 9 месяцев. Один год прожили 53,8 % (21 человек) 1-ой группы, 40 % (14 человек) – 2-ой и 29,4 % (10 человек) – 3-ей группы. Два года прожили 28,2 % (11 человек) 1-ой группы и 14,3 % (5 человек) – 2-ой. Из 3-ей группы два года не прожил никто (рис. 1). Очевидно, это связано с тем, что пациенты этой группы не получали ДЛТ на лёгкое и регионарные лимфоколлекторы.
Общяая выживаемость больных с IV стадией МРЛ (Kaplan-Meier) о Complete Censored
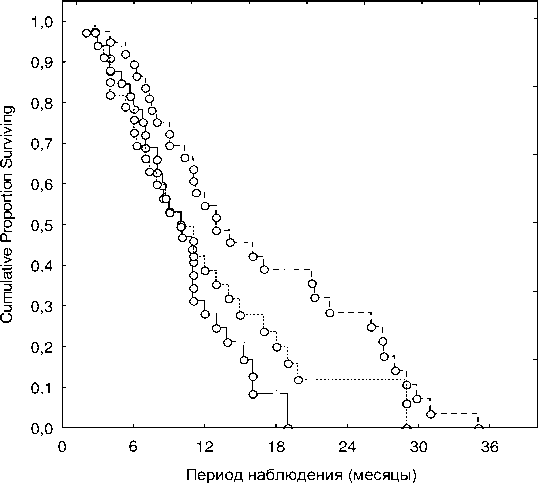
Рис . 1. Общая выживаемость больных мелкоклеточным раком лёгкого по группам.
Группа 1 (1+1,5 Гр)
Группа 2 (3 Гр)
Группа 3 (8 Гр)
Данные, представленные на рисунке, свидетельствуют о том, что те больные, которым провели паллиативный курс ДЛТ в режиме ускоренного гиперфракционирования на первичную опухоль, жили относительно дольше пациентов, пролеченных симптоматическим курсом ДЛТ на метастазы с целью снятия болевого синдрома и предотвращения патологических переломов. Статистически значимые отличия общей выживаемости пациентов выявлены между 1-ой и 3-ей группами Gehan's Wilcoxon test (p=0,015). Сравнение 1-ой и 2-ой групп не выявило 95 %-ной достоверности различий, однако при увеличении статистической мощности исследо- вания (наблюдении большего количества больных), вероятность получить достоверную разницу довольно высока, поскольку уже сейчас данный показатель находится на грани достоверности (p=0,051).
Результаты химиолучевого лечения распространённого МРЛ в нашем радиологическом центре сопоставимы с международными данными. На VII европейской конференции «Перспективы при раке лёгкого» были приведены сводные данные о результатах лечения при этом злокачественном новообразовании. Общий эффект составил 60-80 %, полная ремиссия – 0-15 %, медиана выживаемости – 7-11 месяцев, а 2-летняя выживаемость – 1-5 % [11].
До настоящего времени не выработан стандартный подход к лечению больных IV клинической стадией МРЛ, которым не показано радикальное лечение в силу значительной распространённости заболевания и/или низкого соматического статуса. Как правило, этот контингент больных не получает высокотехнологической медицинской помощи, в частности, ЛТ. Продолжительность жизни в таком случае не превышает 6-ти месяцев [1, 9]. В настоящее время установлено, что отрицательное влияние на выживаемость больных неоперабельным раком лёгкого оказывает удлинение курса ЛТ. Следовательно, перспективным является применение нетрадиционных режимов облучения в паллиативном химиолучевом лечении МРЛ, позволяющих сократить сроки, а также стоимость лечения, повысив его эффективность.
Выводы
Таким образом, облучение первичного внутригрудного очага с применением методики ускоренного гиперфракционирования в химиолучевом лечении пациентов с распространённым МРЛ позволяет статистически достоверно увеличить общую выживаемость по сравнению с химиотерапией в сочетании с облучением только отдалённых метастазов крупными фракциями. Через 6 месяцев в группе ускоренного гиперфракционирования выявлено достоверно меньше случаев прогрессирования заболевания, чем в каждой из двух других групп. Проведение лучевой терапии по данной методике с паллиативной целью позволяет повысить эффективность лечения распространённого МРЛ, хорошо переносится больными, сокращает общее время лечения, не требует дополнительных материальных затрат.
Список литературы Лучевая терапия в паллиативном лечении распространённого мелкоклеточного рака лёгкого
- Бычков М.Б. Мелкоклеточный рак лёгкого: что изменилось за последние 30 лет?//Современная онкология. 2007. Т. 9, №1. С. 34-36.
- Вальков М.Ю., Золотков А.Г., Мардынский Ю.С. и др. Ускоренные схемы фракционирования в лучевом лечении неоперабельного немелкоклеточного рака лёгкого//Вопросы онкологии. 2003. Т. 49, № 5. С. 647-651.
- Золотков А.Г., Мардынский Ю.С., Гулидов И.А. и др. Повышение эффективности лучевой терапии рака лёгкого: клинические и экономические проблемы//Клиническая радиология. 2008. № 3. С. 16-20.
- Золотков А.Г., Мардынский Ю.С., Гулидов И.А. Лучевая терапия опухолей лёгких//Терапевтическая радиология: руководство для врачей/Под ред. А.Ф. Цыба и Ю.С. Мардынского. М., 2010. С. 170-173.
- Состояние онкологической помощи населению России в 2010 году/Под ред. В.И. Чиссова, В.В. Старинского, Г.В. Петровой. М., 2011.
- Ставицкий Р.В., Паньшин Г.А. Периферический рак лёгкого: количественная оценка эффективности радикального химиолучевого лечения. М., 2008. С. 95-103.
- American society of clinical oncology. (ASCO) 43rd Annual Meeting ASCO 2007. June 1-5. Chicago, Illinois. 2007.
- Gaspar L.E. Limited small cell lung cancer (stage 1-3): observation from the NCL//ASCO. 2004. Abs. 7042.
- Quioix E. Is there are improvement of survival in SCLC patients?//II International conference «New perspectives in the treatment of SCLC», Lausanne, 2002. Р. 129-130.
- Shepherd F.A., Crowley J., van Houtte P. et al. The International Association for the Study of Lung Cancer Staging Project: proposals regarding the clinical staging of small sell lung cancer in the forthcoming (seventh) edition of the Tumor, Node, Metastasis Classification for Lung Cancer//J. Thoracic. Oncol. 2007. V. 3. Р. 1067-1077.
- Thatcher N. Some treatment concepts in SCLC//VII Eur. conf. «Perspectives in lung cancer». Athens. 2006. Р. 67-73.
- Turrisi A.T., III, Kim K., Blum R. et al. Twice-daily compared with once-daily thoracic radiotherapy in limited small-cell lung cancer treated concurrently with cisplatin and etoposide//The New England Journal of Medicine. 2011. V. 340, N. 4. Р. 265-271.


