Лучевые повреждения полости рта и ротоглотки после внутритканевой нейтронной терапии источниками 252Cf
Автор: Полькин В.В., Медведев В.С., Дербугов Д.Н., Исаев П.А., Васильков С.В., Севрюков Ф.Е., Федина А.К., Иванов С.А., Каприн А.Д.
Рубрика: Научные статьи
Статья в выпуске: 2 т.30, 2021 года.
Бесплатный доступ
Лучевая терапия применяется для лечения примерно 80% пациентов с раком головы и шеи. Несмотря на огромный прогресс в планировании и доставке лучевой терапии, значительное количество пациентов будет испытывать связанные с облучением токсические эффекты. Существует множество вариантов эффективного лечения острой токсичности, связанной с лучевой терапией, но варианты лечения поздних осложнений после лучевой терапии гораздо более ограничены и имеют относительную пользу. В основу настоящей работы положены наблюдения над 586 больными раком слизистой оболочки полости рта и ротоглотки, которым внутритканевая нейтронная терапия проводилась в самостоятельном варианте или в сочетании с дистанционной лучевой терапией. Лучевые повреждения имели место у 130 (22,2%) пациентов, у 92 (15,7%) они проявлялись в виде лучевых язв и у 38 (6,4%) - остеорадионекроз нижней челюсти. Клиническая картина и течение лучевых повреждений после внутритканевой нейтронной терапии источниками 252Cf существенно не отличались от лучевых осложнений после фотонного облучения.
Злокачественные новообразования головы и шеи, местные лучевые повреждения, рак полости рта и ротоглотки, лучевая терапия, внутритканевая нейтронная терапия, лучевая язва, остеорадионекроз, нижняя челюсть, источники 252cf, острая токсичность
Короткий адрес: https://sciup.org/170179211
IDR: 170179211 | УДК: 616.31+616.327.3]-006.6-085.849.12-06 | DOI: 10.21870/0131-3878-2021-30-2-123-13
Текст научной статьи Лучевые повреждения полости рта и ротоглотки после внутритканевой нейтронной терапии источниками 252Cf
Лучевая терапия (ЛТ) играет ключевую роль в лечении пациентов с раком головы и шеи (РГШ). Приблизительно 80% (от 73,9 до 84,4%) всех пациентов с РГШ получают ЛТ хотя бы один раз в течение их заболевания [1]. Эффективность ЛТ оценивается не только по результатам излечения опухоли, но и по частоте и тяжести лучевых осложнений. Острые лучевые реакции, которые развиваются во время ЛТ, могут отрицательно повлиять на её выполнение, но обычно проходят в течение нескольких недель после завершения ЛТ. Поздние лучевые повреждения возникают, по общепринятому определению, через 3 месяца и более после завершения ЛТ. Многие поздние эффекты прогрессируют с течением времени и в конечном итоге могут негативно повлиять на качество жизни пациентов [2-4]. Ни одна технология ЛТ не может полностью защитить нормальные ткани от облучения, и пациенты всегда будут испытывать некоторую степень токсичности, связанной с облучением. В области головы и шеи, пожалуй, наиболее распространённые и сложные побочные эффекты ЛТ связаны с нарушением функционирования слюнных желез и дисфагия [5]. Тем не менее, другие ткани и структуры в области головы и шеи также могут подвергаться риску, в основном в зависимости от расположения опухоли, например, нижней челюсти и слухового аппарата. В контексте современных стандартов лечения у многих пациентов повреждение, вызванное облучением, дополнительно усугубляется одновременными системными цитотоксическими агентами [6]. Частота умеренной или тяжёлой поздней ксеростомии
Полькин В.В.* – зав. отд., к.м.н.; Медведев В.С. – гл. науч. сотр., д.м.н.; проф.; Дербугов Д.Н. – врач; Исаев П.А. – вед. науч. сотр., д.м.н.; Васильков С.В. – науч. сотр.; Севрюков Ф.Е. – вед. науч. сотр., к.м.н.; Федина А.К. – клин. ординатор; Иванов С.А. – директор, д.м.н., проф. РАН. МРНЦ им. А.Ф. Цыба – филиал ФГБУ «НМИЦ радиологии» Минздрава России. Каприн А.Д. – ген. директор, акад. РАН, д.м.н., проф. ФГБУ «НМИЦ радиологии» Минздрава России.
-
* Контакты: 249035, Калужская обл., Обнинск, ул. Королёва, 4. Тел.: +79108637283; e-mail: polkin83@mail.ru.
в исследованиях, реализующих двухмерное планирование ЛТ, составляла 60-75%, и около 40% в более поздних сериях с использованием современных методов ЛТ, таких как IMRT [4, 7, 8].
В проспективном когортном исследовании 238 пациентов с РГШ, получавших 3-мерную конформную ЛT (65%) или IMRT (35%) одновременно с химиотерапией (11%), распространённость дисфункции глотания 2-4 степени, рассчитанная по RTOG/EORTC критериям оценки поздней радиационной заболеваемости, составила 22% через 6 месяцев и 14% через 12 и 24 месяца [9]. По данным различных авторов частота встречаемости остеорадионекроза (ОРН) варьировала от 2 до 22%: этот широкий диапазон отражает не только различия в применяемых методах ЛТ, но также неоднозначность в определении и трудности в диагностике ОРН [10, 11]. В крупном обзоре, включающем 31 исследование, опубликованное Peterson et al. [12], распространённость ОРН у пациентов с различными РГШ, получавших традиционную ЛТ, составила 7,4%, IMRT -5,2%, химиолучевую терапию - 6,8% и брахитерапию 5,3%. De Felice et al. [13] рассмотрели 10 исследований (более 3000 пациентов), в которых применяли исключительно IMRT: частота встречаемости ОРН варьировала от 0 до 6,3% (в среднем 1,4%). В детальном анализе 531 пациента с раком полости рта, ротоглотки и слюнной железы, получавших IMRT и дозы до нижней челюсти >60 Гр, Studer et al. [14] сообщили об общей заболеваемости ОРН - 7%; у пациентов с раком полости рта, перенёсших операции на нижней челюсти, этот показатель составил 29% (при отсутствии операции на нижней челюсти - 7%), а при удалении маргинальной или периостальной кости - 39% (сегментарная резекция или отсутствие резекции - 7%).
В связи с этим особое значение приобретает метод, позволяющий создавать оптимальные дозы излучения в опухоли, достаточные для её разрушения, при одновременном щажении окружающих нормальных тканей. Одним из таких методов облучения является внутритканевая ЛТ, характерной особенностью которой является размещение источников излучения в ткани опухоли. Поэтому изучение клинической картины, частоты и основных причин возникновения лучевых повреждений слизистой оболочки полости рта и ротоглотки после проведения внутритканевой терапии источниками 252Cf в самостоятельном варианте и в различных сочетаниях с дистанционной ЛТ, а также полихимиотерапией, представляет значительный интерес.
Материалы и методы
В основу настоящей работы положены наблюдения над 586 больными раком слизистой оболочки полости рта и ротоглотки, лечение которых выполнено в отделении лучевого и хирургического лечения заболеваний головы и шеи Медицинского радиологического научного центра им. А.Ф. Цыба (в настоящее время - филиал ФГБУ «НМИЦ радиологии» Минздрава России) в период с сентября 1979 г. по июнь 2016 г.
Соотношение между женщинами и мужчинами составило приблизительно 1:6. Основную часть больных, как мужчин, так и женщин, представляли лица в возрасте старше 40 лет (90,1%). Средний возраст наблюдаемой группы больных составил 53,86±11,1 года (медиана 54 года, диапазон от 17 лет до 81 года). Общее состояние по шкале ECOG у всех пациентов, включённых в исследование, был <2.
У 471 (80,4%) больных опухоли были первичными, у 115 (19,6%) - рецидивными или остаточными. Наиболее часто новообразования поражали язык - 231 (39,4%), дно полости рта -169 (28,8%), губу - 138 (23,6%) и реже ткани ротоглотки - 30 (5,1%) и щеки - 18 (5,1%).
У всех больных диагноз злокачественного новообразования подтверждён гистологическим исследованием. По морфологической структуре у 445 (76,0%) больных наблюдалась картина плоскоклеточного рака разной степени дифференцировки (G1-G2) с ороговением, у 128 (21,8%) – плоскоклеточного неороговевающего (G3) и у 13 (2,2%) – низкодифференцированные формы плоскоклеточного рака (G4).
Первичные опухоли, соответствующие символу Т1, наблюдались у 106 (18,1%) больных, Т2 – у 273 (46,6%), Т3 – у 55 (9,4%) и Т4а – у 37 (6,3%). Метастазы рака в регионарных лимфатических узлах шеи до начала лечения были выявлены и подтверждены морфологическим исследованием у 93 (15,9%) больных.
У 115 (19,6%) больных опухоли были рецидивными или остаточными. Размеры рецидивных и остаточных новообразований варьировали от 1 до 6 см в диаметре, составляя в 83 (13,1%) наблюдениях более 2 см в наибольшем измерении. Всем этим больным на предыдущих этапах проводилась дистанционная гамма-терапия с подведением суммарной очаговой дозы от 45 до 70 Гр. Кроме того, у 6 больных проводили внутритканевую терапию 60Co, у 12 – выполняли различные по объёму хирургические вмешательства и у 7 проводили системную химиотерапия. У 96 (83,5%) больных рецидивы возникли спустя 3-12 месяцев после окончания лечения и только у 19 (16,5%) в более поздние сроки.
Основным показанием к выбору тактики лечения были: степень распространённости, локализация опухоли и общее состояние больного. В соответствии с проведёнными методами лечения все больные были разделены на 7 клинических групп (табл. 1).
Таблица 1
Распределение больных по группам в зависимости от метода лечения и распространённости первичного очага
|
Группы больных |
Метод лечения |
Всего |
Распространённость первичной опухоли |
Рецидив опухоли |
||||
|
Т1 |
Т2 |
Т3 |
Т4 |
до 2 см |
более 2 см |
|||
|
I |
252Cf перв. |
82 (14%) |
38 |
44 |
– |
– |
– |
– |
|
II |
252Cf рец. |
73 (12,5%) |
– |
– |
– |
– |
22 |
51 |
|
III |
252Cf губа |
119 (20,3%) |
40 |
43 |
– |
– |
10 |
26 |
|
IV |
ДЛТ + 252Cf |
91 (15,5%) |
5 |
50 |
22 |
14 |
– |
– |
|
V |
252Cf + ДЛТ |
136 (23,2%) |
7 |
80 |
30 |
19 |
– |
– |
|
VI |
ХТ + 252Cf |
45 (7,7%) |
15 |
24 |
– |
– |
6 |
– |
|
VII |
ДЛТ + ХТ + 252Cf |
40 (6,8%) |
1 |
32 |
3 |
4 |
– |
– |
|
Всего |
586 (100%) |
106 (18,1%) |
273 (46,6%) |
55 (9,4%) |
37 (6,3%) |
38 (6,5%) |
77 (13,1%) |
|
В I группе – 82 (14%) больных с первичными опухолями полости рта и ротоглотки, получавших самостоятельный курс внутритканевой нейтронной терапии. Во II группе – 73 (12,5%) больных с рецидивными и остаточными опухолями, которым нейтронную терапию проводили в самостоятельном варианте. В отличие от рака других локализаций полости рта при раке губы отмечается более благоприятный прогноз. В связи с чем, рак губы нами был выделен в отдельную группу. III группа состоит из 119 (20,3%) больных с первичными и рецидивными опухолями верхней и нижней губы, получавших самостоятельный курс внутритканевой нейтронной терапии. В IV группе – 91 (15,5%) больному был проведён традиционный курс сочетанной ЛТ по методике «поздний имплантат»: на первом этапе – дистанционная гамма-терапия, на втором – внутритканевая нейтронная терапия. Особое место в нашем исследовании занимают 136 (32,6%) больных V группы, которым проводился нетрадиционный курс сочетанной ЛТ. Нами впервые при лечении больных раком органов полости рта была разработана и применена новая методика («ранний имплантат»), согласно которой внутритканевую нейтронную терапию проводили на первом этапе лечения с последующим дистанционным облучением. В VI группе – 45 больным самостоятель- ный курс внутритканевой нейтронной терапии источниками 252Cf проведён в комбинации с одновременной полихимиотерапией (ПХТ), в VII группе – 40 больным проводили сочетанную ЛТ в комбинации с одновременной ПХТ.
Конструкция медицинских источников из 252Cf представлена в виде штырьков и гибких сборок. Штырьковые препараты представляют собой линейные источники излучения длиной 20 мм с наружным диаметром 1,2 мм. Гибкие сборки состоят из точечных источников и дистанциониру-ющих элементов, собранных в пружинной оболочке из нержавеющей стали. Длина гибкой сборки варьирует от 80 до 120 мм с наружным диаметром 1,1 мм. Конструкция штырьковых препаратов предусматривала проведение внутритканевой нейтронной терапии по принципу последовательного введения игл-интрастатов и радиоактивных источников («simple afterloading»). Этот метод состоял из двух этапов. На первом этапе в радиоманипуляционной к нормальной слизистой оболочке подшивали направляющую пластинку так, чтобы её центр совпадал с центром опухоли. Далее через отверстия в пластинке в соответствии с выбранной геометрией в ткань опухоли вводили интрастаты. Второй этап включает введение радиоактивных препаратов в интрастаты. Для исключения самопроизвольного смещения и выпадения источников весь имплантат закрывали пластмассовой крышкой, которую фиксировали к пластинке шелковыми лигатурами. В течение нескольких суток (от 1 до 5) больной находился в «активной» палате. За этот период времени к опухолевому очагу подводили запланированную дозу излучения. После окончания лечения в ра-диоманипуляционной источники извлекали. В зависимости от величины облучаемого объёма требовалось не более 2-10 источников, размещённых в одной, двух и трёх плоскостях.
Дозиметрическое планирование внутритканевой нейтронной терапии источниками 252Cf основано на принципах Парижской системы. Облучаемые объёмы в своём сечении чаще всего имели форму квадрата, треугольника, прямоугольника, эллипса. Во всех наблюдениях облучение было однородным во всём объёме опухоли, и очаговая доза на границе облучаемого объёма составляла 85% минимальной поглощённой дозы между источниками центральной плоскости (рис. 1).
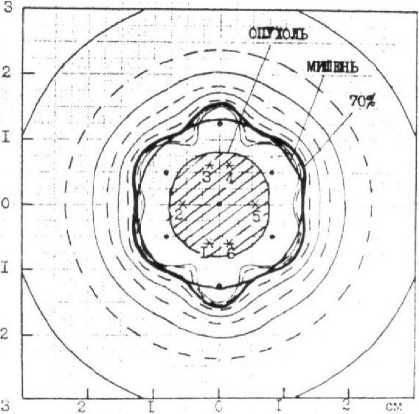
Рис. 1. Дозиметрическая карта внутритканевой лучевой терапии 7 источниками из 252Cf. Границы опухоли и выбранная для расчёта 85% изодоза на отдельных участках прилежат друг к другу.
Обозначения: точка (•) – проекции источников; звездочка (*) – точки для расчёта опорной мощности дозы.
Суммарные очаговые дозы (СОД) при самостоятельном облучении составили 7-9 Гр по нейтронам. При традиционной схеме сочетанного облучения на первом этапе на первичный очаг и зоны регионарного лимфатического оттока проводится дистанционная гамма-терапия, на втором этапе – внутритканевая терапия с использованием штырьковых источников 252Cf. Дистанционное облучение проводили в общепринятом режиме фракционирования по 2 Гр пять раз в неделю до СОД 40-45 Гр. Внутритканевую терапию источниками 252Cf осуществляли через 2-3 недели после окончания дистанционного облучения. Очаговые дозы нейтронного излучения в мишени, равные первоначальному объёму опухоли, составляли 4-6 Гр.
С учётом физических и радиобиологических особенностей излучения 252Cf был применён новый способ сочетанной терапии (ранний имплантат), при котором внутритканевая нейтронная терапия предшествует дистанционному облучению. СОД нейтронов варьировала от 3,5 до 5 Гр, СОД гамма-терапии составила 30-40 Гр.
В схему химиотерапии включён цисплатин. В первый день лечения, до начала ЛТ, внутривенно на фоне гипергидратации вводили цисплатин из расчёта 100 мг на м2 площади поверхности тела. При проведении сочетанной ЛТ на первом этапе оба цикла химиотерапии с интервалом в 21 день проводили одновременно с дистанционным облучением.
Для классификации остеорадионекрозов использовали классификацию Notani: I стадия – ОРН ограничена альвеолярной костью, II стадия – ОРН ограничена альвеолярной костью и/или выше уровня нижнего альвеолярного канала, III стадия – ОРН находится под нижней частью нижнего альвеолярного канала с фистулой или переломом кости.
Использовалась следующая классификация лучевых повреждений слизистой оболочки и мягких тканей: 1 степень – эрозия слизистой оболочки или поверхностная язва до 1 см в наибольшем измерении. Дно язвы было выполнено фибринозной плёнкой. При пальпации этой области отмечалась умеренная болезненность. Функция органов полости рта не нарушалась. 2 степень характеризовалась язвой до 2 см в диаметре с распространением на подлежащие мышцы. Дно и края язвы были покрыты плёнкой некроза, грязно-серого цвета, плотно фиксированного к подлежащим тканям. Отмечались выраженные боли, особенно усиливающиеся при разговоре и приеме пищи. 3 степень – размеры язвы более 2 см в диаметре, дно и края её были выполнены расплавленными грязно-серыми некротическими массами с неприятным запахом. Из-за сильного болевого синдрома больные испытывали затруднения в разговоре и приеме пищи.
Результаты
Среди наблюдаемых нами больных лучевые повреждения имели место у 130 (22,2%) пациентов (табл. 2). Наиболее часто они возникали у больных с опухолями языка и дна полости рта. Клиническая картина лучевых повреждений была весьма многообразной: у 92 они проявлялись в виде лучевых язв, у 38 (6,4%) – ОРН нижней челюсти, причём у 26 из них после лечения рака дна полости рта. Это обусловлено близостью нахождения источников к нижней челюсти.
Сроки диагностирования лучевых повреждений варьировали от 2 месяцев до 9 лет. У большинства больных – 107 (82,3%) лучевые осложнения были диагностированы в ближайшие 12 месяцев после окончания лечения. В сроки от 1 года до 2 лет они возникли у 14 (10,8%) больных, от 2 до 3 лет – у 4 (3,1%) и в более поздние сроки – у 5 (3,8%) пациентов. Осложнения, проявляющиеся до 3 месяцев после окончания лечения, относятся к ранним лучевым повреждениям, а после 3 месяцев – к поздним. Полученные данные согласуются с публикациями, свидетельствующими, что лучевые повреждения, возникающие после внутритканевой ЛТ, проявляются у большинства больных в ближайшие 12 месяцев после лечения.
Таблица 2
Количество и характер лучевых повреждений в зависимости от локализации опухоли
|
Локализация опухоли |
Лучевые повреждения |
Итого |
|||||
|
лучевая язва |
остеомиелит нижней челюсти |
||||||
|
1 ст. |
2 ст. |
3 ст. |
1 ст. |
2 ст. |
3 ст. |
||
|
Язык |
23 |
21 |
3 |
7 |
4 |
1 |
59 (25,5%) |
|
Дно полости рта |
12 |
17 |
– |
6 |
16 |
4 |
55 (32,5%) |
|
Нижняя губа |
5 |
4 |
– |
– |
– |
– |
9 (6,5%) |
|
Слизистая щеки |
– |
2 |
– |
– |
– |
– |
2 (11,1%) |
|
Ротоглотка |
1 |
4 |
– |
– |
– |
– |
5 (16,7%) |
|
Всего |
41 |
48 |
3 |
13 |
20 |
5 |
130 (22,2%) |
При распространении первичной опухоли, обозначаемой как Т1, лучевые осложнения возникли у 8 из 106 пролеченных больных (7,5%), при Т2 – у 78 из 273 (28,6%), при Т3 – у 11 из 55 (20%) и при Т4 – у 11 из 37 (29,7%). При рецидивных новообразованиях в зависимости от размеров рецидива лучевые повреждения наблюдались при опухолях до 2 см у 6 (15,8%) из 38 больных и более 2 см у 16 (20,8%) из 77 пациентов. Анализ полученных данных показывает, что при большей степени распространения опухолевого очага, как при первичных, так и рецидивных новообразованиях, частота возникновения лучевых осложнений увеличивается.
Анализируя причины, которые могли бы явиться основным условием возникновения лучевых осложнений, мы разделили их на две группы. Первую группу составили в основном клинические факторы – возраст больных, локализация, форма роста, распространённость опухоли, сопутствующие заболевания, состояние зубочелюстной системы, наличие вредных привычек. Вторую группу составили факторы, обусловленные проведением лечебных мероприятий – методика ЛТ с учётом поглощённой дозы, мощность дозы, время облучения, расположение источников и некоторые другие факторы.
Из анамнеза известно, что из 130 больных с лучевыми повреждениями 121 (93,1%) пациентов курили или злоупотребляли алкоголем. Причём, у 85 (65,4%) больных вредные привычки сочетались. Такая высокая частота лучевых повреждений у больных с наличием вредных привычек позволяет говорить о понижении репаративных процессов слизистой оболочки полости рта и предрасположенности этой группы больных к проявлению лучевых осложнений.
Установлена определённая зависимость между состоянием зубов, пародонта и возникновением лучевых осложнений. Так, из 296 (50,5%) больных с явлением пародонтита и пародонтоза лучевые повреждения возникли у 116 (39,2%) пациентов, а из 290 (49,5%) больных без этой патологии – у 14 (4,8%).
Анализируя результаты частоты лучевых осложнений при самостоятельном варианте лечения первичных опухолей, установлено, что частота их возникновения после нейтронного излучения не выше, чем при фотонном, а клиническое течение существенно не отличается. Наиболее часто лучевые повреждения наблюдаются у больных с поглощённой очаговой дозой выше 9 Гр и при минимальном расстоянии между источниками от 14 до 16 мм.
После проведения внутритканевой нейтронной терапии источниками 252Cf в самостоятельном варианте рецидивных опухолей полости рта и ротоглотки лучевые осложнения наблюдались у 18 из 73 (24,7%) больных. Наиболее часто лучевые повреждения развивались у больных с новообразованиями более 2 см при очаговой дозе более 7 Гр – у 8 из 21 (38,0%) больного. По-видимому, основной причиной появления лучевых осложнений у этих больных являлось не только снижение толерантности тканей к нейтронному излучению вследствие ЛТ на предыдущем этапе, но и завышение доз выше терапевтического уровня.
Число и характер лучевых осложнений после проведения нового варианта сочетанного облучения существенно не отличались от лучевых повреждений, возникших после традиционной схемы облучения. Необходимо отметить, что независимо от методики лечения при увеличении поглощённой дозы от внутритканевого этапа облучения свыше 4 Гр число лучевых повреждений возрастает.
В процессе выполнения работы была предложена комплексная программа консервативной терапии лучевых повреждений. Она включала в себя противовоспалительную терапию, стимуляцию регенеративных процессов. В результате консервативного лечения и ограниченных хирургических вмешательств у 117 (90%) больных достигнуто заживление лучевых язв и радионекрозов нижней челюсти без каких-либо косметических дефектов и функциональных расстройств. У других 13 пациентов наряду с консервативной терапией выполнялись различные хирургические вмешательства. Так, у 10 (7,7%) больных была произведена секвестрэктомия нижней челюсти, у 2 (1,5%) краевая резекция нижней челюсти, и только у 1 больного была выполнена резекция ½ половины нижней челюсти.
Заключение
Таким образом, клиническая картина и течение лучевых повреждений после внутритканевой нейтронной терапии источниками 252Cf существенно не отличались от лучевых осложнений после фотонного облучения. У большинства больных течение лучевых повреждений не было отягощённым. Важное значение для предотвращения появления лучевых повреждений, а также возникновения повторных лучевых осложнений имеет строгое выполнение следующих рекомендаций: всем больным перед лучевой терапией необходима тщательная санация полости рта, в постлучевом периоде необходим постоянный уход за полостью рта, а также соответствующая щадящая диета, отказ от курения и употребления алкоголя. Больным рекомендуется диспансерное наблюдение у стоматолога по месту жительства с целью своевременной санации полости рта. Экстракция зубов на нижней челюсти должна проводиться только после неэффективного консервативного лечения по экстренным показаниям на фоне противовоспалительной терапии. Удаление зубов на верхней челюсти не противопоказано.
Данная работа выполнена на базе МРНЦ им. А.Ф. Цыба – филиал ФГБУ «НМИЦ радиологии» Минздрава России, на протяжении многих лет успешно сочетающего в своей работе экспериментальные исследования и их клиническое применение [15, 16].
Литературы
Late complication of the oral cavity and oropharynx after interstitial neutron therapy with sources of 252Cf
Polkin V.V., Medvedev V.S., Derbugov D.N., Isaev P.A., Vasil`kov S.V., Sevrukov F.E., Fedina A.K., Ivanov S.A., Kaprin A.D.1
A. Tsyb MRRC, Obninsk;
-
1 NMRRC, Moscow
Список литературы Лучевые повреждения полости рта и ротоглотки после внутритканевой нейтронной терапии источниками 252Cf
- Borras J.M., Barton M., Grau C., Corral J., Verhoeven R., Lemmens V., van Eycken L., Henau K., Primic-Zakelj M., Strojan P., Trojanowski M., Dyzmann-Sroka A., Kubiak A., Gasparotto C., Defourny N., Malicki J., Dunscombe P., Coffey M., Lievens Y. The impact of cancer incidence and stage on optimal utilization of radiotherapy: methodology of a population based analysis by the ESTRO-HERO project //Radiother. Oncol. 2015. V. 116, N 1. P. 45-50. DOI: 10.1016/j.radonc.2015.04.021.
- Barnett G.C., West C.M., Dunning A.M., Elliott R.M., Coles C.E., Pharoah P.D., Burnet N.G. Normal tissue reactions to radiotherapy: towards tailoring treatment dose by genotype //Nat. Rev. Cancer. 2009. V. 9, N 2. P. 134-142. DOI: 10.1038/nrc2587.
- Jellema A.P., Slotman B.J., Doornaert P., Leemans C.R., Langendijk J.A. Impact of radiation-induced xerostomia on quality of life after primary radiotherapy among patients with head and neck cancer //Int. J. Radiat. Oncol. Biol. Phys. 2007. V. 69, N 3. P. 751-760.
- Langendijk J.A., Doornaert P., Verdonck-de Leeuw I.M., Leemans C.R., Aaronson N.K., Slotman B.J. Impact of late treatment-related toxicity on quality of life among patients with head and neck cancer treated with radiotherapy //J. Clin. Oncol. 2008. V. 26, N 22. P. 3770-3776.
- Machtay М., Moughan J., Trotti A., Garden A.S., Weber R.S., Cooper J.S., Forastiere A., Kian Ang K. Factors associated with severe late toxicity after concurrent chemoradiation for locally advanced head and neck cancer: an RTOG analysis //J. Clin. Oncol. 2008. V. 26, N 21. P. 3582-3589.
- Pignon J.P., le Maître A., Maillard E., Bourhis J., MACH-NC Collaborative Group. Meta-analysis of chemotherapy in head and neck cancer (MACH-NC): an update on 93 randomised trials and 17,346 patients //Radiother. Oncol. 2009. V. 92, N 1. P. 4-14.
- Wijers O.B., Levendag P.C., Braaksma M.M., Boonzaaijer M., Visch L.L., Schmitz P.I. Patients with head and neck cancer cured by radiation therapy: a survey of the dry mouth syndrome in long-term survivors //Head Neck. 2002. V. 24, N 8. P. 737-747.
- Nutting C.M., Morden J.P., Harrington K.J., Urbano T.G., Bhide S.A., Clark C., Miles E.A., Miah A.B., Newbold K., Tanay M., Adab F., Jefferies S.J., Scrase C., Yap B.K., A'Hern R.P., Sydenham M.A., Emson M., Hall E.; PARSPORT trial management group. Parotid-sparing intensity modulated versus conventional radiotherapy in head and neck cancer (PARSPORT): a phase 3 multicentre randomised controlled trial //Lancet Oncol. 2011. V. 12, N 2. P. 127-136.
- Christianen M.E.M.C., Verdonck-de Leeuw I.M., Doornaert P., Chouvalova O., Steenbakkers R.J.H.M., Koken Ph.W., Leemans C.R., Oosting S.F., Roodenburg J.L.N., van der Laan B.F.A.M., Slotman B.J., Bijl H.P., Langendijk J.A. Patterns of long-term swallowing dysfunction after definitive radiotherapy or chemoradiation //Radiother. Oncol. 2015. V. 117, N 1. P. 139-144.
- Buglione M., Cavagnini R., Di Rosario F., Sottocornola L., Maddalo M., Vassalli L., Grisanti S., Salgarello S., Orlandi E., Paganelli C., Majorana A., Gastaldi G., Bossi P., Berruti A., Pavanato G., Nicolai P., Maroldi R., Barasch A., Russi E.G., Raber-Durlacher J., Murphy B., Magrini S.M. Oral toxicity management in head and neck cancer patients treated with chemotherapy and radiation: dental pathologies and osteoradionecrosis (Part 1) literature review and consensus statement //Crit. Rev. Oncol. Hematol. 2016. V. 97. P. 131-142.
- Dhanda J., Pasquier D., Newman L., Shaw R. Current concepts in osteoradionecrosis after head and neck radiotherapy //Clin. Oncol. (R. Coll. Radiol.). 2016. V. 28, N 7. P. 459-466.
- Peterson D.E., Doerr W., Hovan A., Pinto A., Saunders D., Elting L.S., Spijkervet F.K., Brennan M.T. Osteoradionecrosis in cancer patients: the evidence base for treatment-dependent frequency, current management strategies, and future studies //Support Care Cancer. 2010. V. 18, N 8. P. 1089-1098.
- De Felice F., Musio D., Tombolini V. Osteoradionecrosis and intensity modulated radiation therapy: an overview //Crit. Rev. Oncol. Hematol. 2016. V. 107. P. 39-43.
- Studer G., Bredell M., Studer S., Huber G., Glanzmann C. Risk profile for osteoradionecrosis of the mandible in the IMRT era //Strahlenther. Onkol. 2016. V. 192, N 1. P. 32-39. DOI: 10.1007/s00066-015-0875-6.
- Каприн А.Д., Галкин В.Н., Жаворонков Л.П., Иванов В.К., Иванов С.А., Романко Ю.С. Синтез фундаментальных и прикладных исследований - основа обеспечения высокого уровня научных результатов и внедрения их в медицинскую практику //Радиация и риск. 2017. Т. 26, № 2. С. 26-40.
- Каприн А.Д., Мардынский Ю.С., Смирнов В.П., Иванов С.А., Костин А.А., Полихов С.А., Решетов И.В., Фатьянова А.С., Денисенко М.В., Эпатова Т.В., Коренев С.В., Терещенко А.В., Филоненко Е.В., Гафаров М.М., Романко Ю.С. К истории развития лучевой терапии (часть I) //Biomedical Photonics. 2019. Т. 8, № 1. С. 52-62. DOI: org/10.24931/2413-9432-2019-8-1-52-62.


