Лучевые реакции нормальных тканей у больных раком молочной железы: взаимосвязь с аллельными формами гена СОМТ
Автор: Жарикова И.А., Кондрашова Т.В., Осокова Е.А., Смирнова И.А.
Рубрика: Научные статьи
Статья в выпуске: 4 т.18, 2009 года.
Бесплатный доступ
Нами были изучены лучевые реакции нормальных тканей у пациенток в зависимости от полиморфизма гена СОМТ*H/L. Ген СОМТ участвует в инактивации катехоловых эстрогенов, его аллельные формы имеют разную активность, аллель L (от англ. low) в 3-5 раз менее активна, чем аллель H (от англ. high). В исследование вошла 91 пациентка, получившая лучевую терапию с суммарной очаговой дозой 50-60 Гр. Лучевые реакции оценивали по 3 степеням выраженности - низкой, средней, высокой. Для генотипирования использовали метод полимеразной цепной реакции PCR-RFLP. На этом материале была выявлена существенная ассоциация индивидуальной лучевой реакции с генотипом СОМТ: средняя аллельная частота L составляла 0,46 у женщин без лучевых реакций, 0,52 - у женщин со слабовыраженными лучевыми реакциями и 0,64 - у женщин со средней и сильной степенью ранних лучевых повреждений нормальных тканей. Тенденция роста указанных величин оказалась достоверной при pСОМТ*H/L может быть использован для индивидуализации планирования лучевой терапии у больных раком молочной железы.
Рак молочной железы, полиморфизм гена сомт, лучевая реакция нормальных тканей
Короткий адрес: https://sciup.org/170169986
IDR: 170169986
Текст научной статьи Лучевые реакции нормальных тканей у больных раком молочной железы: взаимосвязь с аллельными формами гена СОМТ
Степень 0 – без изменений по отношению к исходному состоянию;
Степень 1 – слабо или незначительно выраженная эритема, выпадение волос, сухое шелушение;
Степень 2 – слабая эритема, сухой эпидермит, зуд, умеренный отек, влажно-очажковое шелушение;
Степень 3 – сливное влажное слущивание, влажный эпидермит, образование язв, пастозный отек;
Степень 4 – слущивающийся дерматит, изъязвление, геморрагии, некроз, требующий хирургического вмешательства.
Характер и особенности клинического проявления лучевых повреждений определяются индивидуальной радиочувствительностью больного, его возрастом и состоянием, энергией используемого излучения, распределением поглощенной энергии в облучаемом объеме тканей, а также разовой и суммарной очаговой дозой и другими факторами. При этом возможно возникновение ранних и поздних лучевых повреждений, причем в 20 % случаев стандартное терапевтическое облучение приводит к поздним лучевым повреждениям кожи [1]. А поскольку время их проявления и степень тяжести сильно варьируют даже в пределах одной дозы, то, возможно, реакция на облучение в сильной степени зависит от генетических факторов.
Из всего этого следует актуальность определения генетических факторов радиочувствительности для оптимизации лучевой терапии. Ген COMT может быть одним из таких факторов.
Физиологическая роль белка COMT (катехол-О-метилтрансфераза) состоит в инактивации катехоловых эстрогенов. Чтобы разобраться в том, как он работает, необходимо понять, какие процессы происходят в организме женщины.
Эстрон, одна из разновидностей белков эстрогенов, преимущественно циркулирует в русле крови, а эстрадиол (отличается от эстрона гидроксильной группой, вместо кетогруппы) наиболее активен в тканях молочной железы. Тот факт, что эстрадиол является канцерогеном, то есть веществом, способным быть причиной возникновения рака, доказано в работах на животных [10, 12]. По данным МАИР (IARC, International Agency for Research of Cancer) эстрадиол является канцерогеном и для людей.
Канцерогенное действие эстрогена основано, во-первых, на том, что он стимулирует процессы деления клеток молочной железы, а при активном делении увеличивается вероятность внесения случайных нарушений в генетический материал [11]. Во-вторых, метаболизм эстрогенов сопровождается временным появлением генотоксичных продуктов. В результате метаболизма эстрона и эстрадиола образуются катехоловые эстрогены – 4-гидроксиэстрадиол и 2-гидроксиэстрадиол. Основную роль в канцерогенезе играет 4-гидроксиэстрадиол, в то время как 2-гидроксиэстрадиол, по-видимому, является веществом, не способным вызывать рак [14]. При действии на них белка COMT происходит их метилирование, и в результате образуются безвредные инактивированные метаболиты. Если же метилирования не происходит, то дальнейший метаболизм катехоловых эстрогенов приводит к возникновению окислительного стресса в ткани. Окислительный стресс (избыточное накопление свободных радикалов) индуцирует повреждения ДНК и поэтому, в свою очередь, обладает канцерогенным потенциалом [5]. Упрощенная схема, иллюстрирующая роль эстрогенов в развитии РМЖ, а также роль белка COMT в этих процессах, представлена на рисунке 1.
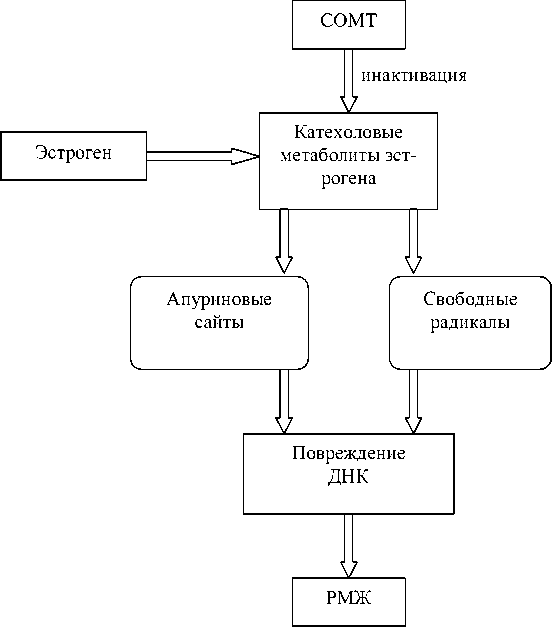
Рис . 1. Схематичное изображение эстрогенозависимого канцерогенеза и роли белка COMT в этих процессах.
Белок COMT в организме человека существует в двух формах: растворимая форма (S-COMT) и примембранная форма (MB-COMT). Обе формы кодируются одним геном, расположенным на длинном плече 22-й хромосомы (22q) [7].
Ген COMT характеризуется популяционным полиморфизмом. В частности, определенный участок 4-го экзона этого гена имеет две аллельные формы. У некоторых людей в последовательности нуклеотидов этого участка имеет место замена гуанина (G) на аденин (А). Эта мутация приводит к замене валина метионином в кодоне 158 аминокислотной последовательности продукта этого гена, т.е. белка COMT, причем активность метионин-содержащего белка снижена в 3-4 раза по сравнению с его валин-содержащим аналогом [8, 9]. Эта замена обозначается как Val158Met. Метионин-содержащий белок кодируется аллелем, в котором находится A, и поэтому этот аллель принято называть аллелем низкой активности (аллель L, от англ. low). Валин-содержащий белок кодируется аллелем, в котором находится G, и поэтому этот аллель называют аллелем высокой активности (аллель H, от англ. high). Таким образом, другое общепринятое обозначение данного полиморфизма – COMT*H/L.
С целью определения – какой из аллелей H и L является базовым (или «диким», как принято говорить в генетике), а какой – вариантным, группой ученых были проведены исследования на приматах (одна горилла, две самки шимпанзе, две обезьяны бонобо и две самки орангутанга). Эти исследования показали, что у всех приматов в последовательности нуклеотидов данного полиморфного участка находится гуанин. Таким образом, базовым аллелем является аллель H, а вариантным – L [13].
Анализ различных этнических групп показал, что частоты аллелей H и L существенно колеблются. У народов Восточной Азии и Африки частота вариантного аллеля L значительно ниже, чем у жителей Европы, Юго-Западной Азии и Северной и Центральной Америки. Эти результаты представлены в публикации [13]. Исследования, в которых бы анализировались генотипы россиян, крайне немногочисленны [3].
Таким образом, человеческая популяция людей характеризуется двумя аллельными формами гена COMT . Пониженная активность метионин-содержащего белка COMT (у лиц с аллелем L) может привести к накоплению свободных радикалов, и, как следствие, созданию окислительного стресса и повреждению ДНК.
Одним из эффектов облучения злокачественной опухоли (в данном случае РМЖ) является создание окислительного стресса в опухолевой ткани, приводящего к её повреждению. Наличие вариантного аллеля гена COMT (кодирующего белок СОМТ с низкой активностью) может усугубить этот стресс. Следовательно, можно ожидать, что у носительниц аллеля L реакция опухоли на облучение будет отличаться от реакции опухоли на облучение носительниц аллеля H.
Такое же предположение можно сделать и относительно реакции нормальных тканей на лучевую терапию. Поэтому представляется интересным сравнить выраженность лучевых реакций не только опухоли, но и окружающей опухоль нормальной ткани молочной железы у носительниц разных аллельных форм гена СОМТ.
Результаты таких сравнений могут быть очень важны для индивидуальной оптимизации лучевой терапии с учетом генетических особенностей реакции на нее. В доступной нам научной литературе не удалось найти данных о возможной ассоциации полиморфизма гена СОМТ со степенью выраженности тканевых лучевых реакций.
Материалы и методы
Для выполнения данной работы нами были проанализированы образцы крови 91 женщины, которым диагноз «рак молочной железы» был поставлен в клинике МРНЦ РАМН.
Данные о проведении и результатах лучевой терапии были получены из отделения лучевого и хирургического лечения заболеваний торакальной области с группой лечения заболеваний молочной железы МРНЦ РАМН.
Генотипы СОМТ определяли в образцах геномной ДНК, выделенной из лейкоцитов периферической крови.
Данный анализ проводили следующим образом.
-
1) Сбор и хранение образцов периферической крови
Образцы крови собирали в вакутейнеры, содержащие ЭДТА (для предотвращения свертывания крови), и хранили при -80˚C до выделения ДНК. На данный момент образцы крови содержатся в помещениях Молекулярно-биологической группы МРНЦ РАМН и могут быть использованы при необходимости повторного анализа.
-
2) Выделение ДНК из лейкоцитов периферической крови
Выделение геномной ДНК из клеток включает в себя следующие основные этапы:
-
• Удаление эритроцитов из образца крови (растворы, содержащие 3 % уксусную кислоту).
-
• Лизис лейкоцитов и удаление белковых компонентов клеток (смесь равных частей фенола и хлороформа с добавлением изоамилового спирта).
-
• Очистка полученной ДНК (изопропиловый и этиловый спирты).
Геномную ДНК выделяли с помощью ряда коммерчески доступных наборов: Puregene (Gentra Systems), Wizard Genomic DNA Purification Kit (Promega) и GenElute Mammalian Genomic DNA (Sigma), в соответствии с протоколом производителя. Эти наборы несколько отличаются друг от друга по составу входящих в них веществ, но принцип их действия одинаковый. Вся процедура выделения ДНК проводится в стерильном помещении с использованием чистых пипеток и штативов, одноразовых пробирок и наконечников для пипеток.
-
3) Определение концентрации полученной ДНК
Концентрацию ДНК определяли спектрофотометрическим методом, который основан на определении величины поглощения исследуемым образцом света определенной длины волны. Соотношение между концентрацией образца и интенсивностью проходящего света определяется законом Ламберта-Бера:
It = Io х IO-501, где It – интенсивность проходящего света, I0 – интенсивность падающего света, e – молярный коэффициент поглощения (литр/моль/см), с – концентрация поглощающего свет вещества в образце, l – оптическая длина пути (путь света в толще образца). Величина ecl называется оптической плотностью данного образца и обозначается буквой А или буквами OD (optical density). Таким образом,
A = ecl .
Максимальное поглощение света в растворах нуклеиновых кислот имеет место при длине волны 260 нм. Поэтому для определения концентрации таких растворов применяют спектрофотометры с источником УФ света (ксеноновая или дейтериевая лампа). Основные элементы оптических модулей спектрофотометров таковы: источник света – фокусирующая линза – кювета с раствором образца – фокусирующая линза – щель – рассеивающее устройство (система зеркал и решеток) – фотодиодный детектор.
Одна единица оптической плотности, измеренная на 260 нм при длине оптического пути 1 см, соответствует концентрации двунитевой ДНК, равной 50 мкг/мл.
В данной работе концентрацию ДНК определяли с помощью разных спектрофотометров, включая однолучевой сканирующий УФ-ВИД (модель UV-2800), Lambda-35 производства Perkin Elmers и Genway производства BioRad. Пользовались микрокюветой, благодаря чему можно было определять концентрацию ДНК в малых объемах (70 или 300 мкл).
-
4) Амплификация фрагментов ДНК , содержащих полиморфный сайт СОМТ *H/L, ме тодом ПЦР
ПЦР позволяет амплифицировать (размножить) генный фрагмент в бесклеточной системе, в пробирке, в количестве, достаточном для дальнейшего анализа. Для этого необходимо смешать четыре компонента в определенных пропорциях.
Во-первых, необходима ДНК, выделенная из крови обследуемого человека. Во-вторых, смесь четырех нуклеотидов, из которых состоит всякая ДНК: это материал для амплификации, т.е. для синтеза новых копий ДНК. В-третьих, Taq-полимераза. Это фермент, осуществляющий синтез ДНК. В отличие от других полимераз, которые работают в любом живом организме при температуре около 37˚С, Taq-полимераза лучше всего работает при 72˚С. Более того, она уникально термостабильна: не разрушается даже при 95˚С. Полимеразная цепная реакция, которая идет при высоких температурах, стала возможной только благодаря открытию термостабильной Taq-полимеразы. В-четвертых, необходимы два праймера. Праймеры – это короткие, длиной около 20 нуклеотидов, последовательности ДНК, комплементарные последовательностям, расположенным по краям того генного фрагмента, который необходимо амплифициро-вать. Прямой праймер комплементарен последовательности на 5’-конце одной из двух нитей ДНК, а обратный – последовательности на 5’-конце сестринской нити. И, наконец, последний компонент ПЦР – это буферный раствор, содержащий нужные для реакции ионы и обеспечивающий нужное значение pH.
Для амплификации фрагмента COMT длиной 169 bp (пар оснований, от английского base pairs), содержащего полиморфный сайт G/A (H/L), используют праймеры 5’-ACTGTGGCTACTCAGCTGTG (прямой) и 5’-CCTTTTTCCAGGTCTGACAA (обратный). Реакционная смесь содержит 100 нг геномной ДНК, 0,15 мM каждого dNTP (GeneAmp), 0,5 мкМ каждого праймера и 0,625 Ед. полимеразы HotStarTaq (Quiagen) в общем объеме 25 мкл. Реакция проводится при следующих условиях: денатурация при 95˚C в течение 15 мин, 40 циклов амплификации (30 с при 94˚C, 60 с при 57˚C и 30 с при 72˚C) и 10-минутная элонгация при 72˚C.
-
5) Определение генотипов гена СОМТ с помощью рестрикционного анализа
После этого проводят обработку продуктов ПЦР ферментами рестрикции. Ферменты рестрикции (рестриктазы) можно очень точно определить как биологические ножницы. Рестрикта-зы – это класс белков, которые узнают специфические короткие последовательности ДНК (сайты узнавания) и разрезают ДНК строго в определенном месте (сайте рестрикции). Амплифика-ты COMT подвергали действию рестриктазы Hsp92 II , что приводит к появлению фрагментов длиной 114 bp (если в полиморфном сайте находился аллель COMT-H) и 96 bp (для аллеля COMT-L).
Генотипирование проводится «вслепую» для исполнителя в том смысле, что статус образца ДНК (получен ли он от здоровой женщины или из той или иной группы больных) остается ему неизвестен.
-
6) Электрофорез фрагментов ДНК в полиакриламидном геле
Принцип электрофореза основан на способности движения молекул в электрическом поле в зависимости от суммарного заряда. Скорость перемещения зависит не только от размера и конформации анализируемых молекул, но и от свойств самого геля, главным образом, его концентрации. По длине пути, пройденного образцом в геле за фиксированное время, можно судить о размере и массе анализируемого фрагмента ДНК. Молекулы ДНК длиной от 70 до 500 bp (а именно с такими фрагментами мы работали) за 35-50 минут при напряжении 250300 В успевают пройти расстояние 6-7 см.
Проводится электрофорез в полиакриламидном геле, который готовится на основе 30 %-ной смеси акриламид/бисакриламид (26,6 мл), 3 % аммония персульфата (2,1 мл), дистиллированной воды (61,3 мл) и буферного раствора (TBE, tris-borate-EDTA, 10 мл). Для полимеризации (затвердевания) геля добавляется ТЕМЭД (тетраметилэтилендиамин), в количестве, которое зависит от температуры помещения (25-35 мкл).
Фрагменты визуализируются с помощью окраски гелей этидиум-бромидом (EtBr), который специфически связывается с ДНК (4 мкл этидиум-бромида на 100 мл воды). Для просмотра гелей они просвечиваются УФ. Диапазон длин волн возбуждения этидиум-бромида составляет 254-366 нм, а длина волны испускаемого им свечения равна 590 нм.
В нашей работе ЭФ проводился на двух этапах генотипирования. После амплификации аликвоты продуктов ПЦР подвергают электрофорезу в 8 % полиакриламидном геле, чтобы убедиться в наличии ожидаемых фрагментов. После рестрикции проводят повторный электрофорез для получения конечной информации о генотипе и наличии вариантного аллеля.
Статистическая обработка результатов
Сравнение частот генотипов (категориальные переменные) выполняли с помощью χ 2-теста. В случаях, когда хотя бы одна из ожидаемых частот оказывалась меньше 5, вместо χ 2 использовали точный критерий Фишера. Критерий χ 2 применяли также в тестах гетерогенности при сравнении нескольких средних. Для оценки достоверности тренда (P trend , для определения достоверности убывания или возрастания последовательности из трех и более пропорций) при сравнении нескольких пропорций использовали статистику χ 2 с одной степенью свободы. Статистически значимыми считали различия при p<0,05. При выборе статистических подходов, а также в процессе вычислений руководствовались рекомендациями, содержащимися в руководстве [6].
Применявшиеся терапевтические схемы
При лечении РМЖ важно правильно подобрать и организовать курс терапии. В МРНЦ РАМН используются разнообразные терапевтические схемы, нередко сочетающие лучевую терапию, химиотерапию и оперативное вмешательство. В частности, при лечении обследованной нами группы больных применялись следующие терапевтические схемы:
-
1. Радикальная лучевая терапия: облучение молочной железы по 2 Гр 5 дней в неделю до достижения суммарной очаговой дозы (СОД) 60 Гр.
-
2. Предоперационное облучение (по 3 Гр ежедневно, чередуя молочную железу и подмышечную область, до СОД 24 Гр на молочную железу и 18 Гр на подмышечную область), хи-
- рургическое удаление опухоли и послеоперационное облучение (на лимфоузлы по 2 Гр 5 дней в неделю до СОД 50 Гр).
-
3. Радикальная лучевая терапия (облучение молочной железы по 2 Гр 5 дней в неделю до достижения СОД 60 Гр) и хирургическое вмешательство.
Таким образом, лучевые реакции оценивали у женщин, получивших СОД не менее 50 Гр.
Ассоциации между наличием вариантного аллеля в полиморфном сайте СОМТ*H/L и реакцией нормальных тканей на облучение
Вопросом снижения нагрузки на окружающие опухоль органы занимается отделение клинической дозиметрии и топометрии МРНЦ РАМН. Тем не менее, в процессе облучения опухоли не всегда удается избежать повреждения прилегающих нормальных тканей.
Кожные реакции, наблюдавшиеся в обследованной нами группе больных РМЖ, варьировали от умеренного отека и сухого эпидермита до некроза, требовавшего хирургического вмешательства. Данные по типам реакции нормальной ткани были доступны для 91 больной. Реакции нормальных тканей степеней 0 и 1 (см. классификацию, приведенную выше) мы объединили в группу, характеризующуюся отсутствием реакции; кроме того, поскольку реакция степени 4 (некроз) отмечалась только у одной больной, мы включили этот случай в подгруппу реакций степени 3. Таким образом, мы анализировали три подгруппы, обозначив их как «отсутствие кожной реакции», «слабая реакция» и «средняя и сильная реакция». Данные о числе лиц с реакцией каждого из трех типов представлены в таблице 1.
Таблица 1
Распределение больных РМЖ по типу реакции нормальной ткани на облучение
|
Число больных, n (%) |
||
|
Отсутствие реакции |
54 (58,7 %) 24 (26,1 %) 13 (14,1 %) 1 (1,1 %) |
|
|
Наличие реакции |
слабой степени средней степени сильной степени |
|
|
Всего |
91 (100,0 %) |
|
Сначала сопоставляли данные о наличии или отсутствии какой-либо заметной реакции кожных покровов с генотипами пациенток (т.е. объединили типы «слабая реакция» и «средняя и сильная реакция»). В результате были получены данные, представленные в таблице 2.
Таблица 2
Распределение генотипов и аллельные частоты в полиморфном сайте СОМТ *H/L среди больных РМЖ , у которых наблюдали и не наблюдали реакцию нормальной ткани на терапевтическое облучение
|
Отсутствие кожной реакции |
Наличие кожной реакции |
P |
|
|
COMT-HH COMT-HL COMT-LL COMT-HL+COMT-LL Аллельная частота L |
14 (25,9 %) 30 (55,6 %) 10 (18,5 %) 40 (74,1 %) 0,46 |
5 (13,2 %) 23 (60,5 %) 10 (26,3 %) 33 (86,8 %) 0,57 |
0,289 |
|
0,136 0,170 |
Результаты сравнения данных, приведенных в таблице 2, не позволяют говорить о значимости различий в частоте генотипов между больными, у которых наблюдали лучевые реакции нормальных тканей, и теми, у кого их не было. Однако заметна следующая тенденция: среди больных с повышенной радиочувствительностью нормальных тканей вариантный аллель L встречался чаще, чем в группе пациентов, у которых реакция кожных покровов не наблюдалась. При этом, соответственно, носительниц генотипа COMT-НН было меньше среди больных, чувствительных к облучению.
Более детальный анализ лучевых эффектов – с учетом степени их тяжести – позволил подтвердить эту тенденцию. Распределение генотипов среди а) женщин, не проявивших лучевых реакций нормальных тканей, б) женщин со слабовыраженными реакциями и в) женщин с реакциями средней и сильной степени показано на рисунке 2.
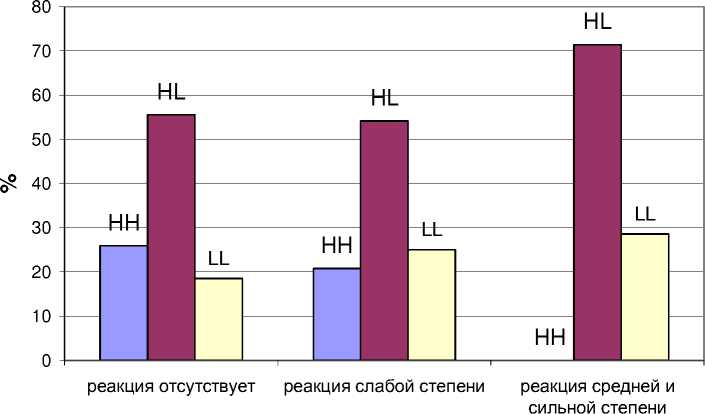
Рис . 2. Распределение генотипов по реакции нормальной ткани на облучение с учетом тяжести лучевых эффектов. По оси ординат – доля женщин с указанным генотипом.
Из рисунка видно, что действительно частота аллеля L тем выше, чем более выражена кожная лучевая реакция. Среди женщин с реакцией средней и сильной степени не было ни одной носительницы генотипа COMT-HH.
Вычисление величины P trend для этих данных показало, что увеличение тяжести лучевых эффектов значимо (P trend =0,046) коррелирует с присутствием вариантного аллеля гена COMT.
Взаимосвязь между тяжестью реакции нормальных тканей на облучение и частотой аллеля L гена COMT можно наглядно изобразить в виде графической зависимости (рис. 3). Выявленная зависимость указывает на то, что пониженная активность фермента COMT служит одной из причин возникновения выраженных лучевых эффектов.
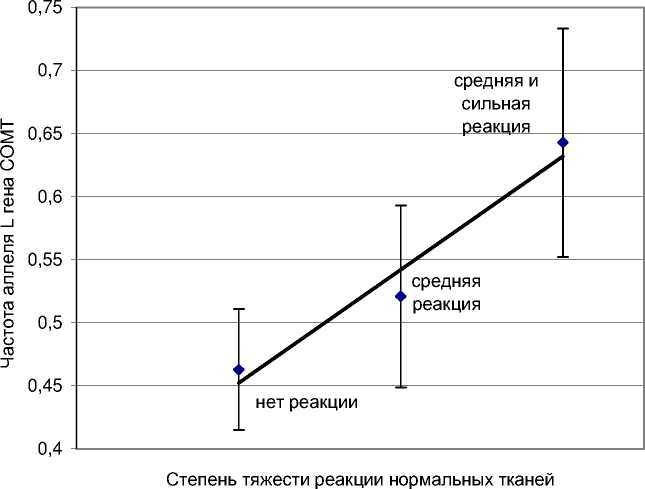
Рис . 3. Средняя частота аллеля L гена COMT у больных РМЖ с разной степенью тяжести реакции здоровых тканей на облучение.
Таблица 3
Распределение генотипов и аллельные частоты в полиморфном сайте СОМТ *H/L среди больных РМЖ с разной реакцией нормальной ткани на терапевтическое облучение в зависимости от тяжести лучевой реакции
|
Реакция отсутствует |
Слабой степени |
Средней и сильной степени |
P trend |
|
|
COMT-HH COMT-HL+ COMT-LL Аллельная частота L |
14 (25,9 %) 40 (74,1 %) 0,46 |
5 (20,8 %) 19 (79,2 %) 0,52 |
0 (0 %) 14 (100,0 %) 0,64 |
0,046 0,094 |
Обсуждение
Главной задачей работы являлась проверка предположения о том, что лучевые реакции могут быть более выражены у лиц, являющихся носителями вариантного аллеля СОМТ-L, поскольку этот аллель предрасполагает к созданию тканевого окислительного стресса. Мы анализировали выраженность лучевых реакций окружающих опухоль нормальных тканей, которые при терапевтическом облучении тоже подвергаются лучевой нагрузке.
Лучевые реакции нормальных тканей были исследованы по клиническим данным (91 человек). На этом материале была выявлена существенная ассоциация индивидуальной лучевой реакции с генотипом СОМТ: средняя аллельная частота L составляла 0,46 у женщин без лучевых реакций, 0,52 – у женщин со слабовыраженными лучевыми реакциями и 0,64 – у женщин со средней и сильной степенью ранних лучевых повреждений нормальных тканей. Тенденция роста указанных величин оказалась значимой при p<0,05 (см. таблицу 3).
Этот результат представляется важным. Изучение реакции нормальных тканей на лучевую терапию имеет большое значение, поскольку в современной медицине уделяется большое внимание методам оптимизации облучения, включая как повышение эффективности уничтожения клеток опухоли, так и сведение к минимуму неблагоприятных последствий для окружающих опухоль тканей. Лучевые поражения очень плохо поддаются лечению. Основываясь на результатах проделанной работы, можно будет планировать курсы лучевой терапии с учетом индивидуальной радиочувствительности больных и назначать более щадящую терапию лицам с генетически заложенной сниженной активностью белка COMT.
Хотелось бы подчеркнуть, что исследования, посвященные роли полиморфизма СОМТ в степени выраженности лучевых реакций, ранее не проводились или, по крайней мере, не публиковались.
Список литературы Лучевые реакции нормальных тканей у больных раком молочной железы: взаимосвязь с аллельными формами гена СОМТ
- Бардычев М.С., Цыб А.Ф. Местные лучевые повреждения. М.: Медицина, 1985.
- Важенин А.В., Воронин М.И., Ваганов Н.В. и др. Лучевая диагностика и лучевая терапия: издание 2-е, переработанное. Челябинск: Иероглиф, 2003.
- Зимарина Т.С., Кристенсен В.Н., Имянитов Е.Н., Берштейн Л.М. Анализ полиморфизма генов CYP1B1 и COMT у больных раком молочной железы и тела матки//Мол. биол. 2004. № 38(3). С. 386-393.
- Чиссов В.И., Старинский В.В., Ременник Л.В. Рак в России на пороге XXI столетия как медицинская и социологическая проблема//Российский онкологический журнал. 1998. № 3. С. 8-21.
- Box H.C., Dawidzik J.B., Budzinski E.E. Free radical-induced double lesions in DNA//Free Radio Biol Med. 2001. P. 856-868.
- Dawson-Saunders B., Trapp R.G. Basic and Clinical Biostatistics, 2nd ed. Norwalk, CT, USA: Appleton and Lange, 1994.
- Grossman M.H., Emanuel B.C., Budarf M.L. Chromosomal mapping of the human COMT gene to 22q11.1-q11.2//Genomics. 1992. V. 12. P. 822-825.
- Huber J.C., Schneeberger C., Tempfer C.B. Genetic modeling of the estrogen metabolism as a risk factor of hormone-dependent disorders//Maturitas. 2002. V. 42. P. 1-12.
- Lachman H.M., Papolos D.F., Saito T. et al. Human catechol-O-methyltransferase pharmacogenetics: description of a functional polymorphism and its potential application to neuropsychiatric disorders//Pharmacogenet. 1996. V. 6. P. 243-250
- Liehr J.G., Fang W.F., Sirbasku D.A., Ari-Ulubelen A. Carcinigenicity of catechol estrogens in Syrian hamsters//J Steroid Biochem. 1986. V. 24. P. 353-356.
- Liehr J.G. Is estradiol a genotoxic mutagenic carcinogen?//Endocr Rev. 2000. V. 21. P. 40-54.
- Nandi S., Guzman R.C., Yang J. Hormones and mammary carcinogenesis in mice, rats, and humans: a unifying hypothesis//Proc Natl Acad Sci USA. 1995. V. 92. P. 3650-3657.
- Palmatier M.A., Min Kang A., Kidd K.K. Global variation in the frequencies of functionally different catechol-O-methyltransferase alleles//Biol Psychiatry. 1999. V. 46. P. 557-567.
- Zhu B.T., Conney A.H. Is 2-methoxyestradiol an endogenous estrogen metabolite that inhibits mammary carcinogenesis?//Cancer Res. 1998. V. 58. P. 2269-2277.


