Макробентос лагунной экосистемы Ермолинской губы (Кандалакшский залив, Белое море): особенности структуры, разнообразие и тенденции изменений
Автор: Столяров Андрей Павлович
Журнал: Вестник Тверского государственного университета. Серия: Биология и экология @bio-tversu
Рубрика: Зоология
Статья в выпуске: 4, 2016 года.
Бесплатный доступ
Изучена видовая, пространственная и трофическая структура макробентоса Ермолинской губы и проанализированы основные изменения, произошедшие с момента ее изучения. Наиболее существенные изменения пространственной структуры сообщества наблюдаются относительно мареографического уровня - от верхней литорали к средней, нижней и сублиторали. В целом в губе Ермолинская можно выделить 4 сообщества макробентоса, различающихся видовым составом, плотностью и биомассой популяций, а также трофической структурой - сообщество верхней литорали с доминированием собирающих детритофагов Hydrobia ulvae, Macoma balthica и скоблильщиков Littorina saxatilis, средней литорали, где преобладали детритофаги H. ulvae, M. balthica и сестонофаги Mya arenaria и в меньшей степени Mytilus edulis; нижней литорали при доминировании фильтраторов M. edulis и в меньшей степени собирающих детритофагов H. ulvae и M. balthica и скоблильщиков L. littorea и сублиторали, где лидирующее положение занимала группировка собирающих детритофагов M. balthica. Постепенное зарегулирование губы, ее заиление и уменьшение связи с морем привело к преобладанию в сублиторали губы литорального комплекса видов, а виды, характерные для сублиторали в 60-е годы прошлого века, сейчас в основном встречаются на входе в губу.
Лагуны, макробентос, структура, тенденции изменений
Короткий адрес: https://sciup.org/146116665
IDR: 146116665 | УДК: 574.5
Текст научной статьи Макробентос лагунной экосистемы Ермолинской губы (Кандалакшский залив, Белое море): особенности структуры, разнообразие и тенденции изменений
Введение. Ермолинская губа является типичным морским прибрежным водоемом лагунного типа. Прибрежные лагуны - это мелководные, в большинстве случаев озеровидные водоемы, отделенные от моря барьером (наносными косами, баром) и связанные с ним (постоянно или временно) одним или несколькими узкими проливами (Kjerfve, 1994; Зданович, Криксунов, 2004; Лабай, 2011).
Прибрежные лагуны в геологическом времени являются эфемерными экосистемами. В течение относительно короткого временного периода они могут менять свою форму и размеры под воздействием естественных процессов (Dennison et al., 2009). Большинство лагун сформированы в течение периодов повышения уровня моря, так называемых периодов трансгрессии. Чаще всего лагуны образуются, когда растущее море захватывает относительно плоский берег, формируя на выходе барьер. В периоды понижения уровня моря (регрессии), происходит обратный процесс - наступления суши и деградации лагун (уменьшение связи с морем, понижение солености, повышение скорости осадконакопления, уменьшение размеров и т.д.). В лагунах, которые мы рассматриваем как особый тип эстуарных систем, в силу их мелководности и относительной замкнутости бассейна наблюдаются заметные изменения абиотических факторов (солености, характера грунта, содержания в нем органических веществ, pH и Eh среды, колебаний температуры, времени осушения литорали и т.д., что приводит к формированию нескольких разновыраженных и разнонаправленных изменений (градиентов) видовой структуры сообществ живых организмов (Хлебович, 1974, 2012; Junoy, Vietez, 1990; Сафьянов, 1996; Meire et al., 2005; Столяров, Бурковский, 2005; Бурковский, 2006; Бергер, 2007; Лисицын, 2008; Столяров, 2012, 2013; Montagna et al., 2013). Наиболее важные из них — это продольные изменения (от кутовых участков к мористым - параллельно береговой линии) и вертикальные (от верхней литорали и соленого марша к нижней и сублиторали -перпендикулярно береговой линии) (De Wit, 2011; Столяров, 2013).
Ермолинская губа представляет в значительной степени обособленную акваторию со специфическими абиотическими условиями обитания для населяющих ее сообществ живых организмов. Это один из многочисленных небольших заливов Белого моря, отделенный от основного бассейна мелководным порогом.
Надо отметить, что детальное исследование макробентоса Ермолинской губы последний разы проводилось в 1957, 1962 и 1965 гг. (Броцкая и др., 1963; Кузнецов, 1970). Основное внимание в данных исследованиях было сосредоточено в основном на сублиторальных сообществах (их видовой, пространственной и трофической структуре). В нашей работе мы постарались равномерно охватить все районы и зоны Ермолинской губы - от соленого марша и верхней литорали до средней, нижней и сублиторали, а также от куга губы, куда впадает два ручья (один довольно крупный), до выхода из нее, где располагается обширная мидиевая банка. В задачу нашего исследования входило изучение особенностей видового состава, пространственной и трофической структуры сообществ макробентоса как одного из важнейших элементов мелководной прибрежной экологической системы лагунного типа, а также на тех изменениях, которые произошли за последние 55 лет с начала исследования Ермолинской губы (Броцкая и др., 1963; Кузнецов, 1970).
Методика. Исследование макробентоса губы Ермолинской проводили в июле 2013 (литораль) и в начале августа 2014 гг. (сублитораль) (рис. 1).
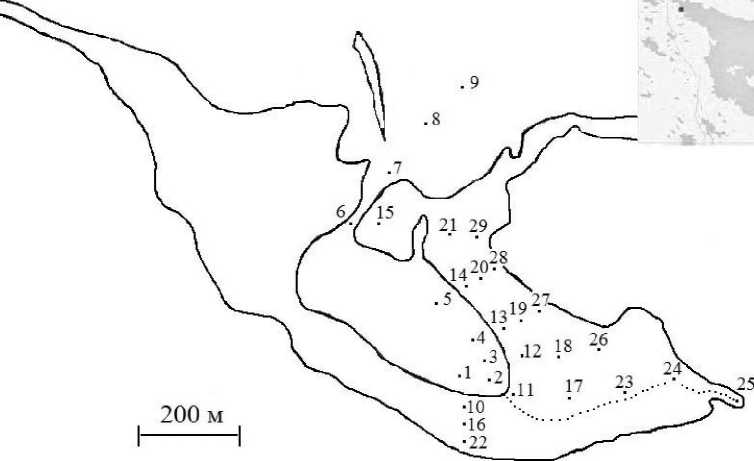
Рис. 1. Карта-схема района исследования: цифрами обозначены станции, прерывистой линией ручей
Шесть литоральных разрезов были взяты последовательно вдоль восточного берега в направлении от кутового района в сторону мористой области. Каждый разрез представлял собой 3 станции, соответствующие трем горизонтам литорали: нижнему, среднему и верхнему. Дополнительно к ним были отобраны пробы с двух станций, расположенных в самом куту губы в районе большого ручья - в начале ручья ив 100 м от него на выходе из основного русла (рис. 1). В суб литорали 6 станций были взяты напротив шести литоральных разрезов, а седьмая, восьмая и девятая - на выходе из губы (рис.1). В целом пробы отбирались с 29 станций, включая сублиторальные. В приливно-отливной полосе на каждой станции брали два вида проб -рамками 12.5 на 12.5 см и 25 на 25 см. Мелкие организмы, такие, как Hydrobia ulvae, мелкие полихеты и олигохеты, собирали на участке 12.5 на 12,5 см общей площадью 1/64 м2 до глубины 8-10 см. Организмы средних размеров учитывали под рамкой 25 на 25 см общей площадью 1/16 м2 до глубины залегания плотной безжизненной глины (20-35 см). Крупных беспозвоночных, глубоко зарывающихся в грунт (Arenicola marina и Муа arenaria\ учитывали по норкам на площади 1 м2 и путем выкапывания пробных экземпляров. На нижней литорали (а иногда и в средней) к стандартному пробоотбору добавлялся отбор в скоплениях Mytilus edulis. Дополнительно определяли проективное покрытие пляжа скоплениями мидии. Грунт, взятый с площади 1/64 и 1/16 м2, аккуратно промывался на сите с ячеей 0,5 мм и 1 мм соответственно. Промытые пробы просматривались прижизненно в лаборатории. Для расчета биомассы определяли сырой вес организмов. В некоторых случаях биомассу определяли по ранее полученным соотношениям между средними размерами животного и его биомассой. Также определяли биомассу произрастающих здесь растений (сырой вес) с учетом их проективного покрытия. Сублиторальный макробентос отбирали с помощью дночерпателя Экмана-Берджи с площадью захвата 1/40 м2 или 0,025 м2 по два дночерпателя на станцию. Грунт промывали на сите с ячеей 1 мм.
Параллельно со сбором гидробиологического материала измеряли важнейшие параметры среды: соленость на малой (конец отлива - начало прилива) и полной воде (конец прилива - начало отлива) (с помощью кондуктометра), характер грунта (визуально на четыре категории: ил, песчаный ил, илистый песок, песок), pH и Eh среды, а также глубину в сублиторали с помощью маркированного конца с якорем. Пробы воды на соленость в приливно-отливной полосе отбирали с поверхности у уреза воды, а в сублиторали - в придонном слое воды.
Для каждой станции были получены плотности и биомассы видовых популяций, а также посчитаны индексы видового разнообразия Шеннона (Shannon, Weaver, 1949).
Был проведен статистический анализ данных. Для оценки сходства локальных сообществ, формирующихся на разных станциях (количественные данные), проводили кластерный анализ методом среднего присоединения на основе матриц сходства Пианки (Pianka, 1974), реализованный в пакете прикладных программ SYSTAT 13.1 (Systat Software, Inc., 2009) и ECOS 1.3 (Азовский, 1993): s ^ Pik X Pjk
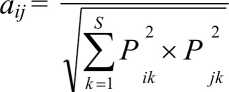
где Pik, Pjk - доля ^-го вида для станций 1 иу, 5- число видов.
Этот индекс мало чувствителен к различиям по редким признакам, что позволяет нивелировать влияние «хвоста» случайных видов (ECOS 1.3). '
При проведении кластер-анализа по качественному составу макрозоофитобентоса использовали индекс сходства Съеренсена (Sorensen, 1948):
К = 2с/(а + Ь), где с - число общих видов для станций X и У, а и b - число видов, отмеченных лишь у одной из станций.
Для выбора приемлемой степени дробности полученных кластеров использовался критерий «значимого сходства», который рассчитывается как верхняя 95% доверительная граница среднего (по всей совокупности) сходства между станциями.
В качестве меры нарушений в структуре бентосных сообществ использовался ABC-индекс (Warwick, 1986; Meire, Dereu, 1990):
АВО^ (в, - NJ I N, где Bi и Ni - накопленные %% биомассы и численности i первых по порядку видов, W- общее число видов.
Значения АВС-индекса могут принимать как отрицательные, так и положительные значения. Положительные значения индексов соответствуют нормальным, а отрицательные - нарушенным сообществам.
Высокие положительные значения индексов означают, что доминирование по биомассе выражено значительно сильнее, чем по плотности видовых популяций, а отрицательные значения АВС-индекса, что кривая рангового распределения «вид - обилие» убывает более резко для плотности популяций, чем для биомасс.
Результаты. Абиотические условия и характеристика района исследования. Губа Ермолинская расположена в 2,5 км от ББС МГУ (Кандалакшский залив, 66° с.ш. и 33° в.д.) и имеет ограниченное сообщение с морем, особенно в малые воды - остается один узкий пролив шириной 10-15 м и глубиной около 1 м (рис. 1). Длина губы составляет около 1 км с учетом кутового района, ширина в средней части - 0.4-0.5 км, наибольшая глубина в центральной части губы достигает 4-5 м в малую воду.
Осушная полоса губы в силу ее пологости занимает значительную часть берега (до 400 м) и защищена от сильного ветра и течений со стороны моря мелководными порогами (лудами, коргами, косами) (рис. 1). Это типичная беломорская илисто-песчаная литораль с характерным поясным делением на нижний, средний и верхний горизонты с обширным соленым маршем, большей частью заливаемым при сизигийных приливах. При этом кут губы сильно заилен, где скапливается большое количество органических веществ и куда впадает 2 ручья (один побольше в самом кугу и другой поменьше в 300 м от него), протекающие через всю литораль и частично соединяющиеся в районе нижнего горизонта верхней литорали. По мере движения от кутовой части губы в сторону моря илисто-песчаная литораль, преобладающая на большей части губы, переходит в песчано-каменистую (песок разной зернистости) на выходе из губы и уменьшается в размерах (от 400 -500 м в кугу до 150 - 200 м в мористой области). На выходе из губы в районе порогов расположена обширная мидиевая щетка (в основном в нижней литорали). Сублитораль Ермолинской губы представлена главным образом мягкими илистыми грунтами чаще с значительным содержанием детрита (много полуразложившихся морских трав и водорослей -зостера и фукусы) и запахом сероводорода. Только на выходе из губы в районе активной гидродинамики мягкие илистые осадки сменяются песчаными грунтами. В табл. 1 и 2 представлены показатели основных абиотических факторов Ермолинской губы.
Таблица 1
Параметры среды на литорали Ермолинской губы в июле 2013 г.
|
Разрезы |
Станции |
Абиотические факторы |
||
|
Характер грунта |
Соленость, %о |
|||
|
Малая вода |
Полная вода |
|||
|
1 (кут) |
Ниж. л. |
Ил |
19-20 |
21-22 |
|
Ср. л. |
Ил |
|||
|
Верх. л. |
Ил. песок, мелкозер. песок |
|||
|
2 |
Ниж. л. |
Ил |
19-20 |
21-22 |
|
Ср. л. |
Ил, песчанистый ил |
|||
|
Верх. л. |
Илистый песок |
|||
|
3 |
Ниж. л. |
Ил |
19-20 |
21-22 |
|
Ср. л. |
Ил |
|||
|
Верх. л. |
Песч. ил, ил. песок |
|||
|
4 |
Ниж. л. |
Ил |
19-20 |
21-22 |
|
Ср. л. |
Песч. ил, ил |
|||
|
Верх. л. |
Ил, мелкозер. песок |
|||
|
5 |
Ниж. л. |
Ил |
19-20 |
21-22 |
|
Ср. л. |
Песч. Ил |
|||
|
Верх. л. |
Ил. Песок |
|||
|
6 (м.б.) |
Ниж. л. |
Ил. песок с ракушей |
20-21 |
21-22 |
|
Ср. л. |
Ил. песок, мелкозер. песок |
|||
|
Верх. л. |
Мелкозер. песок, ил. песок |
|||
Примечание. Станции и разрезы расположены в соответствии с рис.1: 1 - нижняя, 2 -средняя, 3 - верхняя литораль и т. д. М.б. - мидиевая банка.
Таблица 2
Параметры среды в сублиторали губы Ермолинская в начале августа 2014 г.
|
Разрезы |
Станции |
Абиотические факторы |
|||||
|
Характер грунта |
Глубина (м) |
pH |
Eh |
Соленость, %о |
|||
|
в повеу слое (1-2 |
IXHOCTHOM грунта см), МВ |
Малая вода |
Полная вода |
||||
|
1 |
1 |
Ил |
1 |
6,8 |
-180 |
19-20 |
21-22 |
|
2 |
2 |
Ил |
1,5-2 |
7,0 |
-100 |
19-20 |
21-22 |
|
3 |
3 |
Ил |
2-2,5 |
7,0 |
-180 |
19-20 |
21-22 |
|
4 |
4 |
Ил |
3 |
7.1 |
-150 |
19-20 |
21-22 |
|
5 |
5 |
Ил |
4-5 |
7,1 |
-160 |
20-21 |
21-22 |
|
6 |
Ил |
1 |
7,4 |
-150 |
20-21 |
21-22 |
|
|
6 |
7 |
Ил |
1,5-2 |
7,2 |
-150 |
20-21 |
21-22 |
|
8 |
Ил |
2,5-3 |
7,1 |
-150 |
20-21 |
21-22 |
|
|
9 |
Ил |
2,5-3 |
7,1 |
-170 |
20-21 |
21-22 |
|
Примечание. Станции и разрезы расположены в соответствии с рис.1.
Видовой состав и общие показатели структуры сообщества.
Всего в губе Ермолинской летом 2013, 2014 гг. было встречено 36 видов зообентоса и 9 видов морских трав и водорослей. В составе зообентоса преобладали полихеты (10 видов) и брюхоногие моллюски (8 видов), меньше было встречено двустворчатых моллюсков (4 вида) и ракообразных (5 видов) и не найдено ни одного вида иглокожих. Зато были обнаружены представители насекомых (3 вида) и олигохет (2 вида) (табл. 3).
Полученные данные по качественному составу макробентоса свидетельствуют о менее морском характере фауны этого замкнутого мелководного бассейна по сравнению с внешней акваторией, что является, по-видимому, следствием большей его опресненности, пусть даже только в определенном месте (район верхней литорали и соленого марша) и в определенное время (ранней весной во время снеготаяния или осенью во время сильных дождей и т.д.).
Таблица 3
Виды макробентоса, встреченные в губе Ермолинской летом 2013, 2014 гг.
|
Макробентос |
Литораль 07.2013 г. |
Сублитораль 08.2014 г. |
|
Зообентос: |
||
|
кл. Polychaeta |
||
|
7. Harmothoe imbricate (L.) |
- |
+ |
|
2. Nereimyra punctata (Muller) |
- |
+ |
|
3. Pygospio elegans Clapared |
+ |
+ |
|
4. Polydora quadrilobata Jacobi |
- |
+ |
|
5. Scoloplos armiger (0. F. Muller) |
+ |
- |
|
6. Arenicola marina (Linnaeus) |
+ |
+ |
|
7. Fabricio sabella Ehrenberg |
+ |
- |
|
8. Micronephthys minuta (Theel) |
- |
+ |
|
9. Capitella capitata (Fabricius) |
- |
+ |
|
10. Terebellides stroemi Sars |
+ |
- |
|
кл. Oligochaeta |
||
|
11. Paranais litoralis (0. F. Muller) |
+ |
- |
|
72. Tubificoides benedem (Udekem) |
+ |
+ |
|
кл.Gastropoda |
||
|
13. Littorina saxatilis (Olivi) |
+ |
- |
|
14. Littorina obtusata (Linnaeus) |
+ |
- |
|
75. Littorina littorea (Linnaeus) |
+ |
+ |
|
16. Hydrobia ulvae (Pennant) |
+ |
+ |
|
77. Buccinum undatum L. |
+ |
- |
|
18. Onoba aculeus (Gould) |
+ |
+ |
|
19. Cylichnoides occultus (Mighels et Adams) |
+ |
- |
|
20. Lacuna neritoidea (Gould) |
+ |
- |
|
кл. Bivalvia |
||
|
27. Mytilus edulis Linnaeus |
+ |
+ |
|
22. Macoma balthica (Linnaeus) |
+ |
+ |
|
23. Mya arenaria Linnaeus |
+ |
- |
|
24. Musculus laevigatus (Gray) |
- |
+ |
|
кл. Crustacea |
||
|
25. Gammarus duebeni Lilljeborg |
+ |
- |
|
26. Jaera albifrons (Leach) |
+ |
- |
|
27. Pontoporeia femorata Kroyer |
- |
+ |
|
28. Crassicorophium bonellii (Milne Edwards) |
- |
+ |
|
29. Atylus carinatus (Fabricius) |
- |
+ |
|
кл.Insecta |
||
|
30. Chironomus salinarius Kieffer |
+ |
+ |
|
31. Cladotanytarsus mancus Walker |
+ |
+ |
|
32. Bezzia nobilis (Winertz) |
+ |
- |
|
тип Nemathelminthes |
||
|
33. Halicriptus spinulosus Siebold |
+ |
+ |
|
34. Priapulus caudatus Lamark |
+ |
- |
|
тип Nemertini |
||
|
35. Amphiporus lactifloreus (Johnston) |
+ |
+ |
|
36. Linens gesserensis (0. F. Muller) |
+ |
- |
|
Макрофиты (морские травы и водоросли): |
||
|
7. Puccinellia maritima (Hudson) Pari. |
+ |
- |
|
2. Triglochin maritima Linnaeus |
+ |
- |
|
3. Salicornia pojarkovae N. Semenova |
+ |
- |
|
4. Aster tripolium Linnaeus |
+ |
- |
|
5. Ruppia maritima Linnaeus |
+ |
- |
|
6. Zostera marina Linnaeus |
+ |
+ |
|
7. Cladophora sericea (Hudson) Kiitzing |
+ |
- |
|
8. Fucus vesiculosus Linnaeus |
+ |
+ |
|
9. Fucus distichus Linnaeus |
+ |
- |
Примечание. «+» - наличие вида, «-» - вид не найден.
Для Ермолинской губы характерно массовое развитие в нижней литорали морской травы Zostera marina, которая образует здесь сплошной ковер (преобладает в кугу и центральной части губы). Надо отметить, что морские травы (за исключением зостеры) были приурочены главным образом к верхней литорали и соленому маршу (в основном кутового и центрального районов), а морские водоросли (фукусы и Cladophora sericea) - к нижней и частично средней литорали в основном центрального и мористого районов губы. В целом надо отметить, что максимальная биомасса растений наблюдалась в нижней литорали (преобладают Z. marina, фукусы и С. sericea), в 1,5-2 раза она была ниже в средней (преобладают Salicornia pojarkovae, Ruppia maritima, C. sericea и выбросы Z. marina, фукусов (меньше) и верхней литорали (преобладают солончаковые растения).
Интегральные показатели структуры сообщества макрозообентоса (видовое разнообразие, общая плотность, общая биомасса) в губе Ермолинская преимущественно увеличивались от верхней литорали к средней и нижней и снижались к сублиторали. Снижение общих показателей структуры сообщества в сублиторали по сравнению с нижней и средней литоралью вызвано значительным заилением дна этого водоема и снижением плотности популяций или отсутствием видов, характерных для этих горизонтов (Л/. edulis, L. littorea, L. saxatilis, Mya arenaria, H. ulvae, T. benedeni) при доминировании менее многочисленных Macoma balthica, Nereimya punctatata, Capitella capitata, Arenicola marina. Более высокие показатели общей плотности, биомассы и видового разнообразия сообщества макробентоса в средних и особенно в нижних горизонтах осушной полосы обусловлены более благоприятными условиями жизни в этих биотопах - меньшее опреснение и заиление. Сообщества верхней литорали и соленого марша в силу напряженных условий жизни для большинства беспозвоночных животных (значительное осушение и опреснение, а в куту и центральной части еще и сильное заиление) были представлены весьма скудно и бедно и в основном мелкими эвритопными видами - моллюсками Н. ulvae и олигохетами Paranais litoralis и Т. benedeni (меньше) (табл.4).
Таблица 4
Общие показатели структуры сообщества макрозообентоса губы Ермолинской
|
Интегральные показатели |
Районы исследования (разрезы и станции) |
||||||||
|
1 р-з кут |
2 р-з |
3 р-з |
4 р-з |
5 р-з |
6 р-з (м. д.) |
Море |
|||
|
Сублитораль |
1ст. |
2ст. |
Зет. |
4ст. |
5 ст. |
бет. |
7ст. |
8ст. |
9ст. |
|
5 |
7 |
5 |
6 |
6 |
6 |
4 |
7 |
6 |
8 |
|
N, экз/м2 |
1440 |
1880 |
4000 |
1080 |
560 |
280 |
1160 |
680 |
1200 |
|
В, г/м2 |
327 |
37 |
35 |
206 |
96 |
1.3 |
291 |
34 |
60 |
|
Н |
2,8 |
1,4 |
1,2 |
1,5 |
2,3 |
1,8 |
2,3 |
2,4 |
1,9 |
|
Ниж. лит. |
Юст. |
Пет. |
12ст. |
13 ст. |
14ст. |
15ст. |
|||
|
5 |
9 |
6 |
7 |
9 |
7 |
16 |
|||
|
N, экз/м2 |
12239 |
3139 |
6717 |
9612 |
17538 |
8183 |
|||
|
В, г/м2 |
369 |
100 |
598 |
271 |
371 |
15741 |
|||
|
Н |
0,7 |
1,3 |
0,8 |
1,2 |
0,5 |
2,3 |
|||
|
Ср. лит. |
16ст. |
17ст. |
18ст. |
19ст. |
20ст. |
21 ст. |
|||
|
S |
11 |
5 |
12 |
12 |
5 |
9 |
|||
|
N, экз/м2 |
7216 |
12044 |
13625 |
18324 |
4996 |
9272 |
|||
|
В, г/м2 |
297 |
78 |
244 |
500 |
196 |
460 |
|||
|
Н |
0,9 |
1,3 |
1,1 |
1,4 |
0,4 |
0,8 |
|||
|
Верх. лит. |
22ст. |
23ст. |
26ст. |
27ст. |
28ст. |
29ст. |
24ст. |
25ст. |
|
|
5 |
2 |
3 |
4 |
4 |
5 |
6 |
4 |
4 |
|
|
N, экз/м2 |
3008 |
832 |
2368 |
3392 |
7104 |
4096 |
1158 |
2771 |
|
|
В, г/м2 |
15,4 |
51,4 |
55,6 |
48,8 |
86,4 |
54,7 |
29,0 |
16,7 |
|
|
Н |
1,0 |
1,3 |
0,9 |
0,6 |
0,7 |
0,8 |
0,8 |
1,0 |
|
Примечание. S - число видов. N - общая плотность. В - общая биомасса. Н - индекс Шеннона по плотности популяций. М. д. - мидиевая банка. Станции 24 и 25 были взяты в русле большого ручья.
Наиболее значительные изменения в продольном направлении от кутовых районов к мидиевой банке наблюдались в средней и нижней литорали, обусловленные сменой гидрологических условий на выходе из губы (зона повышенной гидродинамики) и массовым развитием там сообщества неподвижных сестонофагов М. edulis (до 15576 г/м2). Поселения М. edulis встречались практически на всем протяжении губы (преимущественно в нижнем горизонте литорали), однако если на выходе из губы они образовывали мощные щетки, то в куту были обнаружены лишь единичные экземпляры, заносимые приливными течениями. В верхней литорали и в сублиторали продольный градиент структуры сообщества менее выражен.
Таким образом, изменения структуры сообщества макробентоса происходят как в вертикальном (от верхней литорали к средней, нижней и сублиторали), так и продольном (от кутовых районов к мористым) направлении. Однако продольный градиент структуры сообщества выражен слабее и не так резко, как вертикальный.
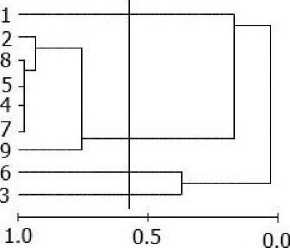
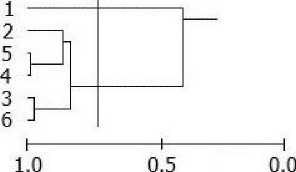
Пространственная структура сообществ (сходство станций). При анализе дендрограмм сходства станций по качественному составу макрозоофитобентоса или биомассе видовых популяций макрозообентоса (кластерограммы практически повторяют друг друга) на уровне значимого сходства можно выделить сообщества сублиторали (ст. 8-4), среднего и нижнего (ст. 15-21) горизонта литорали и верхней литорали (ст. 29 - 22 и ст. 25, 24) (рис. 2, а).
Надо отметить, что сообщества нижней и средней литорали имели большее сходство видовой структуры, чем сообщества сублиторали и нижней литорали, с одной стороны, и сообщества верхней и средней литорали с другой (рис. 2, а). Кроме того, в группе станций нижней и средней литорали (15-21) можно выделить подгруппу станций (на высоком уровне сходства > 0,75) в основном нижней литорали (ст. 16-12), что свидетельствует о большей однородности структуры сообщества нижней литорали по сравнению со средней (рис. 2, а). Различия двух групп станций верхней литорали (ст. 29 - 22 и ст. 25, 24) связаны с тем, что станции 25 и 24 расположены в русле большого ручья и по своим биотическим показателям (видовое разнообразие, плотность, биомасса) несколько отличаются (много олигохет Paranais litoralis, присутствует Муа arenaria) от остальных станций верхней литорали. Впрочем, это неудивительно, т. к. в малую воду русло ручья покрыто небольшим количеством воды. Отметим, что отличия станции 9 (сублитораль) от остальных сублиторальных, станции 27 (верхняя литораль) от верхнелиторальных и станции 17 (средняя литораль) от среднелиторальных станций в основном связаны с присутствием или отсутствием макрофитов.
Для выявления структурного сходства и различий в распределении макробентосных сообществ вдоль продольной оси Ермолинской губы был проведен кластерный анализ для каждого горизонта литорали в отдельности (по биомассе видовых популяций зообентоса на основе коэффициента Пианки). В целом наибольшее сходство видовой структуры демонстрируют сообщества нижней литорали (среднее сходство 0,73), меньшее - верхней (0,47), средней (0,40) и сублиторали (0,43). Высокая интегрированность сообщества нижней литорали объясняется лучшей аэрированностью этого биотопа (большая прибойность) по сравнению с сублиторалью и выше расположенными горизонтами приливно-отливной зоны и обилием доступной пищи (макрофитов, фитопланктона и детритных частиц различной природы) для популяций неподвижных сестонофагов М.
edulis и сопутствующих видов - L. littorea, М. balthica и мелких Н. ulvae.

б
В
д
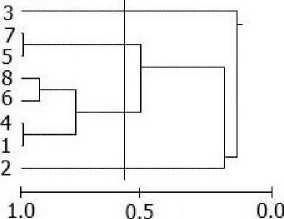
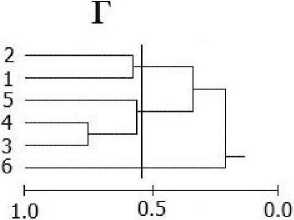
Рис. 2. Дендрограмма сходства локальных сообществ (станций) по качественному составу макрозоофитобентоса (коэффициент Съеренсена) (а) в губе Ермолинская (ст. 1-29: 1-9 сублитораль, 10-15 нижняя, 16-21 средняя, 22-29 верхняя литораль) и по биомассе популяций (индекс Пианки) в сублиторали (б), нижней (в), средней (г) и верхней (д) литорали: вертикальной линией показан уровень значимого сходства. Нумерация станций согласно рис. 1.
Кластер-анализ, выполненный для сублиторальных станций на уровне значимого сходства, позволяет выделить одну группу станций (2, 8, 5, 4, 7, 9), имеющих высокое сходство в распределении видов, и три станции (1, 3, 6), не имеющих сходства ни с одной из станций, что связано с разными условиями существования гидробионтов в кугу и в районе мидиевой банки (рис. 2, б). В нижней литорали все станции группируются в один кластер на уровне сходства 0.84 за исключением станции 1 кутового района губы, которая была не сходна с остальными (рис. 2, в). В средней литорали выделяется две группы станций — кутового (ст. 1, 2) и мористого (ст. 5, 4, 3) районов, а также станция 6, имеющая низкое сходство с остальными станциями и расположенная в районе мидиевой щетки (рис. 2, г). В верхней литорали на уровне значимого сходства практически все станции группируются в один кластер (1, 4-8) за исключением станций 2 и 3, расположенных в кугу губы в районе большого ручья (рис. 2, д).
Таким образом, в Ермолинской губе мы можем выделить сообщества верхней, средней, нижней литорали и сублиторали, а также сообщество мидиевой банки, расположенное на выходе из губы в зоне повышенной подвижности водных масс с характерными для данного биотопа твердыми песчаными осадками и сообщество кутового района с преобладанием мелких и многочисленных Н. ulvae и Tubificoides benedeni, биотоп которого значительно заилен и представлен тонкими мягкими илистыми грунтами и характеризуется замедленной гидродинамикой.
Трофическая структура сообщества макробентоса. Из табл. 5 видно, что в вертикальном направлении (от верхней литорали к средней, нижней и сублиторали) наблюдается изменение трофической структуры сообщества от преобладания группировок, собирающих детритофагов (в основном Н. ulvae и, в меньшей степени, М. balthica) и скоблильщиков (Я saxatilis) в верхней литорали к преобладанию детритофагов (Я. ulvae, М. balthica) и неподвижных сестонофагов (Муa arenaria и в меньшей степени М. edulis) в средней и далее к доминированию в основном неподвижных сестонофагов (М. edulis) и, в меньшей степени, собирающих детритофагов (Н. ulvae и М. balthica) и скоблильщиков (Ldittorea) в нижней литорали и, наконец, к преобладанию группировок собирающих детритофагов (в основном М. balthica) и грунтоедов (Л. marina) в сублиторали.
В продольном направлении трофическая структура сообщества макробентоса немного менялась особенно в кутовом районе, где в основном преобладали детритофаги (Я. ulvae, Tubificoides benedeni) и скоблильщики (L. saxatilis, L. litorea) и в районе мидиевой щетки, где доминировали неподвижные сестонофаги М. edulis. При этом трофическая структура сообществ верхней литорали мало менялась на всем протяжении губы.
Таблица 5
Трофическая структура сообщества макрозообентоса губы Ермолинской
|
Трофические группы |
Районы исследования |
Районы исследования |
|
Сублитораль |
Средняя литораль |
|
|
С,О (%) |
9±9 |
10,5±6,2 |
|
НС (%) |
4Д±3,2 |
40,2± 11,1 |
|
ПС (%) |
1Д±Е0 |
0 |
|
Д(%) |
72,3±10.3 |
48,4±10,6 |
|
Г (%) |
4,9±4,5 |
0,2±0,1 |
|
Х(%) |
4,8±1,7 |
0,2±0,1 |
|
П(%) |
3,7±3,6 |
0,5±0,5 |
|
Нижняя литораль |
Верхняя литораль |
|
|
С,О (%) |
23,8±10,3 |
22,2± 11,8 |
|
НС (%) |
53,3±12,1 |
11,0±9,6 |
|
ПС (%) |
0 |
0 |
|
Д (%) |
22,4±7,0 |
66,5±13,3 |
|
Г (%) |
0,1±0,1 |
0 |
|
Х(%) |
0,3±0,2 |
0,3±0,2 |
|
П(%) |
0,1±0,1 |
0 |
Примечание. С, О - скоблильщики, обгрызатели, НС - неподвижные сестонофаги, ПС - подвижные сестонофаги, Д - собирающие детритофаги, Г - грунтоеды (безвыборочно заглатывающие грунт), X - хищники, П - полифаги. % — % от общей биомассы сообщества (средние значения).
Таким образом, в пределах бентали Ермолинской губы можно различать сообщества верхней литорали с доминированием собирающих детритофагов Н. ulvae, М. balthica и скоблильщиков L. saxatilis, средней литорали, где преобладали детритофаги Н. ulvae, М. balthica и сестонофаги Муа arenaria и в меньшей степени М. edulis; нижней литорали при доминировании сестонофагов М. edulis и в меньшей степени собирающих детритофагов Н. ulvae, М. balthica и скоблильщиков L. littorea и сублиторали, где лидирующее положение занимала группировка собирающих детритофагов М. balthica (в основном) и грунтоедов Л. marina. Также хорошо выделяется сообщество плотных поселений М. edulis, расположенное на выходе из губы преимущественно в нижней и средней литорали и сообщество мелких детритофагов Н. ulvae, Т. benedeni и более крупных скоблильщиков L. littorea или L. saxatilis в куту губы (вся прибрежная зона).
Нарушение структуры сообщества и ЛВС-индексы.
В Ермолинской губе, бенталь которой очень сильно заилена за исключением района мидиевой банки (расположенной на выходе из нее), показатели ABC-индексов во всей литоральной зоне были отрицательными и только в районе мидиевой банки в нижней и средней литорали принимали положительные значения. В сублиторали, где доминировали более крупные животные - моллюски М. balthica, L. littorea, полихеты A. marina, показатели ABC-индексов в основном принимали положительные значения. Исключение представляет кутовой район (разрезы 2, 3), где индексы были отрицательными или приближались к нулю, что объясняется преобладанием там более мелких популяций Н. ulvae и Т. benedeni (табл. 6).
Таблица 6
Показатели ABC-индексов в Губе Ермолинская
|
Бенталь |
Показатели АВС-индекса |
||||||||
|
1р-з |
2р-з |
Зр-з |
4р-з |
5р-з |
бр-з |
7р-з |
8р-з |
9р-з |
|
|
Сублит. |
+31 |
+2,5 |
-4,0 |
+11 |
+23 |
+9,4 |
+22 |
+22 |
+5,2 |
|
Ниж. Лит. |
-3,2 |
-13,0 |
-4,5 |
-9,3 |
-12,5 |
+13,4 |
|||
|
Сред. Лит. |
-5,7 |
-7,6 |
-10 |
-8,7 |
-26,9 |
+10,9 |
|||
|
Верх. Лит. |
- |
- |
-7,6 |
-16,3 |
-13,2 |
-11,6 |
|||
Отрицательные значения ABC-индексов свидетельствуют о нарушенности структуры сообществ макробентоса в основной части Ермолинской губы и преобладании там мелких форм беспозвоночных животных.
Обсуждение. Ермолинская губа относится к мелководным водоемам лагунного типа с затрудненным водообменом с внешней акваторией (в отлив остается узкий мелководный пролив) и обедненной специфической (в основном литоральной) фауной и флорой. В силу зарегулированности губы внутри ее акватории наблюдается повышенное осадконакопление и отложение значительных количеств минеральной и органической взвеси. Практически вся бенталь лагуны представлена мягкими илистоглинистыми осадками. Даже в районе мидиевой банки есть участки с илисто-песчаными отложениями. Пожалуй, эта губа самая грязная и топкая из всех рядом расположенных губ. Ее можно охарактеризовать как одну большую няшу за исключением района мидиевой щетки, расположенной на выходе из губы в зоне активной гидродинамики. В губе наблюдается хорошо выраженный вертикальный градиент структуры сообществ макробентоса (от верхней литорали к средней, нижней и сублиторали) и менее выраженный продольный - от кутовых наиболее заиленных местообитаний к мористым песчанистым. При этом интегральные показатели структуры сообщества макрозообентоса
(видовое разнообразие, общая плотность, общая биомасса) в губе Ермолинская преимущественно увеличивались от верхней литорали к средней и нижней и снижались к сублиторали, а в продольном направлении - в основном увеличивались от кутовых районов в сторону мидиевой банки.
Отметим одну интересную особенность сублиторального сообщества макробентоса данной экосистемы - это преобладание в сублиторали губы литорального комплекса с доминированием М. balthica в центральной части губы и Н. ulvae в кутовой. Большинство второстепенных видов зообентоса также имеют литоральную природу. Конечно же, сразу возникает аналогия с типичными эстуарными экосистемами (соленость меняется в широких пределах) и тем же Балтийским морем (по существу являющимся бесприливным эстуарием), где в сублиторали в основном обитает литоральная фауна. В эстуариях это происходит в основном из-за негативного влияния солености, в результате чего морские сублиторальные виды не выдерживают соответствующего снижения солености, а литоральные (более эвригалинные) спускаются в нижнюю литораль и сублитораль с более благоприятным режимом солености по сравнению с вышележащими горизонтами литорали (Бергер, 1976, 1986). В Ермолинской лагуне основным фактором, влияющим на распределение макробентоса и распространение, в частности, литоральных видов в сублиторали является, по-видимому, не соленость, а характер грунта, его чрезмерное заиление и преобладание процессов сульфатредукции уже в поверхностных слоях грунта (отрицательные значения Eh) (табл. 2). Литоральные виды как более эвритопные (более устойчивые к осушению, опреснению, органической нагрузке) находят здесь весьма благоприятные условия обитания (много органического вещества, детрита), а настоящие сублиторальные не выдерживают чрезмерного заиления. Нельзя исключать и негативного влияния солености, ее снижения ранней весной во время снеготаяния или летом и особенно осенью в результате обильных дождей, что могло приводить к гибели или перемещению в более благоприятные морские условия комплекса видов, не приспособленных к такому снижению солености. Отметим также, что такой сдвиг солености сопровождался повышением температуры поверхностной воды, которая становилась более теплой и менее соленой, а это способствовало расслоению водной массы Ермолинской губы и могло приводить к дефициту кислорода, заморным явлениям, активизации процессов сульфатредукции и повышенному содержанию сероводорода в поверхностных слоях осадков. Все это благоприятствовало развитию здесь эврибионтных видов беспозвоночных животных с высокой экологической пластичностью, способных выдерживать широкие колебания факторов среды.
По данным сублиторальной съемки 1957, 1962, 1965 гг. А.П. Кузнецов (1970) в пределах бенгали основного бассейна выделял два биоценоза: 1) двустворчатого моллюска Масота balthica с преобладанием собирающих детритофагов и 2) голотурии Chiridota laevis и многощетинкового червя Pectinaria hyperborea с преобладанием безвыборочно заглатывающих грунт представителей инфауны. На выходе из губы ближе к берегам в зоне активной гидродинамики преобладали сестонофаги (мидии, асцидии) (Броцкая и др., 1963). Надо отметить, что сообщество грунтоедов Chiridota laevis + Pectinaria hyperborea, выявленное в 1965 г. (в 1957 и 1962 гг. полихеты Pectinaria hyperborea и Brada granulata встречались в единичных экземплярах или не были найдены) в самой глубоководной части губы ближе к выходу из нее, не было обнаружено в 2014 г. В то же время большинство видов этого комплекса встречаются на входе в губу и входят в состав сообщества Mol gala retortiformis, которое является продолжением прилежащего комплекса Ругозерской губы (Броцкая и др., 1963). Таким образом, этот комплекс был вытеснен за пределы губы. Комплекс двустворчатого моллюска Масота balthica с преобладанием собирающих детритофагов в настоящее время заметно изменился. Доминирующая ранее Масота balthica сейчас остается руководящим видом в основной части сублиторали Ермолинской губы, но не является доминирующим видом в куту губы, где лидирующее положение занимают мелкие эвритопные моллюски Н. ulvae и олигохеты Tubificoides benedeni, а также соскребатели L. litorea. Для биоценоза M.balthica А.П. Кузнецов указывал среднюю численность 666 экз/м2 и среднюю биомассу 94.56 г/м2, при этом M.balthica имела среднюю плотность 525 экз/м2 и биомассу 77.53 г/м2. В настоящее время средняя биомасса всего сублиторального сообщества и основного доминанта М. balthica практически не изменилась, а вот средняя плотность сообщества выросла в 2 раза, тогда как плотность М. balthica снизилась в 2.4 раза. Это означает, что популяция М. balthica в настоящее время в основном представлена взрослыми особями более устойчивыми к воздействию негативных факторов среды. Увеличение же общей плотности макробентосного сообщества при сохранении той же биомассы свидетельствует об увеличении доли мелких видов (в основном гидробий и олигохет). Отметим также, что многие виды, составляющие основу сублиторального комплекса М. balthica в 60-е годы (Броцкая и др., 1963; Кузнецов, 1970) в настоящее время не встречаются в пределах губы (Масота calcarea, Ascidia sp., Pectinaria koreni, Priapulus caudatus, Phyllodoce maculata, Diastylis glabra}, некоторые понизили свою биомассу (Arenicola marina), а другие, наоборот, увеличили (полихета N. punctate и олигохета Т. benedeni}. С другой стороны, виды, которые сейчас входят в сообщество М. balthica в качестве субдоминантов (77 ulvae, Capitella capitata, Amphiporus lactifloreus, L. littorea, Musculus laevigatustus, Harmothoe imbricate}, ранее были охарактеризованы как редкие и второстепенные (77 ulvae, А. lactifloreus} либо вообще не найдены (С. capitata, Н. imbricata, L. littorea, М. laevigatas) (Кузнецов, 1970). Все вышесказанное свидетельствует о повышении роли в современном сообществе макробентоса Ермолинской губы мелких видов детритофагов -собирателей в основном литоральной природы.
Таким образом, начиная с 60-х годов прошлого века наблюдается тенденция вытеснения морских сублиторальных видов за пределы губы и замена их на литоральные, более устойчивые к воздействию органической нагрузки и опреснению в весенний период. В настоящее время наблюдается уже смена доминирующего в основной части губы комплекса М. balthica на комплекс мелких детритофагов Н. ulvae и Т. benedeni, которые обычно преобладают на заиленной литорали.
Отметим, что комплекс сублиторальных видов (Chiridota laevis + Pectinaria hyperborea} может проникнуть в центральный глубоководный район губы при подходящих условиях. Подходящие условия для проникновения этого комплекса видов могут сформироваться в результате уменьшения пресного стока в весеннелетний период, а также сильных штормовых явлений, увеличивающих связь Ермолинской губы с основным бассейном. Однако такой сценарий развития нам кажется маловероятным в силу продолжающегося подъема берегов Кандалакшского залива (Романенко, Шилова, 2012), что способствует дальнейшему зарегулированию губы и, как следствие, уменьшению ее связи с морем и увеличению заиленности осадков и опресненности.
Заключение. Ермолинскую губу можно рассматривать как небольшую эстуарную экосистему лагунного типа, имеющую затрудненный водообмен с внешней акваторией и характеризующуюся обедненной (в основном литоральной) фауной и флорой. Обеднение фауны и постепенное заселение сублиторали губы (последние 55 лет) литоральным комплексом организмов, а также вытеснение из ее кутовой области более крупных детритофагов (М. balthica} и развитие там мелких и многочисленных той же трофической группы (Н. ulvae и Т. benedeni} связано с постепенным зарегулированием губы, изменением ее гидрологического режима (уменьшение скорости течения) и, как следствие, все увеличивающимся заилением ее осадков. Большое количество органического вещества в осадках лагуны, неустойчивый кислородный режим, опреснение в весенний период способствуют развитию в губе (особенно в ее кутовой области) преимущественно мелких видов детритофагов-собирателей с высокой экологической пластичностью, способных выдерживать широкие колебания факторов среды. Такие экосистемы в значительной степени находятся под влиянием углеродной нагрузки и имеют тенденцию к формированию сообществ с нарушенной структурой.
Столяров А.П. Макробентос лагунной экосистемы Ермолинской губы (Кандалакшский залив, Белое море): особенности структуры, разнообразие и тенденции изменений / А.П. Столяров // Вести. ТвГУ. Сер.: Биология и экология. 2016. №4. С. 130-150.
Список литературы Макробентос лагунной экосистемы Ермолинской губы (Кандалакшский залив, Белое море): особенности структуры, разнообразие и тенденции изменений
- Азовский А.И. 1993. ECOS -проблемно-ориентированный пакет программ по экологии сообществ, версия 1.3.
- Бергер В. Я. 1976. О приспособлениях к меняющейся солености некоторых литоральных беломорских моллюсков/Бергер В. Я., Хлебович В. В. (ред.)//Исслед. фауны морей. Т. 17 (25). Соленостные адаптации водных организмов. С. 59-111.
- Бергер В. Я. 1986. Адаптации морских моллюсков к изменениям солености среды. Л.: Наука. 214 с.
- Бергер В.Я. 2007. Продукционный потенциал Белого моря//Исследования фауны морей. Т. 60 (68). СПб.: ЗИН РАН. 292 с.
- Броцкая В. А., Жданова Н. Н., Семенова Н. Л. 1963. Донная фауна Великой Салмы и прилежащих районов Кандалакшского залива Белого моря//Труды Кандалакшского гос. Заповедника. Вып. IV. Воронеж: Воронежское книжное издательство. С. 159-182.
- Бурковский И.В. 2006. Морская биогеоценология. Организация сообществ и экосистем. М.: Тов-во науч. изданий КМК. 285 с.
- Зданович В.В., Криксунов Е.А. 2004. Гидробиология и общая экология: словарь терминов. М.: Дрофа. 192 с.
- Кузнецов А.П. 1970. Материалы по изучению Ермолинской губы (Кандалакшский залив, Белое море) как экосистемы. Часть I. Донная фауна//Труды ин-та океанологии АН СССР. Т. 88. М.: Наука. С. 98-112.
- Лабай В.С. 2011. Эволюция бентоса прибрежных лагун острова Сахалин: причины и следствия//Чтения памяти Владимира Яковлевича Леванидова. Вып. 5. Владивосток: Дальнаука. С. 265-274.
- Лисицын А.П. 2008. Маргинальные фильтры и биофильтры мирового океана//Океанология на старте 21 века. М.: Наука. С. 159-224.
- Романенко Ф.А., Шилова О.С. 2012. Послеледниковое поднятие Карельского берега Белого моря по данным радиоуглеродного и диатомового анализов озерно-болотных отложений п-ова Киндо//Доклады Академии наук. Т. 442. № 4. С. 544-548.
- Сафьянов Г.А. 1996. Геоморфология морских берегов. М.: Изд-во МГУ им. М.В. Ломоносова. 400 с.
- Столяров А.П. 2012. Структурно-функциональная организация эстуарных экосистем Белого моря: прототипическая модель//Успехи соврем. биол. Т. 132. № 4. С. 354-369.
- Столяров А.П. 2013. Особенности структурной организации сообщества макробентоса в эстуарных экосистемах (Кандалакшский залив, Белое море)//Успехи соврем. биол. Т. 133. № 2. С. 191-208.
- Столяров А.П., Бурковский И.В. 2005. Особенности структурной организации экосистемы эстуария и функциональная взаимозависимость ее частей (Кандалакшский залив, Белое море)//Успехи соврем. биол. Т. 125. № 6. С. 579-592.
- Хлебович В.В. 1974. Критическая соленость биологических процессов. Л.: Наука. 236 с.
- Хлебович В.В. 2012. Экология особи (очерки фенотипических адаптаций животных). СПб.: ЗИН РАН. 143 с.
- De Wit R.2011. Biodiversity of coastal lagoon ecosystems and their vulnerability to global change//Ecosystems Biodiversity/Grillo O., Venore G. (Ed.). Chapter 2. Croatia. P. 29-40.
- Dennison W.C., Thomas J.E., Cain C.J., Carruthers T.J.B., Hall M.R., Jesien R.V., Wazniak C.E., Wilson D.E. 2009. Shifting Sands: Environmental and cultural change in Maryland’s Coastal Bays. Cambridge MD: IAN Press. 396 p.
- Junoy J., Vietez J.M. 1990. Macrozoobenthic community structure in the Ria de Foz, an intertidal estuary (Galicia, Northwest Spain)//Marine Biology. V. 107. P. 329-339.
- Kjerfve, B. 1994. Coastal Lagoons. Chapter 1//Coastal lagoon processes/Kjerfve B. (ed.). Amsterdam: Elsevier Oceanography Series. P. 1-8.
- Meire P.M., Dereu J. 1990. Use of the abundance/biomass comparison method for detecting environmental stress: some considerations based on intertidal macrozoobenthos and bird communities//J. Appl. Ecol. V. 27. P. 703-717.
- Meire P., Ysebaert T., Van Damme S., Van den Bergh E., Maris T., Struyf E. 2005. The Scheldt estuary: a description of a changing ecosystem//Hydrobiologia. V. 540. P. 1-11.
- Montagna P.A., Palmer T.A., Pollack J.B. 2013. Hydrological Changes and Estuarine Dynamics//Springer Briefs in Environmental Science. V. 8. 94 p.
- Pianka E.R. 1974. Niche overlap and diffuse competition//Proc. Natl. Acad. Sci. USA. V. 71. P. 2141-2145.
- Shannon C., Weaver W. 1949. The mathematical theory of communication. Urbana: Univ. Illinois Press. 117 p.
- Sørensen T.A. 1948. A new method of establishing groups of equal amplitude in plant sociology based on similarity of a species content and its application to analysis of the vegetation on Danish commons//Kgl. Dan. Videnskab. Selskab. Biol. Skr. V. 5. № 4. P. 1-34.
- Warwick R.M. 1986. A new method for detecting pollution effects on marine macrobenthic communities//Marine Biology. V. 92. P. 557-562.


