Макростомин типидаги berberis алкалоидлари
Автор: Хомидов Иномидин Илмидинович, Раззаков Набижон Алижонович, Махаматова Сохибахон Хасанбоевна
Журнал: Life Sciences and Agriculture.
Статья в выпуске: 3-2, 2020 года.
Бесплатный доступ
Mаколада усимликларда учрайдиган баъзи бир физиологик фаол моддалар, бензилизохинолин алкалоидлари, бензилизохинолин турлари тахлил килинган. Шунингдек, макростомин типидаги 1-бензилизохинолин алкалоидларининг изоляцияси, узаро конверсияси, реактивлиги ва физик-кимёвий тахлил усуллари ёрдамида баъзи алкалоидларнинг тузилишини урнатиш манбалари хакида кискача тухталиб утилди.
Кимё, модда, физиологик фаол, алкалоидлар, усимликлар, бензилизохинолинлар, оила, berberidaceae, papaveraceae, пирролидин халкаси, масс спектри, пмр спектри, мултиплет, метиллаш, заиф майдон, халканинг очилиши
Короткий адрес: https://sciup.org/14125767
IDR: 14125767 | УДК: 547.944/945 | DOI: 10.24411/2181-0761/2020-10130
Текст научной статьи Макростомин типидаги berberis алкалоидлари
Бензилизохинолиновые алкалоиды по своей структуре делятся на 3 группы:
1-Бензилизохинолины (1-БИХ) (I) ;
1-Бензилтетрагидроизохинолины (1-БТГИХ) (II) ; N-
Бензилтетрагидроизохинолины (NБТГИХ) (III) .

I
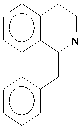
Рисунок 1.
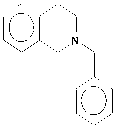
II
III
До настоящего времени в природе найдено более 30 алкалоида этой группы. Они довольно широко распространены в растительном мире и обнаружены в растениях семейств Berberidaceae, Papaveraceae, Ranunculaceae, Menispermaceae, Rhamnaceae, Monimiaceae, Leguminosae.
1-БЕНЗИЛИЗОХИНОЛИНЫ ТИПА МАКРОСТОМИНА
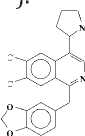
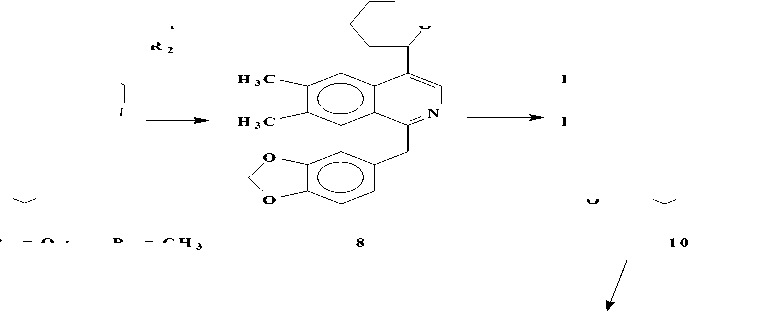
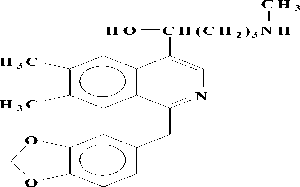
Представители этой подгруппы, первым из которых является макростомин (1), имеют в молекуле пирролидиновое кольцо в положении С-4 изохинолиновой части. В эту подгруппу входит 5 алкалоидов: макростомин (1), дегидронормакростомин (2), цис-N-окись макростомина (3), транс-N-окись макростомина (4) и аренин (5). Все они выделены из растений семейства Papaveraceae (Рисунок 2). Присутствие пирролидинового кольца у макростомина (1), выделенного из P.macrostomine [1], установлено сравнением данных масс- и ПМР-спектров с таковыми никотина. Пик иона с m/z 84 (N-Me пирролидиний ион) в масс-спектре и два мультиплета при 1.5 - 2.2 м.д. (4Н) и при 3.0 - 3.6 м.д. (3Н) в ПМР-спектре характерны для пирролидинового кольца. При метилировании 1 метилируются оба атома азота и образуется 6, где протоны пирролидинового кольца и протон Н-3 в ПМР-спектре сдвигается в более слабое поле, чем у макростомина. Метилирование 6 СН3J приводит к раскрытию пирролидинового кольца (7) (Рисунок 3).
H 3 C
H 3 C
O
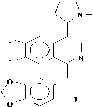
H 3 C
HO
O
O
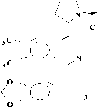
O
H 3
N+ CH
CH
N
Рисунок 2.
Описаны различные пути синтеза макростомина [2, 3]. Дегидронормакростомин (2) выделен из этого же растения [1].
Позже авторами [4] из другого вида Papaver выделены две N-окиси макростомина - цис-(3) и транс-(4)
изомеры, которые при восстановлении Zn в серной кислоте дают один продукт -
макростомин
HC
HC
O
N CH
N+ CH3
CH
HC
HC
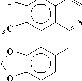
N+ CH
HC
HC
O
<
O
CH (CH2)3N(CH3)2
1 6 7Рисунок 3.
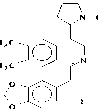
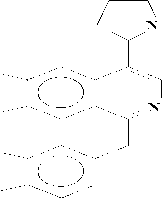
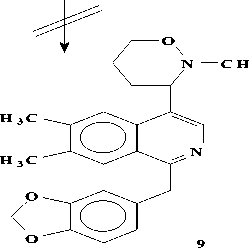
А последний при окислении с Н 2 О 2 дает 3 и 4. В условиях пиролиза 3 и 4 в вакууме при 200о может произойти либо расширение пирролидинового кольца, либо перегруппировка по Коупу и могут образоваться два продукта (8 и 9), при восстановлении его Zn в H 2 SO 4 получается продукт (10), который при ацетилировании дает О,N-диацетилпроизводное (11).
Проявление метинового протона геминалного ацетоксильной группе при 6.27 м.д., свидетельствует о том, что при пиролизе происходит расширение пирролидинового кольца (по типу 8) [4] (Рисунок 4).
Деметилированным производным макростомина (1) [1] является аренин (5), выделенный из P.arenarium [5]. На этот факт
сигнал протона С-8 смещен на 20 Гц в слабое поле по сравнению с таковым в спектре 1, а протоны кольца С и метиленовые протоны смещены примерно на 10 Гц в сильное поле. Эти смещения, по-видимому, связаны с изменением
указывают его данные. При диазометаном Расположение установлено спектров 5 и
спектрометрические
метилировании
образуется
ОН-группы сравнением
в
ПМР-
ориентации молекулы
бензильной части
относительно
макростомина (1) и объясняются заменой ОСН 3 -группы при С-7 в 1 гидроксильной группой в аренине (5).
+ /•R1
R
N CH 3
O
1. В ПМР-спектре 5
O
=
=
=
=
CH
O
O ; R2
CH 3 ; R 2
O
H3C
H 3 C
3. R1
4. R1
CH 3
O
O
H3C
H 3 C
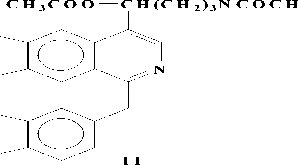
Рисунок 4.
Список литературы Макростомин типидаги berberis алкалоидлари
- Isolation and Chemistry of the alkaloids from Papaver macrostomume Boiss et Huet / Mnatsakanyan V.A., Preininger V., Simanek V. et al. // Tetrahedron Lett. - 1974. - P. 851-854.
- Wykypiel W., Seebach D. A nitrosamine route to macrostomine // Tetrahedron Lett. - 1980. - Vol. 21. - P. 1927-1929.
- Bobbitt J.M., Sih J.C. Synthesis of isoquinolines. VII. 4-Hydroxy-1,2,3,4- tetrahydroisoguinolines // J. Org. Chem. - 1968. - Vol. 33. - P. 856-859.
- Алкалоиды Papaver arenarium / И.А.Исраилов, М.А.Манушакян, В.А.Мнацаканян, М.С.Юнусов // Химия природ. соедин. - 1984. - С. 76.
- Строение аренина / Исраилов И.А., Манушакян М.А., Юнусов М.С. и др. // Химия природ. соедин. - 1978. - С. 417-418.


