Маркер-опосредованный отбор при создании устойчивых к пероноспорозу линий закрепителей стерильности лука репчатого (A. cepa L.)
Автор: Эйдлин Яков Тарасович, Монахос Григорий Федорович, Монахос Сократ Григорьевич
Журнал: Овощи России @vegetables
Рубрика: Селекция и семеноводство сельскохозяйственных растений
Статья в выпуске: 3 (59), 2021 года.
Бесплатный доступ
Актуальность. Селекционные программы по созданию Fi гибридов лука репчатого строятся на основе использования ядерно-цитоплазматической мужской стерильности (ЯЦМС). Селекция и семеноводство на основе ЯЦМС предполагают трехлинейную схему - стерильную материнскую линию, закрепитель стерильности и отцовский компонент. Создание изогенной пары стерильная линия -закрепитель стерильности -один из наиболее трудо-, время- и интелектуальноемких этапов селекционной программы, выполнение которого усложняется с увеличением числа признаков/генов, по которым проводится отбор. Материал исследований и результаты. В данной работе представлена схема создания устойчивой к пероноспорозу (возб. P. destructor) линии закрепителя стерильности лука репчатого с применением маркер-опосредованного отбора по ядерному гену устойчивости к пероноспорозу Pd (молекулярный маркер DMR1), ядерному гену закрепления стерильности ms (молекулярный маркер jnurfl3) и по цитоплазматическим генам, определяющим N, S и T цитоплазмы (маркерная система Scob:orfA501). В результате гибридизации инбредной линии лука репчатого №136 (генотип -цитТ MsMs PdPd) с геном Pd устойчивости к пероноспорозу и донора аллелей закрепления стерильности (ms), инбредной линии лука репчатого Бн1-(13) (генотип - цит-N msms pdpd) получены расщепляющиеся популяции F2, из которых маркер-опосредованным отбором выделены гомозиготные по устойчивости к пероноспорозу линии - закрепители стерильности - цитN msms PdPd. Показано, что наследование гена устойчивости к пероноспорозу Pd в расщепляющихся популяциях от самоопыления гетерозигот Pdpd нестабильно и имеет существенное отклонение от менделевского распределения доминантных и рецессивных признаков в потомстве F2 при моногенном наследовании. Применение маркер-опосредованного отбора по целевым генам позволило создать устойчивую линию закрепитель стерильности цитN msms PdPd за два поколения.
Ген устойчивости, закрепитель стерильности, лук репчатый, линия, маркер-опосредованный отбор, молекулярный маркер, мужская стерильность, пероноспороз, цитоплазма, peronospora destructor
Короткий адрес: https://sciup.org/140257591
IDR: 140257591 | УДК: 635.25:581.16:631.524.86 | DOI: 10.18619/2072-9146-2021-3-34-39
Текст научной статьи Маркер-опосредованный отбор при создании устойчивых к пероноспорозу линий закрепителей стерильности лука репчатого (A. cepa L.)
Forcitations: Eidlin Ya.T., Monakhos G.F., Monakhos S.G. Marker-assisted breeding of onion (A. cepa L.) maintainer line resistant to Downy mildew. Vegetable crops of Russia. 2021;(3):34-39. (In Russ.)
Л ук репчатый является одной из самых экономически значимых овощных культур во всем мире. В 2019 году посевные площади лука репчатого в РФ составили 24,9 тыс. га, а валовый сбор – 1068,4 тыс. т.
Благодаря использованию молекулярных маркеров существенно сокращается селекционный процесс, так как появляется возможность определять аллельное состояние генов [1]. Маркер-опосредованный отбор значительно упрощает традиционные схемы селекции, особенно при проведении отбора по нескольким признакам [2]. Молекулярное генотипирование с использованием кодоминантных маркеров исключает необходимость в проведении анализирующих скрещиваний и испытаний [3]. Для определения аллельного состояния генов растений на сегодняшний день пользуются многими системами ДНК - маркеров, например SCAR, SSR, STS [4].
В селекции и семеноводстве F 1 гибридов лука репчатого используют ядерно-цитоплазматическую мужскую стерильность (ЯЦМС). Генетический контроль ЯЦМС определяется взаимодействием ядерных (хромосомных) генов и цитоплазматических митохондриальных генов, проявляется ЯЦМС в редукции пыльников и отсутствии фертильной пыльцы [5].
В настоящее время у лука репчатого используют два типа стерильности CMS-S и CMS-T. CMS-S определяется взаимодействием генов ядра и цитоплазмы, генетическая основа которого – ядерный ген восстановитель фертильности с двумя аллелями Ms/ms и два типа цитоплазм S - стерильная, N - нормальная, обнаружен в 1925 году у сорта «Italian Red» [5]. У CMS-T стерильность восстанавливается одним доминантным аллелем локуса A или доминантными аллелями двух комплементарно взаимодействующих локусов B и C. Этот тип стерильности был обнаружен во французском сорте «Jaune Paille de Vertus» в 1960 году [6].
В 2003 году Engelke et al. разработали систему молекулярных маркеров (5'cob и orfA501), дифференцирующих типы цитоплазм [7]. Визуально определить тип стерильности лука репчатого невозможно, поэтому созданная система молекулярных маркеров становится необходимой при селекции F 1 -гибридов на основе мужской стерильности.
Цитоплазматическая мужская стерильность, контролируется только фактором стерильности цитоплазмы, наиболее удобна с точки зрения селекции и семеноводства. Такую ЦМС лука создал Havey при отдаленной гибридизации Allium galantum L. с Allium cepa L. с насыщающими скрещиваниями [8]. Однако, большинство селекционных фирм этой системой пока не пользуются.
Одним из наиболее распространенных и вредоносных заболеваний лука репчатого является ложная мучнистая роса или пероноспороз. Возбудитель болезни – оомицет Peronospora destructor [Berk.] Casp. [9]. Источником инфекции являются зараженные листья, луковицы и семена. Начало развития болезни можно наблюдать в ювенильной стадии развития растения. Первыми симптомами заболевания являются хлоротичные пятна и фиолетовый налет на листьях, который можно увидеть ранним утром. Пораженные части растения отмирают. Если не производить заблаговременные обработки фунгицидами, то совместно с пероноспорозом распространяется и другое заболевание – альтернариоз ( Alternaria ), при развитии которого образуется сплошной черный налет [10].
Мицелий Peronospora destructor из пораженной луковицы проникает во все ткани растения. На семен- никах патоген проникает по сосудистой системе листьев в генеративные органы. При поражении генеративной сферы семена образуются щуплые, показатели посевных качеств семян снижаются.
Использование устойчивых сортов и гибридов является одним из наиболее дешевых и экологически безопасных способов защиты растений. В зарубежных странах с началом использования устойчивых к болезням и вредителям сортов и гибридов сельскохозяйственных культур использование пестицидов сократилось на 40% [11].
Ежегодные потери урожая при выращивании лука репчатого делают актуальным поиск источников и доноров генетической устойчивости к ложной мучнистой росе. До 80-х годов 20-го века был создан только один устойчивый сорт лука репчатого «Calred», в котором устойчивость проявлялась только в цветочных стрелках, но не в листьях [12].
В 1990 году Kofoet и Kik выявили высокую устойчивость у Allium roylei , контролируемую одним доминантным геном Pd [13]. В наших ранних исследованиях показано, что Allium roylei легко скрещивается с луком репчатым ( A.cepa ), труднее проходит беккроссное скрещивание. После третьего беккросса отобраны растения, формирующие нормальную луковицу и гетерозиготные по гену устойчивости Pd . В потомствах этих растений наблюдалось значительное отклонение в наследовании устойчивости от менделевского (не опубликовано).
Позднее в 2015 году корейскими учеными Kim et al. был разработан кодоминантный молекулярный маркер DMR1 сцепленный с геном устойчивости Pd [11, 13]. Хрусталева Л.И. с помощью технологии GISH-гибридизации установила, что ген устойчивости Pd расположен в дистальной части длинного плеча 3-й хромосомы [14, 15].
С целью защиты от несанкционированного размножения F 1 гибридов и получения устойчивого к пероноспорозу F 2 -потомства, как правило в гибридах ген устойчивости используют в гетерозиготном состоянии. Таким образом, при самоопылении в F 2 четверть растений будут восприимчивыми. При этом у селекционеров возникает дилемма, какая из родительских линий должна быть гомозиготой по гену устойчивости. Учитывая, что поражение цветочных стрелок ведет к резкому снижению семенной продуктивности и ухудшает посевные качества семян, по нашему мнению, лучшим вариантом будет использование устойчивой стерильной материнской линии. Вместе с тем такой подход требует более длительной селекционной программы. Поэтому целью данного исследования является создание линий закрепителей мужской стерильности лука репчатого ( A. cepa L.) с генетической устойчивостью к пероноспорозу с применением маркер-опо-средованного отбора.
Материалы и методы
Исследования проведены в 2018-2021 годах в ООО «Селекционная станция имени Н.Н. Тимофеева» и в лаборатории генетики, селекции и биотехнологии овощных культур РГАУ-МСХА имени К.А. Тимирязева.
В качестве донора устойчивости к пероноспорозу (возб. P. destructor) использовали инбредную линию лука репчатого 136 (генотип – цитT MsMsPdPd) с геном устойчивости к пероноспорозу Pd, ранее переданному из гибрида лука репчатого F1 Santero (Hazera) путем серии скрещиваний, инбридинга и отбора на инфекционном фоне. В качестве донора аллелей закрепле- ния стерильности (ms) использовали инбредную линию лука репчатого Бн1-(13) (генотип – цитN msms pdpd) из генетической коллекции ООО «Селекционная станция имени Н.Н. Тимофеева».
Гибридизацию и инбридинг проводили в контролируемых условиях пленочной теплицы.
Устойчивость растений к пероноспорозу (возб. P. destructor ) оценивали на искусственном инфекционном фоне в полевых условиях. Фитопатоген, P. destructor , поддерживали в течение зимы в пораженных пероноспорозом луковицах лука севка. Для размножения возбудителя пораженные пероноспорозом луковицы высаживали на участке среди оцениваемых на устойчивость растений. Инокулюм готовили смывом спор с сильно пораженных листьев лука с обильным спороношением, плотность суспензии спор P. destructor доводили до 1x106 спор/мл. Инокуляцию проводили в утренние часы опрыскиванием листьев растений лука в течение пяти суток. Оценку устойчивости/восприимчивости проводили на 15-й день после инокуляции. За устойчивые принимали растения без симптомов поражения пероноспорозом, за восприимчивые – с симптомами разной степени развития болезни.
Для корректности создания искусственного инфекционного фона и надежности проведения оценки устойчивости/восприимчивости растений использовали восприимчивый к пероноспорозу контроль – гибриды F 1 Birdy и F 1 Sonoma.
Выделение ДНК проводили CTAB-методом по [18]. Для выделения использовали 200-250 мг свежей ткани молодых листьев.
Процедуру амплификации проводили в ПЦР-ампли-фикаторе Thermal Cycler C1000 Touch (Bio-Rad). Реактивы для проведения амплификации хранили при температуре -20°С, перед использованием размораживали, далее встряхивали и осаждали на вортексе. Амплификацию ДНК-фрагментов проводили согласно описанию в оригинальных статьях авторов-разработчиков молекулярных маркеров.
Молекулярно-генетический анализ и дифференциацию генотипов в расщепляющихся популяциях проводили с использованием следующих молекулярных маркеров:
-
1. DMR1 – SCAR-маркер ядерного гена устойчивости к пероноспорозу Pd [16];
-
2. Jnurf13 – SSR-маркер ядерных генов стерильно-сти/фертильности Ms, ms [17];
-
3. 5'cob и orfA501 – система маркеров на тип цитоплазмы: N-нормальная цитоплазма, фертильный мужской гаметофит; S и T – цитоплазмы с фактором стерильности, определяющие мужскую стерильность при взаимодействии с рецессивной гомозиготой ядерного гена msms [7].
Молекулярный маркер orfA501 Т-цитоплазмы (длина ДНК-фрагмента 473 п.н.) амплифицировали с использованием двух праймеров (прямой 5'-A TG G CTCG CCTTG A A A G A G A G C-3' и обратный 5'-CCAA G CA TTTG G CG CTG A C-3') при температуре отжига 60 °С.
Молекулярный маркер 5'cob S-цитоплазмы (длина ДНК-фрагмента 414 п.н.) амплифицировали с использованием прямого праймера 5'-GTCCAGTTCCTATAGAACCTATCACT-3' и обратного праймера 5'-CTTTTCTATGGTGACAACTCCTCTT-3' при температуре отжига 53°С.
Молекулярный маркер 5'cob N -цитоплазмы (длина ДНК-фрагмента 180 п.н.) амплифицировали с использованием прямого праймера 5'-TCTAGATGTCGCATCAGTGGAATCC-3' и обратного праймера 5'-CTTTTCTATGGTGACAACTCCTCTT-3' при температуре отжига 53°С.
Молекулярный маркер Jnurf-13 гена закрепления стерильности ms амплифицировали с использованием прямого праймера 5'- TTGCCAAAGGTTGCAATACA-3' и обратного праймера 5'-TGCAAGCTTGGAACTTACG-3' при температуре отжига 57°С. Длина ожидаемого фрагмента для доминантного аллеля Ms – 241 п.н., для рецессивного ms – 229 п.н.
Молекулярный маркер DMR1 гена устойчивости к пероноспорозу Pd амплифицировали с парой праймеров, прямым DMR1-F 5'- TGAGGCTCAAGTTGACATG-3' и обратным DMR1-R 5'-TTCGTAGCAGCATCAAGGTG-3' при температуре отжига 65 °С. Аплифицируемый ДНК-фрагмент длиной 505 п.н. сцеплен с доминантным Pd -аллелем, ДНК-фрагмент длиной 438 п.н. с рецессивным аллелем pd .
Разделение ДНК-продуктов амплификации проводили электрофорезом в 1,5% агарозном геле. ДНК-фрагменты окрашивали флуоресцентным красителем GelRed (Biotium, USA). Визуализацию и фотодокументацию разделенных электрофорезом фрагментов ДНК, продуктов амплификации, осуществляли в проходящем ультрафиолетовом свете с помощью гельдокумен-тирующей системы ChemidocXRS+ (Bio-Rad).
Результаты и обсуждение
Применение классических методов селекции для создания закрепителя стерильности лука репчатого с устойчивостью к пероноспорозу предполагает сложную и трудоемкую генетико-селекционную схему с большим количеством анализирующих скрещиваний, с использованием оценки устойчивости к пероноспорозу на искусственном инфекционном фоне в вегетативной стадии и анализом фертильности/стерильности в генеративной стадии развития. В связи с тем, что устойчивость контролируется доминантным геном для дифференциации доминантной гомозиготы и гетерозиготы необходимо два поколения при оценке на инфекционном фоне. Следует учесть, что оценку стерильности/фертильности необходимо проводить в защищенном грунте в свободных от насекомых-опылителей условиях, а самоопыление – с использованием индивидуальных изоляторов. Такая работа требует больших затрат средств, труда и времени.
Создание закрепителя стерильности при ядерно-цитоплазматической мужской стерильности требует передачи рецессивного аллеля ms с цитоплазмой S- и T-типа в растение с нормальной N-цитоплазмой для чего необходима гибридизация, инбридинг и серия анализирующих скрещиваний. В нашей работе мы использовали созданные в предыдущие годы линии закрепители стерильности восприимчивые к пероноспорозу.
В 2018 году провели гибридизацию инбредной линии закрепителя стерильности Бн1-(13) (генотип – ЦитN msmspdpd ) с линией 136 (генотип – цитT MsMsPdPd ), содержащей доминантные аллели гена устойчивости Pd в гомозиготном состоянии (рис. 1). Полученное потомство было гетерозиготным как по гену устойчивости Pd , так и по гену мужской стерильности Ms . Для отбора генотипов, сочетающих гомозиготность по аллелям устойчивости PdPd и аллелям закрепления стерильности msms, в 2019 году провели самоопыление растений первого гибридного потомства и создали сегрегирующую по двум генам Ms и Pd популяцию F 2 . В 2020 году растения F 2 -популяции оценили на
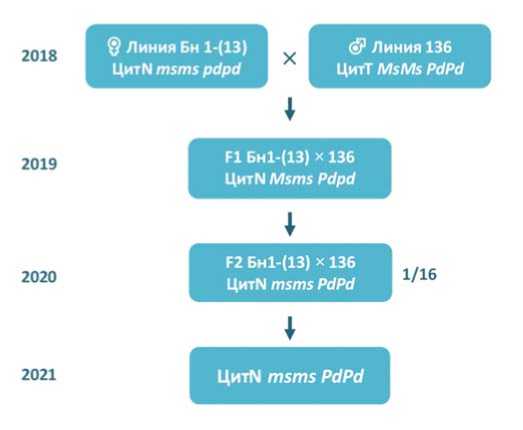
Рис. 1. Схема гибридизации и отбора линии лука репчато-го,закрепителя стерильности (ЦитN msms),гомозиготной по гену устойчивости к пероноспорозу (Pd): ♀ – материнская линия,♂ – отцовская линия,x – гибридизация, F 1 – первое гибридное потомство, F 2 – второе гибридное потомство от самоопыления F 1 ,1/16 –доля целевых генотипов в потомстве F 2
Fig. 1. Breeding scheme for the development of onion sterility maintainerline (CytN msms),homozygous forthe Downy mildew resistance gene,Pd: ♀ – female line,♂ – male line,x – hybridiza-tion,F 1 – firsthybrid progeny,F 2 – second hybrid progenyfrom F 1 self-pollination, 1/16 –- the frequency of CytN msm sPdPd genotype in the F 2 segregated population

Рис. 2. Расщепление по устойчивости/восприимчивости к пероноспорозу (возб. P. destructor)в F 2 -потомстве (Бн1(13) x 136)2, слева растение без симптомов, справа пораженное пероноспорозом.
Fig. 2. Downymildew (pathogen P.destructor)symptoms
(the planton the left)in segregated F 2 -progeny(Bn1 (13) x 136) 2.
Таблица 1. Результаты оценки устойчивости/восприимчивости растений лука репчатого к пероноспорозу (P. destructor) на искусственном инфекционном фоне Table 1. Downy mildew (pathogen P. destructor) disease reaction of onion accessions
Инокуляция растений суспензией спор P. destructor привела к 100%-му поражению пероноспорозом зарубежных гибридов (F 1 Mondella, F 1 Birdy, F 1 Sonoma), что свидетельствует об эффективности инокуляции и выровненности искусственного инфекционного фона (табл. 1). Следует отметить, что эти гибриды по степени поражения различались, F 1 Mondella поражался в меньшей степени.
Гибридные комбинации МсБн1-1 x 163, МсБн x Вал1-8, МсБн1 x 136 и линия Вал1-8К3 проявили полную устойчивость, расщепление по устойчивости/воспри-имчивости к пероноспорозу отсутствовало, что свидетельствует о гомозиготном состоянии гена устойчивости Pd родительских линий 163, 136 и Вал1-8 (табл. 1).
Анализ устойчивости (R), восприимчивости (S) (рис.
-
2) в расщепляющихся популяциях F 2 (МсБн1(11) x 163)2, (МсБн1(11) x 163)9, (Бн1(13) x 136)1, (Бн1(11) x 136)1, (Бн1(11) x 136)3 выявил меньшее число устойчивых растений, чем теоретически ожидаемое число при моногенном доминантном контроле устойчивости к пероноспорозу (3R : 1S) (Табл. 1). Отклонение расщепления от ожидаемого, вероятно, связано с избирательностью оплодотворения, снижающего долю формирующихся доминантных по гену Pd гомозигот.
1 2 3 4 5 6 7 8 9 10 11 12 13 14 Ar Led 15 16 17 18 19 20 21 22 23 24 К Led
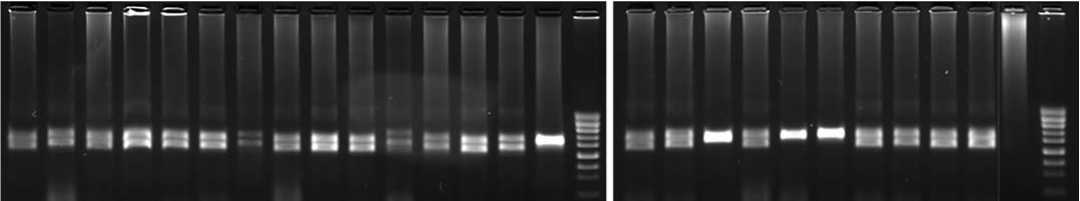
Рис. 3. Электрофореграмма продуктов амплификации ДНК устойчивых растений F2-потомств с молекулярным маркером DMR1 гена устойчивости к пероноспорозу Pd: 1-3 – F 1 МсБн1 x 136,4 – (Байрам x Вал1-8)3,5-6 –F 1 МсБн x Вал1-8,7-8 - (МсМэл xВал 1-1)1,9-15 – F 1 МсБн1-1 x 163,16-19 - (Бн 1(13)× 136)2,20 – Вал1-8К3,21- (Бн1(11) x 136)1,22 – (МсБн1-(11)x 163)2,23 – (МсБн1-(11) x 163)9,24 – (Бн 1-(13)× 136)2,Ar– A.roylei(R),положительный контроль,K – H 2 O,отрицательный контроль,Led – маркер длин ДНК-фрагментов,100 bp
Fig. 3. Downymildew Pd resistance gene DMR1-markerin selected resistant plants: 1-3 – F 1 MsBn1 x 136,4 – (Bayram x Val1-8)3,5-6 – F 1 MsBn x Val1-8,7-8 – (MsMelx Val1-1)1,9-15 – F 1 MsBn1-1 x 163,16-19 – (Bn 1 (13) × 136)2,20 – Val1-8K3,21 – (Bn1 (11) x 136)1,22 – (MsBn1- (11)x 163)2,23 – (MsBn1- (11)x 163)9,24 – (Bn 1- (13) x 136)2,Ar– A.roylei(R),K – H 2 O,Led – 100 bp DNA-ladder
При небольшом числе растений в F 2 -потомствах (МсМэл x Вал1-1)1-1, (Бн1(13) x 136)2, (Байрам x Вал1-8)3 число устойчивых растений преобладало над числом восприимчивых. Малое число растений данных расщепляющихся популяций не позволяет делать выводы о закономерностях распределения устойчивых и восприимчивых генотипов, в то же время позволило произвести отбор устойчивых растений, сочетающих устойчивость с другими хозяйственно-ценными признаками.
Все отобранные устойчивые к пероноспорозу растения расщепляющихся популяций были заложены на хранение и яровизирующую обработку при +4°С. Весной 2021 года растения высадили в наполненные торфяным субстратом горшки объемом 3 л. и разместили для культивирования в поликарбонатной теплице. Ткани отрастающих молодых листьев использовали для выделения ДНК CTAB-методом и последующего молекулярно-генетического анализа с молекулярными маркерами гена устойчивости к пероноспорозу Pd (DMR1), типа цитоплазмы N, S, T (5`cob:orfA501) гена закрепителя стерильности ms (jnurf13), результаты которого представлены на рисунках 3, 4, 5 и 6.
По результатам молекулярно-генетического анализа растений по маркеру DMR1 гена устойчивости Pd установлено, что только 2 устойчивых растения, отобран-
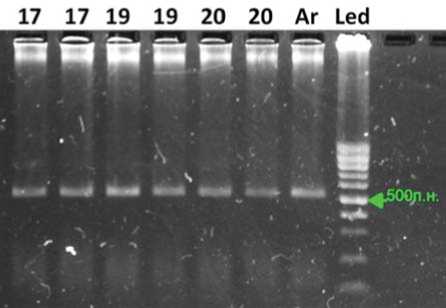
Рис. 4. Электрофореграмма продуктов амплификации повторного/контрольного ПЦР-анализа устойчивых растений F 2 -потомств с молекулярным маркером DMR1 гена устойчивости к пероноспорозу Pd: 17,19 – растения (Бн1-(13) x 136)2, 20 – линия Вал1-8К3,Ar– A. roylei(R),положи-тельный контроль,Led – маркер длин ДНК-фрагментов,100 bp
Fig. 4. Control Downy mildew Pd resistance gene DMR1-marker analysis in selected resistant plants: 17, 19 – plants (Bn1-(13) x 136)2,20 – line Val1-8K3,Ar– A. roylei (R),Led – 100 bp DNA-lad-der ных на искусственном инфекционном фоне из потомств F2, содержали доминантный аллель Pd в гомозиготном состоянии. Один фрагмент ДНК на электрофореграмме размером 505 п.н. свидетельствует о
17 19 20 MsMsMsmsLed
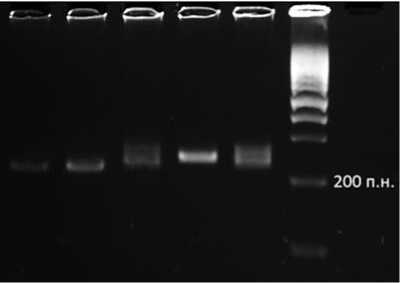
Рис. 5. Электрофореграмма продуктов амплификации ДНК устойчивых растений гомозиготных по гену устойчивости к пероноспорозу с молекулярным маркером Jnurf 13 на ген закрепления стерильности ms: 17,19 – (Бн 1(13) x 136)2,20 – Вал1-8К3, MsMs – образец с известным генотипом MsMs, Msms – образец с известным генотипом Msms,Led – маркер длин ДНК-фрагментов,100 bp
Fig. 5. Electropherogram ofamplified DNA products ofmolecular markerJnurf13 forthe sterilitymaintainerms gene ofresistantto Downy mildew homozygous onion plants: 17, 19 – (Bn1 (13) x 136)2, 20 – Val1-8K3, MsMs – accession with known genotype MsMs,Msms – accession with known genotype Msms,Led – 100 bp DNA-ladder гомозиготности доминантного аллеля гена устойчивости Pd – генотипы 17 и 19 из F2-популяции (Бн1-(13) x 136)2, и генотип 20, линия Вал1-8К3 (рис. 3).
В качестве положительного контроля маркерной системы использовали линию Allium roylei , донор устойчивости к пероноспорозу, в дорожке которого на электрофореграмме присутствует один фрагмент 505 п.н. ( PdPd ). У всех остальных устойчивых растений наблюдалось два фрагмента 505 п.н. и 437 п.н., что свидетельствует о гетерозиготном состоянии аллелей гена устойчивости ( Pdpd ).
Доминантное гомозиготное состояния гена устойчивости к пероноспорозу Pd у выделенных растений подтвердили повторным ПЦР-анализом с молекулярным маркером DMR-1 (рис. 4).
Молекулярно-генетическим анализом гена закрепления стерильности ms с использованием ДНК-маркера Jnurf13 выделенных гомозиготных (PdPd) по устойчивости растений из потомства (Бн1(13) x 136)2 (дорожки
17 19 20 Led 17 19 20 Led
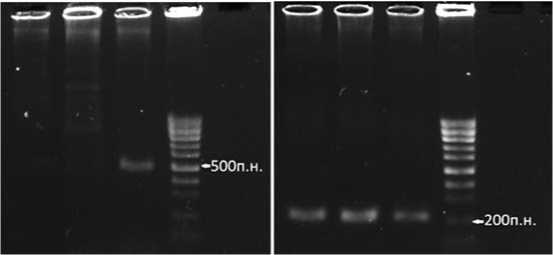
Рис. 6. Электрофореграмма продуктов амплификации ДНК устойчивых к пероноспорозу гомозиготных по гену Pd,гомозиготных по гену закрепления стерильности ms-растений 17 и 19 и Вал1-8К3 (20) и определение типа цитоплазмы (N,S,T) в системе маркеров 5'cob:orfA501.
Fig. 6. Electropherograms ofthe 5'cob and orfA501 markeramplification products for determination ofthe cytoplasm type (N,S,T)ofhomozygous forthe Pd gene resistance to Downymildew,and the ms sterilitymaintainergene onion plants 17,19 (Bn1
(13)x 136)2 and line Val1-8K3 (20).
17 и 19, рис. 3, 4) выявлено рецессивное гомозиготное состояние ядерных генов ( msms ), на что указывает наличие одного ДНК-фрагмента размером 229 п.н. (рис. 5). У PdPd -растения линии Вал1-8К3 (дорожка 20, рис. 3, 4) выявлено гетерозиготное состояние ядерных генов ( Msms ), о чем свидетельствует проявление двух фрагмента размером 229 п.н. и 241 п.н. В качестве контроля использовали образцы с известным генотипом MsMs и Msms (рис. 5).
Молекулярно-генетическим анализом растений 17 и 19 и Вал1-8К3 (20) по типу цитоплазмы (N, S, T) с использованием системы маркеров 5'cob:orfA501 было установлено, что растения 17 и 19 из потомства
(Бн1-(13) x 136)2 содержат N–цитоплазму (нормальная), а растение из потомства Вал1-8К3 (20) содержит T-цитоплазму (рис. 6).
Заключение
Таким образом, в результате гибридизации инбредной линии лука репчатого №136 (генотип – цитT MsMs PdPd ) с геном Pd устойчивости к пероноспорозу (возб. P. destructor ) и донора аллелей закрепления стерильности ( ms ), инбред-ной линии лука репчатого Бн1-(13) (генотип – цитN msms pdpd ) получены расщепляющиеся популяции F 2 , из которых мар-кер-опосредованным отбором выделены гомозиготные по устойчивости к пероноспорозу линии – закрепители стерильности – цитN msms PdPd .
Наследование гена устойчивости к пероноспорозу Pd в расщепляющихся популяциях от самоопыления гетерозигот Pdpd нестабильно и имеет существенное отклонение от менделев-ского распределения доминантных и рецессивных признаков в потомстве F 2 при моногенном наследовании, что, вероятно, связано с избирательностью оплодотворения гамет, содержащих доминантный аллель Pd .
Применение маркер-опосредованного отбора по целевым ядерным генам Pd – устойчивость к пероноспорозу, ms – закрепление мужской стерильности и по цитоплазматическим факторам, определяющим N, S и T цитоплазмы, позвоÏлило создать устойчивую линию закрепитель стерильности цитN msms PdPd за два поколения.
Об авторах:
Сократ Григорьевич Монахос – зав. кафедрой ботаники, селекции и семеноводства садовых растений, доктор с.-х. наук, , , Scopus ID 56052882900, Researcher ID I-7729-2017
Aboutthe authors:
Sokrat G. Monakhos – Dr. Sci. (Agriculture), Head of the Department Botany, Plant Breeding and Seed Technology, RSAU-MTAA, , ,
Scopus ID 56052882900, Researcher ID I-7729-2017
Список литературы Маркер-опосредованный отбор при создании устойчивых к пероноспорозу линий закрепителей стерильности лука репчатого (A. cepa L.)
- Collard B. C. Y., Mackill D. J. Marker-assisted selection: an approach for precision plant breeding in the twenty-first century. Philosophical Transactions of the Royal Society B: Biological Sciences. 2008.;363(1491):557-572. https://doi.org/10.1098/rstb.2007.2170
- Narasimhulu R. et al. Genetic variability and association studies for yield attributes in mungbean (Vigna radiata L. Wilczek). Indian J. Plant Sci. 2013;2(3):82-86.
- Brumlop S., Finckh M.R. Applications and potentials of marker assisted selection (MAS) in plant breeding. Final report of the F+ E project “Applications and Potentials of Smart Breeding” (FKZ 350 889 0020) On behalf of the Federal Agency for Nature Conservation December. 2010.
- Murovec N., Erker R.S., Prodan I. Determinants of environmental investments: testing the structural model. Journal of Cleaner Production. 2012;(37):265-277. https://doi.org/10.1016/j.jclepro.2012.07.024
- Clarke, A.E., Jones H.A., Little T.M. Inheritance of bulb color in onion. Genetics. 1944;(29):569–575.
- Berninger E. Contribution a l'etude de la sterilite male de l'oignon (Allium cepa L.). Ann. Amelior. Plant (Paris). 1965;(23):183–199.
- Engelke T., Terefe D., Tatlioglu T. A PCR-based marker system monitoring CMS-(S), CMS-(T) and (N)-cytoplasm in the onion (Allium cepa L.). Theoretical and Applied Genetics. 2003;107(1):162-167. https://doi.org/10.1007/s00122-003-1230-3
- Havey M.J. Seed yield, floral morphology, and lack of male-fertility restoration of male-sterile onion (Allium cepa) populations possessing the cytoplasm of Allium galanthum. Journal of the American Society for Horticultural Science. 1999;124(6):626-629.
- Yarwood C. E. et al. Onion downy mildew. Hilgardia. 1943;14(11).
- Jesperson G.D., Sutton J.C. Evaluation of a forecaster for downy mildew of onion (Allium cepa L.). Crop protection. 1987;6(2):95-103.
- Demidov E.S. Methods of protecting onions from false powdery mildew (Peronospora destructor Berk.). Tiraspol: "Tipar", 2004. 92 p.
- Jones H.A., Mann L.K. Onions and their allies. Soil Science. 1964;98(1):68.
- Kofoet A. et al. Inheritance of resistance to downy mildew (Peronospora destructor [Berk.] Casp.) from Allium roylei Stearn in the backcross Allium cepa L.×(A. roylei × A. cepa). Plant Breeding. 1990;105(2):144-149.
- Khrustaleva L. et al. The power of genomic in situ hybridization (GISH) in interspecific breeding of bulb onion (Allium cepa L.) resistant to downy mildew (Peronospora destructor [Berk.] Casp.). Plants. 2019;8(2):36. https://doi.org/10.3390/plants8020036
- Scholten O.E., Van Heusden A.W., Khrustaleva L.I., Burger-Meijer K., Mank R.A., Antonise R.G.C., Harrewijn J.L., Van haecke W., Oocst E.H., Peters R.J. The long and winding road leading to the successful introgression of downy mildew resistance into onion. Euphytica 2007;(156):345–353. https://doi.org/10.1007/s10681-007-9383-9
- Kim S. et al. Development of a simple PCR marker tagging the Allium roylei fragment harboring resistance to downy mildew (Peronospora destructor) in onion (Allium cepa L.). Euphytica. 2016;208(3):561-569. https://doi.org/10.1007/s10681-015-1601-2
- Kim S. A codominant molecular marker in linkage disequilibrium with a restorer-of-fertility gene (Ms) and its application in reevaluation of inheritance of fertility restoration in onions. Mol. Breeding. 2014;(34):769-778. https://doi.org/10.1007/s11032-014-0073-8
- Rogers S.O., Bendich A.J. Extraction of DNA from plant tissues. Plant molecular biology manual. Springer, Dordrecht, 1989. P.73-83.


