Масс-спектрометрическое изучение водно-ацетонитрильных растворов унитиола
Автор: Кулешов Денис Олегович, Кулешова Т.Э., Бобков Д.Е., Дьяченко А.А., Галль Н.Р., Галль Л.Н.
Журнал: Научное приборостроение @nauchnoe-priborostroenie
Рубрика: Приборостроение физико-химической биологии
Статья в выпуске: 3 т.28, 2018 года.
Бесплатный доступ
Унитиоловый тест с измерением времени полуокисления унитиола электрохимическими и фотометрическими методами нашел широкое применение в изучении биологического влияния геомагнитных и космофизических факторов на живые организмы. Изучение продуктов окисления унитиола и скоростей их образования было проведено методом масс-спектрометриии с электрораспылением. Показано, что в масс-спектрах водно-ацетонитрильных растворов унитиола наряду с катионированным натрием ионом мономера унитиола (C3H7O3S3Na)Na+ присутствуют в значительном количестве ионы катионированных натрием ассоциатов унитиола общего вида (C3H7O3S3Na) n Na+, где величина n достигала 8. Интенсивности пиков ассоциатов уменьшались с увеличением числа молекул в ассоциате, однако общая интенсивность ассоциатов превышала интенсивность мономера. С повышением концентрации относительная суммарная интенсивность ассоциатов возрастала, что позволяет предположить их образование непосредственно в водном растворе. Изучение процессов окисления может дать дополнительную информацию о влиянии внешних условий на окислительно-восстановительные процессы живого организма.
Влияние физических факторов, унитиоловый тест, масс-спектрометрия с электрораспылением, ассоциаты
Короткий адрес: https://sciup.org/142214875
IDR: 142214875 | УДК: 542.9 | DOI: 10.18358/np-28-3-i7283
Текст научной статьи Масс-спектрометрическое изучение водно-ацетонитрильных растворов унитиола
В настоящее время все более пристальное внимание в науках о жизни уделяется изучению роли слабых физических факторов, особенно электромагнитных полей, в процессах, протекающих в молекулярных системах живых организмов. В связи со сверхнизкими интенсивностями этих факторов, проявляющихся, однако, в выраженных макроскопических реакциях живых систем, для их регистрации используются, как правило, биологические тесты, а потому весьма актуальной является задача изучения молекулярных систем и биохимических процессов, которые могут быть задействованными в таких реакциях в качестве тестовых.
Как известно, огромную роль в биохимических процессах, протекающих в живых системах, играют окислительно-восстановительные реакции (ОВР). К их числу относятся ОВР тиолов, окисление которых в мягких физиологических условиях приводит к образованию дисульфидов, причем эта реакция является обратимой. Биотиолы в мягких физиологических условиях легко вступают в разнообразные химические реакции, причем на их скорость оказывают влияние любые внешние воздействия, вызывающие изменения пространствен- ной конфигурации тиолсодержащей молекулы или окружающей ее среды [1]. Важнейшим признаком тиоловых соединений, определяющим их специфическую биологическую активность, является высокая реакционная способность сульфгидрильных групп, обусловленная уникальными особенностями атома серы: легкой поляризуемостью электронов и подвижностью незанятых d-орбиталей [2]. Это позволило в рамках концепции прямой зависимости биохимических реакций и физиологических процессов от окислительно-восстановительного состояния биологической системы [3] и окружающей ее среды [4] выделить окислительно-восстановительные превращения тиоловых соединений в качестве единой тиол-дисульфидной системы организма (ТДС), представляющей собой совокупность реакционноспособных тиоловых соединений, находящихся в организме в данный момент в восстановленном и окисленном состояниях и сохраняющих способность к их изменению — окислению или восстановлению.
В.В. Соколовским было показано [5], что состояние ТДС организма может быть количественно охарактеризовано отношением концентраций сульфгидрильных и дисульфидных групп, т. е. величиной тиол-дисульфидного отношения (ТДО), являющегося интегральным показателем реакции организма на действие окружающей среды. Возможность количественно определить ТДО в свою очередь позволила перейти от теоретических концепций биологических редокс-систем к их практическому использованию при изучении механизмов развития и поиске путей лечения заболеваний, а также при использовании ТДО в качестве показателя физиологического состояния организма, его неспецифической резистентности. Используя ТДО в качестве инструмента для оценки редокс-состояния живого организма, В.В. Соколовский впервые доказательно связал между собой процессы жизнедеятельности и их изменение под действием солнечной активности, раскрыв, тем самым, биологический механизм влияния внешних физико-химических и космогеофизических факторов на физиологическое состояние живого организма. Исследования в этом направлении, интерес к которым сильно вырос в связи с развитием космонавтики и появлением гелиобиологии как самостоятельного направления исследований, базировались на регистрации ТДО крови in vivo и регистрации его изменения в корреляции с изменением внешних факторов, воздействующих на организм человека, выступающий в данном случае в качестве биологического теста. Однако признанные успехи химического теста Дж. Пиккарди (реакция гидролиза хлорида висмута) в установлении влияния космических процессов на свойства этого коллоидного раствора вдохновили В.В. Соколовского [6] предложить модельную химическую систему для изучения реакции ТДС организма на влияние внешних химических, физических и биологических факторов. В качестве перспективной модели ТДС им было предложено использовать реакцию окисления унитиола (2,3-димеркаптопропан- сульфоната-1 натрия) нитритом натрия, причем за количественный критерий было принято время полуокисления тиоловых групп унитиола (ВПОУ). Им предполагалось, что пространственная близость двух SH-групп облегчает образование внутримолекулярной дисульфидной связи при окислении в "мягких" условиях и, таким образом, позволяет имитировать функциональный центр белков, ответственный за их редокс-превращения. Полная корреляция между величинами ТДО in vivo и ВПОУ, неизменно подтверждаемая в многолетних экспериментах группы В.В. Соколовского, позволяет считать этот тест полноценным химическим сенсором in vitro для изучения редокс-изменения состояния тиоловых соединений живого организма. Унитиоловый тест с измерением ВПОУ нашел широкое применение в изучении биологического влияния геомагнитных и космофизических факторов на живые организмы [7].
В работах В.В. Соколовского унитиоловый тест реализовывался с использованием электрохимических и спектрофотометрических методов, крайне трудоемких, связанных с ручным титрованием растворов и требующих значительной затраты времени. При этом единственным результатом каждого измерения являлось определение ВПОУ, в то время как возможность определения продуктов окисления и изучения скоростей их образования может дать дополнительную информацию о влиянии факторов различной природы на биологические объекты. Такая информация может быть получена при использовании масс-спектрометрического детектирования процесса окисления унитиола, и первым этапом такого исследования является масс-спектрометрическое изучение растворов унитиола.
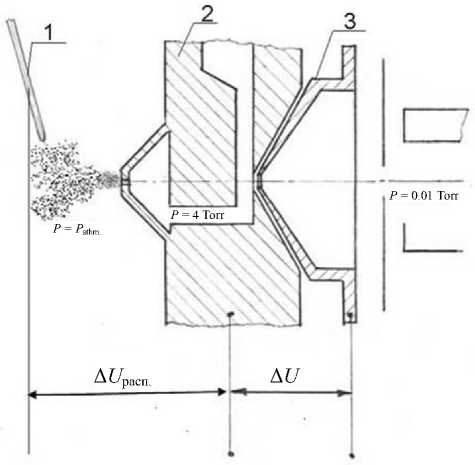
Рис. 1. Схематичное изображение газодинамического интерфейса времяпролетного масс-спектрометра МХ-5310.
1 — распыляющий капилляр, 2 — газодинамическое сопло, 3 — скиммер
ОБОРУДОВАНИЕ И РЕАКТИВЫ
Исследования проводились на хроматомасс-спектрометре высокого разрешения МХ-5310 (ИАП РАН, Россия) с ионизацией электрораспылением. Интерфейс масс-спектрометра, характерные размеры и напряжения на элементах системы распыления раствора представлены на рис. 1. В качестве образца для исследования использовались фармацевтический препарат в ампулах, содержащий 5 % раствор унитиола, и порошковый моногидрат унитиола. Для поддержания необходимого pH использовалась уксусная кислота. Для приготовления растворов использовалась дистиллированная вода и ацетонитрил класса 0.
РЕЗУЛЬТАТЫ
Типичный масс-спектр унитиола представлен на рис. 2. Масс-спектр получен путем прямого ввода пробы в масс-спектрометр с помощью шприцевого насоса. Исследуемая проба готови- лась из фармацевтического препарата унитиола разведением 1 % уксусной кислотой в 100 раз, а затем ацетонитрилом — в 10 раз. Масс-спектр записывался в течение 5 мин. Скорость подачи пробы на ввод в узел распыления масс-спектрометра составляла 1 мкл/мин. Давления в интерфейсе, газонаполненной квадрупольной ячейке и масс-анализаторе были постоянными в ходе всех экспериментов и составляли 4 Торр (интерфейс), 10–2 Торр (газонаполненная квадрупольная ячейка), 1.6·10–7 Торр (масс-анализатор). Калибровка шкалы масс осуществлялась по резерпину. Точность определения m/z составляла 10 ppm во всех измерениях.
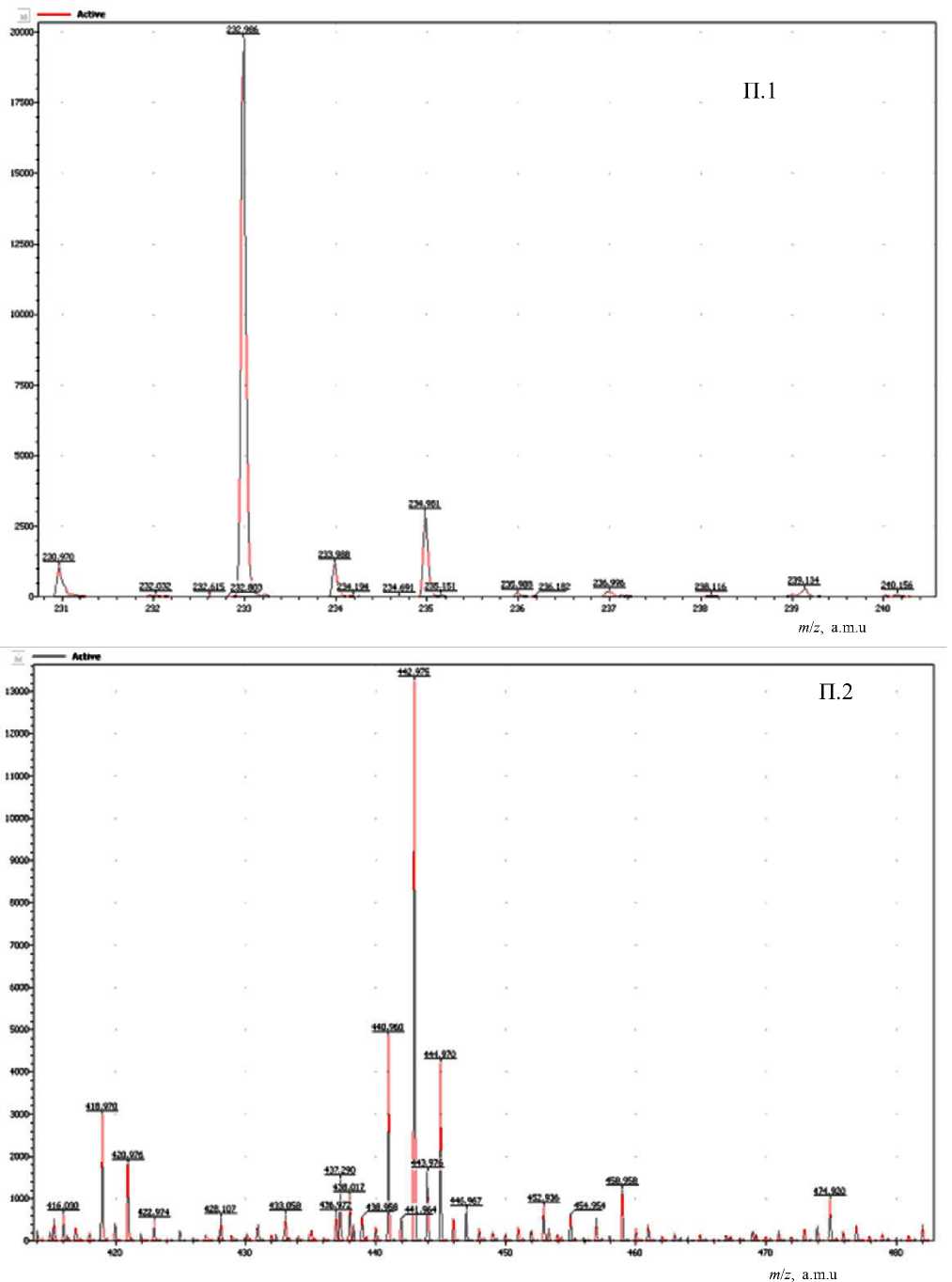
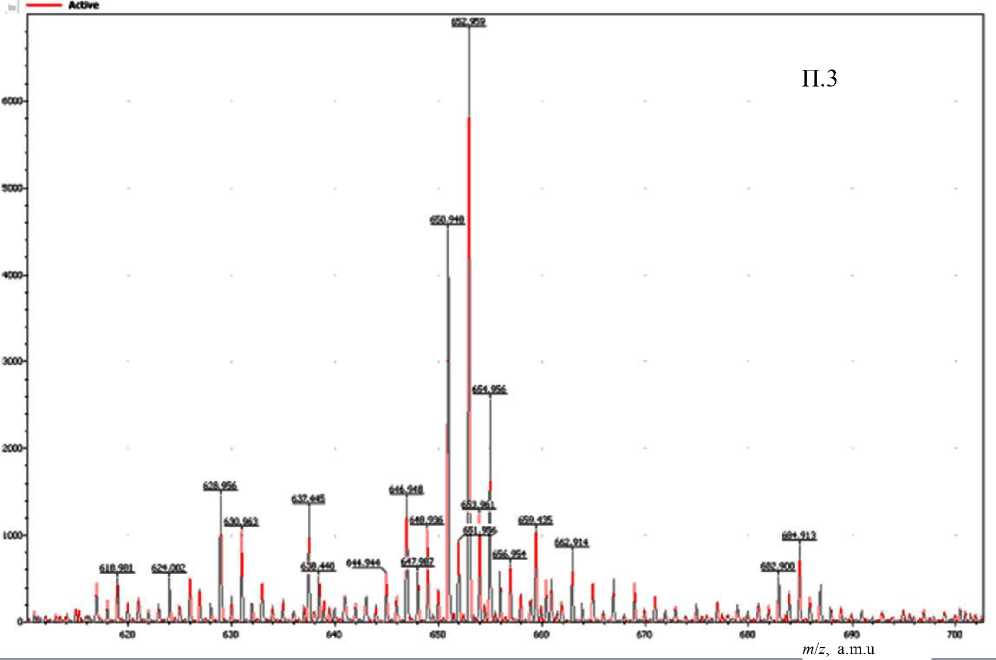
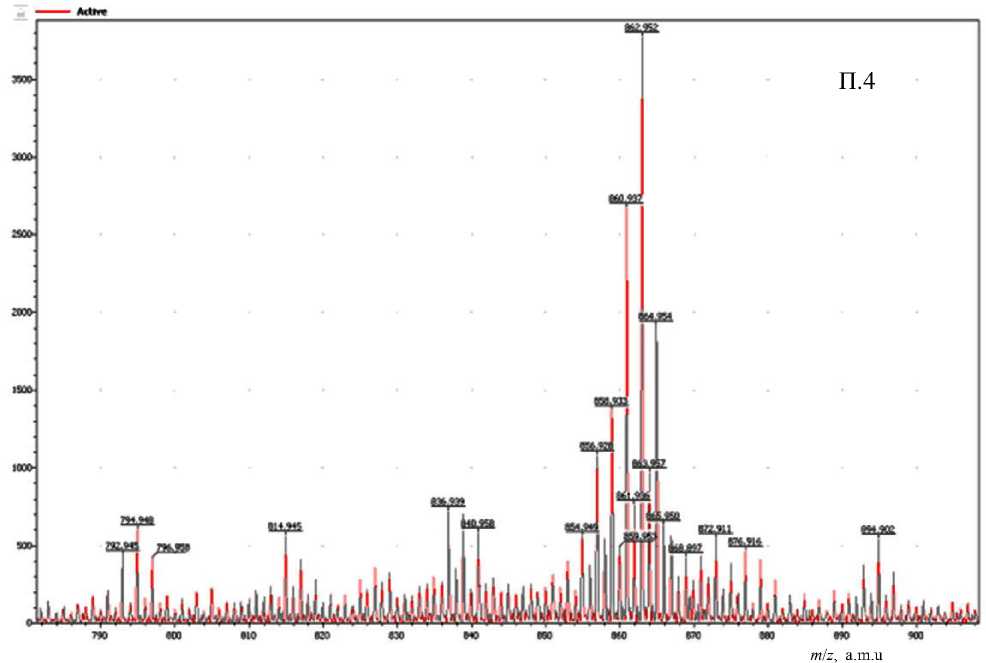
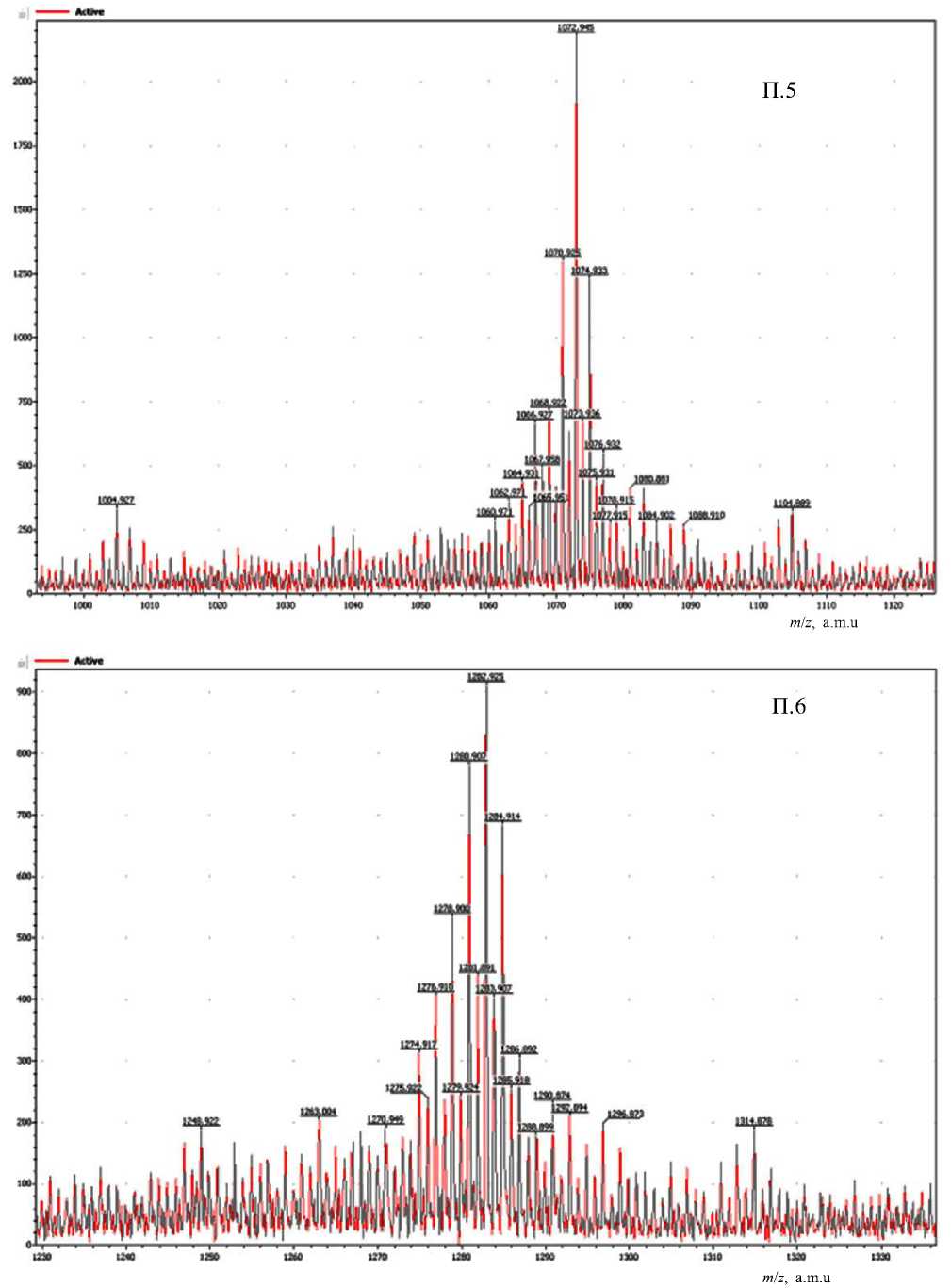
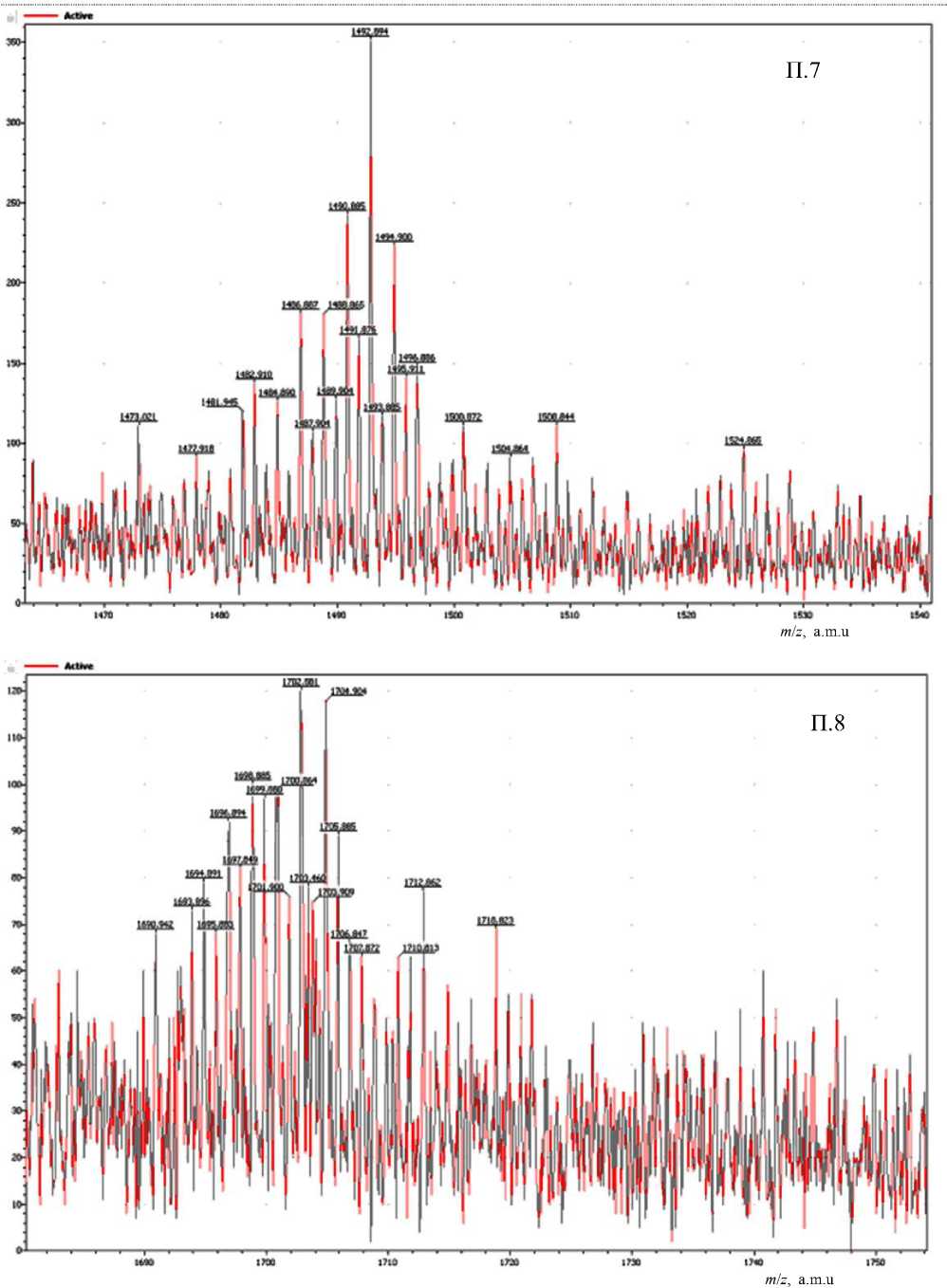
Как видно из рис. 2, в масс-спектре унитиола зарегистрированы восемь групп пиков с наиболее интенсивными ионами m / z = 232.98, 442.97, 652.95, 862.95, 1072.9, 1282.9, 1492.8, 1702.9. Для проведения идентификации ионов эти группы более детально представлены в Приложении, П.1–П.8.
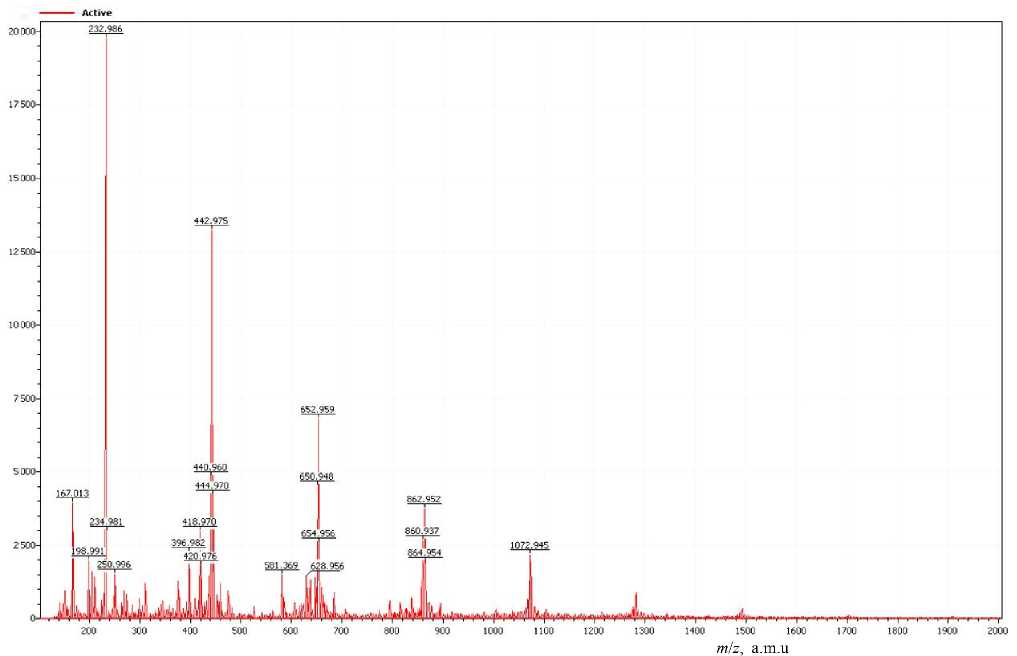
Рис. 2. Масс-спектр раствора унитиола ( C = 2.38·10 –4 моль/л) в диапазоне m / z 100–2000.
Напряжение распыления — 3200 В, разность потенциалов между соплом и скиммером — Δ U =120 В
Ранее уже было установлено [8], что молекулы унитиола, наблюдаемые в масс-спектре, образуют ионы, катионированные натрием. Это позволяет считать, что пик m / z = 232.98 в первой группе ионов (Приложение, рис. П.1) есть катионированный натрием ион унитиола, что подтверждается его изотопными (по сере) пиками с m / z = 233.98 и 234.98. Аналогично можно считать, что основной пик второй группы ионов m / z = 442.975 есть катионированый натрием ион ассоциата двух мо-ноизотопных молекул унитиола, причем ионы с m / z = 443.97 и 444.97 являются его изотопными (по сере). В этой же группе пик с m / z = 440.96 является моноизотопным ионом катионированной натрием молекулы ациклического димера унитио-ла, а пики m / z = 441.96 и 442.97 — его изотопными. В остальных группах ионов (Приложение, рис. П.3–П.8) основные пики соответствуют ассоциатам, образованным тремя, четырьмя и далее до восьми молекулами унитиола, что позволяет описать все катионированые ассоциаты, представленные на рис 2 (Приложение, П.1–П.8), общей формулой (C 3 H 7 O 3 S 3 Na) n Na+, где n = 1,…, 8. Кроме уже перечисленных, в спектрах всех групп также присутствуют ионы, соответствующие продуктам окисления унитиола в свободной и ассоциированной формах, катионированных ионом натрия.
ОБСУЖДЕНИЕ РЕЗУЛЬТАТОВ
Присутствие в спектре водного раствора уни-тиола интенсивных групп ионов ассоциатов с n = 2
и более, вместо ожидаемых только ионов мономеров ( n = 1), позволяет сделать два предположения:
-
1) ассоциаты возникают в результате комплекса физических процессов при электрораспылитель-ной ионизации либо
-
2) ассоциаты образуются непосредственно в водном растворе при растворении унитиола.
Для проверки первого предположения было исследовано влияние условий распыления раствора и транспортировки ионов в интерфейсе на состав ионов унитиола в различных группах масс-спектра. В качестве изменяющихся условий были взяты напряжение распыления U расп. , определяющее структуру аэрозоля, и разница потенциалов между соплом и скиммером Δ U , характеризующая не только столкновительные процессы в интерфейсе, но и пропускание ионов в отверстие скиммера (рис. 1). Напряжение распыления U расп. изменялось от 2400 В до 4000 В с шагом 400 В; разность потенциалов Δ U между соплом и скиммером изменялась дискретно от 40 В до 240 В при фиксированных напряжениях распыления U расп. и U ским. . Скорость подачи пробы в масс-спектрометр во всех измерениях составляла 1 мкл/мин.
На рис. 3 представлено изменение количества ионов ассоциатов в зависимости от параметров распыления и фокусировки ионов в интерфейсе. Из рисунка видно, что в широком диапазоне изменения напряжения распыления относительное количество ассоциатов изменяется незначительно, не более чем на 20%, но весьма существенно зависит от напряжения между соплом и скиммером.
Σ I + n %
250 г
200 •
50 •
О
250 AZ7 [В] 300
Рис. 3. Влияние потенциала распыления U расп. и разности потенциалов между соплом и скиммером Δ U на величину относительного количества ионов ассоциатов унитиола с различным числом n молекул в ассоциате.
1 — n = 2; 2—– n = 3; 3 — n = 4; 4 — n = 5; 5 — n = 6
Состав исследуемых проб
|
C (унитиол), моль/л |
V (р-р унитиола ( C = 10 –3 моль/л)), мкл |
V (1% р-р CH 3 COOH), мкл |
V (ацетонитрил), мкл |
|
10–5 |
10 |
490 |
|
|
2∙10–5 |
20 |
480 |
|
|
3∙10–5 |
30 |
470 |
|
|
4∙10–5 |
40 |
460 |
|
|
5∙10–5 |
50 |
450 |
|
|
6∙10–5 |
60 |
440 |
500 |
|
7∙10–5 |
70 |
430 |
|
|
8∙10–5 |
80 |
420 |
|
|
9∙10–5 |
90 |
410 |
|
|
10 –4 |
100 |
400 |
|
|
2.5∙10–4 |
250 |
250 |
При этом наряду с ионами мономера ионы ассоциатов присутствуют всегда, составляя от 60 % до 200 % от их интенсивности. Перераспределение кластеров разных масс в масс-спектре в зависимости от Δ U , видимо, связано с более сложными электрогазодинамическими процессами, не учитываемыми в данном случае.
Второе объяснение присутствия в масс-спектре ассоциатов больших масс связано с предположением, что они были образованы непосредственно в растворе при растворении унитиола. Для его проверки была проведена регистрация масс- спектров в диапазоне концентраций 10–5– 2.5∙10–4 М. Для этого раствор порошкового моногидрата унитиола первоначально готовился в 1 % уксусной кислоте с концентрацией C = = 10–3 моль/л. Далее из этого раствора путем его разбавления 1 % уксусной кислотой CH3COOH и ацетонитрилом CH3CN готовились пробы, состав которых приведен в таблице. Полученные пробы вводились в область распыления интерфейса масс-спектрометра через распылительный капилляр с помощью шприцевого насоса. Скорость
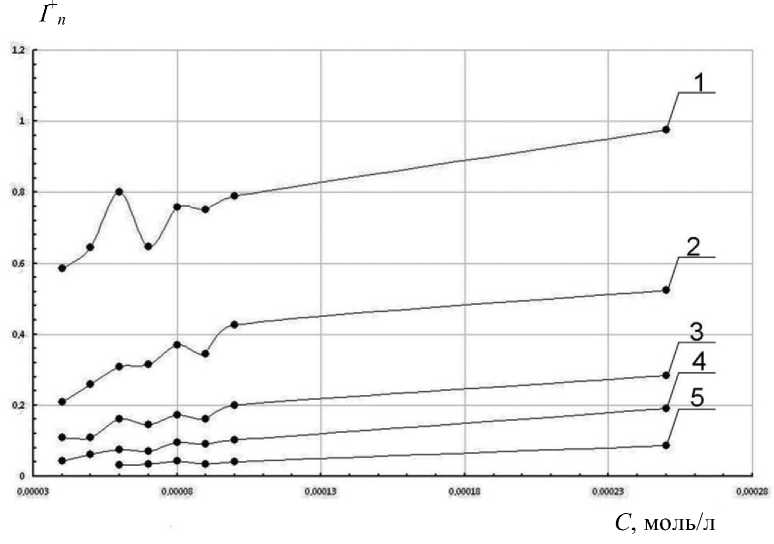
Рис. 4. Изменение относительного количества ионов ассоциатов унитиола с различным числом n молекул в ассоциате при изменении концентрации раствора С моль/л.
1 — n = 2, 2 — n = 3, 3 — n = 4, 4 — n = 5, 5 — n = 6. Интенсивности пиков ассоциатов нормированы на интенсивность аналитического сигнала мономера унитиола
подачи составляла 1 мкл/мин (рис. 1). В ходе работы записывалось по 5 спектров на каждую точку, значения интенсивностей пиков в которых усреднялись. Погрешности определения интенсивностей в области низких концентраций (до 3·10–5 М) составляли величины до 20 %, в связи с чем в дальнейшем обсуждении эти концентрации не рассматривались. При увеличении концентрации унитиола интенсивности пиков воспроизводились значительно лучше, и при концентрациях выше 4∙10–5 М погрешность определения интенсивностей даже наиболее слабых пиков не превышала 6 %. Каждый спектр записывался в течение 50 с. В качестве электрических параметров для изучения зависимости вида масс-спектра унитиола от его концентрации были использованы следующие их величины: U расп. = 3200 В и U сопл. = 180 В. Результаты измерений представлены на рис. 4.
Из рис. 4 видно, что в диапазоне концентраций от 4∙10–5 до 2.5·10–4 моль/л с увеличением концентрации унитиола в растворах, приготовленных из кристаллического моногидрата унитиола, относительное содержание ионов-ассоциатов в масс-спектре растет с увеличением концентрации, что подтверждает предположение о том, что ассоциаты возникают непосредственно в растворе уни-тиола. Значительные колебания относительных интенсивностей пиков связаны, предположительно, со взаимопревращениями ассоциатов унитиола в растворе. Такой же характер имеет зависимость содержания в масс-спектре ионов-ассоциатов от концентрации для растворов унитиола, приготовленных путем разведения 1 % уксусной кислотой исходного фармацевтического препарата "унитиол".
ЗАКЛЮЧЕНИЕ
Как следует из проведенных измерений, в масс-спектрах водно-ацетонитрильных растворов уни-тиола наряду с катионированным натрием ионом мономера унитиола (C 3 H 7 O 3 S 3 Na)Na+, присутствуют в значительном количестве ионы катиониро-ванных натрием ассоциатов унитиола общего вида (C 3 H 7 O 3 S 3 Na) n Na+, где наблюдаемая величина n достигала 8. Интенсивности пиков ассоциатов уменьшались с увеличением числа молекул в ассоциате, однако общая интенсивность суммы ассоциатов превышала интенсивность мономера. С повышением концентрации относительная суммарная интенсивность ассоциатов возрастала, что подтверждает второе предположение, а именно, что ассоциаты возникают непосредственно в водном растворе унитиола и далее в таком виде находятся в растворе. Это означает, что процесс окисления является значительно более сложным, чем это предполагалось создателями унитиолового теста. Изучение этих процессов может дать дополнительную информацию о влиянии внешних условий на окислительно-восстановительные процессы живого организма.
ПРИЛОЖЕНИЕ
Фрагменты полного масс-спектра унитиола: группы пиков ассоциатов n = 1–8
Работа выполнена при поддержке госзадания
№ 43-12, а также при финансовой поддержке Российского научного фонда (проект 14-50-00068)
Список литературы Масс-спектрометрическое изучение водно-ацетонитрильных растворов унитиола
- Соколовский В.В. Тиолдисульфидная система в реакции организма на факторы окружающей среды. СПб.: Наука, 2008. 112 с.
- Jocelyn P. Biochemistry of the SH-group. The occurrence, chemical properties, metabolism and biological function of thiol and disulphides. London, N.Y.: Acad. Press, 1972. 404 p.
- Essex D. Redox control of platelet function//Antioxidants and redox signaling. 2009. Vol. 11, no. 5. P. 1191-1225.
- Daynes R., Enioutina E., Jones D. Role of redox imbalance in the molecular mechanisms responsible for immunosenescence//Antioxidants and redox signaling. 2003. Vol. 5, no. 5. P. 537-548.
- Соколовский В.В. Тиоловые антиоксиданты в молекулярных механизмах неспецифической реакции организма на экстремальное воздействие//Вопросы медицинской химии. 1988. Т. 34, № 6. C. 200-210.
- Соколовский В.В., Соколовская Т.М., Шубина Л.Н. О биохимическом механизме токсического действия двуокиси азота//Фармакология и токсикология. 1974. Т. 37, № 4. С. 469-471.
- Горшков Э.С., Иванов В.В., Соколовский В.В. Редокс реакции в космобиологии. СПб.: Изд. Политехн. университета, 2014. 194 с.
- Kuleshov D.O., Berezkina T.E., Russkikh Y.V., et al. Application of high-performance liquid chromatography/high-resolution mass spectrometry to the investigation of sodium 2, 3-disulfanyl-1-propanesulfonate (unithiol) and products of its oxidation with hydrogen peroxide//Journal of Analytical Chemistry. 2016. Vol. 71, no. 14. P. 1381-1388.


