Масс-спектрометрия электронного удара в анализе включения стабильных изотопов дейтерия и углерода-13 в молекулы аминокислот биологических объектов
Автор: Мосин Олег Викторович, Игнатов И., Швец В.И., Тыминский Г.
Журнал: Научное приборостроение @nauchnoe-priborostroenie
Рубрика: Физика и химия приборостроения
Статья в выпуске: 4 т.25, 2015 года.
Бесплатный доступ
В работе продемонстрирована возможность использования масс-спектрометрии электронного удара (ЭУ) на приборе MB-80 A ("Hitachi", Япония) с двойным электронным фокусированием для анализа смесей [ 2H, 13С]аминокислот L -фенилаланин-продуцирующего штамма Brevibacterium methylicum и L -лейцин-продуцирующего штамма Methylobacillus flagellatum, а также [ 2H, 13С]аминокислот суммарных белков биомассы, выделенных при выращивании клеток бактерий на средах, содержащих в качестве источников стабильных изотопов [ 2Н]метанол, [ 13С]метанол и 2Н 2О. Для масс-спектрометрического анализа уровней включения стабильных изотопов 2H и 13С в молекулы [ 2H, 13С]аминокислот их многокомпонентные смеси в составе культуральных жидкостей и белковых гидролизатов (гидролиз в 6 М 2НСl (3 % фенол) и 2 М Ва(ОН) 2) модифицировали в N-бензилоксикарбонил-производные: [ 2H, 13С]аминокислоты и метиловые эфиры N-5-(диметиламино)нафталин-1-сульфонил-производных [ 2H, 13С]аминокислот, - которые разделяли методом обращенно-фазовой высокоэффективной жидкостной хроматографии на колонке с октадецилсилановым селикагелем Separon SGX С18. Уровни включения 2Н и 13С в молекулы секретируемых аминокислот и аминокислотные остатки суммарных белков биомассы варьируются в зависимости от метаболических путей биосинтеза [ 2H, 13С]аминокислот и содержания 2H- и 13C-меченых субстратов в ростовых средах и различаются для разных аминокислот (от 20.0 атом. % для L -лейцина / изолейцина и до 97.5 атом. % для L -аланина).
Стабильные изотопы, метилотрофные бактерии, изотопно-меченые аминокислоты, оф вэжх, масс-спектрометрия эу
Короткий адрес: https://sciup.org/14264995
IDR: 14264995 | УДК: 579.871.08+577.112.385.4.08
Текст научной статьи Масс-спектрометрия электронного удара в анализе включения стабильных изотопов дейтерия и углерода-13 в молекулы аминокислот биологических объектов
Метод изотопного мечения является важным инструментальным этапом в разнообразных биохимических и метаболических исследованиях с использованием аминокислот и других биологически активных соединений (БАС), меченных стабильными изотопами 2Н, 13С, 15N, 18O [1]. Тенденции к предпочтительному применению стабильных изотопов по сравнению с их радиоактивными аналогами обусловлены отсутствием радиационной опасности и возможностью определения локализации метки в молекулах БАС методами высокого разрешения, включая ЯМР [2], ИК-спектроскопию [3] и масс-спектрометрию [4]. Развитие инструментальных методов детектирования и анализа стабильных изотопов за последние годы позволило повысить эффективность биохимических исследований, а также изучать структуру и механизм действия клеточных БАС на молекулярном уровне. В частности, 2Н- и 13С-меченые аминокислоты применяются для изучения пространственной структуры и конформационных изменений белков, взаимодействия белковых молекул, а также в химических синтезах изотопно- меченых соединений на их основе [5, 6].
Определяющим фактором в исследованиях с применением [2Н, 13С]аминокислот, является их доступность. [2Н, 13С]аминокислоты могут быть получены с использованием химических, ферментативных и микробиологических методов. Химические синтезы часто многостадийны, требуют больших расходов дорогостоящих реагентов и меченых субстратов и приводят к продукту, представляющему собой рацемическую смесь D - и L -энантиомеров, для разделения которых требуются специальные методы [7]. Тонкие химические технологии синтеза [2Н, 13С]аминокислот связаны с использованием комбинации химических и ферментативных подходов [8].
Микробиология предлагает альтернативный химическому синтезу метод получения [2H, 13C]аминокислот, который приводит к высоким выходам синтезируемых продуктов, к эффективному включению стабильных изотопов в молекулы, и к сохранению природной конфигурации синтезируемых [2H, 13C]соединений. При микробиологическом получении [2Н, 13С]аминокислот используют несколько подходов, один из которых заключается в равномерном обогащении синтези- руемых соединений стабильными изотопами по всему углеродному скелету молекулы за счет выращивания штаммов продуцентов на селективных средах, содержащих в качестве источников стабильных изотопов [13С]метанол, [2Н]метанол и 2Н2О [9, 10]. Этот подход включает также комплексное использование химических компонентов биомассы, выращенной на [2H, 13C]ростовых субстратах, и последующее выделение целевых 2H-и 13C-меченых соединений. Другой подход заключается в селективном обогащении аминокислот стабильными изотопами по определенным положениям молекул за счет ассимиляции клеткой изотопно-меченых предшественников, например [1,4-13С]сукцината, [1, 2-13С]ацетата и [1-13С]лактата [11].
Настоящая работа является продолжением исследований, связанных с применением масс-спектрометрии электронного удара (ЭУ) в анализе уровней включения стабильных изотопов 2Н и 13С в сложные многокомпонентные смеси [2Н, 13С]аминокислот, полученные микробиологически за счет утилизации клетками микроорганизмов низкомолекулярных меченых субстратов — [2Н]метанола, [13С]метанола и 2Н 2 О. Чувствительность масс-спектрометрии ЭУ составляет 10–9–10–11 моль, что существенно выше, чем при использовании ИК- и ЯМР-спектроскопии. Данный метод в сочетании с обращенно-фазовой высокоэффективной жидкостной хроматографией (ОФ ВЭЖХ) показал большие перспективы в исследовании уровней изотопного обогащения молекул [2Н, 13С]аминокислот в составе их многокомпонентных смесей, каковыми являются образцы культуральных жидкостей штаммов-продуцентов аминокислот и гидролизаты суммарных белков биомасс, полученные с минимальных ростовых сред, содержащих изотопно-меченые субстраты.
ПРИБОРЫ И МАТЕРИАЛЫ
Для синтеза производных [2H, 13C]аминокислот использовали N-5-(диметиламино)нафтален-1-сульфонил хлорид (Dns-хлорид) ("Sigma Aldrich", США), бензилоксикарбонилхлорид ("Sigma Aldrich", США) и диазометан, получаемый из N-нитрозометилмочевины ("Sigma Aldrich", США). Для приготовления рóстовых сред использовали
-
2Н 2 О (99.9 атом. % 2Н), 2НCl (95.6 атом. % 2Н), [2Н]метанол (98.5 атом. % 2Н) и [13C]метанол (99.5 атом. % 13С), полученные из Российского научно-технического центра "Изотоп" (Санкт-Петербург, Россия). Неорганические соли предварительно перекристаллизовывали в 2Н 2 О, 2H 2 O дистиллировали над KMnO 4 с последующим контролем изотопной чистоты 1Н ЯМР-спектроскопией на приборе Brucker WM-250
("Brucker Daltonics", ФРГ) (рабочая частота 70 МГц, внутренний стандарт Me 4 Si), химические сдвиги протонов ( δ , ppm) измерены в миллионных долях по отношению к Ме 4 Si.
Разделение смеси метиловых эфиров N-Dns-[2H, 13C]аминокислот из культуральной жидкости и белковых гидролизатов проводили методом ОФ ВЭЖХ на жидкостном хроматографе Knauer Smartline ("Knauer", Германия), снабженном УФ-детектором UF-2563 и интегратором С-R 3A ("Shimadzu", Япония) при t = 20–(±25) °С, используя колонку размерами 250 × 10 мм с неподвижной обращенной фазой Separon SGX С18, 7 мкм ("Kova", Словакия). Подвижная фаза: (А) — аце-тонитрил—трифторуксусная кислота = 100 : (0.1– 0.5) об. % и (Б) — ацетонитрил = 100 об. % в условиях градиентного элюирования. Объем пробы — 50 - 100 мкл; скорость элюирования — 1.5 мл/мин. Выход индивидуальных метиловых эфиров N-Dns-[2Н, 13C]аминокислот — 75 - 89 %; хроматографическая чистота — 95 - 98 %.
Ионообменную хроматографию белковых гидролизатов [2H, 13C]аминокислот осуществляли на приборе Biotronic LC 5001 ("Eppendorf-Nethleler-Hinz", Германия) с использованием колонки Biotronic resin BIC 2710; t = 20–(±25) °С; размеры колонки — 3.2 × 230 мм. Неподвижная фаза — сульфированная стирольная смола UR-30 ("Beckman Spinco", США); подвижная фаза — 0.2 М Na-цитратный буфер. Рабочее давление — 50–60 атм; скорость подачи Na-цитратного буфера — 18.5, нингидрина — 9.25 мл/ч; детекция при λ = 570 нм и λ = 440 нм (для пролина).
Масс-спектры ЭУ производных [2H, 13C]амино-кислот регистрировали на приборе MB-80 A ("Hitachi", Япония) с двойным электронным фокусированием при ионизирующем напряжении 70 эВ, ускоряющем напряжении 8 кВ и температуре катодного источника 180–200 °С. Сканирование анализируемых образцов проводили при разрешении 7500 усл. ед., используя 10 %-ю резкость изображения.
УСЛОВИЯ ЭКСПЕРИМЕНТА
Штаммы-продуценты [2Н, 13С]аминокислот
Исследования проводили с генетически маркированными штаммами бактерий, полученными из коллекции культур Всероссийской коллекции промышленных микроорганизмов (ВКПМ) Государственного научно-исследовательского института генетики и селекции промышленных микроорганизмов:
-
1) Brevibacterium methylicum ВКПМ В 5652 — L -лейцин-зависимый штамм факультативных ме-
- тилотрофных бактерий, продуцент L-фенилаланина;
-
2) Methylobacillus flagellatum KT — L -изо-лейцин-зависимый штамм облигатных метило-трофных бактерий, продуцент L -лейцина;
Условия выращивания бактерий и выделения 2Н, 13С-меченых белков и аминокислот
Выращивание метилотрофных бактерий B. methylicum и M. flagellatum осуществляли в минеральной среде М9 в колбах Эрленмейера объемом 250 мл с наполнением средой 50 мл по методике [12], используя в качестве источников стабильных изотопов [2H]метанол, [13С]метанол и 2Н2O в присутствии L -лейцина для B. methylicum и L -изолейцина для M. flagellatum в концентрациях 10 мг/л. Клетки отделяли центрифугированием на центрифуге Т-24 ("Heraues Sepatech", Германия) (10 000 g , 20 мин). В культуральной жидкости анализировали секретируемые аминокислоты. Для выделения фракции суммарных белков биомассы клетки дважды промывали дистиллированной водой с последующим центрифугированием (10 000 g , 20 мин), экспонировали ультразвуком при 40 кГц (3×15 мин) и центрифугировали. Полученный осадок (10 мг) после отделения липидов и пигментов смесью органических растворителей хлороформ— метанол—ацетон (2 : 1 : 1) использовали в качестве фракции суммарных белков биомассы. Липиды и пигменты экстрагировали смесью хлороформ— метанол—ацетон (2 : 1 : 1) по методу Блайя и Дайера [13]. Гидролиз белка проводили с помощью 6 М 2НСl (3 % фенол в 2Н 2 О) или 2 М Ва(ОН) 2 (110 °С, 24 ч).
Синтез N-Dns-[2H, 13C]аминокислот
Для синтеза N-Dns-[2H, 13C]аминокислот к 4–5 мг лиофилизованных препаратов культуральной жидкости и белковых гидролизатов в 1 мл 2 М NaHCO 3 , рН = 9–10, порциями при перемешивании добавляли 25.5 мг дансилхлорида в 2 мл ацетона. Реакционную смесь выдерживали 1 ч при перемешивании при t = 40 °С, затем подкисляли 2 М HСl до рН = 3.0 и экстрагировали этилацетатом (3 x 5 мл). Объединенный экстракт промывали водой до значения рН = 7.0, сушили безводным сульфатом натрия, растворитель удаляли при 10 мм. рт. ст.
Синтез метиловых эфиров N-Dns-[2H, 13C]аминокислот
К 20 мл 40 % КОН в 40 мл диэтилового эфира добавляли 3.0 г влажной нитрозометилмочевины и перемешивали на водяной бане со льдом в течение 15–20 мин. После окончания интенсивного газовыделения из реакционной смеси диазометана эфирный слой отделяли, промывали ледяной водой до рН = 7.0, сушили безводным сульфатом натрия и использовали для обработки препаратов N-[2H, 13C]дансиламинокислот в составе культуральной жидкости или гидролизатов суммарных белков биомассы.
Синтез N-Cbz-[2H, 13C]аминокислот
Для синтеза N-Cbz-[2H, 13C]аминокислот к 1.5 мл охлажденного до 0 °С раствора культуральной жидкости (50 мг) или белковых гидролизатов (4–5 мг) в 4 М NaOH добавляли порциями при перемешивании 2 мл 4 М NaOH и 28.5 мг бензилоксикарбо-нилхлорида. Реакционную смесь выдерживали при 0 °С, перемешивали ~3 ч, подкисляли 2 М HCl до рН = 3.0 и экстрагировали этилацетатом (3×5 мл). Объединенный экстракт промывали водой до рН = 7.0, сушили безводным сульфатом натрия, растворитель удаляли при 10 мм. рт. ст.
РЕЗУЛЬТАТЫ И ИХ ОБСУЖДЕНИЕ
Выделение [2Н, 13C]аминокислот из культуральных жидкостей и белковых гидролизатов
Объектами исследования служили полученные в результате мутагенеза L -фенилаланин-про-дуцирующий штамм факультативных метило-трофных бактерий Brevibacterium methylicum , ассимилирующий метанол по рибулозо-5-монофосфатному циклу ассимиляции углерода, и L -лейцин-продуцирующий штамм облигатных ме-тилотрофных бактерий Methylobacillus flagellatum , реализующий 2-кето-3-дезокси-глюконат-альдолаз-ный вариант рибулозо-5-монофосфатного цикла ассимиляции углерода. Для компенсации ауксо-трофности по L -лейцину и L -изолейцину эти аминокислоты добавляли в ростовые среды в протонированном виде. Уровни накопления L -фенилаланина и L -лейцина в культуральных жидкостях штаммов-продуцентов достигали величины 0.8 и 1.0 г/л соответственно [14, 15]. Включение дейтерия в молекулы секретируемых аминокислот и суммарных белков биомассы осуществляли за счет выращивания штамма B. methylicum на минеральных средах М9 с 2Н 2 О и обычным метанолом, т. к. уровень включения 2Н в молекулы аминокислоты за счет ассимиляции [2Н]метанола незначителен.
Поскольку в клетке происходит ассимиляция водорода (дейтерия) из Н 2 О/2Н 2 O сред, мы подбирали условия включения дейтерия в молекулы аминокислот и белков при ступенчатом возрастании концентрации 2Н 2 O в ростовых средах, как показано в табл. 1. Рост микроорганизмов
Табл. 1. Влияние изотопного состава среды на рост штаммов B. methylicum и M. flagellatum
|
Номер опыта |
Среда выращивания* |
Величина лаг-фазы, ч |
Выход биомассы, % от контроля |
Время генерации, ч |
|
1 |
0 |
24.0 |
100 |
2.2 |
|
2 |
24.5 |
32.1 |
90.6 |
2.4 |
|
3 |
49.0 |
40.5 |
70.1 |
3.0 |
|
4 |
73.5 |
45.8 |
56.4 |
3.5 |
|
5 |
98.0 |
60.5 |
32.9 |
4.4 |
|
6 |
CН 3 ОН |
0 |
100 |
1.1 |
|
7 |
13СН 3 ОН |
0.1 |
72.0 |
1.0 |
* Данные опытов 1–5 приведены для B. methylicum при выращивании на водных средах М9, содержащих 2 % метанол и указанное количество (об. %) 2Н 2 О. Данные опытов 6–7 приведены для M. flagellatum при выращивании на водной среде М9, содержащей 1 % метанол (6) или 1 % [13С]метанол.
на 2H 2 O-cодержащих средах характеризуется увеличением продолжительности лаг-фазы, времени клеточной генерации и снижением выходов микробной биомассы (табл. 1), поэтому было необходимо проводить клеточную адаптацию к 2Н 2 О.
Метод адаптации штамма факультативных ме-тилотрофных бактерий B. methylicum к росту на 2Н 2 О при сохранении способности к биосинтезу L -фенилаланина описан в работе [16]. В данной работе были исследованы образцы культуральной жидкости B. methylicum и гидролизаты биомассы, полученные в ходе многоступенчатой адаптации бактерий к тяжелой воде на минимальных минеральных средах М9 с различным содержанием 2Н 2 О (от 24.5 до 98.0 % 2Н 2 О). Поскольку данный штамм метилотрофных бактерий удалось адаптировать к росту на 2Н 2 О, исследование уровней включения дейтерия в молекулы аминокислот представлялось наиболее интересным.
В отличие от выращивания на 2Н 2 О-среде, где необходимо проводить клеточную адаптацию к дейтерию, при получении [13С]аминокислот за счет ассимиляции 13СН 3 ОН данный этап не является обязательным, поскольку этот изотопный субстрат не оказывает негативного биостатическо-го эффекта на ростовые характеристики метило-трофов (см. табл. 1). Поэтому в случае со штаммом облигатных метилотрофных бактерий M. flagellatum включение изотопа 13С в молекулы аминокислот осуществляли в одну стадию за счет выращивания бактерий на водных средах М9, содержащих 1 % [13C]метанол в качестве источника изотопа углерода-13 .
Основные этапы при выделении [2H, 13C]-аминокислот заключались
– в выращивании соответствующих штаммов- продуцентов на средах с мечеными субстратами — [2Н]метанолом, [13С]метанолом и 2Н2О;
– отделении культуральных жидкостей (КЖ), содержащих секретируемые аминокислоты от микробной биомассы;
– очистке от липидов;
– разрушении клеток;
– выделении фракции суммарных белков биомассы с последующим их гидролизом, обработкой смесей аминокислот дансилхлоридом, бензилок-сикарбонилхлоридом и диазометаном;
– разделении метиловых эфиров N-Dns-производных аминокислот и N-Cbz-производных аминокислот методом ОФ ВЭЖХ;
– масс-спектрометрии ЭУ полученных производных аминокислот.
2Н- и 13C-меченые аминокислоты выделяли из лиофилизованных культуральных жидкостей штаммов-продуцентов аминокислот B. methylicum и M. flagellatum , а также в составе гидролизатов суммарных белков биомассы. При выделении фракции суммарных белков необходимо учитывать наличие в них углеводов, липидов и пигментов. В работе использовали богатые по белку штаммы бактерий со сравнительно небольшим содержанием углеводов в них. Гидролизу в качестве фракции суммарных белков подвергали остаток после исчерпывающего отделения липидов и пигментов экстракцией органическими растворителями (метанол—хлороформ—ацетон). В редких случаях для полного отделения от сопутствующих клеточных компонентов прибегали к высаливанию их сульфатом аммония.
Гидролиз 2H-меченых белков проводили в условиях предотвращения реакций изотопного обмена водорода на дейтерий в ходе гидролиза и сохра- нения остатков ароматических [2H]аминокислот в белке. Рассмотрены два альтернативных варианта проведения гидролиза — кислотный и щелочной. Кислотный гидролиз белка в стандартных условиях (6 М HCl, 24 ч, 110 °С) приводит к полному разрушению триптофана и частичному разрушению серина, треонина и некоторых других аминокислот [17]. Другим существенным недостатком при проведении гидролиза в HCl является изотопный (1Н—2Н) обмен ароматических протонов (дейтеронов) в молекулах триптофана, тирозина и гистидина, а также протонов (дейтеронов) при атоме С3 аспарагиновой и С4 глутаминовой кислот [18]. Поэтому, чтобы получить реальные данные о биосинтетическом включении дейтерия в молекулы аминокислот необходимо проводить гидролиз белка с использованием дейтерированных реагентов (6 М 2НCl с 3 % фенолом (в 2Н2O)).
Другой вариант гидролиза белка заключался в использовании 2 М Ba(OH) 2 (110 °C, 24 ч). В этих условиях гидролиза белка реакций изотопного обмена водорода на дейтерий в ароматических [2H]аминокислотах — тирозине и триптофане — не происходит, а триптофан не разрушается. Оба метода гидролиза показали хорошие результаты по сохранению ароматических [2H]амино-кислот в гидролизатах белка и содержанию дейтерия в молекулах [2H]аминокислот. Для препаративного получения 2H-меченых аминокислот из белка микроорганизмов целесообразнее использовать гидролиз с использованием 2НСl в 2Н 2 О (в присутствии добавки фенола для сохранения ароматических аминокислот), позволяющего избежать рацемизации.
Для получения летучих производных [2H, 13C]аминокислоты переводили в метиловые эфиры N-Dns-[2H, 13C]аминокислот или в N-Cbz-[2H, 13C]аминокислоты, которые затем разделяли методами ОФ ВЭЖХ. Условия N-дериватизации [2H, 13C]аминокислот отрабатывали таким образом, чтобы получить в масс-спектрах ЭУ как можно более интенсивные пики их молекулярных ионов (М+.) на уровне фона метаболитов среды. Для этого проводили реакцию N-аминирования [2H, 13C]аминокислот (в составе лиофилизованных культуральных жидкостей и гидролизатов суммарных белков биомассы) пятикратным избытком дансилхлорида (в ацетоне) или бензилоксикарбо-нилхлорида.
В условиях реакции N-аминирования для лизина, гистидина, тирозина, серина, треонина и цистеина наряду с монопроизводными образовывались N-ди-Dns- и N-ди-Cbz-производные. Кроме этого, из аргинина синтезировался N-три-Dns-(Cbz)-аргинин. Поэтому в масс-спектрометрических исследованиях молекулярные ионы (М+) этих соединений соответствовали ди- или три-производным.
Эффективность использования N-Cbz- и N-Dns-производных аминокислот в ОФ ВЭЖХ и в масс-спектрометрических исследованиях была показана нами ранее [19]. Летучесть N-производных аминокислот при масс-спектрометрическом анализе может быть повышена за счет дополнительной этерификации по карбоксильной группе, поэтому N-Dns-[2H, 13C]аминокислоты были переведены в их метиловые эфиры. Для предотвращения обратного изотопного обмена ароматических протонов (дейтеронов) при этерификации 2H-меченых аминокислот в данной работе отдали предпочтение использованию диазометана. Свежеприготовленным раствором диазометана в диэтиловом
Табл. 2. Результаты одноступенчатого градиентного разделения смеси метиловых эфиров N-Dns-[2Н]аминокислот из белкового гидролизата методом ОФ ВЭЖХ на колонке 250×10 мм, t = 20–( ± 25) °C, с октадецилсилановым селикагелем Separon SGX С18, 7 мкм ("Kova", Словакия)
|
Номер обработки |
Компоненты подвижной фазы, об.% |
Время элюирования, мин |
|
|
А * |
Б ** |
||
|
1 |
90 |
10 |
10 |
|
2 |
80 |
20 |
10 |
|
3 |
60 |
40 |
10 |
|
5 |
50 |
50 |
10 |
|
6 |
30 |
60 |
5 |
|
8 |
20 |
80 |
5 |
|
9 |
10 |
90 |
5 |
|
10 |
0 |
100 |
5 |
*
А: ацетонитрил—трифторуксусная кислота 100 : (0.1–0.5) об. %;
Б: ацетонитрил 100 об. %.
эфире обрабатывали сухие остатки смесей аминокислот. При этерификации аминокислот диазометаном происходило дополнительное N-метилирование по α -NH-(Dns)-группе [2H]аминокис-лот, что приводило к появлению в масс-спектрах метиловых эфиров N-Dns-аминокислот дополнительных пиков, соответствующих соединениям, с молекулярной массой на 14 массовых единиц бóльших исходных.
Исследование уровней включения изотопов 2Н и 13С в молекулы секретируемых аминокислот и белковых гидролизатов
Уровни включения изотопов 2Н и 13С в молекулы аминокислот мультикомпонентных смесей в составе культуральных жидкостей и белковых гидролизатов определяли аналитически методом масс-спектрометрии ЭУ. Метиловые эфиры N-Dns-[2H, 13C]производных аминокислот или N-Cbz-[2H, 13C]производные аминокислот разделяли методом ОФ ВЭЖХ на колонке с октадецилсилановом селикагелем Separon SGX С18, 7 мкм. Наилучшее разделение достигалось при градиентном элюировании метиловых эфиров N-Dns-[2H, 13C]производных аминокислот смесью растворителей (А): ацетонитрил—трифторуксусная кислота = 100 : (0.1–0.5) об. % и (Б): ацетонитрил = 100 об. % в условиях градиентного элюирования за счет постепенного увеличения концентрации компонента Б в смеси от 0 до 100 % (см. табл. 2). В этом случае каждый из компонентов смеси разделяется при наиболее оптимальном составе элюента, отчего достигается их полное и качественное разделение за гораздо меньшее время, чем при изократическом режиме. Кроме того, при использовании градиента существенно увеличивается максимальное количество пиков, способных разместиться на хроматограмме, — пиковая емкость, что весьма немаловажно при разделении сложных многокомпонентных смесей, каковыми являются белковые гидролизаты. Таким способом удалось разделить триптофан и трудно разрешимую пару фенилаланин / тирозин. Степени хроматографической чистоты [2Н, 13С]аминокислот, выделенных из культуральных жидкостей B. Methylicum , и M. Flagellatum , и гидролизатов белков в виде N-Cbz-[2H, 13C]производных их аминокислот, составили 96–98 % при выходах 67–89 %. Для отдельных [2H, 13C]аминокислот оказалось более удобным разделение в виде метиловых эфиров N-Dns-[2H, 13C]производных аминокислот. При этом степень хроматографической чистоты полученных из гидролизатов суммарных белков биомассы метиловых эфиров N-Dns-[2H]фенилаланина, N-Dns-[2H]тирозина и N-Dns-[2H]триптофана со-
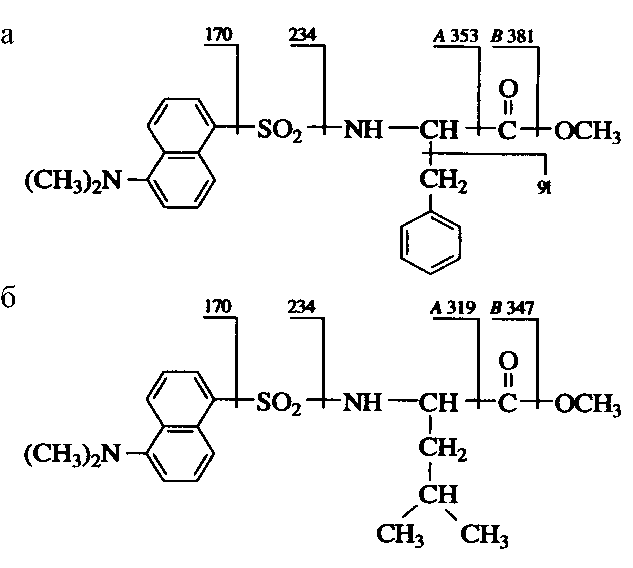
Рис. 1. Фрагментации метиловых эфиров N-Dns-фенилаланина c Мr = 412 (а) и N-Dns-лейцина с Мr = 378 (б) при масс-спектрометрии электронного удара ставили 96, 97 и 98 % соответственно. Данный результат важен потому, что именно метиловые эфиры N-Dns-аминокислот вследствие своей химической стабильности, наличия высокоинтенсивных молекулярных ионов (М+) при высоких молекулярных массах оказались весьма удобными для масс-спектрометрических исследований и позволяют идентифицировать [2H, 13C]аминокислоты в присутствии низкомолекулярных метаболитов среды и других продуктов аминирования и карбоксиметилирования аминокислот. Последний факт очень важен для изучения состава пула [2H, 13C]аминокислот, секретируемых в культуральные жидкости (КЖ) штаммов-продуцентов.
Пути фрагментации метиловых эфиров N-Dns-фенилаланина и N-Dns-лейцина при масс-спектрометрии ЭУ приводят к формированию пиков их молекулярных ионов (М+.) при m/z = 412 и m/z = 378 и к образованию дансильных фрагментов и продуктов их дальнейшего распада до N-диметиламинонафталина, а также к образованию аминных А+ и аминоацильных фрагментов В+ (рис. 1). Показанная на рис. 1 фрагментация метиловых эфиров N-Dns-фенилаланина и N-Dns-лейцина характерна для этих производных всех других аминокислот, что позволяет проводить масс-спектрометрический мониторинг [2H, 13C]аминокислот в составе культуральных жидкостей штаммов-продуцентов, содержащих сумму аминокислот и других метаболитов среды, до стадии их хроматографического разделения, а также исследовать включение стабильных изотопов 2Н и 13С в молекулы аминокислот белковых гидролизатов.
При использовании в качестве источников стабильных изотопов [13С]метанола и 2Н2О в клетке синтезируются изотопно-замещенные [13C, 2H]аминокислоты, различающиеся количеством атомов, замещенных на 13С и 2Н. При этом чем выше молекулярная масса аминокислот, тем возможен больший набор молекулярных ионов (M+.), соответствующих изотопно-замещенным формам. Пики при m/z = 323.2, 337.4, 368.5, 382.3, 420.5 в масс-спектре [13С]аминокислот обработанной культуральной жидкости M. flagellatum, полученной с водной средой и c 1 % [13С]метанолом (рис. 2, б), соответствуют по массе метиловым эфирам N-Dns-[13C]глицина, N-Dns-[13C]аланина, N-Dns-[13C]валина, N-Dns-[13C]лейцина / [13C]изолейцина и N-Dns-[13C]фенилаланина. Следует подчеркнуть, что величина m/z для молекулярного иона (M+) метиловых эфиров N-Dns-[13C]лейцина и [13C]изо-лейцина в масс-спектрах электронного удара одинакова, поэтому данным методом нельзя точно идентифицировать эти аминокислоты. Максимальные уровни включения 13С в молекулы аминокислот, измеренные по увеличению усредненного значения соотношения массы к заряду m/z для молекулярного иона (М+) изотопно-меченого образца в сравнении с молекулярной массой природной аминокислоты варьируют от 35 % для [13C]аланина до 95 % для [13С]фенилаланина (рис. 2). Учитывая ауксотрофность штамма по L-изолейцину, разброс значений может быть объяснен вкладом экзогенного изолейцина в уровень изотопного включения [13C]лейцина, а также других метаболически связанных с ним аминокислот — [13C]аланина и [13C]валина.
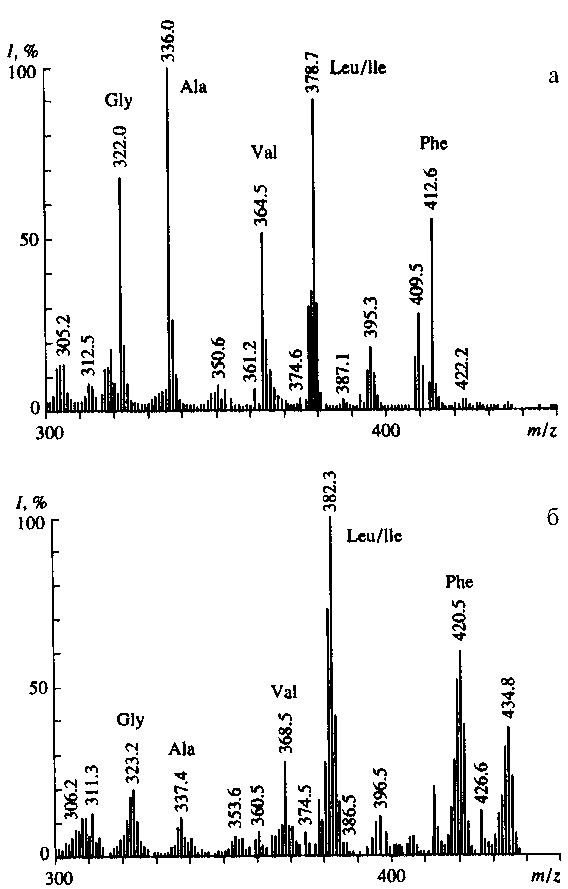
Рис. 2. Масс-спектры ЭУ метиловых эфиров N-Dns-[13C]аминокислот из культуральной жидкости M. flagellatum после обработки дансилхлоридом и диазометаном.
a — 1 % метанол и Н 2 О (контроль);
б — 1 % [13C]метанол и Н 2 О.
Символами аминокислот обозначены пики молекулярных ионов [М]+ метиловых эфиров N-Dns-[13C]аминокислот. Интенсивность пиков приведена в %
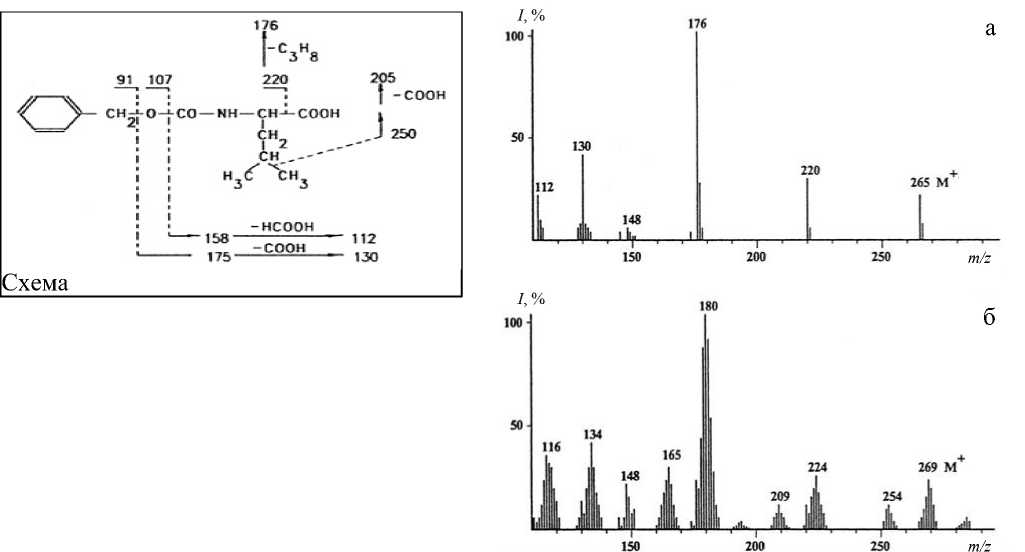
Рис. 3. Масс-спектры ЭУ N-Cbz-[13C]-Leu, выделенного из культуральной жидкости M. flagellatum после обработки бензилоксикарбонилхлоридом.
a — 1 % метанол и Н 2 О (контроль); б — 1 % [13C]метанол и Н 2 О.
Схема — углеродный скелет молекулы
Данные масс-спектрометрии ЭУ по уровням включения 13С и 2Н в молекулы N-Cbz-[2H, 13C]производных аминокислот в пределах различных концентраций 2Н2О не отличались от таковых для метиловых эфиров N-Dns-[2H, 13C]производных аминокислот (точность определения уровней изотопного включения в молекулы аминокислот данным методом составляет ±5 %). В качестве примера на рис 3, б, изображен масс-спектр N-Cbz-[13C]-Leu (относительно немеченого N-Cbz-Leu, (рис. 3, а), выделенного методом ОФ ВЭЖХ из КЖ M. fla-gellatum после обработки бензилоксикарбонил-хлоридом. Пик молекулярного иона N-Cbz-[13C]-Leu соответствует среднему значению (M+) при m/z = 269 (относительно (M+) при m/z = 265 в контрольных условиях), что свидетельствует о включении 4 атомов изотопа 13С в молекулу лейцина (рис. 3, схема). Специфическая фрагментация N-бензилоксикарбонильного производного [13C]лейцина при электронном ударе позволяет локализовать сайты включения атомов изотопа 13С по углеродному скелету молекулы. Как видно из рис. 3, таковыми являются 4 атома углерода в положениях [2, 3, 4, 5] углеродного скелета молекулы лейцина.
Для штамма факультативных метилотрофных бактерий B. methylicum наблюдалось специфиче- ское возрастание уровней изотопного включения дейтерия в молекулы индивидуальных [2H]аминокислот культуральных жидкостей (табл. 3) при ступенчатом увеличении концентраций 2Н2O в ростовой среде. Уровни включения дейтерия в молекулы разных [2H]аминокислот при одинаковых условиях культивирования различаются. При этом во всех опытах наблюдалось пропорциональное возрастание уровней изотопного включения 2H в молекулы метаболически родственных [2H]аминокислот при ступенчатом увеличении концентраций тяжелой воды в ростовых средах (табл. 3). Такой результат зафиксирован во всех экспериментах, где источником стабильных изотопов является 2Н2О.
Из масс-спектра ЭУ метиловых эфиров N-Dns-[2H]производных аминокислот культуральной жидкости B. methylicum , полученной со среды, содержащей 49 % 2Н 2 О (рис. 4, б), видно, что молекула фенилаланина содержит 6 изотопно-замещеных форм со средним значением пика молекулярного иона (M+) при m/z = 414.2, которое возрастает по сравнению с контрольными условиями ( m/z = 412.0, рис. 4, а) на 2.2 единицы, т. е. 27.5 атом. % от общего количества атомов водорода в молекуле замещены на дейтерий. Область масс-спектра со значениями m/z = 90–300
Табл. 3. Уровни включения 2Н и 13С в молекулы аминокислот (атом. %), секретируемых в культуральную жидкость (КЖ) B. Methylicum , и M. flagellatum , и в аминокислотные остатки белков
|
Аминокислоты |
Содержание 2Н 2 О в среде, %* |
1% 13СН 3 ОН** |
||||||||
|
24.5 |
49.0 |
73.5 |
98.0 |
|||||||
|
КЖ |
Белок |
КЖ |
Белок |
КЖ |
Белок |
КЖ |
Белок |
КЖ |
Белок |
|
|
Глицин |
– |
15.0 |
– |
35.0 |
– |
50.0 |
– |
90.0 |
60.0 |
90.0 |
|
Аланин |
24.5 |
20.0 |
50.0 |
45.0 |
50.0 |
62.5 |
55.0 |
97.5 |
35.0 |
95.0 |
|
Валин |
20.0 |
15.0 |
50.0 |
46.0 |
50.0 |
50.0 |
55.8 |
50.0 |
50.0 |
50.0 |
|
Лейцин / изолейцин |
20.0 |
15.0 |
50.0 |
42.0 |
50.0 |
50.0 |
50.0 |
50.0 |
40.0 |
49.0 |
|
Фенилаланин |
15.0 |
24.5 |
27.5 |
37.5 |
51.2 |
50.0 |
75.0 |
95.0 |
95.0 |
80.5 |
|
Тирозин |
— |
20.0 |
— |
25.6 |
— |
68.5 |
— |
92.8 |
— |
53.5 |
|
Серин |
– |
15.0 |
– |
36.7 |
– |
47.6 |
– |
86.6 |
– |
73.3 |
|
Аспарагиновая кислота |
– |
20.0 |
– |
36.7 |
– |
60.0 |
– |
66.6 |
– |
33.3 |
|
Глутаминовая кислота |
— |
20.0 |
— |
40.0 |
— |
53.4 |
— |
70.0 |
— |
40.0 |
|
Лизин |
— |
10.0 |
— |
35.3 |
— |
40.0 |
— |
58.9 |
— |
54.4 |
* Приведены данные по включению 2Н в молекулы аминокислот B. methylicum при выращивании на водных средах М9, содержащих 2 % метанол и указанное количество (об.%) 2Н 2 О.
** Данные по включению 13С приведены для M. flagellatum при выращивании на водной среде М9, содержащей 1 % [13С]метанол.
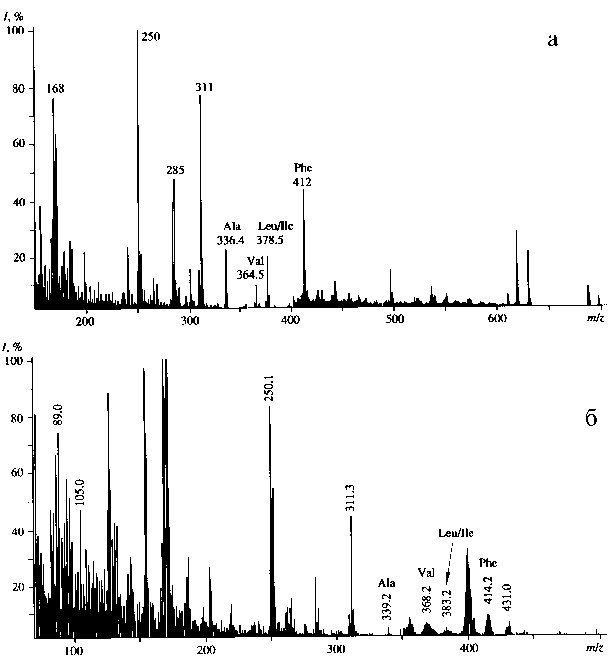
Рис. 4. Масс-спектр ЭУ метиловых эфиров N-Dns-[2Н]аминокислот из КЖ B. methylicum после обработки дансил-хлоридом и диазометаном.
a — 2 % метанол и 98.0 % Н2О (контроль); б — 2 % [2H]метанол и 49.0 % 2Н2О соответствует продуктам дериватизации метаболитов ростовой среды. Пик с m/z = 431.0, зафиксированный в масс-спектре ЭУ культуральной жидкости и проявляющийся во всех опытах, соответствует продукту дополнительного метилирования фенилаланина по α-NH-(Dns)- группе. Пик с m/z = 400 (рис. 4, б) отвечает продукту отщепления метильной группы от дейтерированного производного [2H]фенилаланина.
Присутствие в масс-спектре ЭУ (рис. 5) образца культуральной жидкости B. methylicum, полученной на среде с 73.5 % 2Н2О, пика молекулярного иона метилового эфира N-Dns-[2H]фенил-аланина (М+) при m/z = 416.1 указывает на увеличение молекулярной массы [2H]фенилаланина на 4.1 единицы, т. е. 51.2 % атомов водорода в молекуле [2H]фенилаланина замещены на дейтерий. Очевидно, что вышеобозначенные атомы дейтерия включились в молекулу [2H]фенилаланина за счет процесса биосинтеза de novo, т. е. по углеродному скелету молекулы. К легко обмениваемым относятся протоны (дейтероны) при гетероатомах в NH2- и СООН-группах аминокислот, которые замещаются за счет легкости диссоциации в Н2О (2Н2О).
Из табл. 3 видно, что в условиях ауксотрофно-сти по L -лейцину уровни включения 2Н в молекулы [2Н]лейцина / [2Н]изолейцина ниже, чем для фенилаланина. Отмеченная особенность отчетливее всего проявляется на среде с максимальной концентрацией 2Н 2 О. Еще раз этот результат подтвердил рис. 6, где показан масс-спектр ЭУ метиловых эфиров N-Dns-[2Н]аминокислот культуральной жидкости после выращивания бактерий B. methylicum в указанных условиях. Видно, что величина пика молекулярного иона метилового эфира N-Dns-[2Н]фенилаланиа (М+) при m/z = = 418.0 увеличивается по сравнению с контрольными условиями на 6 единиц, что соответствует
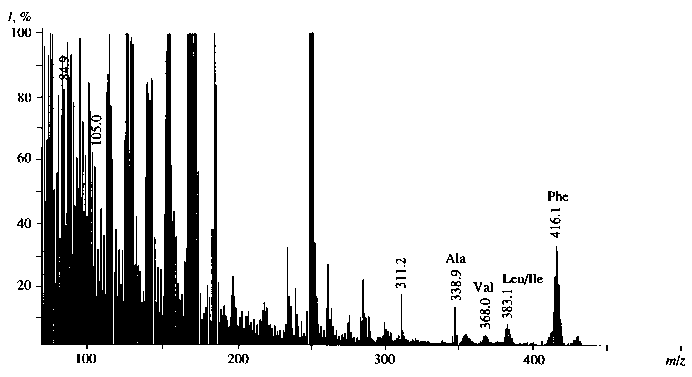
Рис. 5. Масс-спектр ЭУ метиловых эфиров N-Dns-[2Н]аминокислот из КЖ B. methylicum при выращивании в среде, содержащей 2 % [2Н]мета-нол и 73.5 % 2Н 2 О
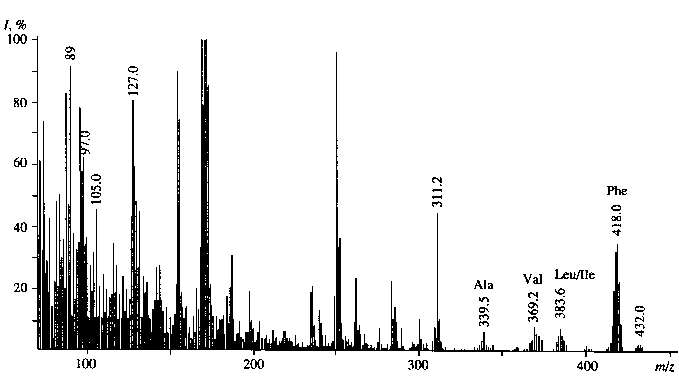
Рис. 6. Масс-спектр ЭУ метиловых эфиров N-Dns-[2Н]аминокислот из КЖ B. methylicum при выращивании в среде, содержащей 2 % [2Н]мета-нол и 98.0 % 2Н 2 О (максимально дейтерированная среда)
замещению 75.0 атом. % от общего количества атомов водорода в молекуле. В отличие от [2Н]фе-нилаланина уровень включения дейтерия в [2Н]лейцин / [2Н]изолейцин составил 50.0 атом. %, а в [2Н]валин — 58.8 атом. %. Пик при m/z = 432, зафиксированный в масс-спектре ЭУ метиловых эфиров N-Dns-[2Н]аминокислот КЖ на рис. 6 соответствует продукту дополнительного метилирования [2Н]фенилаланина по α-NH2-группе. Кроме этого, в масс-спектре фиксируется пик обогащенного дейтерием бензильного С6Н5СН2-фрагмента молекулы [2Н]фенилаланина при m/z = 97 (вместо m/z = 91 в контроле), что указывает на то, что местами локализации 6 атомов дейтерия в молекуле [2Н]фенилаланина являются положения С1–С6 ароматических протонов в бензильном С6Н5СН2-фрагменте. Из масс-спектрометрических данных следует, что при других концентрациях 2Н2О дейтерий также включается в ароматическое кольцо [2Н]фенилаланина, т. к. метаболизм адаптированного к 2Н2О штамма B. methylicum не претерпевает существенных изменений в 2Н2О.
Аналогичная закономерность в уровнях включения 13С в молекулы аминокислот, связанных с ауксотрофным метаболизмом, проявляется при выращивании L -изолейцин-зависимого штамма M. flagellatum на среде с 1 % [13С]метанолом. Как видно из табл. 3, в отличие от наблюдаемого для [13С]фенилаланина (уровень изотопного включения 95.0 %) уровни включения изотопа 13С в молекулы [13С]лейцина / изолейцина, [13С]аланина и [13С]валина составили 38.0, 35.0, 50.0 % соответственно. Уровень изотопного включения для [13C]глицина (60 %), хотя и выше, чем для трех последних аминокислот, но намного ниже, чем для [13С]фенилаланина.
а
б
Рис. 7. Масс-спектр ЭУ метиловых эфиров N-Dns-[2Н]аминокислот из гидролизатов суммарных белков биомассы B. methylicum при выращивании в среде M9, содержащей 2 % метанол и Н 2 О (контроль) (а) и 2 % [2Н]метанол и 98.0 % 2Н 2 О (б)
Суммируя полученные данные по уровням включения 2Н и 13С в молекулы секретируемых аминокислот, можно сделать вывод о сохранении минорных путей метаболизма, связанных с биосинтезом лейцина и метаболически родственных с ним аминокислот de novo . Другим логическим объяснением наблюдаемого эффекта, если принять во внимание происхождение лейцина и изолейцина по различным путям биосинтеза (лейцин принадлежит к семейству пирувата, а изолейцин — к семейству аспартата), может быть ассимиляция клеткой немеченого лейцина из среды на фоне биосинтеза изотопно-меченого изолейцина de novo . Учитывая вышесказанное, следует подчеркнуть, что использование ауксотрофных форм микроорганизмов для получения изотопно-меченых аминокислот не оправдывает себя практически из-за множественного включения изотопов в молекулы [20]. Напротив, использование для этих целей прототрофных форм микроорганизмов кажется более перспективным.
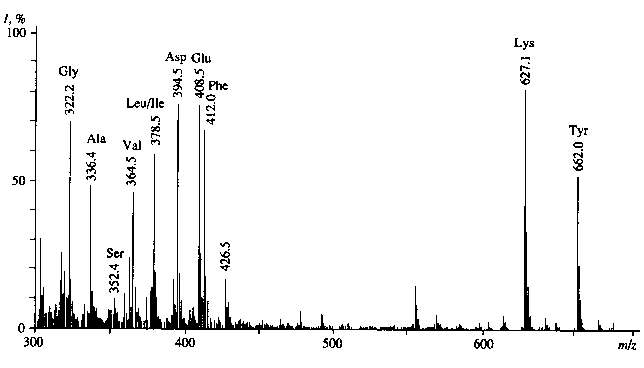
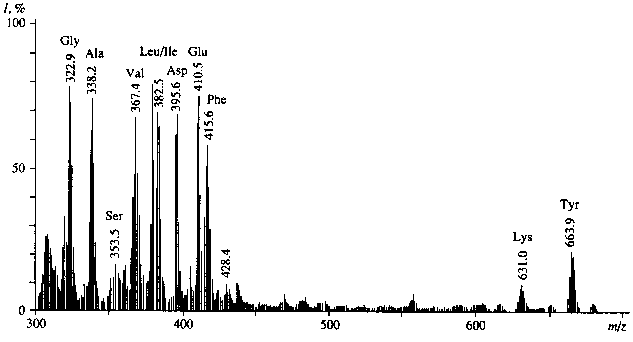
Общие принципы изучения уровней изотопного включения в молекулы аминокислот при данном способе введения метки были продемонстрированы на примере масс-спектрометрического анализа сложных многокомпонентных смесей, полученных после гидролиза суммарных белков биомассы ме-тилотрофных бактерий B. methylicum. Как видно из рис. 7, до десяти аминокислот могут быть идентифицированы в масс-спектре ЭУ гидролизата белка B. methylicum по пикам молекулярных ионов (М+) метиловых эфиров их N-Dns-[2Н]производных аминокислот.
Как и в случае с секретируемыми аминокислотами, пики молекулярных ионов (М+) соответствовали смесям изотопно-замещеных форм производных аминокислот. Для лизина и тирозина пики (М+) соответствовали метиловым эфирам дипроизводных аминокислот — α , ε -ди-Dns-лизину ((М+) при m/z = 631.0) и О,N-ди-Dns-тирозину ((М+) при m/z = 663.9). Уровни изотопного включения дейтерия в молекулы [2H]аминокислот гидролизата суммарных белков биомассы при содержании 2Н 2 O в ростовой среде 49.0 % варьируют от 25.6 % для [2Н]тирозина до 45.0 % для [2Н]аланина (рис. 8, б, и табл. 3). В молекулах [2H]глицина,
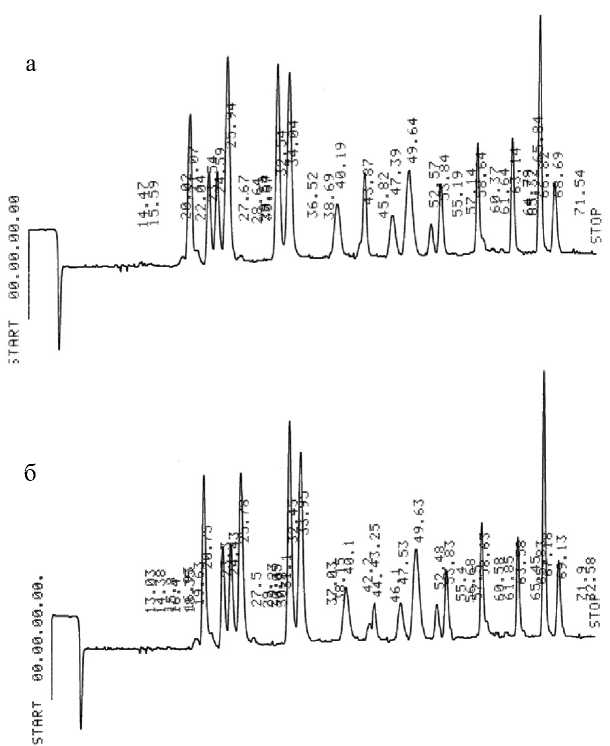
Рис. 8. Ионообменная хроматография аминокислот из гидролизатов протонированных (a) и дейтерированных (б) клеток B. methylicum на максимально дейтерированной среде.
Прибор Biotronic LC-5001 (230 × 3.2 мм) ("Eppendorf-Nethleler-Hinz", Germany). Подвижная фаза: сульфонированная стирольная смола UR-30 ("Beckman-Spinco", USA). Диаметр гранул — 25 мкм; рабочее давление 50–60 атм; подвижная фаза — 0.2 M Na-цитратный буфер (pH = 2.5); скорость подачи элюента — 18.5, нингидрина — 9.25 мл/ч; детекция при λ = 570 и λ = = 440 нм (для пролина)
[2H]валина, [2H]фенилаланина, [2H]серина, [2H]лизина, [2H]аспарагиновой и [2H]глутаминовой кислот они находятся в пределах 35–46 %. Как и в случае с секретируемыми аминокислотами, при повышении концентрации 2Н 2 О в ростовой среде наблюдалось пропорциональное повышение уровней включения 2Н в молекулы аминокислот. Что касается других [2H]аминокислот, не детектируемых данным методом, очевидно, что уровни изотопного включения в них приблизительно такие же. Это подтверждается данными по разделению белковых гидролизатов метилотрофных бактерий методом ОФ ВЭЖХ в виде N-Cbz-[2Н]производных аминокислот и метиловых эфиров N-Dns-[2Н]производных аминокислот и ионообменной хроматографией исходных белковых гидролизатов, где детектируется уже 15 аминокислот (рис. 8, табл. 4).
Полученные данные свидетельствуют о возможности достижения максимальных уровней включения стабильных изотопов 2Н и 13С в аминокислотные остатки суммарных белков биомассы (за исключением аланина, валина и лейцина / изолейцина, сниженные уровни включения для которых объясняются эффектом ауксотрофно-сти по L -лейцину и по L -изолейцину). Например, в случае с дейтерированными аминокислотами полного замещения на стабильные изотопы удалось достичь за счет использования в качестве источника дейтерия 98.0 % 2Н 2 О (табл. 4). Как видно из табл. 4, при выращивании B. methylicum на среде с 98.0 % 2Н 2 О уровни включения 2H в остатки глицина, аланина, фенилаланина и тирозина составляют 90.0, 97.5, 95.0 и 92.8 %. В экспериментах
Табл. 4. Аминокислотный состав белкового гидролизата суммарных белков биомассы B. methylicum , полученный при росте в максимально дейтерированной среде,* и уровни дейтерированности молекул**
|
Аминокислота |
Выход, % от сухого веса 1 г биомассы |
Количество включенных атомов дейтерия в углеродный скелет молекулы |
Уровень дейтерирован-ности молекул, % от общего количества атомов *** водорода |
|
|
протонированный образец (контроль) |
образец, полученный в 98.0% 2H 2 О |
|||
|
Глицин |
8.03 |
9.69 |
2 |
90.0 |
|
Аланин |
12.95 |
13.98 |
4 |
97.5 |
|
Валин |
3.54 |
3.74 |
4 |
50.0 |
|
Лейцин |
8.62 |
7.33 |
5 |
50.0 |
|
Изолейцин |
4.14 |
3.64 |
5 |
50.0 |
|
Фенилаланин |
3.88 |
3.94 |
8 |
95.0 |
|
Тирозин |
1.56 |
1.83 |
7 |
92.8 |
|
Серин |
4.18 |
4.90 |
3 |
86.6 |
|
Треонин |
4.81 |
5.51 |
— |
- |
|
Метионин |
4.94 |
2.25 |
— |
- |
|
Аспарагин |
7.88 |
9.59 |
2 |
66.6 |
|
Глутаминовая ки- |
11.68 |
10.38 |
4 |
70.0 |
|
слота |
||||
|
Лизин |
4.34 |
3.98 |
5 |
58.9 |
|
Аргинин |
4.63 |
5.28 |
- |
- |
|
Гистидин |
3.43 |
3.73 |
- |
- |
* Данные получены на среде M9 с 98.0 % 2Н 2 O и 2 % [2Н]метанолом .
** При подсчете уровня дейтерированности протоны (дейтероны) при СООН- и NH 2 -группах молекул аминокислот не учитывались из-за легкости их диссоциации и изотопного обмена в H 2 O / 2Н 2 O.
*** Прочерк означает отсутствие данных.
по включению изотопа 13С в суммарные белки биомассы за счет ассимиляции [13С]метанола ме-тилотрофными бактериями M. flagellatum также наблюдались высокие уровни изотопного включения в [13С]глицине (90.0 %), [13С]аланине (95.0 %) и [13С]фенилаланине (80.5 %) (табл. 3). Как и в случае с секретируемыми аминокислотами, сниженные уровни включения стабильных изотопов в [13С]лейцине / изолейцине (49.0 %), а также в метаболически связанных с ним [13С]аминокислотах в этих условиях могут быть объяснены эффектом ауксотрофности штамма по L -изолейцину, который добавляли в ростовую среду в протонированном виде.
Во всех экспериментах по включению стабильных изотопов в молекулы аминокислот уровни включения 2Н и 13С в метаболически связанные аминокислоты обнаружили коррелляцию. Так, уровни изотопного включения для аланина, валина и лейцина (семейство пирувата), фенилаланина и тирозина (семейство ароматических аминокислот, синтезируемых из шикимовой кислоты) коррелируют. В то же время уровни изотопного включения для аланина, валина и лейцина / изолейцина сохраняют стабильность в пределах широкого разброса концентраций 2Н 2 О вследствие эффекта ауксотрофности по лейцину. Уровни изотопного включения для глицина и серина (семейство серина), аспарагиновой кислоты и лизина (семейство аспарагина) также имеют близкие величины и находятся в корреляции. Уровни изотопного включения секретируемых аминокислот и соответствующих аминокислотных остатков суммарного белка при выращивании бактерий на средах с одинаковым изотопным составом, в целом, также коррелируют. Причина некоторых наблюдаемых расхождений в уровнях включения изотопов в молекулы аминокислот может быть связана с эффектом ауксотрофности штаммов по определенным аминокислотам.
ЗАКЛЮЧЕНИЕ
Проведенные исследования продемонстрировали эффективность метода масс-спектрометрии ЭУ на примере N-Cbz- и N-Dns-производных [2Н, 13С]аминокислот с различными уровнями изотопного обогащения, полученных микробиологическим синтезом, для исследования уровней изотопного обогащения молекул [2Н, 13С]аминокислот в составе их многокомпонентных смесей, полученных микробиологически с использованием клеток микроорганизмов. Метод удобен для изучения состава пула аминокислот, секретируемых в культуральные жидкости штаммов-продуцентов и гидролизатов белков биомассы, выращенной на средах со стабильными изотопами 2Н и 13С, и может найти применение в метаболических и биомедицинских исследованиях.
Работа выполнялась при финансовой поддержке Научно-исследовательского центра медицинской биофизики (Болгария), грант № 115-RU.
Список литературы Масс-спектрометрия электронного удара в анализе включения стабильных изотопов дейтерия и углерода-13 в молекулы аминокислот биологических объектов
- Мосин О.В. Изучение методов биотехнологического получения белков, аминокислот и нуклеозидов, меченных стабильными изотопами 2H и 13C с высокими степенями изотопного обогащения. Автореф. дис. … канд. хим. наук. М.: МГАТХТ им. М.В. Ломоносова, 1996. 25 с.
- LeMaster D.M. Uniform and selective deuteration in two-dimensional NMR studies of proteins//Annu. Rev. Biophys. Chem. 1990. Vol. 19, no. 2. P. 243-266 DOI: 10.1146/annurev.bb.19.060190.001331
- MacCarthy P. Infrared spectroscopy of deuterated compounds: an undergraduate experiment//J. Chem. Educ. 1986. Vol. 62, no. 7. P. 633-638 DOI: 10.1021/ed062p633
- Мосин О.В., Складнев Д.А., Егорова Т.А., Швец В.И. Масс-спектрометрическая оценка уровня включения 2Н и 13С в молекулы аминокислот бактериальных объектов//Биоорганическая химия. 1996. Т. 22, № 10-11. С. 856-869.
- Мосин О.В., Складнев Д.А., Егорова Т.А., Швец В.И. Методы получения аминокислот и белков, меченных стабильными изотопами 2H, 13C, 15N, 18O//Биотехнология. 1996, № 10. С. 24-40.
- Мосин О.В., Швец В.И., Складнев Д.А., Игнатов И. Биосинтез фотопреобразующего трансмембранного белка бактериородопсина, меченного дейтерием по остаткам ароматических аминокислот Phe, Tyr и Trp//Научное приборостроение. 2013. Т. 23, № 2. С. 14-26.
- Matthews H.R., Kathleen S., Matthews K., Stanley J. Selective deuterated amino acid analogues. Synthesis, incorporation into proteins and NMR properties//Biochim. et Biophys. Acta. 1977. Vol. 497. P. 1-13 DOI: 10.1016/0304-4165(77)90134-9
- LeMaster D.M., Cronan J.E. Biosynthetic production of 13C-labeled amino acids with site-specific enrichment//Journal of Biological Chemistry. 1982. Vol. 257, no. 3. P. 1224-1230.
- Mosin O.V., Ignatov I. Microbiological synthesis of 2H-labeled phenylalanine, alanine, valine, and leucine/isoleucine with different degrees of deuterium enrichment by the Gram-positive facultative methylotrophic bacterium Вrevibacterium methylicum//International Journal of Biomedicine. 2013. Vol. 3, no. 2. P. 132-138.
- Мосин О.В., Швец В.И., Складнев Д.А., Игнатов И. Микробный синтез дейтерий-меченного L-фенила-ланина факультативной метилотрофной бактерией Brevibacterium meyhylicum на средах с различными концентрациями тяжелой воды//Биофармацев-тический журнал. 2012. Т. 4, № 1. С. 11-22.
- Patel G.B., Sprott G.D., Ekiel I. Production of specifically labeled compounds by Methanobacterium espanolae grown on H2-CO2 plus acetate//Applied and Environmental Microbiology. 1993. Vol. 59, no. 4. P. 1099-1103.
- Mosin O.V., Shvets V.I., Skladnev D.A., Ignatov I. Microbial synthesis of 2H-labelled L-phenylalanine with different levels of isotopic enrichment by a facultive methylotrophic bacterium Brevibacterium methylicum with RuMP assimilation of carbon//Biochemistry (Moscow). Supplement Series B: Biomedical Chemistry. 2013. Vol. 7, no. 3. P. 249-260.
- Bligh E.G., Dyer W.J. A rapid method for total lipid extraction and purification//Can. J. Biochem. Physiol. 1959. Vol. 37, no. 8. P. 911-918 DOI: 10.1139/o59-099
- Складнев Д.А., Мосин О.В., Егорова Т.А. и др. Метилотрофные бактерии -источники изотопно-меченых 2Н-и 13С-аминокислот//Биотехнология. 1996. № 5. С. 25-34.
- Karnaukhova E.N., Mosin O.V., Reshetova O.S. Biosynthetic production of stable isotope labeled Amino Acids using methylotroph Methylobacillus flagellatum//Amino Acids. 1993. Vol. 5, no. 1. P. 125.
- Mosin O.V., Skladnev D.A., Shvets V.I. Biosynthesis of 2H-labeled phenylalanine by a new methylotrophic mutant Brevibacterium methylicum//Bioscience, biotechnology, and biochemistry. 1998. Vol. 62, no. 2. P. 225-229 DOI: 10.1271/bbb.62.225
- Cohen J.S., Putter I. The isolation of deuterated amino acids//Biochim. Biophys. Acta. 1970. Vol. 222. P. 515-520 DOI: 10.1016/0304-4165(70)90143-1
- Penke B., Ferenczi R., Kovács K. A new acid hydrolysis method for determining tryptophan in peptides and proteins//Analytical Biochemistry. 1974. Vol. 60, no. 1. P. 45-50 DOI: 10.1016/0003-2697(74)90129-8
- Егорова Т.А., Мосин О.В., Еремин С.В., Карнаухова Е.Н., Звонкова Е.Н., Швец В.И. Разделение аминокислот белковых гидролизатов природных объектом методом ВЭЖХ в виде карбобензоксипроизводных//Биотехнология. 1993. № 8. С. 21-25.
- Мосин О.В., Игнатов И. Биологическое воздействие дейтерия на клетки прокариот и эукариот//Разработка и регистрация лекарственных средств. 2014. Т. 2, № 7. С. 122-131.


