Масс-спектрометрия с бомбардировкой быстрыми атомами в установлении путей биосинтеза пуринового рибонуклеозида [2н] инозина
Автор: Мосин Олег Викторович, Игнатов И., Швец В.И., Тыминский Г.
Журнал: Научное приборостроение @nauchnoe-priborostroenie
Рубрика: Приборостроение физико-химической биологии
Статья в выпуске: 2 т.26, 2016 года.
Бесплатный доступ
Продемонстрирована возможность применения масс-спектрометрии с бомбардировкой быстрыми атомами (ББА) на импульсном масс-спектрометре VG-70 SEQ ("Fisons VG Analytical", США) для установления путей биосинтеза 2Н-меченого пуринового рибонуклеозида инозина, секретируемого в культуральную жидкость (КЖ) грамположительной хемогетеротрофной бактерией Bacillus subtilis ВКПМ B-3157 при выращивании на тяжеловодородной среде с 2 % гидролизатом дейтерированной биомассы метилотрофной бактерии Brevibacterium methylicum ВКПМ B-5662 как источника 2Н-меченых ростовых субстратов. Выделение [2Н]инозина из КЖ производили адсорбцией/десорбцией смеси рибонуклеозидов на поверхности активированного угля, экстракцией 0.3 М NH4-формиатным буфером (рН = 8.9) с последующей перекристаллизацией в 80 % этаноле и ионообменной хроматографией на колонке с катионообменной смолой AG50WX 4, уравновешенной 0.3 М NH4-формиатным буфером с 0.045 М NH4Cl. Исследование распределения дейтерия в молекуле биосинтетического [2H]инозина методом масс-спектрометрии ББА продемонстрировало включение 5 атомов дейтерия в молекулу (общий уровень дейтерированности - 62.5 атом. % 2H) с включением 3 атомов дейтерия в рибозный фрагмент и 2 атомов дейтерия - в гипоксантиновый фрагмент молекулы. Три не обмениваемые атома дейтерия были включены в рибозный фрагмент молекулы за счет гликолиза по пути Эмбдена-Мейергофа вследствие реакций ферментативной изомеризации глюкозы в 2H2O-среде с участием реакций изотопного (1Н-2Н) обмена, в то время как два других атома дейтерия при С2-, С8-положениях в гипоксантиновом остатке происходили из [2H]аминокислот дейтерированного метилотрофного гидролизата Brevibacterium methylicum ВКПМ B-5662.
2h-меченый инозин, биосинтез, тяжелая вода, bacillus subtilis вкпм b-3157, масс-спектрометрия бба
Короткий адрес: https://sciup.org/14265018
IDR: 14265018 | УДК: 543.51:
Текст научной статьи Масс-спектрометрия с бомбардировкой быстрыми атомами в установлении путей биосинтеза пуринового рибонуклеозида [2н] инозина
Природные нуклеозиды, меченные дейтерием (2Н), представляют значительный научно-практический интерес для многочисленных биохимических и диагностических целей [1], структурнофункциональных исследований [2], а также в матричных синтезах молекул дейтерированных РНК для изучения их пространственной структуры и конформационных изменений [3]. Тенденции к их предпочтительному применению обусловлены отсутствием радиационной опасности и возможностью использования инструментальных методов масс-спектрометрии для определения локализации дейтериевой метки в молекулах синтезируемых соединений [4]. Как аналитический метод масс-спектрометрия обладает исключительно высокой чувствительностью и позволяет обнаруживать и количественно определять микро и следовые количества органического вещества в больших объемах жидкостей и газов, а также в биологических системах [6]. В случае бомбардировки быстрыми атомами (ББА) быстрые ато- мы образуются путем предварительной ионизации в разряде атомов благородных газов (Ar, Xe), ускорения образующихся ионов и последующей их нейтрализации при столкновении с незаряженными атомами [6]. Масс-спектрометрию ББА применяют при анализе веществ, которые способны растворяться или диспергироваться в жидкой матрице (глицерин, тиоглицерин, полиэтиленгликоль, м-нитробензиловый спирт и др.) [7]. Масс-спектры ББА отличаются от масс-спектров химической ионизации тем, что они содержат пики ионов [M + H]+ или [M - H]–, но не M+ или M–. Методом ББА можно анализировать молекулы разной природы с молекулярной массой до 10 кДа [8]. Метод ББА особенно удобен при исследовании соединений, содержащих кислотные, основные или ионные группировки. Вместе с тем метод ББА менее чувствителен, чем ионизация электронами и матрично-активированная лазерная десорбция, и малопригоден для количественных определений, но удобен для качественного определения нелетучих веществ без их химической модификации в летучие производные.
Основным препятствием практического использования дейтерированных нуклеозидов в вы-шеобозначенных исследованиях является недостаток 2Н-меченых ростовых субстратов высокого уровня дейтерированности. Прежде всего это связано с ограниченной доступностью и высокой стоимостью высокоочищенного дейтерия, выделяемого из природных источников. Природная распространенность дейтерия составляет 0.015 атом. %, однако, несмотря на невысокое содержание дейтерия в пробах, разработанные в последние годы методы обогащения и очистки позволяют получать 2Н-меченые субстраты высокого уровня изотопной чистоты.
Инозин (1,9-дигидро-9-бета-D-рибофуранозил-6H-пурин-6-ОН) — рибонуклеозид, состоящий из гипоксантина, связанный с остатком рибозы (рибофуранозы) посредством β –N9-гликозидной связи, обладающий полифункциональным биологическим воздействием на организм. В клетках простейших и эукариот инозин является предшественником АТФ, повышает активность ряда ферментов цикла Кребса, стимулирует синтез нуклеотидов. Как метаболическое средство инозин оказывает антигипоксическое, метаболическое и антиаритмическое действие, а также оказывает положительное влияние на процессы обмена в миокарде, улучшает коронарное кровообращение, предотвращая дистрофические изменения миокарда, вызванные физическими нагрузками, инфекцией или эндокринными заболеваниями [9]. 2
Для биосинтеза природных 2Н-меченых нуклеозидов, в том числе инозина, разработаны подходы с использованием в качестве ростовых субстратов гидролизатов дейтерированной биомассы метилотрофных бактерий, ассимилирующих метанол по рибулозо-5’-монофосфатному (РМФ) и сериновому пути фиксации углерода, интерес к которым возрастает благодаря интенсивному развитию технологии химического синтеза метанола [10, 11]. Уровень ассимиляции биомассы метилотрофных бактерий клетками простейших организмов и эукариот составляет 85-98 %, а их производительность, измеренная по уровню биоконверсии метанола в клеточные компоненты, достигает 50 % [12]. Как было показано нами ранее, метилотрофные бактерии — неприхотливые объекты, растут на минимальных средах с 2-4 % метанолом, в которых другие бактерии не размножаются, и достаточно легко адаптируются к максимальным концентрациям 2Н2О [13]. Однако эксперименты обнаружили бактериостатический эффект 2Н2О, заключающийся в ингибировании жизненно-важных функций клеток бактериальных штаммов-продуцентов [14]. Поэтому целый ряд практических вопросов биосинтеза природных дейтерированных нуклеозидов в 2Н2О остается неизученным.
Большой научно-практический интерес к использованию аналитических методов масс-спектрометрии для изучения биосинтетических путей дейтерированных природных соединений определил цель настоящей работы, связанной с изучением принципиальной возможности использования масс-спектрометрии ББА для установления путей биосинтеза 2Н-меченого пуринового рибонуклеозида инозина, синтезируемого грамположительной хемогетеротрофной бактерией Bacillus subtilis ВКПМ B-3157.
ПРИБОРЫ И МАТЕРИАЛЫ
Для приготовления ростовых сред использовали 2Н 2 О (99.9 атом. % 2Н), 2НCl (95.6 атом. % 2Н) и [2Н]метанол (98.5 атом. % 2Н), полученные из Российского научно-технического центра "Изотоп" (Санкт-Петербург, Россия). Неорганические соли предварительно перекристаллизовывали в 2Н 2 О, 2H 2 O дистиллировали над KMnO 4 с последующим контролем изотопной чистоты 1Н ЯМР-спектроскопией на приборе Brucker WM– 250 ("Brucker Daltonics", Германия) (рабочая частота —70 МГц, внутренний стандарт —Me 4 Si), химические сдвиги протонов ( δ , ppm) измерены в миллионных долях по отношению к Ме 4 Si.
УФ-спектрофотометрию проводили на программируемом спектрофотометре Beckman DU-6 ("Beckman Coulter", США) в диапазоне длин волн 220 - 280 нм.
Аналитическое определение инозина проводили в пробах культуральной жидкости (КЖ) объемом 10 мкл на хроматографических пластинках (150 х 150 мм) с закрепленным слоем флуоресцентного носителя Silufil UV-254 ("Kavalier", Словакия) с использованием стандартного набора рибонуклеозидов фирмы "Beckman Spinco" (США) в системе растворителей: н -бутанол— уксусная кислота—вода = 2 : 1 : 1 об. %. Элюирование пятен проводили 0.1 н. HCl. УФ-поглощение элюатов определяли спектрофотометрически при λ = 249 нм, используя стандартную калибровочную кривую.
Ионообменную хроматографию осуществляли на приборе Biotronic LC 5001 ("Eppendorf-Nethleler-Hinz", Германия) с использованием колонки Biotronic resin BIC 2710; t = 20–(±25) ºС; размеры колонки — 3.2 х 230 мм; неподвижная фаза — сульфированная стирольная смола (7.25 % сшивки полимера) UR-30 ("Beckman Spin-co", США); подвижная фаза — 0.2 М Na-цитратный буфер; рабочее давление — 50–60 атм; скорость подачи Na-цитратного буфера —
18.5 мл/ч; нингидрина — 9.25 мл/ч; детекция при λ = 570 нм и λ = 440 нм (для пролина).
Высокоэффективную жидкостную хроматографию осуществляли на жидкостном хроматографе Knauer Smartline ("Knauer", Германия), снабженном УФ-детектором UF-2563 и интегратором С-R 3A ("Shimadzu", Япония) при t = 20– (±25) °С, используя колонку размером 250 х 10 мм с неподвижной фазой Ultrasorb CN, 10 мкм ("Kova", Словакия); подвижная фаза: ацетонит-рил—вода = 75 : 25 об. % в условиях градиентного элюирования; объем пробы — 50 - 100 мкл; скорость элюирования — 1.5 мл/мин.
Масс-спектрометрию ББА проводили на импульсном масс-спектрометре VG-70 SEQ ("Fisons VG Analytical", США), снабженным цезиевым (Cs+) источником на глицериновой матрице с ускоряющим напряжением 8 - 30 кВ и ионным током 0.6 - 0.8 мА путем предварительной ионизации образцов в разряде атомов благородного газа (Ar, Xe).
УСЛОВИЯ ЭКСПЕРИМЕНТА
Штамм-продуцент [2Н]инозина
Объектом исследования являлся полиауксо-трофный по гистидину, тирозину, аденину и урацилу (потребность 10 мг/л) штамм спорообразующих аэробных грамположительных хемогетеро-трофных бактерий Bacillus subtilis ВКПМ В-3157, продуцент инозина, полученный из Всероссийской коллекции промышленных микроорганизмов (ВКПМ) Государственного научно-исследовательского института генетики и селекции промышленных штаммов микроорганизмов (Москва, Россия). Штамм был предварительно адаптирован к дейтерию рассевом до отдельных колоний на 2 % агаре со ступенчато увеличивающимся градиентом концентрации 2Н2О и последующей селекцией по признаку устойчивости к 2Н 2 О.
Биосинтез [2H]инозина
[2H]инозин получен микробиологическим синтезом с выходом 3.9 г/л на синтетической тяжеловодородной (ТВ) среде (89-90 атом. % 2Н), используя в качестве штамма-продуцента штамм хемогетеротрофных бактерий Bacillus subtilis ВКПМ В-3157, а в качестве источника 2Н-меченых ростовых субстратов — гидролизат дейтерированной биомассы метанол-ассимилиру-ющего штамма факультативных метилотрофных бактерий Brevibacterium methylicum ВКПМ B-5662 (условия получения: автоклавирование в 0.1 н. 2НС1 ~30-40 мин при 0.8 атм), выделенный селекцией в условиях многостадийной адаптации на твердой минеральной среде М9 (2 % агар) с 2 % [2Н]метанолом со ступенчато увеличивающимся градиентом концентрации тяжелой воды (от 0 до 98 об. % 2Н2О).* Сырую метилотрофную биомассу (выход 200 г с 1 л среды) суспендировали в 100 мл 0.5 н. 2НCl (в 2Н2О), автоклавировали 30-40 мин при 0.8 атм. Полученную суспензию нейтрализовали 0.2 н. KОН (в 2Н2О) до рН = 7.0, после чего использовали в качестве источника ростовых субстратов при выращивании штамма-продуцента инозина. Для этого посевной материал в количестве 5-6 масс. % переносили в ТВ-среду с 2Н2О (масс. %): глюкоза — 12.0; дейтерированный гидролизат B. methylicum ВКПМ B-5662 — 2.0; NH4NO3 — 2.0; MgSO4·7H2O — 1.0; СаСО3 — 2.0; аденин — 0.01; урацил — 0.01. В качестве контроля использовали протонированную среду на основе белково-витаминного концентрата (БВК) дрожжей, состав которой аналогичен составу ТВ-среды, за исключением 2 % БВК дрожжей. Культивирование бактерий проводили в колбах Эрленмейера вместимостью 500 мл (наполнение средой 100 мл) в течение 3-4 сут при t = +32 ºС в условиях интенсивной аэрации реакционной смеси на орбитальном шейкере S-380 ("Biorad Labs", Венгрия). Бактериальный рост контролировали по способности к образованию отдельных колоний на поверхности твердых ага-ризованных (2 % агар) сред, а также по величине оптической плотности (ОП) суспензии клеток, измеренной на спектрофотометре Beckman-DU6 ("Beckman Coulter", США) при λ = 540 нм в кварцевой кювете с длиной оптического пути 10 мм. Уровень биоконверсии углеродного субстрата определяли глюкозооксидазным методом, как описано в работе [15].
Выделение [2H]инозина
Пробы КЖ центрифугировали на центрифуге Т-24 ("Carl Zeiss", ФРГ) при 2000 g 10 мин, концентрировали при 10 мм рт. ст. в роторном испарителе РВО-6 ("Microtechna", Венгрия) до объема в 2 раза меньше исходного, добавляли ацетон при 0 ºС (3 × 5 мл). Смесь выдерживали 14–15 ч при +4 ºС, осадок отделяли центрифугированием при t = +4 ºС при 1200 g 5 мин. К супернатанту добавляли 10 г активированного угля, выдерживали 1 сут при t = +4 ºС. Водную фракцию отделяли фильтрованием, к твердой фазе добавляли 20 мл 50 % этанола в 25 % аммиаке (1 : 1 об. %), кипятили при t = +60 ºС с обратным водяным холодильником. Через 2–3 ч смесь фильтровали и упаривали при 10 мм рт. ст. Продукт экстрагировали 0.3 М NH 4 -формиатным буфером (рН =
Здесь и далее использованы проценты по объему.
= 8.9), промывали ацетоном (2 × 10 мл), сушили безводным СaCl 2 . Инозин перекристаллизовывали из 80 % этанола ([ α ] D 20 = +1.61º, выход 3.1 г/л (80 %)). Затем образцы наносили на откалиброванную колонку (150 × 10 мм) с ручным отбором проб с катионообменной смолой АG50WX 4 ("Pharmacia", США). Колонку уравновешивали 0.3 М NH 4 -формиатным буфером (рН = 8.9) c 0.045 М NH4Cl и элюировали тем же буфером в условиях изократической элюции (хроматографическая чистота, 92 %). Элюат подвергали лиофильной сушке и хранили в запаянных ампулах в морозильной камере холодильника при t = –10 ºС. Выход: 3.1 г/л (80 %); Т пл. = 68–70 ºС; [ α ] D 20 = = +1.61º (этанол); R f = 0.5; рК a = 1.2 (фосфатный буфер, рН = 6.87). УФ-спектр (0.1 н. НСl): ( λ max = = 249 нм, ε 249 = 7100 М–1 см–1); масс-спектр ББА (жидкая матрица — глицерин, ускоряющее напряжение Cs+ — 8 - 30 кВ, ионный ток — 0.6– 0.8 мА): [M + H]+ m/z ( I , %): 273, 20 % (4 атома 2Н); 274, 38 % (5 атомов 2Н); 275, 28 % (6 атомов 2Н); 276, 14 % (7 атомов 2Н), [А + H]+ 136, 46 %; [В + Н]+ 138, 55 %; [В – НCN]+ 111, 49 %; [В – HCN]+ 84, 43 %.
РЕЗУЛЬТАТЫ И ИХ ОБСУЖДЕНИЕ
Получение 2Н-меченой биомассы B. methylicum ВКПМ В-3157
В качестве продуцента инозина использовали полиауксотрофный по гистидину, тирозину, аденину и урацилу штамм грамположительных хемогетеротрофных бактерий B. subtilis ВКПМ В-3157 (предварительно адаптированный к дейтерию селекцией до отдельных колоний), который из-за нарушения метаболических путей регуляции биосинтеза пуриновых рибонуклеозидов синтезирует в стандартных условиях выращивания (дрожжевая среда, поздний экспоненциальный рост, t = +32 ºС) 17–20 г инозина на 1 л КЖ [16]. Максимальный выход инозина достигался при использовании протонированной среды, содержащей в качестве источника углерода и энергии глюкозу (12 масс. %), а в качестве источника ростовых факторов и аминного азота 2 % белково-витаминный концентрат (БВК) дрожжей. При проведении биосинтеза требовалось заменить протонированные ростовые субстраты их дейтерированными аналогами, а также использовать 2Н2О высокого уровня изотопной чистоты. Для решения поставленной задачи использовали биомассу адаптированного к дейтерию штамма факультативных метилотрофных бактерий B. methy-licum ВКПМ B-5662, ассимилирующего метанол по рибулозо-5’-монофосфатному пути фиксации углерода, который благодаря 50 %-му уровню биоконверсии метанола (при эффективности конверсии 15.5-17.3 г сух. биомассы на 1 г потребленного субстрата) и устойчивому росту в минеральной дейтерированной среде М9 оказался очень удобным источником для наработки дейтеро-биомассы, а затраты на биоконверсию
Табл. 1. Условия адаптации, изотопный состав ростовых сред и характеристики бактериального роста B. methylicum ВКПМ B-5662*
|
Номер опыта |
Компоненты среды, об. % |
Лаг-период, ч |
Выход микробной биомассы, % от контроля |
Время генерации, ч |
|||
|
H 2 O |
2H 2 O |
метанол |
[2H]метанол |
||||
|
1 |
98.0 |
0 |
2 |
0 |
20.0 |
100.0 |
2.2 |
|
2 |
98.0 |
0 |
0 |
2 |
30.0 |
92.3 |
2.4 |
|
3 |
73.5 |
24.5 |
2 |
0 |
32.1 |
90.6 |
2.4 |
|
4 |
73.5 |
24.5 |
0 |
2 |
34.0 |
85.9 |
2.6 |
|
5 |
49.0 |
49.0 |
2 |
0 |
40.5 |
70.1 |
3.0 |
|
6 |
49.0 |
49.0 |
0 |
2 |
44.1 |
60.5 |
3.2 |
|
7 |
24.5 |
73.5 |
2 |
0 |
45.8 |
56.4 |
3.5 |
|
8 |
24.5 |
73.5 |
0 |
2 |
49.6 |
47.2 |
3.8 |
|
9 |
0 |
98.0 |
2 |
0 |
58.3 |
32.9 |
4.4 |
|
10 |
0 |
98.0 |
0 |
2 |
60.0 |
30.1 |
4.9 |
|
10’ |
0 |
98.0 |
0 |
2 |
40.0 |
87.0 |
2.8 |
Данные опытов 1–10 приведены для B. methylicum ВКПМ B-5662 при выращивании в водных средах М9, содержащих 2 % метанол и указанное количество (об. %) 2Н2О. Данные опыта 10’ приведены для адаптированной к максимальному содержанию дейтерия бактерии при выращивании в среде, содержащей 2 % [2H]метанол и 98 % 2Н 2 О. В качестве контроля использовали опыт 1, где использовали обычную воду и метанол.
определяются в основном стоимостью 2Н 2 О и [2Н]метанола [17]. Проведение адаптации для B. methylicum ВКПМ B-5662 определялось необходимостью улучшения ростовых характеристик штамма и достижения высокого выхода микробной биомассы в максимально дейтерированной среде. Для этого использовали ступенчато-увеличивающийся градиент концентрации 2Н 2 О в ростовых средах М9 (от 24.5 до 98.0 % 2Н 2 О) в присутствии 2 % метанола и его дейтерированного аналога, т. к. предполагалось, что постепенное привыкание клеток к 2Н 2 О будет оказывать благоприятный эффект на ростовые параметры (табл. 1).
Для изучения влияния уровня дейтерированно-сти источника углерода на ростовые параметры штамма в опытах 1, 3, 5, 7 и 9 использовали протонированный метанол, а в опытах 2, 4, 6, 8 и 10 — [2Н]метанол (табл. 1). Замена протонированного метанола его дейтерированным аналогом в условиях одинаковой концентрации 2Н2О в среде приводила к небольшим уменьшениям ростовых характеристик штамма (табл. 1, опыты 2, 4, 6, 8 и 10). Поэтому в дальнейших опытах использовали среды с 2Н2О и [2Н]метанолом. При росте исходного штамма B. methylicum ВКПМ B-5662 на контрольной протонированной среде (рис. 1, (1)) с водой и метанолом продолжительность лаг-периода и времени клеточной генерации составили 20 и 2.2 ч, а выход микробной биомассы 200 г с 1 л КЖ (табл. 1, опыт 1). В промежуточных опытах (2-10) биосинтетические параметры изменялись пропорционально концентрации 2Н2О. Выявленная закономерность заключалась в увеличении продолжительности лаг-периода и времени клеточной генерации при уменьшении выходов микробной биомассы с фиксированием самых низких значений этих параметров в максимально дейтерированной среде с 98 % 2Н2О и 2 % [2H]метанолом (табл. 1, опыт 10), где продолжительность лаг-периода и время генерации увеличивались в 3.0 и 2.2 раза по сравнению с контрольными условиями, а выход микробной биомассы уменьшался в 3.1 раза (табл. 1, опыт 1). Улучшить ростовые характеристики штамма в максимально дейтерированной среде позволила адаптация к дейтерию, условия которой показаны в опыте 10’ (табл. 1). За ходом адаптации наблюдали, снимая динамики роста (рис. 1) исходного (б) и адаптированного к дейтерию (в) штамма в максимально дейтерированной среде М9, содержащей 98 % 2Н2О и 2 % [2H]метанол (рис. 1, а, (контроль) получен в протонированной среде), а также по изменению продолжительности лаг-периода, времени генерации и выходов микробной биомассы. В отличие от адаптированного штамма (в) ростовые динамики исходного штамма (б) в максимальной дейтерированной среде ингибировались дейтерием (рис. 1). Выход микробной биомассы у адаптированного штамма (в) уменьшался на 13 % по сравнению с контрольными условиями (рис. 1, а) при увеличении времени генерации до 2.8 ч, а продолжительности лаг-периода до 40 ч (рис. 1, в). В целом улучшенные ростовые характеристики адаптированного мети-лотрофа существенно упрощают схему получения дейтеро-биомассы, оптимальным условием которой является максимально дейтерированная среда М9 с 98 % 2Н2О и 2% [2Н]метанолом (инкубационный период 3–4 сут при t = +32 ºС).
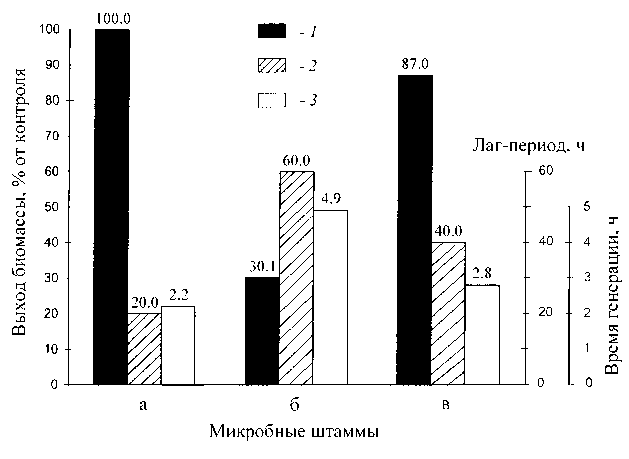
Рис. 1. Выход биомассы B. methyli-cum ВКПМ B-5662 ( 1 ), величина лаг-периода ( 2 ) и время генерации ( 3 ) в различных экспериментальных условиях.
а — исходный метилотроф в протонированной среде с обычной водой и метанолом; б — исходный мети-лотроф в максимально дейтерированной среде; в — адаптированный к дейтерию метилотроф на максимально дейтерированной среде
Биосинтез [2H]инозина
Стратегия биосинтеза 2Н-меченого инозина за счет использования в качестве ростовых субстратов биомассы метилотрофных бактерий разрабатывалась с учетом способности метилотроф-ных бактерий синтезировать большое количество белка (50 % от веса сухого вещества), 15-17 % полисахаридов, 10-12 % липидов (в основном фосфолипиды) и 18 % зольных веществ [18]. Для обеспечения высоких выходов этих соединений и минимизации реакций обратного (1Н—2Н) обмена в аминокислотных остатках гидролиз биомассы проводили автоклавированием в 0.5 н. 2НCl (в 2Н2O). Поскольку штамм B. subtilis ВКПМ В-3157, продуцент инозина, является полиауксо-трофным штаммом, нуждающимся для роста в тирозине и гистидине, исследовали качественный и количественный состав ароматических аминокислот гидролизата метилотрофной биомассы, полученного в максимально дейтерированной среде с 2 % [2Н]метанолом и 98 % 2Н2О, а также уровни их дейтерированности (табл. 2). Качественный и количественный состав аминокислот метилотрофного гидролизата изучали на катионообменной колонке "Biotronic LC-5001" (Германия) с сульфированной смолой UR-30, а уровни дейтерированности молекул — масс-спектрометрией ЭУ метиловых эфиров N-5-(диметиламино)нафтален-1-сульфонильных (дансильных) производных аминокислот, как описано в работе [19]. Из табл. 2 видно, что гидролизат представлен пятнадцатью идентифицированными аминокислотами (за исключением пролина, который детектировался при λ = 440 нм) при содержании тирозина и гистидина в 1 г сухого метило-трофного гидролизата 1.82 и 3.72 %, что удовлетворяет ауксотрофную потребность штамма продуцента в тирозине и гистидине. Содержание других аминокислот в гидролизате также сопоставимо с потребностями штамма-продуцента инозина в источниках углерода и аминного азота (табл. 2). Индикатором, определяющим высокую эффективность включения дейтерия в синтезируемый продукт, служит высокий уровень дейтерирован-ности молекул аминокислот, который варьирует от 49.0 атом. % для лейцина/изолейцина до 97.5 атом. % для аланина (табл. 2). Это позволило использовать гидролизат дейтеро-биомассы метило-трофных бактерий B. methylicum ВКПМ B-5662 как источник ростовых субстратов для выращивания штамма B. subtilis ВКПМ В-3157, продуцента инозина.
Табл. 2. Аминокислотный состав гидролизата биомассы B. methylicum ВКПМ B-5662, полученный с максимально дейтерированной среды, и уровни дейтерированности (атом. %) молекул
|
Аминокислота |
Выход, % от сухого веса 1 г биомассы |
Величина молекулярного иона производных аминокислот [M]+ |
Количество включенных атомов дейтерия в углеродный скелет молекулы* |
Уровень дейтерирован-ности молекул, % от общего количества атомов водорода** |
|
Глицин |
9.69 |
324 |
2 |
90.0 |
|
Аланин |
13.98 |
340 |
4 |
97.5 |
|
Валин |
3.74 |
369 |
4 |
50.0 |
|
Лейцин |
7.33 |
383 |
5 |
49.0 |
|
Изолейцин |
3.64 |
383 |
5 |
49.0 |
|
Фенилаланин |
3.94 |
420 |
8 |
95.0 |
|
Тирозин |
1.82 |
669 |
7 |
92.8 |
|
Серин |
4.90 |
355 |
3 |
86.6 |
|
Треонин |
5.51 |
НД*** |
- |
- |
|
Метионин |
2.25 |
НД |
- |
- |
|
Аспарагин Глутаминовая |
9.59 |
396 |
2 |
66.6 |
|
кислота |
10.38 |
411 |
4 |
70.0 |
|
Лизин |
3.98 |
632 |
5 |
58.9 |
|
Аргинин |
5.27 |
НД |
- |
- |
|
Гистидин |
3.72 |
НД |
- |
- |
*
Данные получены масс-спектрометрией ЭУ для метиловых эфиров N-5-(диметиламино)нафтален-1-
**
сульфонил хлоридных производных аминокислот.
При подсчете уровня дейтерированности протоны (дейтероны) при СООН- и NH 2 -группах молекул аминокислот не учитывались из-за легкости изотопного (1Н—2Н) обмена.
НД — не детектировался.
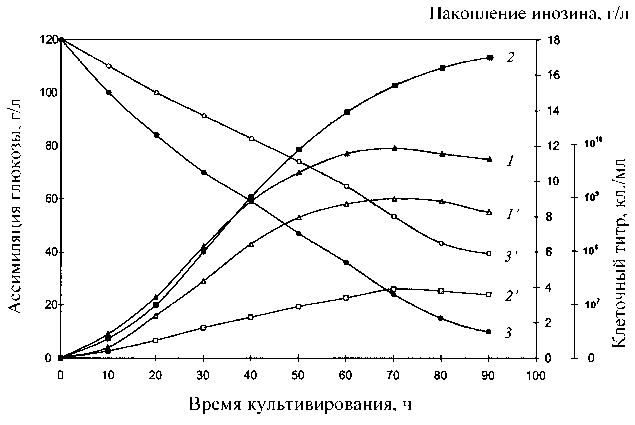
Рис. 2. Динамики роста B. subtilis ВКПМ В-3157, кл/мл ( 1, 1’ ); накопления инозина, г/л ( 2, 2’ ) и ассимиляции глюкозы, г/л ( 3, 3’ ) в различных экспериментальных условиях.
1, 2, 3 — протонированная БВК-среда; 1’, 2’, 3’ — ТВ-среда с 2 % гидролизатом дейтерированной биомассы B. methylicum ВКПМ В-5662
Табл. 3. Состав внутриклеточных углеводов гидролизата биомассы B. subtilis ВКПМ В-3157 и уровни дейтерированности (атом. %) молекул
|
Углевод |
Содержание в биомассе, % от сухого веса 1 г биомассы |
Уровень дейтерированно-сти молекул, %* |
|
|
протонированный гидролизат, полученный в БВК-среде (контроль) |
гидролизат, полученный в ТВ-среде |
||
|
Глюкоза |
20.01 |
21.40 |
80.6 |
|
Фруктоза |
6.12 |
6.82 |
85.5 |
|
Рамноза |
2.91 |
3.47 |
90.3 |
|
Арабиноза |
3.26 |
3.69 |
90.7 |
|
Мальтоза |
15.30 |
11.62 |
- |
|
Сахароза |
8.62 |
НД** |
- |
*
**
Данные получены 1Н ЯМР-спектроскопией. НД — не детектировалось.
***
Ростовые и биосинтетические характеристики штамма продуцента инозина B. subtilis ВКПМ В-3157 изучали в протонированной БВК-среде с обычной водой и в синтетической ТВ-среде с 86 % 2Н2О, 12 % глюкозой и 2 % гидролизатом дейтерированной биомассы B. methylicum ВКПМ B-5662 (рис. 2). Во всех опытах отмечена корреляция в характере изменения ростовых динамик (рис. 2, опыты 1, 1’), выхода инозина (рис. 2, опыты 2, 2’) и ассимиляции глюкозы (рис. 2, опыты 3, 3’). Максимальный выход инозина (17 г/л) зафиксирован на протонированной БВК-среде (рис. 2, опыт 2) при уровне ассимилируемой глюкозы 10 г/л (рис. 2, опыт 3). На ТВ-среде выход инозина снижался в 4.4 (3.9 г/л) (рис. 2, опыт 2’), а уровень ассимиляции глюкозы в 4 раза, о чем свидетельствует 40 г/л остаточной неассимилируемой глюкозы в КЖ (рис. 2, опыт 3’). Экспериментальные данные свидетельствуют о том, что при росте в ТВ-среде глюкоза расходуется менее эффективно, чем в контрольных условиях на протонированной БВК-среде, из-за ингибирования тяжелой водой ферментативных реакций ассимиляции глюкозы клеткой.
Полученный результат требовал изучения содержания глюкозы и других внутриклеточных углеводов в биомассе штамма продуцента B. sub-tilis ВКПМ В-3157, осуществленное методом ВЭЖХ на колонке Ultrasorb CN, 10 мкм с п одвижной фазой ацетонитрил—вода = 75 : 25 об. % (табл. 3). Смесь внутриклеточных углеводов гидролизата биомассы в табл. 3 (нумерация приведена по последовательности их элюции с колонки) составляли моно-(глюкоза, фруктоза, рамноза, арабиноза), ди-сахариды (мальтоза, сахароза), а также четыре других неидентифицированных углевода с временами удерживания 3.08 (15.63 %), 4.26 (7.46 %), 7.23 (11.72 %) и 9.14
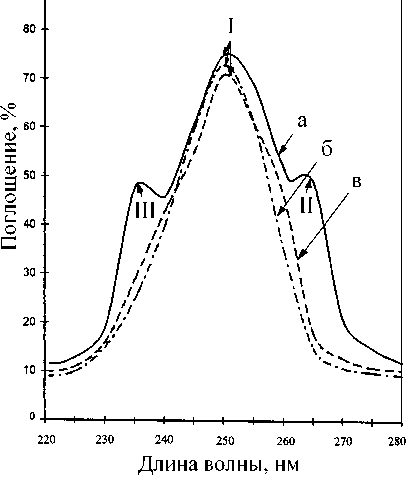
Рис. 3. Спектры УФ-поглощения инозина (0.1 н. раствор НCl).
a — исходная КЖ после выращивания штамма-продуцента B. subtilis ВКПМ В-3157 в ТВ-среде; б — природный инозин; в — инозин, выделенный из КЖ штамма-продуцента. I — инозин, II и III — вторичные метаболиты
(7.95 %) мин (не показаны). Как ожидалось, выход глюкозы в дейтерированном гидролизате составляет 21.4 % от сухого веса, т. е. выше, чем фруктозы (6.82 %), рамнозы (3.47 %), арабинозы (3.69 %) и мальтозы (11.62 %) (табл. 3). Их выходы существенно не отличались от контроля в Н 2 О, за исключением сахарозы, которая не детектируется в дейтерированном гидролизате. Уровни дейтерированности углеводов варьируют от 90.7 атом. % 2Н для арабинозы до 80.6 атом. % 2Н для глюкозы.
Выделение [2H]инозина
Применение комбинации физико-химических методов для выделения биосинтетического [2Н]инозина из КЖ диктовалось необходимостью получать инозин высокой степени хроматографической чистоты (не менее 95 %). Поскольку в КЖ наряду с синтезируемым продуктом присутствуют примеси неорганических солей, белков и полисахаридов, а также сопутствующие вторичные метаболиты нуклеиновой природы (аденозин, гуанозин) и непрореагировавшие субстраты (глюкоза, аминокислоты), проводилось ступенчатое фракционирование КЖ. Повышенная чувстви- тельность инозина к кислотам и щелочам и его нестабильность при выделении требовали использования кислотных и щелочных растворов низкой концентрации, а также проводить выделение при низких температурах, избегая длительного перегрева реакционной смеси. Фракционирование КЖ заключалось в низкотемпературном осаждении высокомолекулярных примесей органическими растворителями — ацетоном и метанолом, ад-сорбции/десорбции на поверхности активированного угля, экстракции продукта, перекристаллизации, ионообменной хроматографии. Белки и полисахариды удаляли низкотемпературным осаждением ацетоном при +4 ºС, проводя последующую адсорбцию суммы рибонуклеозидов активированным углем на холоде. Десорбированные рибонуклеозиды извлекали из прореагировавшей твердой фазы элюированием этанольно– аммиачным раствором при +60 ºС, а сам инозин — экстракцией 0.3 М NH4-формиатным буфером (рН = 8.9) с последующей перекристаллизацией в 80 % этаноле. Окончательная стадия очистки заключалась в колоночной ионообменной хроматографии на катионообменнике AG50WX 4, уравновешенном 0.3 М NH4-формиатным буфе-ромс 0.045 М NH4Cl со сбором фракций при Rf = = 0.5. Данные по выделению инозина из КЖ штамма-продуцента B. subtilis ВКПМ В-3157 представлены в виде спектров УФ-поглощения на рис. 3. Наличие в анализируемом образце (в) основной полосы поглощения Ι, соответствующей природному инозину (λmax = 249 нм, ε249 = = 7100 М–1.см-1) и отсутствие вторичных метаболитов ΙΙ и ΙΙΙ доказывает его однородность и, следовательно, эффективность разработанного метода выделения.
Изучение распределения дейтериевой метки в молекуле [2H]инозина
Уровень дейтерированности инозина исследовали методом масс-спектрометрии ББА, который за счет ионизации быстрыми атомами позволяет обнаруживать микро и следовые количества органического вещества в больших объемах жидкостей и в биологических системах без их предварительной химической модификации в летучие производные. Для этого регистрировали масс-спектры ББА дейтерированного и протонированного инозина, по разности величин пиков молекулярных ионов которых проводили расчет уровня дейтерированности молекулы. Формирование пика молекулярного иона инозина при масс-спектрометрии ББА сопровождается миграцией протона Н+ с формированием молекул с [М + Н]+. Биосинтетический 2Н-меченый инозин (масс-спектр ББА приведен на рис. 4, б, относительно
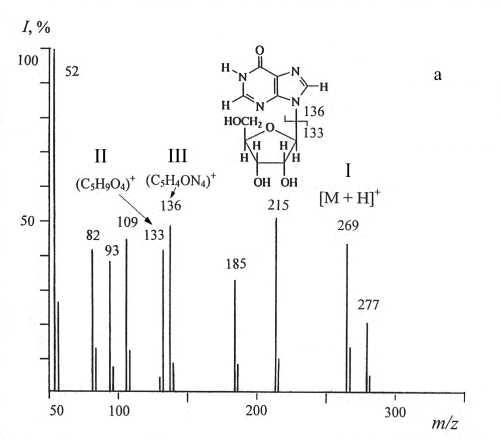
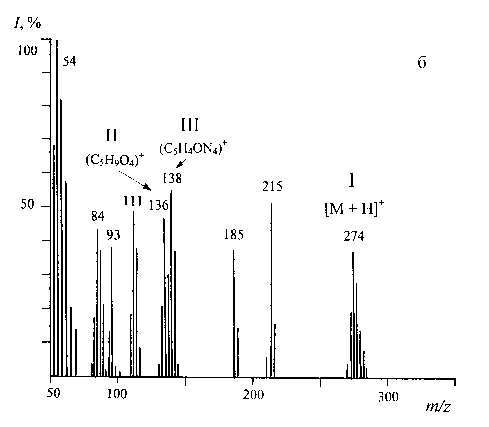
Рис. 4. Масс спектры ББА инозина (глицериновая матрица) в различных экспериментальных условиях.
а — природный инозин; б — [2H]инозин, выделенный из ТВ-среды. Условия ионизации: цезиевый источник в разряде атомов Ar; ускоряющее напряжение — 8 - 30 кВ; ионный ток — 0.6 - 0.8 мА. I — инозин, II — рибозный фрагмент, III — гипоксантиновый фрагмент
Табл. 4. Величины пиков [М + Н]+ в масс-спектрах ББА и уровни дейтерированности (атом. %) молекулы инозина
|
Величина пика [М + Н]+ |
Вклад в уровень дейтери-рованности, мол. % |
Количество атомов дейтерия |
Уровень дейтерированности, % от общего количества атомов водорода* |
|
273 |
20 |
4 |
20.0 |
|
274 |
38 |
5 |
62.5 |
|
275 |
28 |
6 |
72.5 |
|
276 |
14 |
7 |
87.5 |
При вычислении уровня дейтерированности протоны (дейтероны) при ОН-гидроксильных группах, а также имидазольные NH-протоны при гетероатомах азота не учитывались из-за легкости изотопного (Н—2H) обмена в 2Н2О.
контроля (рис. 4, а)) представлял смесь изотопнозамещенных форм молекул с различным количеством атомов водорода, замещенных на дейтерий. Поэтому пики молекулярных ионов инозина [М + Н]+ полиморфно расщеплялись на отдельные кластеры с примесью молекул со статистическим набором массовых чисел m/z с различным вкладом в суммарный уровень дейтерированности молекулы. Его подсчет проводили по вкладу наиболее интенсивного пика молекулярного иона [М + Н]+ (пик с наибольшим вкладом в уровень дейтерированности), зарегистрированного в данных условиях масс-спектрометром. Этим условиям удовлетворял пик I при m/z = 274, 38 % (вместо [М + Н]+ при m/z = 269, 42 % в контрольных условиях (рис. 4, а)), что соответствует включению 5 атомов дейтерия в молекулу инозина (рис. 4, б).
Пик II с m/z = 133, 41 % и пик III с m/z = 136, 49 % соответствуют фрагменту рибозы и гипоксантиновому фрагменту. Как видно из табл. 4, в пике молекулярного иона инозина [М + Н]+ также фиксировались менее интенсивные пики с примесями молекул с включением четырех ( m/z = 273, 20 %), пяти ( m/ z = 274, 38 %), шести ( m/z = 275, 28 %) и семи атомов дейтерия ( m/z = 276, 14 %). Это свидетельствует об изотопном полиморфизме при данном инструментальном методе введения в молекулу дейтериевой метки.
С учетом эффекта изотопного полиморфизма суммарный уровень дейтерированности молекулы инозина (УД), вычисленный по нижеприведенной формуле, составил 62.5 атом. % от общего количества атомов водорода в углеродном скелете молекулы:
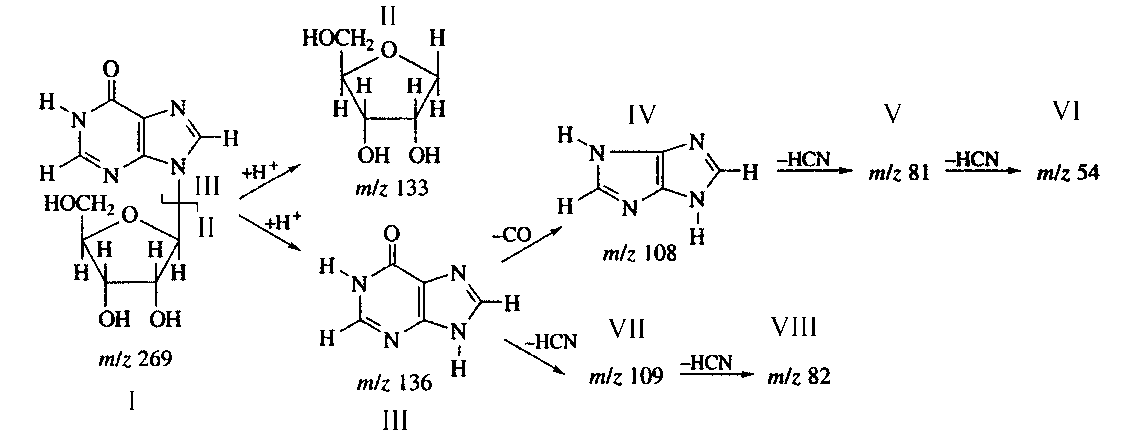
Рис. 5. Схема фрагментации молекулы инозина методом ББА
[ M r 1 ] C + [ Mr 2 ] C 2 + ... + [ M n ] C „ Z C*
где M rn — величины пиков молекулярных ионов инозина; С n — вклад в уровень дейтерированно-сти, мол. %.
Более точную информацию о распределении дейтерия в молекуле инозина дает фрагментация молекулы методом ББА, показанная на рис. 5. Пути фрагментации молекулы инозина методом ББА приводят к распаду инозина на фрагмент рибозы II при массовом соотношении m/z = 133 и гипоксантиновый фрагмент III при m/z = 136 (их распад сопровождается миграцией протона Н+), которые в свою очередь расщепляются на ряд низкомолекулярных осколочных фрагментов (IV– VIII) при m/z = 109, 108, 82, 81 и 54 за счет элиминирования НСN и СО из фрагмента гипоксантина (рис. 5). Следовательно, присутствие в масс-спектре ББА инозина "тяжелых" пиков фрагментов рибозы II с m/z = 136, 46 % (вместо m/z = 133, 41 %) и гипоксантина III с m/z = 138, 55 % (вместо m/z = 136, 48 %), а также осколочных пиков низкомолекулярных фрагментов (VII, VIII), продуктов распада гипоксантина при m/z = 111, 49 % (вместо m/z = 109, 45 %) и m/z = 84, 43 % (вместо m/z = 82, 41 %) свидетельствует о включении трех атомов дейтерия в рибозный и двух атомов дейтерия в гипоксантиновый фрагменты молекулы инозина. Cелективный характер включения дейтерия в молекулу инозина по определенным положениям молекулы подтвержден присутствием дейтерия в осколочных фрагментах.
При анализе уровня дейтерированности [2H]инозина учитывался факт, что уровень и характер включения дейтерия в молекулу определя- ется путями ассимиляции углерода (глюкоза, аминокислоты) данным штаммом хемогетеро-трофных бактерий. Метаболические пути ассимиляции глюкозы хемогетеротрофными бактериями в аэробных условиях определяются в основном гликолизом; анаэробный гликолиз не распространен для этого вида бактерий. Основным источником углерода служила глюкоза, а источником дейтерированных субстратов и аминного азота — гидролизат дейтеро-биомассы метилотрофных бактерий B. methylicum ВКПМ B-5662. Поскольку протоны (дейтроны) в положениях рибозного остатка в молекуле инозина могли синтезироваться из глюкозы, характер изотопного включения дейтерия в рибозный остаток молекулы определяется в основном ассимиляцией глюкозы за счет гликолиза по пути Эмбдена—Мейергофа. Поскольку глюкоза в экспериментах использовалась в протонированной форме, ее вклад в уровень обогащения дейтерием рибозного остатка пренебрегал-ся. Однако, вопреки этому, наблюдалось включение дейтерия в рибозный фрагмент молекулы инозина за счет ферментативной изомеризации глюкозы и реакций изотопного (1Н—2Н) обмена в процессе изомеризации. Эти обменные процессы также могли приводить к специфическому включению атомов дейтерия по определенным положениям в молекуле инозина. Такими доступными положениями в молекуле инозина являются гидроксильные протоны (ОН-), протоны в С'2, C'3-положениях рибозного остатка, имидазольные протоны при гетероатомах (NH+) и протоны в N1-положении в гипоксантиновом остатке, которые могут обмениваться на дейтерий в 2Н2О за счет кето-енольной таутомерии. Три не обмениваемые атома дейтерия в рибозном фрагменте молекулы
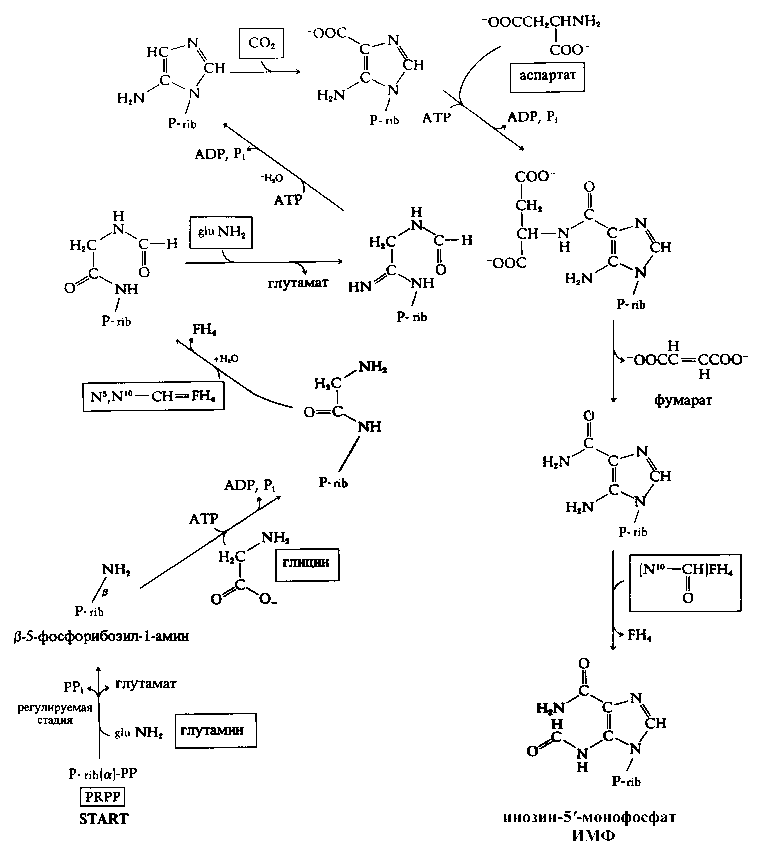
Рис. 6. Общая схема биосинтеза ИМФ микробной клеткой (адаптировано из [21])
могли cинтезироваться за счет ферментативной ассимиляции глюкозы клеткой, в то время как два других атома дейтерия в С2-, С8-положениях гипоксантинового остатка могли синтезироваться из [2Н]аминокислот — глицина, глутамина и аспартата (с участием N10–CHO–FH4 и N5,N10–CH=FH) (рис. 6), источником которых служил дейтерированный гидролизат метилотрофной бактерии B. methylicum ВКПМ B-5662. Гликозидный протон в положении β-N9 гликозидной связи в рибозном фрагменте мог заместиться на дейтерий в процессе реакции элиминирования СО2 на стадии образования рибулозо-5’-монофосфата из 3-кето-6-фосфоглюконовой кислоты с последующим присоединением протона (дейтерона) по С1-положению рибулозо-5’-монофосфата. В целом наши исследования подтверждают эту схему [20]. Тем не менее следует отметить, что ауксо-трофность этого мутантного штамма в тирозине, гистидине, аденине и урациле предполагает разветвленные метаболические пути, отличные от тех, которые указаны выше, поскольку известно, что промежуточные продукты гликолиза являются предшественниками ряда соединений, как нуклеотиды и аминокислоты. Уровень изотопного обогащения молекулы инозина определяется степенью изотопной чистоты 2H2O и дейтерированных субстратов и, следовательно, для униформного включения атомов дейтерия в молекулу инозина вместо протонированной глюкозы должен использоваться ее дейтерированный аналог.
ЗАКЛЮЧЕНИЕ
Согласно проведенному исследованию, масс-спектрометрия ББА хорошо зарекомендовала себя для изучения путей биосинтеза 2Н-меченого инозина и распределения дейтерия в молекуле. В результате удалось установить места локализации дейтерия в молекуле биосинтетического [2H]инозина. Наблюдаемый изотопный полиморфизм, сопровождающийся миграцией протона с образованием [M + H]+ не является препятствием определения дейтерия в молекуле, который определяется с учетом вклада пиков молекулярных ионов в суммарный уровень дейтерированно-сти молекулы (5 атомов 2Н, 62.5 атом. %). Из пяти включенных в молекулу инозина атомов дейтерия три атома дейтерия в рибозном фрагменте молекулы инозина синтезировались за счет ферментативной изомеризации глюкозы клеткой и реакций изотопного (1Н—2Н) обмена, в то время как два других атома дейтерия в С2-, С8-положениях гипоксантинового остатка могли синтезироваться из [2Н]аминокислот – глицина, глутамина и аспартата, источником которых служил гидролизат дейтеро-биомассы B. methylicum B-5662. Кроме этого, реакции изотопного (1Н—2Н) обмена также могли приводить к специфичному включению дейтерия в молекулу. Для достижения более высокого уровня дейтерированности конечного продукта необходимо тщательным образом контролировать изотопный состав ростовой среды и исключить все источники дополнительных протонов, в том числе использовать дейтерированную глюкозу, которая может быть выделена в препаративных количествах из дейтерированной биомассы того же штамма метилотрофных бактерий B. methylicum ВКПМ B-5662. В будущем планируется получать и идентифицировать разработанным методом другие дейтерированные природные нуклеозиды и их аналоги.
Работа осуществлялась при финансовой поддержке Научно-исследовательского центра медицинской биофизики (Болгария). Грант № 48-РП.
Список литературы Масс-спектрометрия с бомбардировкой быстрыми атомами в установлении путей биосинтеза пуринового рибонуклеозида [2н] инозина
- Chen B., Jamieson E.R., Tullius T.D. A general synthesis of specifically deuterated nucleotides for studies of DNA and RNA//Bioorg. & Med. Chem. Lett. 2002. Vol. 12. P. 3093-3096. Doi: DOI: 10.1016/S0960-894X(02)00650-9
- Kundu M.T., Trifonova A., Dinya Z., Foldes A., Chattopadhyaya J. Synthetic studies to improve the deuterium labeling in nucleosides for facilitating structural studies of large RNAs by high-field NMR spectroscopy//Nucleosides, Nucleotides and Nucleic Acids. 2001. Vol. 20, no. 4-7. P. 1333-1337. Doi: DOI: 10.1081/NCN-100002549
- Chirakul P., Litzer J.R., Sigurdsson S.T. Preparation of base-deuterated 2'-deoxyadenosine nucleosides and their site-specific incorporation into DNA//Nucleosid., Nucleotid. Nucleic Acids. 2001. Vol. 20, no. 12. P. 1903-1913. Doi: DOI: 10.1081/NCN-100108321
- Мосин О.В., Складнев Д.А., Егорова Т.А., Швец В.И. Масс-спектрометрическая оценка уровня включения 2Н и 13С в молекулы аминокислот бактериальных объектов//Биоорганическая химия. 1996. Т. 22, № 10-11. С. 856-869.
- Мосин О.В., Швец В.И., Складнев Д.А., Игнатов И. Биосинтез фотопреобразующего трансмембранного белка бактериородопсина, меченного дейтерием по остаткам ароматических аминокислот Phe, Tyr и Trp//Научное приборостроение. 2013. Т. 23, № 2. С. 14-26. URL: http://213.170.69.26/mag/2013/full2/Art3.pdf.
- Caprioli R.M. Continuous flow fast atom bombardment mass spectrometry/R.M. Caprioli (ed.). New York: Wiley, 1990. 125 p. Doi: DOI: 10.1016/0076-6879(90)93417-j
- Tomer K.B. The development of fast atom bombardment combined with tandem mass spectrometry for the determination of biomolecules//Mass Spectrometry Reviews. 1989. Vol. 8, no. 6. P. 445-482. Doi: DOI: 10.1002/mas.1280080602
- Morris H.R., Panico M., Barber M., Bordoli R.S., Sedgwick R.D., Tyler A. Fast atom bombardment: a new mass spectrometric method for peptide sequence analysis//Biochem. Biophys. Res. Commun. 1981. Vol. 101, no. 2. P. 623-631. Doi: DOI: 10.1002/mas.1280080602
- Muñoz García D., Midaglia L., Martinez Vilela J. et al.//Acta Neurologica Scandinavica. 2015. Vol. 131. no. 6. P. 405-410. Doi: DOI: 10.1111/ane.12333
- Мосин О.В., Складнев Д.А., Швец В.И. Биосинтез дейтерированного инозина бактерией Bacillus subtilis на тяжеловодородной среде//Изв. Акад. Наук. Серия биологическая. 1999. № 4. С. 396-402.
- Mosin O.V., Skladnev D.A., Shvets V.I. Biosynthesis of 2H-labeled phenylalanine by a new methylotrophic mutant Brevibacterium methylicum//Biosci, Biotechnol., Biochem. 1999. Vol. 62, no. 2. P. 225-229. Doi: DOI: 10.1271/bbb.62.225
- Mosin O.V., Shvets V.I., Skladnev D.A., Ignatov I. Microbial synthesis of 2H-labelled L-phenylalanine with different levels of isotopic enrichment by a facultive methylotrophic bacterium Brevibacterium methylicum with RuMP assimilation of carbon//Biochemistry (Moscow) Supplement Series B: Biomedical Chemistry. 2013. Vol. 7, no. 3. P. 249-260.
- Мосин О.В., Швец В.И., Складнев Д.А., Игнатов И. Исследование микробного синтеза дейтерий-меченного L-фенилаланина факультативной метилотрофной бактерией Brevibacterium methylicum на средах с различным содержанием тяжелой воды//Биофармацевтический журнал. 2012. Т. 4, № 1. С. 11-22.
- Мосин О.В., Игнатов И. Биологическое воздействие дейтерия на клетки прокариот и эукариот//Разработка и регистрация лекарственных средств. 2014. Т. 2, № 7. С. 122-131.
- Мосин О.В., Казаринова Л.А., Преображенская К.А., Складнев Д.А., Юркевич А.М., Швец Д.А. Рост бактерии Bacillus subtilis и биосинтез инозина на высокодейтерированной среде//Биотехнология. 1996. № 4. С. 19-26.
- Мосин О.В., Швец В.И., Складнев Д.А., Игнатов И. Микробиологический синтез инозина высокого уровня дейтерированности грамм-положительной хемогетеротрофной бактерией Bacillus subtilis//Прикладная биохимия и микробиология. 2013. Т. 49, № 3. P. 255-266. Doi: DOI: 10.1134/S0003683813030137
- Mosin O.V., Ignatov I. Microbiological synthesis of 2H-labeled phenylalanine, alanine, valine, and leucine/isoleucine with different degrees of deuterium enrichment by the Gram-positive facultative methylotrophic bacterium Вrevibacterium methylicum//International Journal of BioMedicine. 2013. Vol. 3, no. 2. P. 132-138.
- Складнев Д.А., Мосин О.В., Егорова Т.А., Еремин С.В., Швец В.И. Метилотрофные бактерии -источники изотопномеченых 2Н-и 13С-аминокислот//Биотехнология. 1996. № 5. С. 25-34.
- Мосин О.В., Игнатов И., Швец В.И., Тыминский Г. Масс спектрометрия электронного удара в анализе включения стабильных изотопов дейтерия и углерода-13 в молекулы аминокислот биологических объектов//Научное приборостроение. 2015. Т. 25, № 4. P. 3-18. URL: http://213.170.69.26/mag/2015/full4/Art1.pdf.
- Ignatov I., Mosin O.V. Possible processes for origin of life and living matter with modeling of physiological processes of bacterium Bacillus subtilis in heavy water as model system//Journal of Natural Sciences Research. 2013. Vol. 3, no. 9. P. 65-76.
- Bohinski R.C. Modern concepts in biochemistry/R.C. Bohinski (ed.). Boston, London, Sydney, Toronto, Massachusetts: Allyn & Bacon Inc, 1983. 378 p.

![Масс-спектрометрия с бомбардировкой быстрыми атомами в установлении путей биосинтеза пуринового рибонуклеозида [2н] инозина Масс-спектрометрия с бомбардировкой быстрыми атомами в установлении путей биосинтеза пуринового рибонуклеозида [2н] инозина](/file/cover/14265018/mass-spektrometrija-s-bombardirovkoj-bystrymi-atomami-v-ustanovlenii-putej.png)
