Массовое разведение интродуцированного энтомофага Сhouioia cunea Yang. Оценка возможности его применения для защиты леса
Автор: Сергеева Ю.А., Долмонего С.О.
Журнал: Лесохозяйственная информация @forestry-information
Рубрика: Охрана и защита лесов
Статья в выпуске: 1, 2013 года.
Бесплатный доступ
Рассмотрен процесс массового разведения энтомопаразитоида Chouioia cunea Yang – интродуцированного биологического агента – для защиты лесов от американской белой бабочки. Изложены результаты исследований способности энтомофага заражать разные виды фитофагов и нецелевых видов бабочек.
Паразитоид, фитофаги, массовое разведение, защита леса
Короткий адрес: https://sciup.org/14336506
IDR: 14336506 | УДК: 630*4
Текст научной статьи Массовое разведение интродуцированного энтомофага Сhouioia cunea Yang. Оценка возможности его применения для защиты леса
В условиях интенсивного воздействия человека на окружающую среду, в том числе на лесные биоценозы, наблюдается все возрастающий интерес к практическому применению биологического метода защиты леса. Так, на 15-м Международном конгрессе по защите растений в Пекине (2004 г.) биологический метод контроля численности живых организмов был назван приоритетным направлением развития [1].
В последние годы большое число лесных организмов, попадающих в Европу и Россию, становятся здесь опасными вредителями [2, 13]. Одно из важных направлений защиты от них – разработка программ интродукции агентов биологической защиты.
Американская белая бабочка Hyphantria cunea Drury, 1773 (АББ) наносит существенный вред лиственным лесам, древесной растительности на сельскохозяйственных землях и городским зеленым насаждениям от западной границы России до границы с Казахстаном. В ряде европейских и азиатских стран, а также в бывш. СССР, энтомофагов этого вредителя неоднократно интродуцировали, однако ни один из них пока не акклиматизировался [4, 10, 11].
Проведенные в 2009–2011 гг. исследования подтвердили, что в России продолжается формирование паразитокомплексов АББ. Комплекс эн-томофагов обширен, однако пока не разработано эффективного агента биологической защиты, способного быстро и эффективно сдерживать численность вредителя, поскольку высокий уровень паразитизма наблюдается в уже затухающих очагах [12].
По сравнению с другими видами паразитои-дов, поражающих АББ, Ch. cunea имеет высокий уровень паразитизма, быстро обосновывается в популяции хозяина, что делает этот вид привлекательным для интродукции. Широкий круг хо- зяев, короткий период развития, групповой паразитизм, пластичность к изменению параметров среды существования делают его достаточно технологичным видом для разведения в искусственных условиях [14, 17, 20, 21].
Интродукция Сh. cunea в очаги АББ может быть перспективной с точки зрения введения нового агента биологического контроля путем «наводнения» в очаги вредителя, что в ряде случаев позволит отказаться от химических обработок.
В 2011–2012 гг. в лаборатории биологических методов защиты леса ВНИИЛМ проведены работы по массовому разведению энтомопарази-тоида на куколках галлерии – большой восковой моли Galleria mellonella L. (Lepidoptera, Pyralidae). Работы проводили по технологической схеме, приведенной на рис. 1.
Разведение насекомого-хозяина и энтомопа-разитоида – непрерывные, циклические и практически независимые друг от друга процессы. Ведение двух линий живых огранизмов, когда один является пищей другого, предусматривает синхронизацию воспроизводств: уязвимая стадия хозяина (в нашем случае – куколки галлерии) должна быть в наличии в период отрождения эн-томофага. Для этого одновременно в лаборатории содержались все фазы развития галлерии. Таким образом было налажено конвейерное размножение культур насекомого-хозяина и энто-мопаразитоида. Полученные куколки использовали для разведения паразитоида Ch. cunea. Разведение галлерии проведено по общепринятым методикам [3, 6, 9].
Оценка популяционных параметров разводимого энтомофага – важное звено в разработке технологии его производства и применения. При лабораторном культивировании возможны снижение плодовитости объекта разведения, изменение соотношения «самец : самка», нарушение поисковых способностей, предпочтение лабораторному хозяину и отказ от заражения естественных хозяев [5, 18]. Поэтому в процессе разведения необходимо оценивать качество культивируемого биоматериала.
Один раз в году размножение энтомопарази-тоида проводили на куколках АББ – для восста-
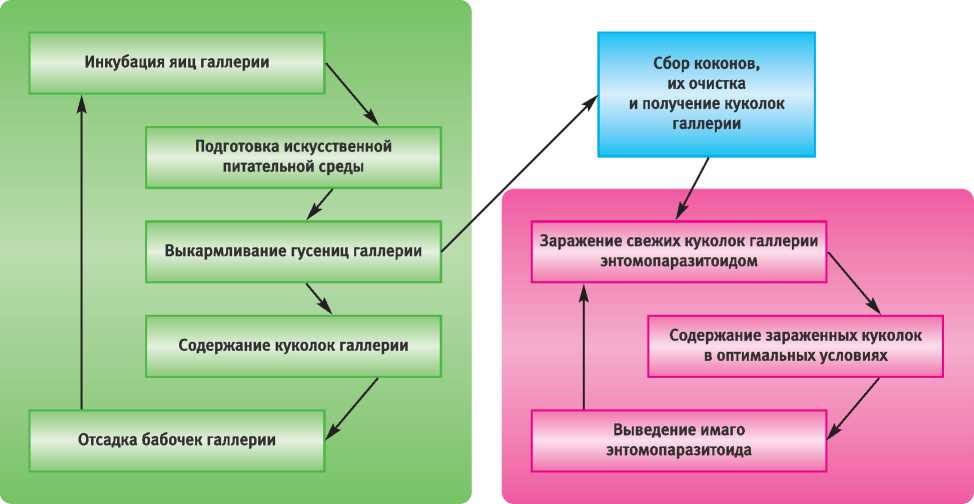
Рис. 1. Технологическая схема ведения культур энтомопаразитоида и галлерии новления его популяционных качеств на естественном хозяине. Для оценки популяционных параметров Ch. cunea после 2-летнего культивирования на галлерии в партиях куколок разного времени заражения в 2012 г. выборочно определена доля зараженных куколок хозяина; число паразитоидов в одной куколке; соотношение самцов и самок; выживаемость (доля отродившихся).
Паразитоид заражает 85–98% куколок галле-рии (табл. 1). Доля куколок с погибшими особями паразитоида возрастает при содержании насекомых при температуре выше 25 °С и ниже 20 °С. В ряде партий наблюдалось развитие бабочек галле-
Таблица 1. Результаты заражения куколок галлерии энтомопаразитоидом в лабораторных условиях
В табл. 2 приведены данные, полученные при выборочном анализе куколок галлерии из разных партий.
Для сокращения трудозатрат были заложены опыты по изучению возможности заражения куколок галлерии без извлечения их из коконов. Коконы лишь надрезали ножницами, чтобы обеспечить паразитоиду доступ к куколке (рис. 2).
Результаты отрождения имаго паразитоида после заражениях куколок в коконах свидетельствуют о том, что в надрезанных коконах энтомофаг благополучно заражал куколки (табл. 3). В про-
Таблица 2. Данные учетов отрождения имаго Ch. cunea из куколок галлерии
|
№ п/п |
Длина/ширина куколки галлерии, мм |
Число вышедших имаго паразитоида, шт. |
Соотношение самцы : самки |
Число не отродившихся из куколки особей паразитоида, шт. |
|
1 |
15,1/4,0 |
144 |
1 : 3 |
12 |
|
2 |
14,9/4,0 |
339 |
1 : 22 |
23 |
|
3 |
13,8/3,5 |
296 |
1 : 32 |
6 |
|
4 |
13,5/3,6 |
388 |
1 : 15 |
14 |
|
5 |
15,2/4,1 |
412 |
1 : 8 |
10 |
|
6 |
12,8/2,6 |
367 |
1 : 8 |
21 |
|
7 |
12,3/2,4 |
285 |
1 : 20 |
16 |
|
8 |
13,6/3,8 |
311 |
1 : 4 |
8 |
|
9 |
14,2/3,5 |
112 |
1 : 34 |
34 |
|
10 |
14,8/3,8 |
324 |
1 : 2 |
18 |
Размер куколки не всегда влияет на число отродившихся имаго паразитоида. В куколках, где закончилось отрождение имаго Ch. cunea , всегда остаются погибшие, недоразвившиеся куколки и имаго паразитоида. Такая картина наблюдается при развитии не только в куколках галлерии, но и в куколках всех видов насекомых-хозяев, включая АББ и китайского дубового шелкопряда. Соотношение «самцы : самки» в разных куколках сильно варьировало – от 1 : 2 до 1 : 34.
Данные, полученные в 2012 г., согласуются с результатами работ 2011 г. [7, 8]. Двухлетнее культивирование Ch. cunea на галлерии не привело к потере качества биоматериала.
Паразитоид не заражает куколку галлерии, находящуюся в коконе, поэтому в 2011 г. и в первом полугодии 2012 г. разрезали коконы и извлекали из них куколок. Эти работы занимали значительную часть времени относительно всех остальных операций по разведению паразитоида: так, для получения 1 тыс. куколок необходимо затратить 15 человекочасов, из них 10 человекочасов – затраты на разрезание коконов и извлечение куколок.

Рис. 2. Надрезанные коконы галлерии перед заражением энтомопаразитоидом анализированных партиях 96,4–99,0% куколок были паразитированы. Снизился процент погибших куколок в сравнении с данными, приведенными в табл. 1, за счет исключения повреждений при извлечении их из коконов. Отродившиеся особи Ch. cunea благополучно прогрызают кокон и выходят из него (рис. 3).
Таблица 3. Результаты заражения коконов галлерии энтомопаразитоидом в лабораторных условиях
|
№ п/п |
Дата заражения (число, месяц) |
Число проанализированных куколок, шт. |
Доля, % |
|||
|
зараженных куколок |
погибших куколок хозяина |
вылетевших бабочек галлерии |
погибших паразитоидов в куколке галлерии |
|||
|
1 |
16.07 |
100 |
97,0 |
0 |
1,0 |
2,0 |
|
2 |
30.07 |
86 |
95,4 |
2,3 |
0 |
2,3 |
|
3 |
8.08 |
305 |
98,3 |
0 |
0 |
1,7 |
|
4 |
20.08 |
130 |
98,5 |
0 |
0,75 |
0,75 |
|
5 |
12.09 |
128 |
97,7 |
0,8 |
1,5 |
0 |
|
6 |
25.09 |
200 |
94,0 |
1,0 |
2,5 |
2,5 |
|
7 |
27.09 |
185 |
99,0 |
0,5 |
0 |
0,5 |
|
8 |
2.10 |
180 |
98,3 |
0,6 |
0,6 |
0,6 |
|
9 |
9.10 |
100 |
96,0 |
0 |
2,0 |
2,0 |
|
10 |
12.10 |
100 |
95,0 |
1,0 |
1,0 |
3,0 |
|
11 |
15.10 |
100 |
97,0 |
0 |
1,0 |
2,0 |
|
12 |
19.10 |
120 |
97,5 |
0,8 |
0,8 |
0,8 |
|
13 |
25.10 |
100 |
98,0 |
1,0 |
0 |
1,0 |
|
14 |
8.11 |
110 |
96,4 |
0 |
1,8 |
1,8 |

Рис. 3. Вылетные отверстия энтомопаразитоида в коконах галлерии
Если на разрезание и извлечение 100 куколок одному исполнителю требуется затратить 1 ч, то при надрезании коконов трудозатраты значительно сокращаются – не более 15 мин. Такой способ разведения Ch. cunea не только существенно снижает трудозатраты, но и позволяет предотвратить повреждение биоматериала.
При попытке усовершенствовать технологию разведения энтомопаразитоида путем заражения замороженных куколок галлерии предполагалось, что этот способ может быть предпочтительнее, так как позволил бы накапливать биоматериал галлерии и, при необходимости, легко синхронизировать получение нужной фазы развития паразитоида к необходимому периоду времени. Куколок галлерии замораживали в тече- ние 2 сут., затем размораживали и заражали па-разитоидом. Визуальные наблюдения показали, что самки Ch. cunea приступили к заражению куколок. Однако через 25 сут. в экспериментальной партии имаго паразитоида не отродились. Все куколки были вскрыты, но развития личинок па-разитоида в них не было. Следовательно, такой способ разведения невозможен.
Сh. сunea является олигофагом. В список его хозяев, кроме АББ, входят также представители других семейств чешуекрылых, в том числе сельскохозяйственных и лесных фитофагов [16]. Возможность использования паразитоида в борьбе с другими видами вредителей требует дополнительных исследований.
Для оценки экологических рисков, связанных с выпуском Ch. cunea в природу, была изучена его способность поражать нецелевые виды бабочек, а также пупарии паразитических двукрылых. Потенциальная способность Ch. cunea развиваться на разных видах насекомых, обитающих в лесах в период выпуска энтомофага в природу, создает возможность сохранения его в биоценозах в период отсутствия подходящей фазы для заражения АББ.
Ch. cunea может быстро снизить численность АББ и способен перейти на другие виды альтернативных хозяев в природе [15]. При росте численности АББ паразитиод вновь начинает поражать основного хозяина.
Каждую зараженную куколку фитофага помещали в отдельную емкость, после отрождения паразитоидов их умервщляли, а затем вели подсчет особей и определяли их пол. Результаты заражения энтомопаразитоидом куколок разных видов насекомых приведены в табл. 4.
куколках сибирского коконопряда Dendrolimus superans sibiricus Tschetverikov, 1908; шелкопряда-монашенки Lymantria monacha Linnaeus, 1758; сосновой совки Panolis flammea Denis & Schifferm u ller, 1775; липового бражника Mimas tiliae Linnaeus, 1758; винного бражника Deilephila
Таблица 4. Результаты заражения Ch. cunea куколок насекомых
|
Вид насекомого |
Всего куколок, шт. |
Куколки, зараженных паразитоидом, шт. |
Погибшие куколки, шт. |
Имаго хозяина, шт. |
Максимальное число имаго Ch.cunea в одной куколке, шт. (самцы : самки) |
|
Непарный шелкопряд Lymantria dispar |
99 |
0 |
84 |
15 |
– |
|
Лунка серебристая Phalera bucephala |
43 |
19 |
24 |
0 |
875 (1:34) |
|
Листовертки. Сем. Tortricidae |
18 |
12 |
8 |
0 |
24,5 (1:8-1:22) |
|
Сосновый бражник Hyloicus pinastri |
34 |
17 |
16 |
1 |
1070 (1:6,5) |
|
Ванесса черно-рыжая Nymphalis xanthomelas |
10 |
10 |
0 |
0 |
486 – 1114 (1:3,6 – 1:7,5) |
|
Пупарии Diptera |
10 |
3 |
4 |
3 |
4 – 23 (1:4) |
Таким образом, можно утверждать, что Ch. cunea может успешно развиваться не на всех видах насекомых. Так, заражение куколок непарного шелкопряда не привело к развитию в них па-разитоида. Большая часть из них после заражения погибла (85%), 15% куколок завершили свое развитие, и из них вылетели бабочки. В куколках листоверток паразитоид успешно развивался в большинстве случаев. В 50% зараженных куколок соснового бражника произошло развитие эн-томофага, в природе массового заражения куколок этого фитофага ожидать не следует. Такая же тенденция наблюдается и при заражении куколок лунки серебристой – развитие произошло в 44% случаев. В популяциях аборигенных видов вредителей можно ожидать снижения численности на 30–60%, в отличие от заражения паразито-идом куколок АББ в очагах массового размножения, когда эффективность достигает 80–90%. Сходные результаты получены и при заражении пупариев мух – из 10 пупариев развитие произошло лишь в 3-х; 4 пупария погибли.
Кроме приведенных в табл. 4 видов насекомых, были заражены единичные куколки фитофагов отряда Lepidoptera. Предварительные результаты развития паразитоида на них выглядят следующим образом. Энтомофаг развивался в elpenor Linnaeus, 1758; парусника-махаона Papilio machaon Linnaeus, 1758; огневки крапивной-большой Pleuroptya ruralis Scopoli, 1763. Развития не произошло в куколках стрельчатки пси Acronicta psi Linnaeus, 1758; стрельчатки ольховой Acronicta alni Linnaeus, 1758; пяденицы-шелкопряда бурополосой Lycia hirtaria Clerck, 1795; совок сем. Noctuidae.
Наблюдения за поведением паразитоида в лаборатории показали, что при наличии куколок АББ самки заражают именно их, не проявляя интереса к другим куколкам. Внесение Ch. cunea в природные местообитания АББ не приведет к тотальной гибели всех обитающих на тот момент в лесу куколок бабочек и пупариев паразитических мух. Массовые выпуски энтомопаразитоида в очаги АББ позволят снизить численность вредителя при минимальном экологическом риске. Однако такие особенности вида не позволяют ожидать пролонгированной защиты насаждений после выпуска в течение ряда последующих генераций. Энтомопаразитоид не будет развиваться на других видах насекомых при отсутствии АББ, уже в следующем поколении зараженность куколок целевого вредителя единичная. Это подтверждается выводами (устные сообщения) В. В. Костюкова (ВНИИБЗР) и П. А. Мельника (Укр-
НИСКР), которые в течение ряда лет выпускали Ch. cunea в насаждениях Краснодара и Украины, но им не удавалось найти зараженных куколок АББ в последующих поколениях. Это свидетель- ствует о необходимости ежегодного получения данного биологического средства. Поэтому в Китае созданы биолаборатории по производству Ch. сunea.


