Математическая модель образования и движения анионных вакансий при восстановлении металлов в комплексных оксидах
Автор: Гамов Павел Александрович, Дрозин Александр Дмитриевич, Чернобровин Виктор Павлович, Дукмасов Владимир Георгиевич, Чаплыгин Борис Александрович, Пластинин Борис Глебович
Журнал: Вестник Южно-Уральского государственного университета. Серия: Металлургия @vestnik-susu-metallurgy
Рубрика: Физическая химия и физика металлургических систем
Статья в выпуске: 4 т.18, 2018 года.
Бесплатный доступ
Предложено математическое описание процесса образования и движения анионных вакансий при восстановлении металлов в комплексных оксидах с позиции диффузионных и тепловых процессов, протекающих в фазах восстановителя и оксида, а также химических реакций на поверхности раздела фаз. Рассмотрена система, состоящая из сферической частицы руды, находящейся в атмосфере газообразного восстановителя. Частица руды представляет собой гомогенный газонепроницаемый комплексный оксид следующего компонентного состава: O, Fe, Si, Mg. Газовая фаза состоит из двух компонентов - СО и СО2. Поверхность рудной частицы является непроницаемой для компонентов обеих фаз. Восстановитель не может проникать внутрь куска, и все обменные процессы протекают на границе раздела. Для фазы рудной частицы составлены уравнения теплопроводности, а также уравнения диффузии компонентов фазы. Для газовой фазы, окружающей частицу, также составлены уравнения теплопроводности и диффузии реагентов с учетом изменения размеров частицы. Для поверхности раздела получено уравнение теплопередачи, связывающее тепловые потоки из обеих фаз к поверхности раздела с тепловым эффектом химических реакций. Кроме того, получены уравнения массопереноса компонентов рудной фазы, связывающие удаление атомарного кислорода с поверхности раздела с подводом его к поверхности раздела из глубины рудной частицы. Составлены уравнения массопереноса компонентов газовой фазы, связывающие подвод реагентов к поверхности раздела фаз с расходом их на поверхности. Учтено влияние основных физико-химических параметров на скорость образования и движения восстановительных вакансий. Составлена математическая модель.
Восстановление металлов, комплексные руды, моделирование
Короткий адрес: https://sciup.org/147232512
IDR: 147232512 | УДК: 669-1 | DOI: 10.14529/met180402
Текст научной статьи Математическая модель образования и движения анионных вакансий при восстановлении металлов в комплексных оксидах
Интерес к бескоксовым способам извлечения железа постоянно растет, повышается необходимость вовлечения в производство бедных и комплексных руд. Следствием этого явилось большое количество работ, посвященных изучению процесса восстановления железа из различных рудных и нерудных материалов с использованием углеродсодержащих восстановителей разного качества. Однако в результате сложности состава рудного материала картина выделения в нем металла в процессе восстановления сильно отличается от результатов восстановления железа в богатых рудах [1–3]. Для бедных и комплексных руд это, как правило, равномерное выделение частиц металла по всему объему оксидной вмещающей фазы. И хотя такие руды обычно являются плотными материалами с низкой газопроницаемостью, восстановление идет с большой скоростью при относительно невысокой температуре [4–6]. Всё это вызывает серьёзные трудности в объяснении механизма восстановления металлов с использований классических положений.
Один из наиболее активно развивающихся подходов к объяснению процесса восстановления металлов из комплексных оксидных материалов основан на рассмотрении твердофазных процессов, протекающих в несовершенных (дефектных) кристаллах [7, 8]. При нагреве в восстановительных условиях кристаллическая решётка оксида насыщена анионными вакансиями (примесными, обусловленными присутствием примесных катионов пониженного заряда, термическими – парными дефектами Шоттки, и восстановительными). Часть вакансий содержит «лишние» (дефектные) электроны. Генератором таких вакансий является восстановитель, который на поверхности реагирования извлекает из решётки оксида кислород, отдавая ему свои валентные электроны, а ранее локализованные у аниона электроны остаются в решётке оксида, удерживаясь электрическим полем. Таким образом, восстановитель взаимодействует не с молекулой оксида металла, а с анионом кислорода кристаллической решетки, например, по реакциям:
( MgFeSiO 4 ) = ( Mg 2 + ) + ( Fe 2 + ) + ( Si 4 + ) + 4 ( O 2 - ) (1) { CO } + ( O 2 - ) = { CO2 } + ( V a2 - ) (2) ( Fe 2 + ) + ( V a2 - ) = Fe (3) ( Mg 2 + ) + ( Si 4 + ) + 3 ( O 2 - ) = ( MgSiO g ) (4)
( MgFeSiO4 ) + { CO } = Fe + ( MgSiO3 ) + { CO2 } , (5) где Va 2 - - восстановительная вакансия, содержащая два электрона. В круглых скобках указаны компоненты оксидной фазы, в фигурных – газовой, без скобок – металлической фазы.
Если в ближайшем окружении все катионы обладают равным сродством, то при перемещении вакансии электроны легко переходят от одного катиона к другому, сопровождая вакансию от места появления до места её стока. В местах стока таких вакансий и формируются зародыши металлической фазы.
Данный подход позволяет объяснить высокую скорость процесса восстановления, а также появление металлической фазы внутри объёма оксидной, куда доступ восстановителя отсутствует. Однако он в значительной мере является качественным и не позволяет оценить степень влияния различных физикохимических параметров на скорость процесса восстановления.
В данной работе предпринята попытка перейти к количественному описанию, построить математическую модель, способную учитывать не только химические реакции, протекающие на поверхности раздела руда – восстановитель, но и учесть диффузионные потоки в системе.
Обоснование методики
В качестве основы для разработки модели взяты результаты предшествующих работ [9–12].
Рассмотрим систему, состоящую из частицы руды (фаза Ф), находящейся в атмосфере газообразного восстановителя (фаза V ). Поверхность рудной частицы F является непроницаемой для компонентов обеих фаз, следовательно, восстановитель не может проникать внутрь куска, и все обменные процессы протекают на границе раздела.
Считаем частицу сферической. Введём сферическую систему координат с началом в центре частицы (см. рисунок). Всю систему также считаем сферической. Полагая, что начальное распределение параметров состояния системы (концентраций компонентов, скоростей, температуры и других величин) обладает сферической симметрией. Можно
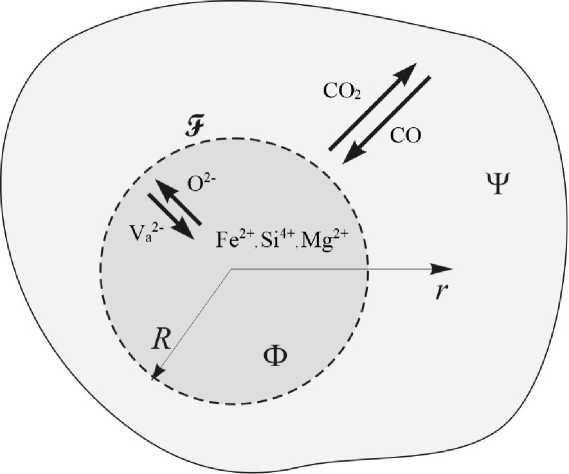
Графическая модель процесса восстановления, протекающего в системе «рудная частица Ф – восстановительная газовая фаза Ψ »
считать, что и в дальнейшем в любой момент времени распределение всех характеризующих систему величин обладает сферической симметрией.
В общем виде химические реакции на поверхности радела фаз можно представить в следующем виде:
« 11 R 1 + - + П 1 m R m = P 1 ,
....................................., (6)
1. В фазе рудной частицы Ф протекают процессы теплопроводности и диффузии:
1) уравнение теплопроводности:
д т = х Ф ХАГ 2 д Т ) д t р Ф c p r 2 д r V д r J ,
n n 1 R 1 + — + n nm R m = P n ,
где R 1 , — , R m - набор компонентов фазы V ;
где T – температура в данной точке; t – время; λ – коэффициент теплопроводности; ρ – плотность; c P - теплоемкость фазы; r ° - расстояние от центра частицы,
2) уравнения диффузии компонентов фа-
P 1 , — , P n - набор компонентов фазы Ф;
n ij ( i = 1, — n ; j = 1, — m ) - стехиометрические коэффициенты реакций. Причем компоненты одной фазы неограниченно растворимы друг в друге и нерастворимы в компонентах другой фазы.
Для примера допустим, что частица руды (фаза Ф) представляет собой гомогенный газонепроницаемый комплексный оксид следующего компонентного состава: O, Fe, Si, Mg. Газовая фаза V состоит из двух компонентов -СО и СО2. При достижении температуры на-
зы Ф :
д c Ф 2
О2
д t
= D Ф 2
О2
1 д r 2 д r
r
V
чала восстановления активизируются реакции
(1)–(5). Ключевой реакцией, отвечающей за массообмен между фазами, является реакция
(2). Для записи этой реакции в виде (6) преобразуем её с учетом ( O 2 - ) = ( O ) + ( V a2 - ) . Тогда
получим [1] { CO } + [1] ( O ) = [1] { CO2 } (в квадратных скобках указаны стехиометрические коэффициенты реакции), или
[ - 1] { CO } + [1] { CO 2 } = [1] ( о ) . (7)
Получена запись вида (6), в которой символом R 1 обозначен CO, R 2 – CO 2 . Продукт реакций (O) обозначен соответственно P 1 . Стехиометрические коэффициенты реакций n ij в случае (7) равны n 11 = - 1, n 12 = 1. И хотя в такой записи отсутствуют прямой учет восстановительных вакансий, их количество обратно пропорционально числу удаленных атомов кислорода из решетки оксида ( O ) . Процессы, описываемые реакциями (1), (3), (4), не связаны с массопереносом между фазами Ф и V и потому не включены в рассмотрение. Тем не менее, фаза Ф помимо аниона О2– содержит катионы Fe2+, Si4+, Mg2+, которые могут участвовать в диффузионных процессах, поэтому их также надо учитывать при составлении математической модели.
Ф д c n . 2 О2 -
дr
,
д c Ф 2+
Fe2+ д t
д c Ф 4+
Si4+ д t
= D Ф
Fe
= D Ф
Si
1 д
-2+ r 2 д r
r 2
V
Г
'4+ r 2 д r
r
V
V
Ф
' F
д r V
Ф д c и I
. 2 Si4 +
д r
V
,
,
где ci – массовая концентрация i -го
компо-
нента; Di o – коэффициент диффузии i -го компонента.
-
2. В фазе Ψ, окружающей частицу, также протекают процессы теплопроводности и диффузии реагентов. Однако вследствие изменения размеров частицы соответствующие уравнения будут несколько сложнее:
-
1) уравнение теплопроводности:
д T XV 1 д Г 2 д Т )
-
= r 2 +
-
д t pV c V r 2 д r V д r J
+
Г пФ ^
TV- 1
V PF J
R 2 dR д Т r 2 dt д r ’
где ρF – плотность на границе частицы; R – радиус частицы.
2) уравнения диффузии компонентов фазы V :
V д c CO
+
д t
(„Ф
V pF
= D v ± А
CO r 2 д r
V r2 ecC»
V д r J
+
—
^
V
R 2 dR д c C i O r 2 dt д r
3. Поверхность раздела фаз:
1) уравнение теплопередачи, связывающее тепловые потоки из фаз Ф и V к поверхности раздела фаз с тепловым эффектом химической реакции (7):
' J [ t, R (t)-0]-x"^- [ t, R (t)- 0]- n
+£ IO AHO = 0, i=1
где I O – мольная скорость удаления кислорода с единицы площади поверхности раздела фаз; A H о - мольная энтальпия реакции (7);
-
2) уравнение массопереноса компонентов фазы Ф , связывающее удаление атомарного кислорода О с поверхности раздела фаз (в соответствие с химическими реакциями (7)) с подводом его к поверхности раздела из глубины рудной частицы:
Р Ф DО’-^с Ф ’ - [ * • R ( t ) - 0 ] +
+[ с0,-( t, R (t))-1] Vo’—1о = 0,(15)
Р Ф D Fe ’ - AF 1 1 ’ R ( t ) — 0 ] +
+ c 0e2+( t, R (t)) Vo’-1 о = 0,(16)
Р Ф D AAS4 t - R ( t ) - 0 ]+
+ с^Д t, R (t)) VO2-1 о = 0,(17)
где νi – молярная масса продукта i , умноженная на его стехиометрический коэффициент, в химической реакции образования продукта i ;
-
3) уравнение массопереноса компонентов фазы " , связывающие подвод реагентов к поверхности раздела фаз с расходом их в соответствие с химической реакцией (7):
р" D'Co |сTo [t,R(t) + 0] + о r L J
V co ) I о = 0, (18)
n
+ ! ( с 'о ( t , R ( t ) ) V o ’
I - —
k = 1
-
4) уравнение химического равновесия химической реакции (7):
-O — a Ф K ( T ) = 0, a CO
-
4. Уравнение изменения размера частицы:
dR dt
= р Ф Vo2 - I о.
5. Граничные условия:
ST
1) ( t ,0) = 0;
d r
(21)
дс Ф
2) -c^- ( t ,0) = 0, i = 1,..., n - 1; d r
(22)
3) - ( t , » ) = - 0 ;
(23)
4) c" ( t , w ) = c 0 " , i = 1,..., m - 1.
(24)
где ai – химическая активность компонента i ; K – константа равновесия химической реак- ции.
Обсуждение результатов
Полученная модель позволяет проводить расчет процесса образования и движения анионных вакансий в объёме комплексного оксида, рассматривая процесс восстановления как взаимодействие восстановителя не с молекулой оксида металла, а с анионом кислорода кристаллической решетки. При этом кислород переходит из решетки оксида (фазы Ф) в газовую фазу Ψ, оставляя после себя восстановительную вакансию, а продукт реакции CO2 удаляется из зоны реакции. Развитие этого процесса приводит к образованию потока восстановительных вакансий, который направлен от поверхности рудной частицы в её объем. В противоположном направлении происходит движение анионов кислорода. В предложенной модели химическая реакция на поверхности раздела фаз описывается уравнением (7). А движение восстановительных вакансий рассматривается как процесс уменьшение концентрации анионов кислорода O2– в объеме фазы Ф. Таким образом, зная изменение концентрации кислорода в любой точке рудной частицы в произвольный момент времени, можно судить о количестве восстановительных вакансий в данной части объема и во всей частице в целом. Процесс восстановления завершится, когда количество анионов кислорода фазы Ф уменьшится на значение, пропорциональное содержанию восстанавливаемого металла, в данном случае Fe.
Необходимо отметить, что данная модель не рассматривает аннигиляцию восстановительных вакансий с образованием металлической фазы, тем не менее из результатов экспериментов [13–15] можно сделать вывод о том, что выделение металлической фазы идет с минимальными энергетическими затратами и в тех частях объема рудных частиц, где происходит скопление восстановительных вакансий.
Заключение
Разработана математическая модель процесса образования и движения анионных вакансий в объёме комплексного оксида, позволяющая учитывать влияние основных физикохимических параметров на скорость появления и перемещения восстановительных вакансий, и, как следствие, на скорость процесса восстановления.
Список литературы Математическая модель образования и движения анионных вакансий при восстановлении металлов в комплексных оксидах
- Effect of Alumina on the Gaseous Reduction of Magnetite in CO/CO2 Gas Mixtures/Y.E. Kapelyushin, X. Xing, J. Zhang et al.//Metallurgical and Materials Transactions B. -2015. -Vol. 46, no. 3. -P. 1175-1185. DOI: 10.1007/s11663-015-0316-z
- In-Situ Study of Gaseous Reduction of Magnetite Doped with Alumina Using High-Temperature XRD Analysis/Y.E. Kapelyushin, Y. Sasaki, J. Zhang et al.//Metallurgical and Materials Transactions B. -2015. -Vol. 46, no. 6. -P. 2564-2572. DOI: 10.1007/s11663-015-0437-4
- Effects of Temperature and Gas Composition on Reduction and Swelling of Magnetite Concentrates/Y.E. Kapelyushin, Y. Sasaki, J. Zhang et al.//Metallurgical and Materials Transactions B. -2016. -Vol. 47, no. 4. -P. 2263-2278. DOI: 10.1007/s11663-016-0719-5
- Рощин, В.Е. Твердофазное предвосстановление железа -основа безотходных технологий переработки комплексных руд и техногенных отходов/В.Е. Рощин, С.П. Салихов, А.Д. Поволоцкий//Вестник ЮУрГУ. Серия «Металлургия». -2016. -Т. 16, № 4. -С. 78-86. DOI: 10.14529/met160408
- Role of a silicate phase in the reduction of iron and chromium and their oxidation with carbide formation during the manufacture of carbon ferrochrome/V.E. Roshchin, A.V. Roshchin, K.T. Akhmetov, S.P. Salikhov//Russian Metallurgy (Metally). -2016. -Vol. 2016, no. 11. -P. 1092-1099. DOI: 10.1134/S0036029516090123
- Formation of a Network Structure in the Gaseous Reduction of Magnetite Doped with Alumina/Y.E. Kapelyushin, Y. Sasaki, J. Zhang et al.//Metallurgical and Materials Transactions B. -2017. -Vol. 48, no. 2. -P. 889-899.
- DOI: 10.1007/s11663-016-0897-1
- Salikhov, S.P. Theoretical Aspects of Pyrometallurgical Processing of Sideroplesite Ore/S.P. Salikhov, A.V. Roshchin, V.E. Roshchin//Chernye Metally. -2018. -No. 8. -P. 13-18.
- Рощин, В.Е. Физика процессов окисления и восстановления металлов в твердой фазе/В.Е. Рощин, А.В. Рощин//Металлы. -2015. -№ 3. -С. 19-25.
- Дрозин, А.Д. Рост микрочастиц продуктов химических реакций в жидком растворе/А.Д. Дрозин. -Челябинск: Изд-во ЮУрГУ, 2007. -57 с.
- Model for nanocrystal growth in an amorphous alloy/P.A. Gamov, A.D. Drozin, M.V. Dudorov, V.E. Roshchin//Russian Metallurgy (Metally). -2012. -Vol. 2012, no. 11. -P. 1002-1005.
- DOI: 10.1134/S0036029512110055
- Yaparova, N.M. Method for internal heat source identification in a rod based on indirect temperature measurements/N.M. Yaparova, A.D. Drozin//Ural Conference on Measurements (UralCon), 2017 2nd International. -IEEE, 2017. -P. 93-98.
- DOI: 10.1109/URALCON.2017.8120693
- Drozin, A.D. Calculating of the True Sizes and the Numbers of Spherical Inclusions in Metal/A.D. Drozin//Metallography, Microstructure, and Analysis. -2017. -Vol. 6, no. 3. -P. 240-246.
- DOI: 10.1007/s13632-017-0354-9
- Рощин, В.Е. Физическая интерпретация теории восстановления/окисления металлов/В.Е. Рощин, А.В. Рощин//Вестник ЮУрГУ. Серия «Металлургия». -2016. -Т. 16, № 4. -С. 29-39.
- DOI: 10.14529/met160404
- Рощин, А.В. Трансформация ионной химической связи в металлическую при восстановлении металлов/А.В. Рощин, В.Е. Рощин, С.П. Салихов//ХХ Менделеевский съезд по общей и прикладной химии. -2016. -С. 109-109.
- Bilgenov, A.S. Statistical Analysis of Metal Particles Forming during Reduction of Oxides with Low Iron Content/A.S. Bilgenov, Y. Kapelyushin, P.A. Gamov//Solid State Phenomena. -2018. -Vol. 284. -P. 673-678.
- DOI: 10.4028/www.scientific.net/SSP.284.673


