Математическая модель процесса нейтрального выщелачивания и сгущения в производстве цинка
Автор: Дюнова Диана Николаевна
Журнал: Вестник Южно-Уральского государственного университета. Серия: Металлургия @vestnik-susu-metallurgy
Статья в выпуске: 1 т.13, 2013 года.
Бесплатный доступ
Рассматривается математическая модель процесса нейтрального выщелачивания и сгущения, основу которой составляют уравнения материального баланса. Разработана топологическая модель исследуемого объекта. Полученная модель, позволяющая определять расходы выходных материальных потоков процесса и их состав, реализована в вычислительной среде Simulink.
Математическая модель, процесс выщелачивания, материальный баланс
Короткий адрес: https://sciup.org/147156805
IDR: 147156805 | УДК: 66.01.001.57
Текст научной статьи Математическая модель процесса нейтрального выщелачивания и сгущения в производстве цинка
Выщелачивание продуктов обжига – основной технологический передел производства цинка гидрометаллургическим способом, который в значительной мере определяет технико-экономические показатели производства в целом, в первую очередь извлечение металла, расход электроэнергии, себестоимость цинка [1].
Цель процесса выщелачивания – более полное извлечение цинка и других полезных компонентов сырья в раствор при минимальном его загрязнении примесями.
Исходным сырьем является огарок, получаемый в результате окислительного обжига цинкового сульфидного материала. Выщелачивание представляет собой процесс растворения цинкового огарка в жидком растворителе. На практике процесс осуществляют отработанным электролитом, получаемым в процессе электролиза раствора сульфата цинка. При выщелачивании в раствор переходят цинк, кадмий, медь, железо и другие компоненты. Нерастворимые в слабых растворах серной кислоты соединения остаются в твердом остатке от выщелачивания – кеке.
При непрерывном способе производства цинка выщелачивание включает две ступени. Задача первой стадии выщелачивания – получение раствора, пригодного для очистки растворов от примесей железа, алюминия, мышьяка, сурьмы, крем-некислоты методом гидролиза, что можно провести лишь в нейтральной среде (рН = 5,2–5,4).
Цинк содержится в огарке в виде соединений: ZnO, ZnSO4, ZnS, ZnO·Fe2O3, 2ZnO·SiO2. Оксид цинка растворяется в растворе серной кислоты. Сульфат цинка хорошо растворяется в воде, поэтому цинк, содержащийся в сульфатной форме, полностью переходит в раствор на нейтральной стадии выщелачивания. Феррит и сульфид цинка в разбавленных растворах серной кислоты практически нерастворимы и переходят в твердый остаток. Наиболее легко растворяется оксид меди с образованием сульфата меди. Ферриты и сульфиды меди переходят в кек. Кадмий присутствует в обожженном концентрате в виде СdО, CdSO4, CdS, СdO·Fe2O3. Хорошо растворяется оксид кадмия с образованием сульфата. Ферриты и сульфиды кадмия переходят в твердый остаток. Свинец при сернокислотном выщелачивании практически весь переходит в кек в виде труднорастворимого сульфата PbSO4. Присутствующий в огарке оксид железа FeO легко взаимодействует со слабой серной кислотой; трехвалентное соединение Fe2O3 практически не растворимо. При выщелачивании обожженного концентрата получается нейтральная пульпа (смесь сульфатного раствора и нерастворимого остатка) с содержанием твердого 20–70 г/л. Для проведения последующих технологических операций ее подвергают разделению на твердую и жидкую фазы путем сгущения и отстаивания. Здесь протекают довольно сложные физикохимические процессы, которые внешне проявляются в осаждении твердых частиц в жидкой среде. После отстаивания получается верхний слив с содержанием твердого 1– 4 г/л и сгущенная пульпа с определенным отношением масс жидкой и твердой фаз (ж :т) = (2–3) : 1.
Рассматривая процессы нейтрального выщелачивания и сгущения как единый объект, выделим основные группы его параметров. Входными параметрами являются расход потока огарка, верхнего слива кислых сгустителей (ВСКС) и поток отработанного электролита (ОЭ). Продукты передела – верхний слив нейтральных сгустителей (ВСНС), нижний слив нейтральных сгустителей (НСНС), содержащий твердую фазу НСНС т и жидкую фазу НСНСж.
С целью исследования процесса нейтрального выщелачивания цинковых огарков и изучения его характеристик интерес представляет получение математической модели, позволяющей определять количество получаемых продуктов рассматриваемого производственного передела на основе информации о количестве поступающих на переработку материальных потоков и их химических составах.
Математическую модель выщелачивания и сгущения представим в виде совокупности балансовых соотношений по твердой и жидкой фазам, а также по компонентам, переходящим в раствор и образующим «цинковый» кек.
Баланс по твердой фазе определяется соотношением:
F НСНСт = F 1 ( C ZnO (1 - a 1 ) + C 2ZnOSiO2(1 -a 1 ) +
+ C ZnS + C ZnO . Fe 2 O 3 + C CuS + C CuS . Fe2O3 + C PbO +
+ C PbSO4 + C CdS + C CdO . Fe2O3 + C SiO2 +
+ C ^3 + C Пр ), (1)
где FНСНС – расход твердой фазы нижнего слива нейтральных сгустителей, кг/ч; F1 – расход огарка, кг/ч; C1ZnO – содержание в огарке оксида цинка, %; C2ZnO.siO2 — содержание силиката цинка в огарке, %; C1ZnS – содержание в огарке сульфида цинка, %; CZnO.Fe2O3 — содержание в огарке феррита цинка, %; CC1 uS – содержание в огарке сульфида меди, %; СcuO.Fe2O3 — содержание феррита меди в огарке, %; C1PbO – содержание оксида свинца в огарке, %; CP1bSO – содержание сульфата свинца в огарке, %; C1Fe O – содержание в огарке оксида железа (III), %; Cп1р – содержание прочих компонентов в огарке, %; α1 – доля оксида цинка, пере- шедшего в раствор.
Баланс по жидкой фазе:
Q ВСНС р ВСНС = Q ВСКС р ВСКС + F 1 + Q O3 р O3 -
FНСНСт бнСНСж рНСНСж,
6нСНС„ рНСНС„ = FНСНСT а2, жжт где QВСНС — расход ВСНС, м3/ч; рВСНС - плотность ВСНС, кг/м3; QВСКС – расход ВСКС, м3/ч; рВСКС — плотность ВСКС, кг/м3; F1 - расход цинкового огарка, кг/ч; QО3 - расход ОЭ, м3/ч; рО3 -плотность ОЭ, кг/м3; Q – расход жидкой ж фазы НСНС, м3/ч; рнснс - плотность жидкой ж фазы НСНС, кг/м3; а2 - величина ж: т в НСНС.
Балансовое соотношения по цинку в растворах:
ВСНС ВСКС
( Q ВСНС + Q НСНС™ ) С Zn = Q ВСКС С Zn +
ж
+ Q O3 С Zn3 + [а 1 F 1 ( C ZnO z1 + C 2ZnO . SiO2 z 2 ) +
+ F 1 C ZnSO4 z 3 ] , (4)
где С Z В n СНС – концентрация цинка в ВСНС, г/л;
ВСКС ОЭ
С Zn – концентрация цинка в ВСКС, г/л; С Zn – концентрация цинка в ОЭ, г/л; z 1 , z 2 , z 3 – стехиометрические коэффициенты пересчета; C 1 ZnSO – концентрация сульфата цинка в огарке, %.
Балансовое соотношение по меди в растворе:
ВСНС ВСКС
( Q ВСНС + Q НСНС„ ) С Си = Q ВСКС С Cu +
ж
+ F 1 ( C CuO z 4 + C CuSO4 z 5 ) ] , (5)
где С C В u СНС – концентрация меди в ВСНС, г/л; С C В u СКС – концентрация меди в ВСКС, г/л; z 4 , z 5 – стехиометрические коэффициенты пересчета; C 1 CuSO – концентрация сульфата меди в огарке, %;
C 1 CuO – концентрация оксида меди в огарке, %.
Балансовое соотношение по кадмию в растворе:
( QВ СНС + Q НСНС Ж ) ССВСНС
ВСКС
= Q ВСКС С Cd
+
+ F 1 C CdO z 6 + C CdSO4 z 7 , (6) где С C В d СНС – концентрация кадмия в ВСНС, г/л; С C В d СКС – концентрация кадмия в ВСКС, г/л;
z 6 , z 7 – стехиометрические коэффициенты пересчета; C C 1 dSO – концентрация сульфата кадмия в огарке, %; C 1 CdO – содержание оксида кадмия в огарке, %.
Баланс по компонентам, образующим твердую фазу НСНС:
|
F НСНСт |
НСНСт С ZnO = |
(1 — « 1 ) F 1 C ZnO , |
(7) |
|
F НСНСт |
НСНСт С 2ZnO . SiO 2 |
= (1 - а 1 ) F1 C 2ZnO . SiO 2 , |
(8) |
|
F НСНСт |
НСНСт С ZnS = |
F 1 C Z 1 nS , |
(9) |
|
F НСНСт |
С НСНСт ZnO . Fe 2 O 3 |
= F 1 C ZnO . Fe2O3 , |
(10) |
|
F НСНСт |
НСНСт С CuS = |
F 1 C C1uS , |
(11) |
|
F НСНСт |
НСНСт С CuO . Fe 2 O 3 |
= F1 C CuO . Fe2O3 , |
(12) |
|
F НСНСт |
НСНСт С PbSO 4 = |
F 1 ( C PbSO4 + C PbO z 8 ) , |
(13) |
|
F НСНСт |
НСНСт С CdS = |
F 1 C C1dS , |
(14) |
|
F НСНСт |
НСНСт С CdO . Fe 2 O 3 |
= F1 C CdOTe2O3 , |
(15) |
|
F НСНСт |
НСНСт С SiO 2 = |
F 1 C S 1 iO2 , |
(16) |
|
F НСНСт |
НСНСт С Fe 2 O 3 = |
F 1 C F1e2O3 , |
(17) |
|
F НСНСт |
НСНСт С пр = |
F 1 C п1р , |
(18) |
НСНС где СZnO т – содержание оксида цинка в твердой фазе НСНС, %; СНСНСт – содержание силиката 2ZnO.SiO2
цинка в твердой фазе НСНС, %; С Z Н n С S НСт – содержание сульфида цинка в твердой фазе НСНС, %;
НСНС
СZпO.FeT2Oз - содержание феррита цинка в твердой фазе НСНС, %; СPНbСSНOСт – содержание сульфата свинца в твердой фазе НСНС, %; СCНdСSНСт – содержание сульфида кадмия в твердой фазе НСНС, %; СCНdСOНFСeт O – содержание феррита кадмия в твер- дой фазе НСНС, %; СSНiOСНСт – содержание кремнезема в твердой фазе НСНС, %; СFНeСOНСт – содержание оксида железа (III) в твердой фазе НСНС, %; НСНС
С пр т – содержание прочих компонентов в твер-
С CuO z 4 + С CuSO4 z 5 ,
Q BCHC + Q HCHC ж
b 15 =
ВСКС С Cd
Q BCHC + Q HCHC„
ж
дой фазе НСНС, %; z 8 – стехиометрический коэффициент пересчета.
Система соотношений (1) – (18) представляет математическую модель нейтрального выщелачивания и сгущения нейтральных пульп. Особенности модели позволяют перейти к ее топологическому аналогу. На рис. 1 представлен сигнальный граф объекта, отражающий причинно-следственные связи между переменными (сигналами). Вершины сигнального графа соответствуют переменным модели, а ветви – коэффициентам или передаточным функциям, характеризующим связь между переменными.
Коэффициентам передач графа соответствуют соотношения:
b1 = C ZnO a 1 + C 2ZnOSiO 2 a 1 + C ZnS + С ZnO - Fe2O3 +
С CdO z 6 + С CdSO4 z 7 b 16 =-------------4— ;
Q BCHC + Q HCHC. ж
+ C CuS + C CuS - Fe2O3 + C PbO + C PbSO4 + C CdS +
+ C CdO - Fe2O3 + C SiO2 + C Fe2O3 + C 1р ;
b 2 a 2 ; b 3 = Р ВСКС ; b 4 = ——
Piiciic, Р вснс Р вснс
ж
b 5 = _Р оЭ_ ; b 6 =--—; b 7 = - Р нСНС ж ;
Р вснс Р вснс Р вснс
ВСКС ОЭ b 8 =----С”-------; b 9 =-----CZn------
QВСНС + QНСНС QВСНС + QHCHC„ жж
b 10 =
a 1 C ZnO z1
b 12 =
Q BCHC + Q HCHC„ ж
C 1ZnSO4 z 3
a 1 C 2ZnOSiO2 z 2 b 11 =---------------- 2-----;
Q BCHC + Q HCHC.,. ж
b 13 =
ВСКС С Cu
b 17 = (1- a 1 ) С ZnO . b 18 = (1 a 1 ) С 2ZnOSiO 2 .
F НСНСт F НСНСт
-
b 19 = ( ZnS ; b 20 = ZnO ' Fe2O 3 ;
F НСНСт F НСНСт
11 b 21 = -C Cu^ ; b 22 = h CuOIeA ;
F НСНСт F НСНСт
С PbO + С PbSO4 z 8
-
b 23 =-----------4— ;
F НСНСт
F НСНСт F НСНСт
11 1
-
b 26 = SiO 2 ; b 27 = Fe 2 O3 ; b 28 =--- пр— .
F НСНСт F НСНСт F НСНСт
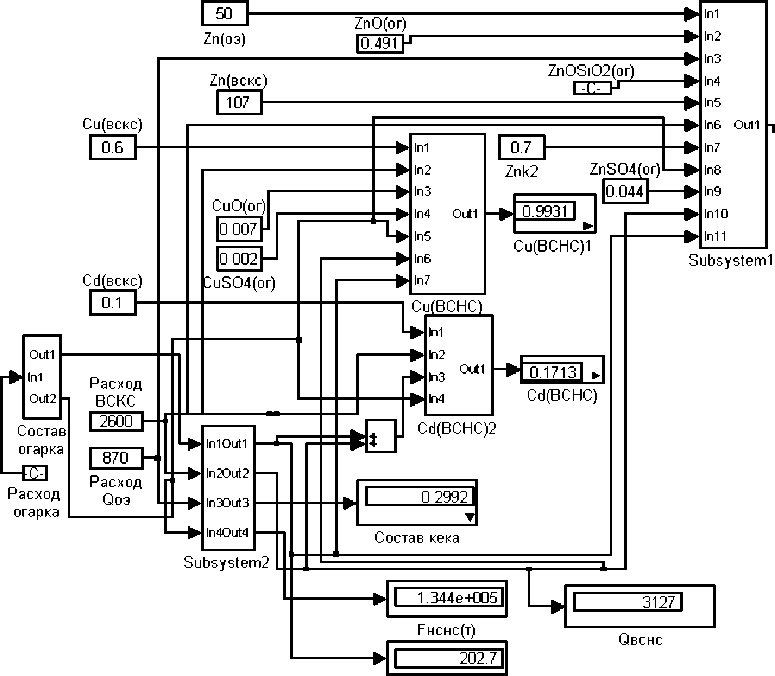
Решение сигнального графа может быть найдено с помощью операций эквивалентного последовательного преобразования [2]. Топологическая модель объекта была реализована в приложении Simulink вычислительной среды MATLAB (рис. 2).
При проведении вычислительного эксперимента полагалось, что в выщелачивательный цех подается обожженный цинковый концентрат в количестве 3,79 т/ч следующего состава, %: ZnO – 49,079; ZnSO 4 – 13,29; 2ZnO·SiO 2 – 4,42; ZnS – 0,76; ZnO·Fe 2 O 3 – 19,56; CuO – 0,69; CuSO 4 – 0,20; CuS – 0,119; CuO·Fe 2 O 3 – 0,30; CdO – 0,125; CdSO 4 – 0,034; CdS – 0,035; CdO·Fe 2 O 3 – 0,07;
Q BCHC + Q HCHC,,
ж
Q BCHC + Q HCHC ж
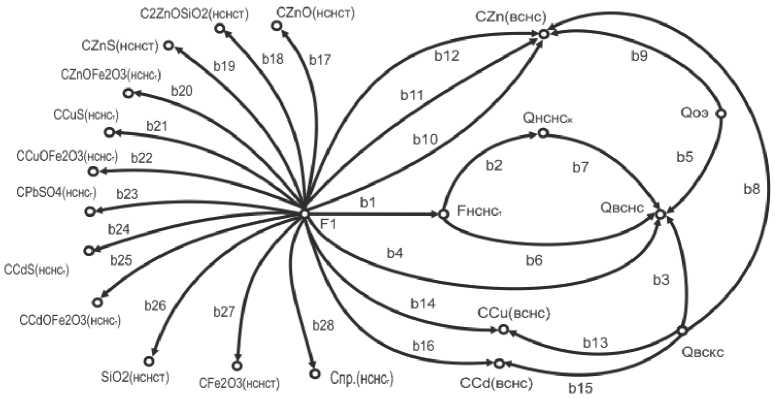
Рис. 1. Сигнальный граф процесса нейтрального выщелачивания и сгущения
Онснс(ж)
Рис. 2. Simulink-модель процесса нейтрального выщелачивания и сгущения

Zn(BCHC)
PbSO 4 – 1,14; PbO – 0,85; FeO – 0,87; Fe 2 O 3 – 0,568; SiO 2 – 1,97; прочие – 5,99.
Для взаимодействия с огарком поступает ВСКС в количестве 118 м3/ч, содержащий: Zn – 107 г/л; Cu – 0,6 г/л; Cd – 0,1 г/л; H 2 SO 4 – 1,5 г/л и отработанный электролит в количестве 36 м3/ч, содержащий: Zn – 50 г/л; H 2 SO 4 – 0,1 г/л. Значения α 1 , α 2 и плотности соответствующих веществ являются исходными данными для расчета, полученными по данным практики работы цинкового производства.
В результате расчета получено: расход ВСНС – 141,6 м3/ч; расход НСНСж – 2,74 м3/ч; расход
НСНСт – 1822 кг/ч. ВСНС содержит: Zn – 108 г/л; Cu – 0,7 г/л; Cd –0,1 г/л. Состав НСНС т , %: ZnO – 29,92; 2ZnO·SiO 2 – 2,82; ZnS – 1,4; ZnO·Fe 2 O 3 – 39,61; CuS – 0,603; CuO·Fe 2 O 3 – 0,203; CdS – 1,016; CdO·Fe 2 O 3 – 2,031; PbSO 4 – 1,62; Fe 2 O 3 – 1,625; SiO 2 – 1,016, прочие – 14,22.
Полученная математическая модель позволяет получить статические характеристики объекта моделирования в виде зависимостей Q ВСНС( Q ВСКС), C Zn(ВСНС) ( Q ВСКС ), Q ВСНС ( Q ОЭ ), C Zn(ВСНС) ( Q ОЭ ) (рис. 3–6).
Таким образом, разработанное математическое описание процесса нейтрального выщелачи-
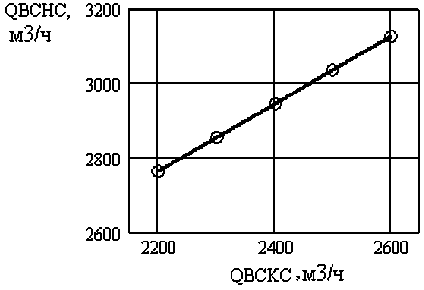
Рис. 3. Статическая характеристика Q ВСНС ( Q ВСКС )
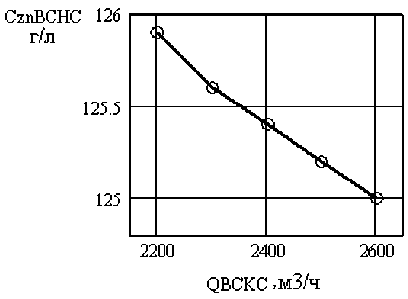
Рис. 4. Статическая характеристика C Zn(ВСНС) ( Q ВСКС )
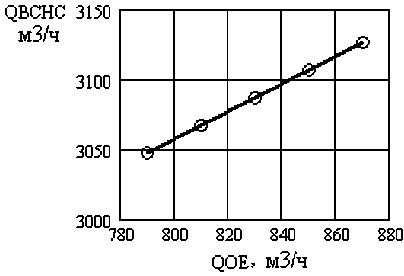
Рис. 5. Статическая характеристика Q ВСНС ( Q ВСКС )
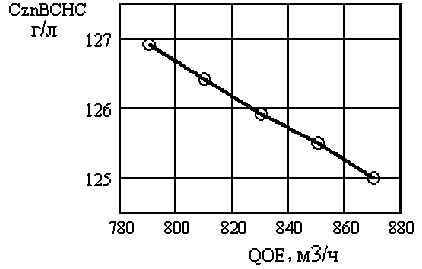
Рис. 6. Статическая характеристика C Zn(ВСНС) ( Q ВСКС )
вания и сгущения позволяет прогнозировать количественные значения массовых расходов выходных материальных потоков ВСНС, НСНСт, НСНСж, а также их компонентов на основе измерительной информации о массовых расходах входных потоков. Математическая модель может быть использована при проектировании новых и анализе функционирования действующих гидрометаллургических систем, а также для решения вопросов по установлению расходных норм по сырью, технологическим показателям и определе- нию неучтенных потерь компонентов сырья в условиях промышленной эксплуатации.
Список литературы Математическая модель процесса нейтрального выщелачивания и сгущения в производстве цинка
- Снурников, А.П. Гидрометаллургия цинка: учеб. пособие/А. П. Снурников. -М.: Металлургия, 1981 -382 с.
- Кафаров, В.В. Принципы математического моделирования химико-технологических систем: учеб. пособие/В.В. Кафаров, В.Л. Перов, В.П. Мешалкин. -М.: Химия, 1974 -343 с.


