Математическая модель расчета стандартной энтальпии образования сложных (небинарных) родственных неорганических соединений
Автор: Рябухин Александр Григорьевич, Груба Оксана Николаевна
Журнал: Вестник Южно-Уральского государственного университета. Серия: Химия @vestnik-susu-chemistry
Рубрика: Химия конденсированного состояния
Статья в выпуске: 11 (187), 2010 года.
Бесплатный доступ
На примерах стандартных энтальпий образования карбонатов щелочных и щелочноземельных металлов показана адекватность модели справочным данным. Зависимость удельной энтальпии образования сложных соединений от удельной ядерной зарядности внешнего катиона является линейной.
Энтальпия образования, карбонаты, щелочные и щелочноземельные металлы, заряд
Короткий адрес: https://sciup.org/147160166
IDR: 147160166 | УДК: 548.3+544.971
Текст краткого сообщения Математическая модель расчета стандартной энтальпии образования сложных (небинарных) родственных неорганических соединений
В работах [1,2] предложена модель расчета и согласования стандартной энтальпии образования (СЭО) бинарных неорганических соединений. Однако в расчетах не учтены возможные фазовые переходы внутри системы (например, оксиды, нитриды, карбиды и т. п. многовалентных металлов). Этот недостаток устранен расчетами на примере многочисленных оксидов титана (дальтонидов и бертоллидов) [3]. В расчетные уравнения были введены коэффициенты, содержащие структурные характеристики. Улучшенная модель подтверждена адекватностью справочным данным на примерах силицидов хрома [4] и оксидов кремния [5].
В основе исходной и улучшенной моделей лежит идея о том, что на каждый ядерный заряд приходится одинаковая доля энтальпии образования данного соединения.
-А .Я
Зависимость удельной СЭО h = —-— является линейной функцией
Sz h = a-¥kHz. (1)
Здесь величина Xz равна сумме ядерных зарядов (порядковых номеров элементов) с учетом состава карбида. В отличие от исходной, в улучшенной модели константы а и к линейной зависимости (1) являются функциями структурных постоянных в пределах каждой области квазиравно-весных твердых растворов.
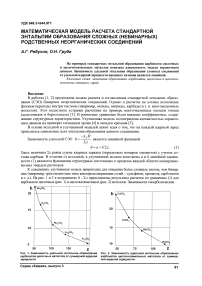
К сожалению, улучшенная модель непригодна для описания более сложных систем, чем бинарные (например, трехэлементные типа кислородсодержащих солей - сульфатов, хроматов, карбонатов и т. д.). На рис. 1 и 2 в координатах h-lLz представлены результаты расчетов по уравнению (1) для карбонатов щелочных (рис. 1) и щелочноземельных (рис. 2) металлов. Зависимости гиперболические.
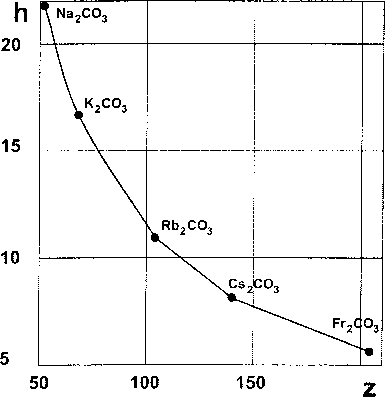
Рис. 1. Зависимость удельной энтальпии образования Рис. 2. Зависимость удельной энтальпии образования карбонатов щелочных металлов от суммарной ядерной карбонатов щелочноземельных металлов от суммар-зарядности ной ядерной зарядности
Химия конденсированного состояния
Таким образом, возникла необходимость создания математической модели расчета, согласования и предсказания СЭО многоэлементных соединений.
Математическая модель и ее проверка
Прежде чем анализировать имеющиеся сведения, необходимо изложить следующее.
-
1. Между любыми частицами (атомы, молекулы, их ассоциации, ионы) осуществляется электромагнитное взаимодействие, приводящее к определенному пространственному расположению этих частиц, т. е. к формированию конкретной сингонии.
-
2. В результате внешнего воздействия изменяется электромагнитное взаимодействие между частицами, что приводит к изменению кристаллической структуры.
-
3. При метаморфозе кристаллических структур в квазикубическую структурная постоянная включает в себя «память» об исходной структуре.
-
4. В пределах одной структуры и неизменных внешних условиях (стандартных) стандартная энтальпия образования является линейной функцией ядерного заряда.
-
5. Сложные вещества (например, соли кислородсодержащих кислот) можно разделить на внутреннюю и внешнюю сферы. Как это принято при анализе комплексных соединений.
Необходимые данные и результаты расчетов приведены в табл. 1 и 2.
Карбонаты щелочных и щелочноземельных металлов выбраны по следующим признакам.
Во-первых, карбонаты щелочных металлов кристаллизуются в одной структуре (моноклинная сингония, структура CaTiO3, F2i/m-4). Карбонаты щелочноземельных металлов также кристаллизуются в одной структуре (орторомбическая сингония, структура KNO3, Pmam-4).
Во-вторых, структуры этих карбонатов принципиально различны.
В-третьих, во внешние сферы входят катионы различных зарядностей: однозарядные ионы щелочных металлов и двухзарядные ионы щелочноземельных металлов.
Из рис. 1 и 2 следует, что для карбонатов щелочных и щелочноземельных металлов зависимости удельной СЭО от суммарного заряда нелинейны, то есть уже не могут быть описаны уравнениями моделей [1] и [3].
СЭО выражается в удельных единицах, логичным было предположить, что и аргумент должен быть выражен в удельных единицах. В качестве такого аргумента примем z3 = —— отно-шение ядерного заряда металла наружной сферы к полному (суммарному) ядерному заряду соединения. При этом прежний вид уравнения зависимости СЭО от ядерного заряда сохраняется:
h = а + к z3 = h^ + к z3. (2)
В полученном уравнении коэффициент к - это комбинация координационного числа, структурных постоянных: исходной и квазикубической, умноженных на 1 кДж/I яд. заряд [3]:
Величина а = h^ (начало отсчета) рассчитывается по формуле аналогичного вида, но с другими значениями структурных постоянных /.
Карбонаты щелочных металлов
Карбонаты щелочных металлов кристаллизуются в моноклинной сингонии, поэтому постоянные уравнения (2) к и а должны содержать структурные постоянные от исходной моноклинной Хюно и квазикубической^; координационное число в квазикубе кч = 6. Во внешнюю сферу карбонатов щелочных металлов М2СО3 входят два катиона, поэтому ядерный заряд металла наруж-нои сферы нужно удвоить: z3 = —— .
Hz
=кч Vmohoi Vkki = 6-|.^.^= = 37,71236.(4)
к = кч • /MZOHO2 ■ /KZK2 = 6 • ЗТЗ ■ 1 = 37,63386.(5)
2(V2-1)
После подстановки значений коэффициентов /z0 и к в расчетное уравнение модели, получим: /z = /?0+^z3 =37,71236 + 37,63386^-.(6)
z
Рябухин А.Г., Груба О.Н.
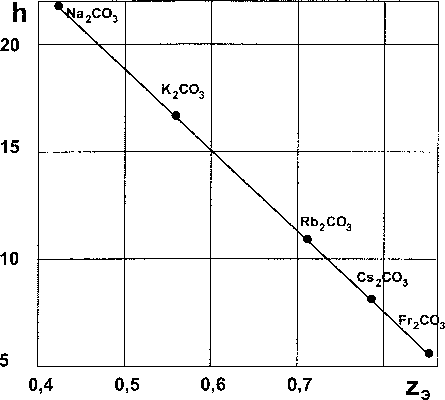
Рис. 3. Зависимость удельной энтальпии образования карбонатов щелочных металлов от удельной ядерной зарядности
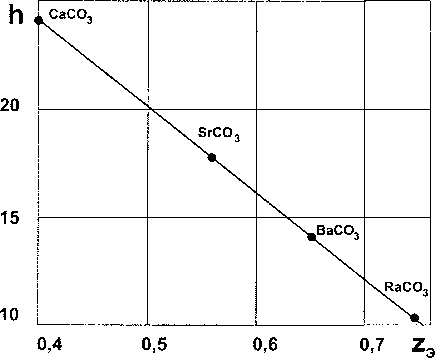
Рис. 4. Зависимость удельной энтальпии образования карбонатов щелочноземельных металлов от удельной ядерной зарядности
Таблица 1
Зависимость СЭО карбонатов щелочных металлов от их ядерных зарядов
|
№ п/п |
Карбонат |
[6-8] |
Sz |
2 z Z3 =--~ Ez |
-А .Я h =—f— Z3 |
К ур. (6) |
-A^° = /z-z3 |
|
1 |
2 |
3 |
4 |
5 |
6 |
7 |
|
|
1 |
Na2CO3 |
1133,0± |
52 |
0,42308 |
21,78846 |
21,79023 |
1133,092 |
|
2 |
К2СО3 |
1135,1± |
68 |
0,55882 |
16,64265 |
16,68181 |
1134,363 |
|
3 |
Rb2CO3 |
1137,2± |
104 |
0,71154 |
10,93462 |
10,93436 |
1137,173 |
|
4 |
CS2CO3 |
1140,0± |
140 |
0,78571 |
8,14286 |
8,14306 |
1140,028 |
|
5 |
ЕггСОз |
— |
204 |
0,85294 |
— |
5,61294 |
1145,040 |
Таблица 2 Зависимость СЭО карбонатов щелочноземельных металлов от их ядерных зарядов
|
№ п/п |
Карбонат |
~^fH°, [6-8] |
Ez |
Z3=^ 3 Ez |
-\fH h =—j— Z3 |
h, yp- (9) |
|
|
1 |
2 |
3 |
4 |
5 |
6 |
7 |
|
|
1 |
СаСО3 |
1205,0± |
50 |
0,4 |
24,10000 |
24,09420 |
1204,710 |
|
2 |
SrCO3 |
1209,0± |
68 |
0,55882 |
17,77941 |
17,77880 |
1208,958 |
|
3 |
ВаСОз |
1212,4± |
86 |
0,65116 |
14,09767 |
14,10694 |
1213,197 |
|
4 |
КаСОз |
1222,2± |
118 |
0,74576 |
10,35763 |
10,34522 |
1220,736 |
Результаты расчетов по ур. (6), представлены в табл. 1 и на рис. 3.
Сравнение экспериментальных данных и результатов расчета (колонки 2 и 7 табл. 1) указывает на их хорошее согласие, а рис. 3 - на линейную зависимость удельной СЭО от удельной величины ядерного заряда в соответствии с ур. (6).
Карбонаты щелочноземельных металлов
Карбонаты щелочноземельных металлов кристаллизуются в орторомбической сингонии (некоторые могут кристаллизоваться и в других сингониях), поэтому коэффициенты уравнения (2) Ло и к в качестве сомножителей должны содержать структурные постоянные орторомбической ^р и квазикубической^ структур.
=кч-ЛРгЛк1 =6-1.4 = 40,0. (7)
Химия конденсированного состояния________________________
£ = кч^ор2^к2=6-8-2(72-1) = 39,76451. (8)
Подставим полученные коэффициенты в расчетное ур. (2):
h = + kz3 = 40,0 + 39,76451 — . (9)
z
Результаты расчетов по ур. (9) представлены в табл. 2 и на рис. 4.
Из сравнения экспериментальных (справочных) данных (колонка 2) и расчетных величин (колонка 7) следует их хорошее согласие. Рис. 4 иллюстрирует линейную зависимость удельной СЭО от удельной величины ядерного заряда рассмотренных карбонатов.
Заключение
-
1. Разработана математическая модель расчета стандартных энтальпий образования сложных неорганических соединений, содержащих три химических элемента.
-
2. Адекватность расчетов справочным данным показана на примерах карбонатов щелочных металлов (кристаллизуются преимущественно в моноклинной сингонии, структура СаТЮ3, F2i/m-4) и щелочноземельных металлов (кристаллизуются в орторомбической сингонии, структура KNO3, Pmam-4).
-
3. Предсказана стандартная энтальпия образования карбоната франция, составившая A jH° (Гг2СО3,к) = 1145,040 кДж-моль”1 и уточнена величина СЭО для кристаллического карбоната радия RaCO3.
Список литературы Математическая модель расчета стандартной энтальпии образования сложных (небинарных) родственных неорганических соединений
- Моисеев, Г.К. О возможности согласования стандартных энтальпий образования (СЭО) родственных, бинарных и квазибинарных неорганических систем/Г.К. Моисеев, Н.А. Ватолин//Доклады РАН. -1999. -Т. 2; 367/2. -С. 208-214.
- Ватолин, Н.А. Термодинамическое моделирование в высокотемпературных неорганических системах/Н.А. Ватолин, Г.К. Моисеев, Б.Г. Трусов. -М.: Металлургия, 1994. -352 с.
- Рябухин, А.Г. Математическая модель расчета энтропии кристаллических оксидов/А.Г. Рябухин.//Вестник ЮУрГУ. Серия «Математика, физика, химия». -2005. -Вып. 6 (46). -С. 179-186.
- Рябухин, А.Г. Термохимические характеристики силицидов хрома при стандартных условиях/А.Г. Рябухин, О.Н. Груба//Вестник ЮУрГУ. Серия «Металлургия». -2006. -Вып. 7. -№10. -С. 19-26.
- Рябухин, А.Г. Расчет параметров структуры и энтальпии образования кристаллических оксидов кремния/А.Г. Рябухин, А.В. Рощин, В.Е. Рощин//Вестник ЮУрГУ. Серия «Металлургия». -2007. -Вып. 8. -№ 13 (85). -С. 3-10.
- Латимер, В.М. Окислительные состояния элементов и их потенциалы в водных растворах: пер. с англ./под ред. проф. К.В. Астахова. -М.: Изд-во иностр. лит., 1954. -400 с.
- Термические константы веществ: справ, в 10 вып./под ред. В.П. Глушко. -М.: АН СССР. ВИНИТИ. -1976. -Вып. IX; 1978. -Вып. X.
- Термодинамические свойства индивидуальных веществ: справ, изд. в 4 т./под ред.В.П. Глушко. -М.: Наука.-1981. -Т. 3; 1982. -Т. 4.