Математическое моделирование динамики транспорта О2 в эритроцитах и плазме крови в капилляре
Автор: Кисляков Ю.Я., Кислякова Л.П.
Журнал: Научное приборостроение @nauchnoe-priborostroenie
Рубрика: Оригинальные статьи
Статья в выпуске: 1 т.10, 2000 года.
Бесплатный доступ
Представлена математическая модель, имитирующая основные процессы, определяющие транспорт О2 в микрососудах - диффузию О2 в цитоплазме эритроцита и плазме крови в капилляре, диффузию оксигемоглобина в эритроците и кинетику его диссоциации. Решение системы дифференциальных уравнений, описывающих модель, осуществлялось на ЭВМ методом конечных разностей. Модель использована для анализа динамики процессов транспорта О2 в цилиндрическом капилляре с учетом реальных изменений формы эритроцитов под действием гемодинамических факторов. На модели рассчитаны зависимости пространственных распределений напряжений О2 в цитоплазме эритроцита и плазме крови в капилляре от формы, времени пребывания и скорости движения эритроцита в капилляре. Результаты моделирования служат теоретической основой для разработки требований к методам и техническим средствам исследования процессов транспорта О2 в системе микроциркуляции.
Короткий адрес: https://sciup.org/14264111
IDR: 14264111 | УДК: (612.23
Текст научной статьи Математическое моделирование динамики транспорта О2 в эритроцитах и плазме крови в капилляре
Разработка аналитических методов и приборов для исследования процессов газообмена в системе микроциркуляции органов и тканей является определяющим фактором успешного развития ряда важных направлений современной физиологии и медицины. Это обусловлено тем, что одним из главных условий нормального функционирования большинства организмов является адекватное потребностям обеспечение клеток их органов и тканей энергией, получаемой внутриклеточными системами аэробного энергетического метаболизма в ходе реакций, идущих с участием кислорода [1]. Поэтому возникающий дефицит кислорода, например понижение его содержания в клетках коры головного мозга до критического уровня (1–3 мм Hg) в результате прекращения поступления с током крови, уже через 2–3 с приводит к потере сознания, а через несколько минут — к необратимому нарушению структуры и функции клеток вплоть до их гибели. Соответствие доставки кислорода к клеткам меняющейся во времени их потребности в нем обеспечивается главным образом эффективностью пространственной организации и функционирования транспортных систем микрицирку-ляторного уровня. В наибольшей степени она зависит от геометрии капилляров, размеров, формы и числа эритроцитов в единице объема крови, скорости движения эритроцитов и плазмы крови по микрососудам, скорости диффузии О2 в ткани, статических и динамических показателей кисло-родсвязывающих свойств крови. В реальных условиях большинство этих параметров под влиянием разнообразных естественных, экстремальных и патологических факторов подвержены быстрым изменениям, что отражается на обеспечении тканей кислородом. Достаточно отметить, что амплитуда колебаний скорости кровотока в микрососудах — одного из ведущих транспортных механизмов в системе микроциркуляции — варьирует в пределах 0,5–100 % от ее средних значений, а их период изменяется от долей секунды до нескольких секунд [2, 3]. Этот интервал времени сопоставим с продолжительностью процессов диссоциации оксигемоглобина (HbО2) в клетках крови [4], являющейся важнейшей динамической характеристикой массопереноса кислорода в капиллярах, а также с длительностью процесса диффузии О2 в межкапиллярном пространстве [5] и пребывания эритроцита в капилляре [6]. Поэтому изучение динамики транспорта О2 в эритроцитах и плазме капилляров, выяснение ее значимости в процессах массопереноса О2 в межкапиллярном пространстве тканей являются актуальной проблемой для физиологических и медицинских исследований, связанных с анализом механизмов обеспечения нормальной деятельности клеток, ее нарушений и коррекции. Однако проведение таких тончайших экспериментальных исследований сталкивается со значительными методическими трудностями, которые обусловлены сложностью пространственно-временнόй организации анализируемых процессов и отсутствием надежных теоретических представлений о транспорте О2 в системе микроциркуляции.
Для решения этой проблемы предлагается использовать возможности методов математического моделирования, достоинства которых показаны, в частности, при исследовании условий транспорта О2 в капиллярах в статике [7, 8, 9, 10]. Как правило, кровь в этих моделях представлена в виде гомогенной среды, а ее кислородсвязывающие свойства описаны кислородной емкостью и кривыми диссоциации оксигемоглобина, что является достаточным для приближенной оценки процессов массопереноса в системе микроциркуляции. Более детальное исследование механизмов кислородного обеспечения тканей выполнено на моделях, имитирующих пространственное распределение О2 в отдельных эритроцитах [11, 12]. Однако для анализа реальной динамической картины действия взаимосвязанных кислородтранспортных механизмов в микроучастках тканей такое приближение недостаточно. Поэтому для изучения динамики процессов транспорта кислорода была разработана модель ячейки капиллярной сети, учитываю-шая диффузию О2 и кинетику диссоциации оксигемоглобина в эритроците дискоидальной формы [13]. Целью настоящей работы явилось дальнейшее совершенствование этой модели (позволяющее учитывать измерения таких важных факторов, влияющих на кислородтранспортные свойства крови, как форма эритроцита и диффузия оксигемоглобина в теле этой клетки) и ее применение для анализа динамики массопереноса О2 в капиллярах.
ОПИСАНИЕ МОДЕЛИ
Анализируется транспорт О 2 в пространстве цилиндрического капилляра радиусом r c , по которому на равном расстоянии l c со скоростью v движутся эритроциты, одинаковых размеров и формы (рис. 1). Известно, что в зависимости от гемодинамических условий (скорости кровотока и вязкости плазмы) и механических свойств цитоплазмы и клеточной мембраны эритроцит может менять свою форму [12]. Учитывая наблюдаемые в экспериментах изменения формы клеток крови в капиллярах, в модели для малых величин v рассматриваются эритроциты обычной дискоидальной формы радиусом r e и толщиной h (рис. 1, а), а для средних и больших v — клетки пулеобразной формы (рис. 1, б), имеющие равные объемы и площади поверхности. Поскольку в нормальных физиологических условиях расположение клеток и плазмы крови в капиллярах является регулярным, рассматривается перенос О 2 в некоторой ячейке, включающей сегмент капилляра, заполненный плазмой с эритроцитом в его центральной части. При этом считается, что эритроцит и окружающая его плазма движутся по капилляру с одинаковой скоростью.
Рис. 1. Схематическое изображение ячейки в виде сегмента капилляра с эритроцитами диско- (а) и пулеобразной (б) формы
Эритроцит в модели представлен в виде трехкомпонентной среды — цитоплазмы, в которой О 2 находится в растворенном состоянии, гемоглобина и оксигемоглобина, в котором О 2 находится в связанном состоянии. Рассматривается сегмент капилляра, в котором кислород, растворенный во внутриклеточном пространстве и плазме крови, переносится путем диффузии по градиенту его концентраций. Поэтому изменение во времени t его парциального давления или напряжения ( р О2) в пространстве ячейки в радиальном ( r ) и осевом ( X ) направлениях Up ( r,x,t ) описывается уравнением диффузии, которое в цилиндрических координатах имеет вид
U _ D^ д t ( д r 2
+ 1 д Up +
r d r
p Y m , д x 2 J a i
где a i ( r , x ) и D i ( r , x ) — коэффициенты растворимости и диффузии О 2 в плазме вне ( αp и Dp ) и внутри ( αe и De ) эритроцита, m ( r, x, t ) — скорость поступления О 2 в плазму эритроцита в результате рассыщения оксигемоглобина.
Считается, что m пропорционально градиенту парциального давления k , при котором осуществляется рассыщение HbO 2 ( Ug ) и давления О 2 , растворенного в цитоплазме эритроцита ( Ue ) (которое равно Up в пределах границ эритроцита) [13]:
m = k [ Ug ( r , x , t ) - Ue ( r , x , t )] .
Парциальное давление Ug зависит от количества О2 , связанного гемоглобином, и определяется по кривой диссоциации оксигемоглобина [14]. В этом случае уравнение, описывающее изменение во времени концентрации О2, связанного гемоглобином (Сg (r, x, t)), в процессе рассыщения и диффузии оксигемоглобина в эритроците по гра- диенту его концентрации имеет вид
?a=Dg (Ca++1 deg+UC.)_ m, dt ^ dr2 r dr 9x2 J ai- где Dg (r, x) — коэффициент диффузии оксигемоглобина в цитоплазме эритроцита.
Парциальное давление О 2 на поверхности капилляра принимается постоянным и близким к его среднетканевым значениям в коре головного мозга — 20 мм Hg [15]. Считается, что на торцах ячейки, на ее левой (G 1 ) и правой (G 2 ) границах (рис. 1) ввиду равномерного распределения эритроцитов в капилляре градиенты напряжений О2 в плазме крови в осевом направлении равны:
d Up _ д Up д t|G| д r|c 2
Решение приведенной системы уравнений осуществлялось на ЭВМ численным методом конечных разностей. Для этого непрерывная область изменения независимых переменных ( r , x , t ) заменялась расчетной сеткой с равномерными шагами по этим переменным. В узлах сетки исходные дифференциальные уравнения аппроксимировались явными разностными уравнениями с точностью до второго порядка. При этом величины шагов сетки подбирались с учетом устойчивости линейной разностной задачи. Затем по начальным значениям искомых переменных последовательно с заданным шагом по времени рассчитывались их текущие величины.
В начальный момент времени р О 2 в цитоплазме эритроцита и плазме крови равно его значениям в плазме артериальной крови — 94 мм Нg [16]. Максимальная внутриклеточная концентрация О 2 ,
Численные значения величин, принятые в модели [13]
|
α p |
Растворимость О2 в плазме крови |
9,4 10 - 10 |
мол/см3 мм Hg |
|
α e |
Растворимость О 2 в цитоплазме эритроцита |
1,56 10 - 9 |
мол/см3 мм Hg |
|
D p |
Коэффициент диффузии О 2 в плазме крови |
1,65 10 - 5 |
см2/с |
|
D e |
Коэффициент диффузии О 2 в цитоплазме эритроцита* |
9,5 10 - 6 |
см2/с |
|
D g |
Коэффициент диффузии HbO 2 в эритроците** |
7,04 10 - 7 |
см2/с |
|
k |
Коэффициент, характеризующий кинетику дезоксигенации HbO 2 |
0,005 |
см3О 2 /см3 с мм Hg |
|
r e |
Радиус эритроцита |
4,2 |
мкм |
|
h e |
Толщина эритроцита |
2,0 |
мкм |
|
r c |
Радиус капилляра |
10 |
мкм |
|
l c |
Длина сегмента капилляра |
10 |
мкм |
— по данным [9], ** — по данным [19].
связанного гемоглобином, исходя из средней величины гематокрита 40 % и кислородной емкости крови 0,2 (мл О 2 )/(мл крови) [17], считается равной 0,5 мл О 2 /см3. При р О 2 = 94 мм Hg, согласно расчетам по кривой диссоциации оксигемоглобина [14], Сg = 0,47 мл О 2 /см3. Шаг сетки в осевом и радиальном направлениях составлял 0,5 мкм, а шаг по времени — 0,00001 с, что обеспечивало приемлемые точность и продолжительность расчетов. Численные значения коэффициентов, принятые в модели, представлены в таблице.
РЕЗУЛЬТАТЫ МОДЕЛИРОВАНИЯ
На модели было рассчитано изменение во времени основных параметров, характеризующих условия транспорта О2 в микрососудах: распределения напряжений О2 в цитоплазме эритроцита (Ue) и плазме крови в капилляре (Up), а также парциального давления О2 , при котором осуществляется рассыщение HbО2 (Ug) и концентрации О2, связанного гемоглобином (Cg), в эритроците при его движении по капилляру от артериального конца к венозному. Полученные данные показали, что в артериальной части капилляра уже в начальный момент рассыщения оксигемоглобина (через 0,006 с нахождения дискоидального эритроцита в капилляре) в плазме крови устанавливается неравномерное распределение рО2 (рис. 2, а). Его наибольшие значения 55,5 мм Hg отмечаются в центральной части ячейки, в месте нахождения эритроцита. Уровень рО2 плавно уменьшается в осевом и радиальном направлениях, достигая на левой и правой границах ячейки 44, а вблизи поверхности капилляра 23–25 мм Hg. Характер распределения рО2 в плазме крови в капилляре в определенной степени зависит от формы эритроцита. Так, в центре ячейки с эритроцитом дискоидальной формы область с повышенным рО2 в плазме крови вытянута в радиальном направлении. В отличие от этого в ячейке с пулеобразным эритроцитом область с повышенным рО2 вытянута в осевом направлении (рис. 2, б). Кроме того, максимальные значения рО2 в центральной части ячейки с пулеобразным эритроцитом и на ее торцах примерно на 10 %
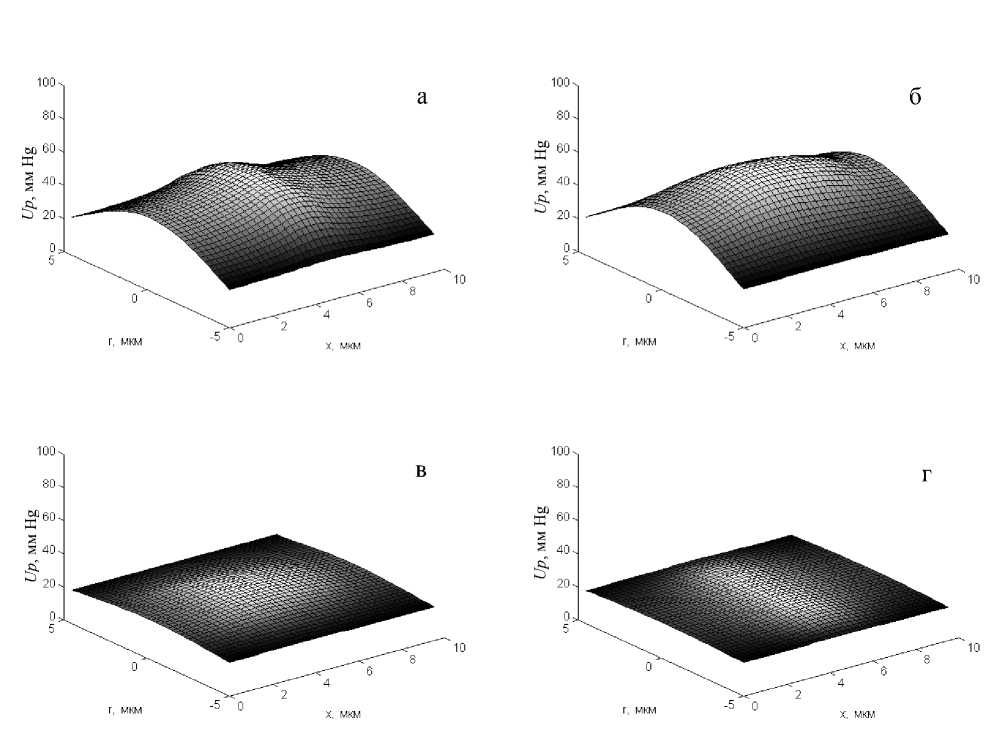
Рис. 2. Распределение рО2 во вне- и внутриклеточной плазме крови в сегменте капилляра дискообразной (а,
в) и пулеобразной (б, г) форм в артериальной (а, б) и венозной (в, г) частях капилляра
выше, чем в ячейке с дискоидальным эритроцитом. Некоторые отличия имеют и градиенты р О 2 в радиальном направлении вблизи поверхности капилляра. В центральной части ячейки с эритроцитом дискоидальной формы они примерно на 30% выше, а на торцах (G1 и G2) на 10% ниже, чем в ячейке с эритроцитом пулеобразной формы. Из этих данных следует, что эритроцит дискоидаль-ной формы при прохождении по капилляру отдает значительное количество О2 в окружающее пространство в узкой зоне, прилежащей к его поверхности и приближенной к поверхности капилляра. В то же время в случае перемещения по капилляру эритроцита пулеобразной формы отдача О 2 эритроцитом в окружающее пространство осуществляется более равномерно по всей поверхности капилляра.
Через 0,6 с пребывания эритроцита в капилляре (что соответствует его нахождению в венозной части микрососуда) уровни рО2 в плазме крови резко уменьшаются (рис. 2, в, г). Так, наибольшие значения рО2 в центре дискоидального эритроцита составляют 25,8, а пулеобразного — 28,9 мм Hg. На оси торцевых плоскостей (G1 и G2) капилляра они равны 21,7 и 23,9 мм Hg соответственно. При этом отмечается сходство общей картины распределения уровней рО2 в плазме крови на артериальном и венозном участках капилляра.
Отмеченные профили распределения р О 2 в пространстве капиллярной ячейки во многом определяются особенностями распределения р О 2 в цитоплазме эритроцита. Согласно полученным данным, в артериальной части капилляра в начальный момент рассыщения оксигемоглобина в эритроците дискоидальной формы уровень р О 2 в его цитоплазме в радиальном направлении уменьшается на 18,7 мм Hg — от 55,5 в центре до 36,8 мм Hg на поверхности клетки (рис. 3, а). В отличие от этого в цитоплазме эритроцита пулеобразной формы, находящегося в артериальной части капилляра, отмечены менее выраженные изменения р О2 — от 59,9 мм Hg в центре до 48,0 мм Hg на его поверхности (рис. 3, б). Тем не менее при нахождении эритроцита в венозной части капилляра независимо от формы клетки в ее цитоплазме устанавливается более равномерное распределение р О 2 . Так, в эритроците дискоидаль-ной формы р О 2 в цитоплазме в радиальном направлении уменьшается на 2,5 мм Hg — от 25,8 в его центральной части до 23,3 мм Hg на его
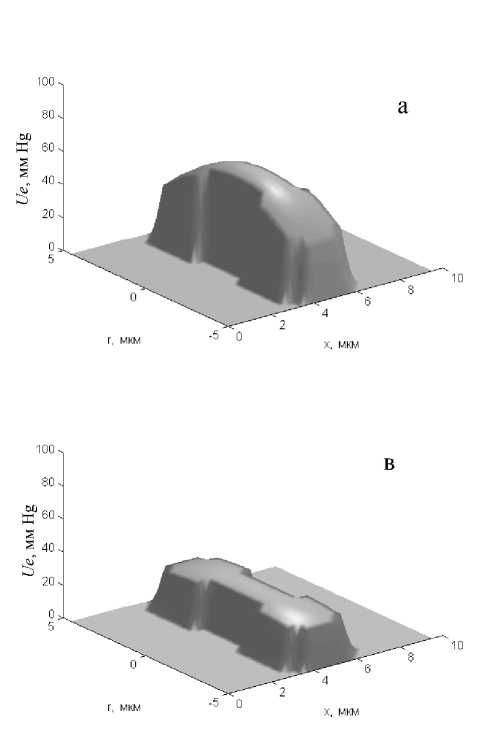
Рис. 3. Распределение р О2 вблизи наружной поверхности и в цитоплазме эритроцита дискообразной (а, в) и пулеобразной (б, г) форм в артериальной (а, б) и венозной (в, г) частях капилляра
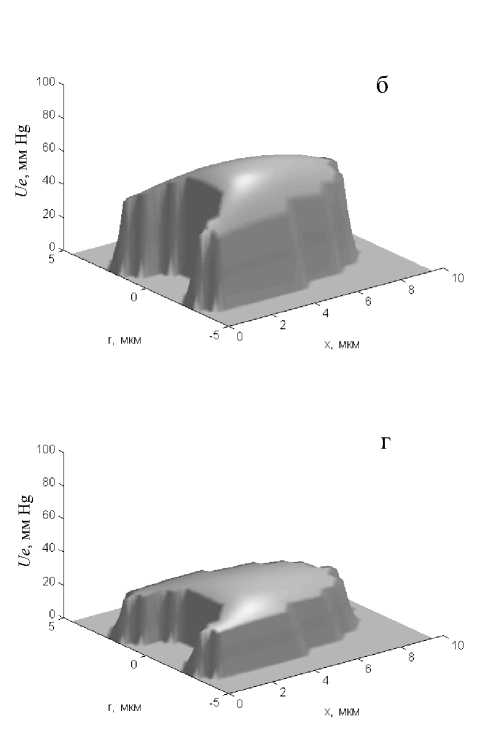
поверхности (рис. 3, в). В эритроците пулеобразной формы, аналогично, р О 2 в радиальном направлении уменьшается на 2,9 мм Hg — от 28,9 в центральной части до 26,0 мм Hg на поверхности клетки (рис. 3, г).
В отличие от распределения рО2 в цитоплазме распределение концентрации О2, связанного гемоглобином (Cg), и парциального давления рассы-щения оксигемоглобина (Ug) в эритроците остаются практически постоянными. Для эритроцита дискоидальной формы на артериальном участке капилляра в начальный момент его рассыщения (через 0,006 с) градиенты Cg и Ug в радиальном направлении от центра эритроцита к его поверхности составляют соответственно 0,0005 мл О2/мл и 0,55 мм Hg (рис. 4, а, б), а на венозном конце капилляра (через 0,6 с) — 0,0002 млО2/мл и 0,02 мм Hg (рис. 4, в, г). Еще меньшие (в 2–3 раза) градиенты этих показателей наблюдаются в эритроцитах пулеобразной формы. Однако уровни данных показателей существенно зависят от времени пребывания эритроцита в капилляре. При этом наи- большие изменения основных параметров, характеризующих транспорт О2 в капилляре (Cg, Ug, Ue), отмечаются в первые доли секунды нахождения эритроцита в капилляре. Так, через 0,1 с после начала рассыщения оксигемоглобина Cg в эритроците пулеобразной формы уменьшается от 0,47 до 0,44 мл О2/см3, Ug — от 94 до 72,1 мм Hg, а Ue — от 94 до 31,7 мм Hg. В дальнейшем наблюдается плавное уменьшение этих показателей по мере увеличения времени пребывания эритроцита в капилляре. Сходная картина наблюдается и в сегменте капилляра с эритроцитом дискообразной формы.
ОБСУЖДЕНИЕ РЕЗУЛЬТАТОВ
Динамические характеристики транспорта О2 в крови, движущейся по капилляру, исследовали с помощью математической модели, которая по сравнению с существующими имеет ряд принципиальных особенностей, позволяющих более детально имитировать реальную ситуацию. Так, во-
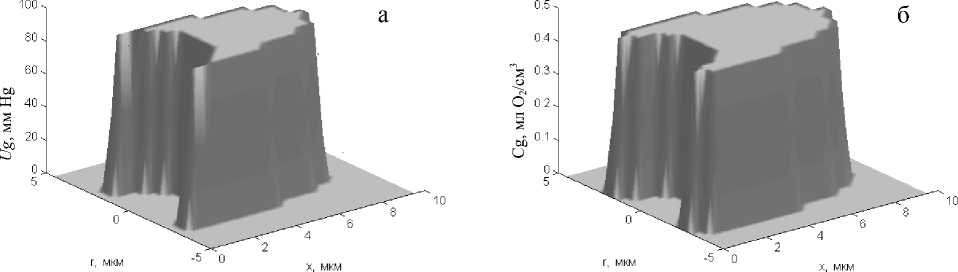
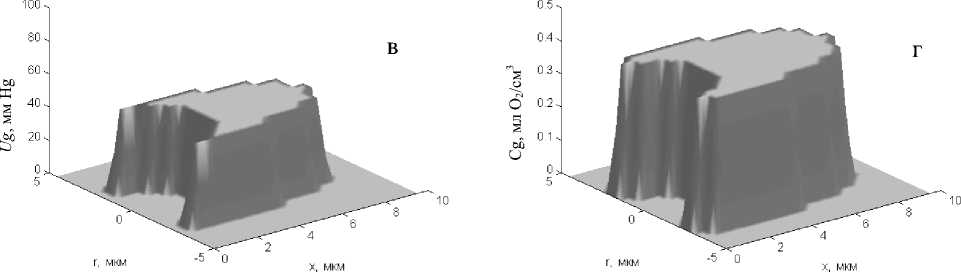
Рис. 4. Распределение парциального давления рассыщения HbO 2 (а, в) и концентрации О 2 , связанного гемоглобином (б, г), в эритроците пулеобразной формы в артериальной (а, б) и венозной (в, г) частях капилляра
первых, эритроцит в ней имеет форму, которую он обычно принимает при движении по капилляру. Во-вторых, рассматриваются процессы внутриклеточной диффузии кислорода, находящегося в растворенном и связанном оксигемоглобином состояниях. В-третьих, учтена кинетика рассыщения оксигемоглобина, которая через параметры кривой диссоциации НgО 2 связана с кислородсвязываю-щими свойствами крови. Последнее важное допущение использовалось ранее при моделировании статического распределения О 2 в эритроцитах [11]. Однако в этой модели статического распределения кислорода в отличие от настоящей модели и ее аналога [13] для характеристики кинетики рассы-щения HbO2 вводилось сложное аналитическое выражение идеализированной кривой Хилла, что ограничивало возможности применения модели для имитации многих реальных ситуаций, связанных с изменением формы кривой диссоциации и концентрации СО 2 в крови. Исследования, выполненные на предлагаемой модели, позволили установить ряд новых принципиальных фактов, касающихся закономерностей динамики транспорта О2 в системе микроциркуляции.
В результате выполненных расчетов удалось показать, что парциальное давление О 2 во вне- и внутриклеточном пространстве крови, движущейся по капилляру, распределено неравномерно: его наибольшие градиенты наблюдаются вблизи поверхности эритроцита. В капиллярной ячейке с эритроцитом дискоидальной формы они примерно в 1,5 раза больше, чем в ячейке с пулеобразным эритроцитом, в которой массоперенос О 2 из капилляра в окружающее пространство осуществляется более равномерно. Из этого следует, что изменения геометрической формы эритроцита под действием механических сил при движении по капилляру не только уменьшают энергозатраты на его перемещение, но и способствуют формированию равномерного стабильного поля напряжений О 2 в тканях, что имеет важное значение для адекватного потребностям обеспечения кислородом клеток с интенсивным его потреблением [15].
Существенную роль в формировании такого поля рО2 играют кислородсвязывающие свойства крови. Расчеты свидетельствуют, что в цитоплазме эритроцита вблизи его поверхности рО2 значительно ниже, чем в его центральной части (рис. 3). Это объясняется особенностью условий диффузии О2 из концентрированного его источника, каким является эритроцит, в окружающую его плазму крови. Однако в отличие от pО2 в цитоплазме уровни парциальных давлений О2, при которых осуществляется диссоциация HbO2, и концентраций связанного гемоглобином кислорода в эритроците (которые характеризуют запасы О2 в клетках крови и их способность отдавать его в окружающее пространство) в центральных и перифе- рических областях эритроцита распределены относительно равномерно. Они отличаются лишь на доли процента, что объясняется высокой скоростью диффузии HbO2 в теле эритроцита, создающей условия для «облегченной диффузии О2» [19]. За счет этого внутри эритроцита создаются достаточно высокие градиенты парциального давления в цитоплазме и давления рассыщения HbO2, что способствует стабилизации скорости отдачи им О2 в течение нескольких секунд нахождения эритроцитарной клетки в капилляре (рис. 4).
Таким образом, проведенные исследования позволили оценить особенности динамики транспорта О 2 в капилляре. Они показывают, что изменение формы эритроцита при движении его по капилляру, как и кинетические свойства процесса диссоциации оксигемоглобина и его диффузионные свойства играют важную роль в формировании стабильного и равномерного поля напряжений кислорода в тканях при постоянном кровотоке и его быстрых колебаниях. Кроме того, полученные результаты свидетельствуют о том, что в процессе движения эритроцита по капилляру осуществляются сложные взаимосвязанные процессы изменения концентраций и парциальных давлений рассыщения оксигемоглобина. Временные характеристики этих процессов значительно отличаются от характеристик изменения парциальных давлений во внеклеточном пространстве крови. Все эти обстоятельства важно учитывать при разработке технических требований к методам и техническим системам исследования процессов транспорта О2 в системе микроциркуляции.
Автор выражает благодарность Горбенко О.М. за помощь в подготовке иллюстраций.
Список литературы Математическое моделирование динамики транспорта О2 в эритроцитах и плазме крови в капилляре
- Wilson D.F., Erecinska M., Drovn C.//Arch. Biochem. Biophys. 1979. V. 153, N 2. P. 485-493.
- Gaehtgens P.A.L.//Pflug. Arch. 1970. V. 316, N 2. P. 140-151.
- Кисляков Ю.Я., Левкович Ю.И., Шумилова Т.Е.//Физиол. журн. СССР. 1984. Т. 70, № 5. С.673-679.
- Moschizuki M.//Jap. J. Physiol. 1966. V. 16, N 6. P. 649-657.
- Кисляков Ю.Я.//Биофизика. 1976. Т.21, № 2. С. 357-361.
- Klitzman B., Johnson P.C.//Am. J. Physiol. 1982. V. 242, N 2. P. H211-H219.
- Krogh A.//J. Physiol. 1919. V. 52, N 6. P. 391-408.
- Thews G.//Pflug. Arch. 1960. V. 271, N 2. P. 197-226.
- Grunewald W//Pflug. Arch. 1969. V. 309, N 3. P. 266-284.
- Кисляков Ю.Я.//Биофизика. 1973. Т. 18, № 1. С. 98-104.
- Clark A., Federspiel W.J., Clark P.A.A.//Biophys. J. 1985. V. 47, N 2. P. 171-181.
- Кисляков Ю.Я.//Физиол. журн. СССР. 1987. Т. 73, № 5. С. 569-578.
- Кисляков Ю.Я.//Биофизика 1996. Т. 41, № 3. С. 681-685.
- Кисляков Ю.Я. Математическое моделирование кровообращения и газообмена в мозгу. Л.: Наука, 1975. 130 с.
- Lubbers D.W.//Adv. Physiol. Sci. 1981. V. 25, P. 3-11.
- Gleichmann U., Ingvar D.H., Lubbers D.W.//Acta Physiol. Scand. 1962. V. 55, N 2-3. P. 127-138.
- Roughton F.J.W.//Handbook of physiology. Sect. 3. I. Respiration. Washington: Waverly Press, Unc., 1964. P. 767-825.
- Honig C.R., Feldstein M.L., Frierson J.L.//Am. J. Physiol. 1977. V. 233, N 1. P. H122-H129.
- Riveros-Moreno V., Wittenberg J.B.//J. Biol. Chem. V. 247, N 3. P. 895-901.


