Математическое моделирование процесса охлаждения донорской печени при гипотермической перфузии
Автор: Бухаров А.В., Гиневский А.Ф., Серегин И.С., Яремин Б.И., Аносова Е.Ю., Казымов Б.И., Новрузбеков М.С.
Журнал: Вестник медицинского института "РЕАВИЗ": реабилитация, врач и здоровье @vestnik-reaviz
Рубрика: Информационно-вычислительные технологии в медицине
Статья в выпуске: 2 т.15, 2025 года.
Бесплатный доступ
Правильное охлаждение донорской печени критически важно для трансплантации, продлевая жизнеспособность органа и минимизируя повреждения тканей. Разработанная нами математическая модель, хотя и упрощенная, выявила, что стандартная методика охлаждения не обеспечивает равномерности процесса: скорость охлаждения различных областей печени существенно отличается. Это создает риск температурного градиента внутри органа и неравномерного ишемического повреждения тканей. Результаты подчеркивают необходимость совершенствования методик охлаждения для обеспечения более равномерного распределения температуры в донорском органе. Цель исследования: разработка математической модели для оптимизации охлаждения донорской печени и минимизации риска ишемически-реперфузионного повреждения. Материалы и методы. Для моделирования процесса охлаждения печени использована система уравнений Навье-Стокса, учитывающая пористую среду и параметры теплообмена. В расчётах применена стандартная методика охлаждения с подачей охлаждающей жидкости через печёночную артерию при постоянном давлении и температуре. Исследование выполнено с использованием программного пакета PHOENICS, позволившего получить динамические данные о скорости течения охлаждающей жидкости, распределении давления, температуры и температурных градиентов внутри печени с течением времени. Модель учитывает анатомические особенности печени и основные характеристики сосудистой сети. Результаты. Численное моделирование показало, что охлаждение печени происходит неравномерно. В первую очередь охлаждаются сегменты, расположенные ближе к входу охлаждающей жидкости, тогда как удалённые сегменты достигают оптимальной температуры значительно позже. Разница температур между различными сегментами в процессе охлаждения достигает критических значений, что может привести к неоднородному ишемическому повреждению. Полное охлаждение органа в предложенной модели происходит за 720 секунд, при этом наблюдаются значительные температурные градиенты между центральными и периферическими участками печени на протяжении большей части процесса охлаждения. Выводы. Существующие методы охлаждения печени требуют оптимизации для обеспечения равномерного распределения температуры во всех сегментах. Предлагается модификация методики с использованием переменного давления подачи охлаждающей жидкости и многоточечной перфузии. Полученная математическая модель может быть использована для разработки усовершенствованных методик охлаждения донорских органов, что позволит повысить их сохранность, снизить риск ишемически-реперфузионного повреждения и улучшить исходы трансплантации. Дальнейшее развитие модели предполагает учет более детальных анатомических особенностей и физиологических параметров печени.
Трансплантация печени, Математическое моделирование, Охлаждение органов, Ишемически-реперфузионное повреждение, Гидродинамика, Теплофизика, Перфузия печени, Консервация органов, Вычислительная гидродинамика, Температурный градиент
Короткий адрес: https://sciup.org/143184265
IDR: 143184265 | УДК: 616.36-089.843:615.832.9:519.876.5 | DOI: 10.20340/vmi-rvz.2025.2.ICTM.1
Текст научной статьи Математическое моделирование процесса охлаждения донорской печени при гипотермической перфузии
Трансплантация печени является одним из самых значимых достижений современной медицины, обеспечивая пациентам с терминальными стадиями заболеваний печени шанс на выживание и улучшение качества жизни. По данным Всемирной организации здравоохранения (ВОЗ), заболеваемость хроническими заболеваниями печени продолжает расти, что делает трансплантацию печени не просто востребованной, а жизненно необходимой процедурой [1].
Одной из ключевых причин актуальности трансплантации печени является глобальный рост числа пациентов с циррозом и раком печени, вызванных вирусными гепатитами B и C, неалкогольной жировой болезнью печени (НАЖБП) и злоупотреблением алкоголем. Согласно статистике Европейской ассоциации по изучению печени (EASL), только в странах Европы ежегодно фиксируется более 200 тыс. случаев смерти, связанных с болезнями печени, что подчеркивает критическую необходимость в эффективных методах лечения, включая трансплантацию [2].
По данным Глобальной обсерватории донорства и трансплантации (GODT), ежегодно в мире выполняется около 35 тыс. трансплантаций печени, однако это число значительно меньше, чем реальная потребность в данной операции [3]. В среднем, на каждые 100 тыс. человек приходится 10-15 пациентов, которым требуется пересадка печени, но лишь около 30-40% из них получают необходимый орган из-за нехватки доноров [1].
Выживаемость после трансплантации печени значительно улучшилась за последние десятилетия благодаря усовершенствованию хирургических методов и иммунносупрессивной терапии. По данным Объединенной сети по обмену органами (UNOS), однолетняя выживаемость после трансплантации печени в развитых странах составляет 85-90%, а пятилетняя выживаемость достигает 75-80% [4]. При этом у пациентов, получивших орган от живого донора, прогнозы ещё более благоприятные - пятилетняя выживаемость может превышать 85% [5].
Несмотря на значительные успехи в области трансплантологии, проблема дефицита донорских органов остаётся одной из наиболее острых. По данным UNOS, в США на конец 2023 года в листе ожидания трансплантации печени находилось более 11 тыс. пациентов, при этом в год проводится в среднем 8 тыс. операций, что означает, что ежегодно тысячи пациентов остаются без жизненно необходимого органа [4]. В странах Европы наблюдается схожая ситуация - в 2022 году потребность в пересадке печени превышала 20 тыс. случаев, в то время как фактически выполнено было только 13 тыс. операций [2]. В странах с низким и средним уровнем дохода доступность трансплантации остаётся ещё более ограниченной из-за нехватки медицинских ресурсов и отсутствия развитой системы донорства.
Ключевую роль в трансплантологии играет концепция консервации донорских органов, предложенная ещё Алексисом Каррелем, которая определяет необходимость специальных мероприятий для сохранения жизнеспособности донорского органа вне тела и подготовке его к предстоящему ишеми-чески-реперфузионному повреждению.
Основная цель консервации - сохранение клеточной структуры и функций органа в период между изъятием и трансплантацией, предотвращение ишемических и реперфузионных повреждений, а также увеличение времени, в течение которого орган остаётся пригодным для пересадки. Современные методы консервации печени можно разделить на два основных типа: статическая холодовая перфузия (Static Cold Storage, SCS) и машинная перфузия (Machine Perfusion, MP).
Статическая холодовая консервация является традиционным и наиболее широко используемым методом сохранения донорских органов, который применяется уже несколько десятилетий. Этот метод заключается в охлаждении печени до 4 °C и хранении её в специальных консервирующих растворах, таких как раствор Висконсинского Университета (UW solution), раствор Custodiol® (HTK) и раствор Celsior®. Основные преимущества данного метода включают простоту и низкую стоимость, что делает его доступным для большинства трансплантационных центров мира. Кроме того, он позволяет транспортировать органы на значительные расстояния. Однако у статической холодовой консервации есть и значительные ограничения, такие как ограниченное время хранения (6-12 часов для печени), высокий риск ишемических повреждений и реперфузионного синдрома после трансплантации, а также низкая эффективность при сохранении маргинальных донорских органов, например печени от пожилых доноров или с жировой инфильтрацией. Эти ограничения способствовали разработке более современных технологий консервации, среди которых ключевую роль играет машинная перфузия.
Машинная перфузия представляет собой инновационную технологию, позволяющую поддерживать органы в более физиологических условиях по сравнению с холодовой консервацией. В отличие от SCS, этот метод предусматривает непрерывное омывание печени специальным раствором, насыщенным кислородом, что снижает ишемические повреждения и улучшает метаболическое состояние органа перед трансплантацией. Различают несколько видов машинной перфузии, включая гипотермическую, нормотермическую и субнормотермическую перфузию.
Гипотермическая машинная перфузия (HMP) проводится при температуре 4-10 °C и использует кислородсодержащие растворы, что помогает снизить ишемические повреждения, минимизировать повреждение эндотелия сосудов и улучшить последующую функцию трансплантата. Одним из её главных преимуществ является возможность продления времени хранения печени до 12-24 часов, а также улучшение восстановления органа после пересадки.
Нормотермическая машинная перфузия (NMP) проводится при температуре 37 °C, что позволяет имитировать физиологические условия работы печени. Донорский орган омывается насыщенной кислородом кровезаменяющей жидкостью, содержащей питательные вещества, лекарственные препараты и субстраты для поддержания клеточного метаболизма. Этот метод позволяет значительно продлить время хранения печени (до 24 часов и более), оценить её функциональное состояние перед трансплантацией и улучшить репаративные процессы, тем самым снижая риск посттрансплантационных осложнений. Последние клинические исследования показывают, что использование нормотермической перфузии увеличивает выживаемость трансплантатов на 20-30% по сравнению с органами, сохранёнными методом SCS.
Субнормотермическая машинная перфузия (SNMP) представляет собой компромиссный вариант между гипотермической и нормотермической перфузией, так как проводится при температуре 20-30 °C. Это позволяет снизить ишемические повреждения и одновременно поддерживать метаболическую активность органа, минимизируя риски, связанные с реперфузионным повреждением. Данный метод менее сложен в исполнении по сравнению с NMP, однако требует дальнейших клинических исследований для подтверждения своей эффективности.
Таким образом, методики консервации донорских органов продолжают совершенствоваться, предоставляя новые возможности для улучшения результатов трансплантации печени. В то время как статическая холодовая консервация остаётся стандартным методом хранения, машинная перфузия демонстрирует значительные преимущества, особенно в случаях использования маргинальных донорских органов. Развитие новых технологий, включая биоинженерию и использование искусственных консервирующих растворов, может в будущем ещё больше повысить эффективность трансплантации печени и помочь справиться с проблемой нехватки донорских органов.
Таким образом, кроме единичных случаев безхо-лодовой перфузии, независимо от методики консервации донорского органа, в начале её осуществляется первичное охлаждение донорского органа. От его темпов и качества зависит качество последующих мероприятий и их исход.
Принцип охлаждения основан на снижении скорости метаболизма клеток, так как органы, удалённые из организма, быстро теряют кровоснабжение, в результате чего клетки лишаются кислорода и питательных веществ. По мере того, как метаболизм продолжается, клетки могут вступать в анаэробное дыхание, что приводит к накоплению побочных продуктов метаболизма и повреждению тканей [6]. Охлаждение замедляет эти обменные процессы и задерживает наступление ишемического повреждения, тем самым продлевая период жизнеспособности органа. Охлаждение помогает уменьшить ишемическое повреждение за счёт снижения потребности клеток в энергии, сохранения уровня АТФ и ограничения процессов клеточной гибели. Исследования показывают, что каждая степень охлаждения коррелирует со значительным снижением клеточного метаболизма. Например, снижение температуры до 4 °C может снизить скорость метаболизма до 90% по сравнению с нормальной температурой тела, что значительно замедляет скорость ухудшения [7].
Для временной консервации и тем самым продления жизнеспособности донорской печени разработаны следующие способы холодовой консервации, каждый из которых направлен на максимизацию жизнеспособности тканей при минимизации побочных эффектов. Эти методы включают в себя статическое хранение в холоде, гипотермическую машинную перфузию и более поздние разработки, такие как переохлаждение и субнормотермическая перфузия. Каждый метод имеет определенные показания, преимущества и ограничения.
Статическое холодовое хранение (СХХ)
Статическое холодовое хранение (СХХ) является наиболее традиционным и широко используемым методом сохранения органов перед трансплантацией. При СХХ орган промывают консервирующим раствором и хранят в холодной среде, обычно при температуре от 0 до 4 °C. Различные консервирующие растворы, такие как раствор Висконсинского университета (UW), раствор гистидина-триптофан- кетоглутарата (HTK) и раствор Celsior, используются для предотвращения набухания клеток и стабилизации мембран во время охлаждения [8]. Этот простой, но эффективный метод является экономически эффективным и значительно снижает клеточный метаболизм органов. Исследования показывают, что, хотя СХХ эффективно в течение более коротких периодов хранения, его эффективность снижается в течение длительного времени, особенно для органов, очень восприимчивых к ишемическому повреждению, таких как сердце и лёгкие. Длительное СХХ может привести к внутриклеточному ацидозу, клеточному отёку и митохондриальной дисфункции, что может поставить под угрозу функцию после трансплантации [9].
Гипотермическая машинная перфузия (ГМП)
Гипотермическая машинная перфузия (ГМП) представляет собой значительный шаг вперёд по сравнению с СХХ. Этот метод предполагает активную перфузию органа холодным консервирующим раствором при температуре 4-10 °С. Процесс перфузии обеспечивает непрерывную доставку кислорода, удаление метаболических отходов и контролируемое давление внутри органа, что оптимизирует среду для сохранения [10]. ГМП особенно полезна для почек и печени, где исследования указывают на заметное снижение задержки функции трансплантата и улучшение выживаемости трансплантата. Эффективность ГМП была продемонстрирована в исследовании Moers и соавт. (2009), в котором почки, сохранённые с помощью ГМП, имели на 10% более высокую выживаемость трансплантатов по сравнению с почками, сохранёнными только с помощью СХХ [9]. Способность НМП снижать реперфузионное повреждение и поддерживать выработку АТФ является основным фактором улучшения этого результата [11].
Нормотермическая и субнормотермическая машинная перфузия (НМП и СНМП)
В отличие от гипотермических условий, НМП и СНМП поддерживают органы на уровне, близком к физиологическому или немного более низком, что позволяет продолжать метаболическую активность, хотя и с меньшей скоростью. Этот метод позволяет оценить функцию органа до трансплантации, что делает его особенно полезным для маргинальных органов или органов высокого риска. Во время НМП органы перфузируются насыщенной кислородом кровью или кровеподобными растворами, что способствует восстановлению клеток и оценке функций [12].
Знаковое исследование Nasralla и соавт. (2018) показало, что NMP улучшает результаты трансплантации печени, снижая частоту ранней дисфункции аллотрансплантата и снижая частоту отбраковки органов [12]. Аналогичным образом, SNMP показала многообещающие результаты в сохранении сердца и печени, обеспечивая более длительное время сохранения и лучшее функциональное восстановление после трансплантации [13].
Консервация органов перфузионным способом более физиологична, чем бесперфузионным. Вместе с тем перфузионная консервация не лишена недостатков, ограничивающих её использование. Главным из них является травма консервируемого органа, наносимая на различных этапах перфузии. В результате ишемии органа возможна «перфузионная нефропатия», что ограничивает время эффективной консервации. Кроме того, этот метод значительно дороже и технически сложнее, чем беспер-фузионная гипотермия.
Переохлаждение и криоконсервация
Переохлаждение и криоконсервация являются новыми подходами к дальнейшему расширению сохранности органов. Переохлаждение включает в себя снижение температуры органа ниже точки замерзания без образования кристаллов льда, что обычно достигается с помощью специализированных криопротекторов и протоколов контролируемого охлаждения [14]. В экспериментальных исследованиях переохлаждение показало потенциал для продления срока сохранности печени с нескольких часов до нескольких дней, что может революционизировать логистику трансплантации и улучшить результаты [15].
Криоконсервация, хотя и более сложная и всё ещё в значительной степени экспериментальная, включает в себя замораживание органов при сверхнизких температурах (-140 °C или ниже) с помощью криопротекторов. Несмотря на техническую сложность, криоконсервация может в один прекрасный день обеспечить долгосрочное хранение органов, что значительно повысит доступность органов и показатели успешности трансплантации [16].
Охлаждение органов, несомненно, улучшило результаты трансплантации, однако оно не лишено проблем. Несмотря на преимущества, ХХК всё же приводит к ишемско-реперфузионному повреждению при согревании и реперфузии органа кровью в момент трансплантации. НМП и ГМП предлагают многообещающие альтернативы, которые уменьшают реперфузионное повреждение и облегчают оценку органов перед трансплантацией, хотя эти методы являются ресурсоёмкими и требуют специализированного оборудования и опыта [17]. Более того, несмотря на то, что такие методы, как переохлаждение и криоконсервация, являются многообещающими, они по-прежнему являются в основном экспериментальными, и проблемы, связанные с токсичностью криопротекторов, образованием кристаллов льда и травмами при согревании должны быть решены, прежде чем они станут рутинной клинической практикой [14].
Определение оптимального диапазона температур и времени охлаждения имеет решающее значение для минимизации ишемического повреждения и предотвращения повреждения клеток из-за экстремального охлаждения.
Не трудно заметить, что общим для всех методов консервации является охлаждение донорской печени, позволяющее существенно замедлить метаболизм органа и тем самым продлить сохранность органа вне тела. Неправильное охлаждение неизбежно приводит к ишемической, а затем и реперфузионной травме различной степени тяжести.
К сожалению, на сегодняшний день наиболее подробно исследован только процесс теплопередачи при охлаждении тонких образцах печёночной ткани. Примерами таких исследований являются работы [18-22]. Теплофизика охлаждения печени как целого исследована не достаточна. Связано это со сложностью организации ткани, затрудняющей проведение точных экспериментальных исследований.
Учитывая важность правильного охлаждения изъятой печени для длительной сохранности органа вне тела, возникла необходимость в создании математической модели печени и численного исследования процесс её охлаждения.
Математическая модель охлаждения печени
В клинической практике большое распространение получила схема сегментарного деления печени по Куино, 1957 (рис. 1). По этой схеме печень делится на восемь сегментов: хвостатый сегмент левой доли (I), задний сегмента левой доли (II), квадратный и передний сегменты левой доли (IV и III соответственно), латеральный верхнезадний сегмент правой доли (VII) и латеральный нижнезадний сегмент (VI ), средний верхнепередний и средний нижнепередний сегменты печени (VIII и V соответственно). Каждый сегмент имеет обособленное кровоснабжение, желчный отток, иннервацию и лимфообращение.
Учитывая сегментарное строение печени, была разработана достаточно простая модель печени, состоящей из следующих частей: капсула печени, сегменты печени и дополнительные перегородки, для прохождения жидкости по всем сегментам печени. Общий вид предлагаемой модели и связь её с реальными секторами печени показан на рисунке 1.
Необходимо отметить, что моделирование охлаждения печени представляет собой нетривиальную задачу. Сложность задачи определяется сложным строением самого объекта, наличием сложных внутренних структур и сложным характером течения охлаждающей жидкости.
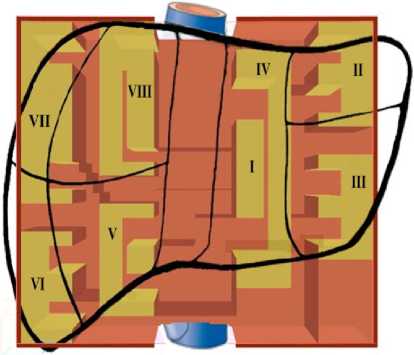
Рисунок 1. Общий вид предлагаемой модели и условная связь её с секторами печени: песочным цветом выделены сегменты печени по Куино в схематичном представлении; коричневым - перегородки, обеспечивающие направленное прохождение охлаждающей жидкости. Расположение и форма сегментов в модели упрощены и адаптированы в интересах математического моделирования и не полностью соответствуют анатомическому строению реальной печени
Figure 1. General view of the proposed model and its conditional relationship with liver sectors: sand color highlights Couinaud liver segments in a schematic representation; brown color shows partitions that ensure directed flow of the cooling fluid. The position and shape of segments in the model are simplified and adapted for mathematical modeling purposes and do not fully correspond to the anatomical structure of the actual liver
В соответствии со стандартной методикой охлаждения, течение охлаждающей жидкости через печень осуществляется соответственно сегментарной системе. Это значит, что охлаждающая жидкость почти одновременно поступает в каждый сегмент печени, проходит через него, а затем одновременно из всех сегментов собирается в артерии. Таким образом, в реальном процессе охлаждения отсутствует порядок протекания охлаждающей жидкости от сегмента к сегменту, в первую очередь или последнюю.
В силу сложного строения печени и наличия в ней большого количества каналов разного диаметра, в предлагаемой модели сделана попытка только в достаточно грубом приближении учесть основные особенности строения печени и процесса её охлаждения. В отличие от реального процесса, охлаждающая жидкость одновременно попадает в правую и левую доли печени, последовательно проходит сегменты печени, а затем одновременно из всех сегментов собирается в артерии. Такой подход имеет право на существование, так как позволяет не только учесть сложное строение печени, но и организовать правдоподобное течение охлаждающей жидкости.
Течение охлаждающей жидкости внутри предлагаемой модели печени описывается системой уравнений Навье-Стокса с учётом однородной пористости среды, в которой осуществляется течение. Оценка показала, что время формирования течения достаточно мало (порядка 10-3 сек) по сравнению со временем охлаждения. В силу этого можно считать, что задача является стационарной и для её решения можно использовать следующее уравнение:
div (р-а ® a-p,v u J=—^ p+^' и. (1)
Расчёт гидродинамических параметров проводился с учётом параметров, соответствующих стандартной методике охлаждения печени: расход охлаждающей жидкости - 1,5 мл/мин/г; температура жидкости - 8-13 °С; давление на артериальном входе - 90-110 мм рт. ст.; р - плотность, ц - коэффициент динамической вязкости.
Предварительно, по известному расходу охлаждающей жидкости и давлению на артериальном входе, был определён коэффициент сопротивления пористой среды ξ = 0,00248.
Дальнейший расчёт гидродинамических параметров проводился на декартовой сетке 65×15×57 при помощи пакета PHOENICS [21].
В результате расчёта получены распределения давления и скорости, представленные на рисунках 2 и 3.
Таким образом, можно сделать вывод, что распределения скорости и давления внутри печени полностью соответствуют представлениям о стационарном течении жидкости в пористой среде.
В силу стационарности течения охлаждающей жидкости внутри печени для решения задачи охлаждения печени использовано следующее уравнение:
р CpuT -X grad ( T ) ] = 0 , (2)
+ div [ д t I
где С р - изобарная теплоемкость, X - коэффициент теплопроводности, Т - температура.
Для уравнения (2) граничными условиями являются граничные условия третьего рода на всех граничных поверхностях:
"^ а T - Тос ) • (3)
В соотношении (3) n - нормаль к поверхности, а - коэффициент теплоотдачи, Тос - температура окружающей среды, принятая равной 22 °С.
Коэффициент теплоотдачи выбирался для каждой поверхности с учётом того, что теплоотдача в окружающем воздухе осуществлялась за счёт естественной конвекции.
Решение задачи охлаждения проводилось с учётом параметров, соответствующих стандартной методике охлаждения печени: расход охлаждающей жидкости - 1,5 мл/мин/г; температура жидкости 8-13 °С; давление на входе - 90-110 мм рт. ст. При расчёте значения ρ, µ, С р и α выбирались из табличных значений для воды. Коэффициент теплопроводности X = 0,55 Вт/м К был выбран в соответствии с результатами работы [22].
Давление, Pa
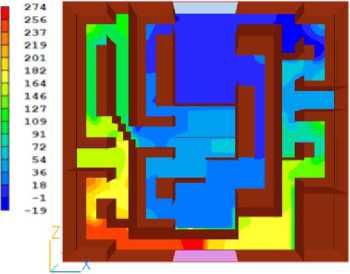
Рисунок 2. Результаты численного моделирования распределения гидродинамического давления внутри печени. Цветовая шкала отражает градиент давления от максимального (красный) до минимального (синий) значения в паскалях. Представленное распределение демонстрирует характерные особенности течения охлаждающей жидкости через пористую структуру органа при стандартной методике перфузии
Figure 2. Results of numerical modeling of hydrodynamic pressure distribution inside the liver. The color scale reflects the pressure gradient from maximum (red) to minimum (blue) values in pascals. The presented distribution demonstrates characteristic features of cooling fluid flow through the porous structure of the organ using the standard perfusion technique
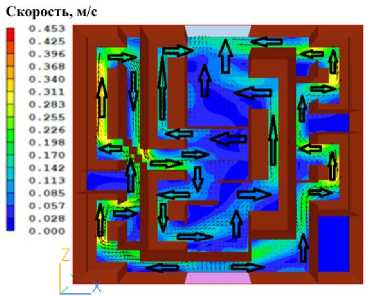
Рисунок 3. Результаты численного моделирования распределения скорости потока охлаждающей жидкости внутри печени. Цветовая шкала отображает градиент скорости от максимальной (красный) до минимальной (синий) в м/с. Визуализация демонстрирует неравномерность перфузии различных сегментов органа и формирование преимущественных путей тока жидкости через пористую структуру печеночной ткани
Figure 3. Results of numerical modeling of cooling fluid flow velocity distribution inside the liver. The color scale displays the velocity gradient from maximum (red) to minimum (blue) in m/s. The visualization demonstrates the uneven perfusion of different organ segments and the formation of preferential fluid flow pathways through the porous structure of liver tissue
Расчёт охлаждения проводился при помощи пакета PHOENICS на той же сетке, что и расчёт течения. Распределение скорости при расчёте охлаждения считалось стационарным, в расчёте использовано поле скорости, рассчитанное на предыдущем этапе. На каждом шаге по времени контролировалась сходимость расчёта и баланс тепла. Баланс тепла выполнялся с точностью, как минимум, 10–5, что является достаточно хорошей величиной.
Результаты расчётов представлены на рисунках 4–10. На рисунках 4–9 представлено распределение температуры в печени в фиксированные моменты времени охлаждения. Более подробно изменение температуры в различных сегментах печени с течением времени представлено на рисунке 10. Цифровое обозначение температурных кривых на рисунке 10 соответствует номерам сегментов на рисунке 1.
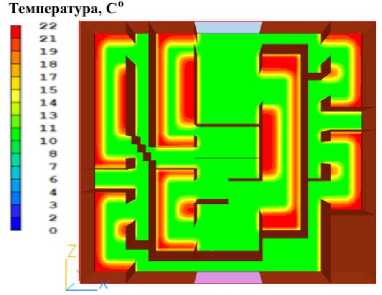
Рисунок 4. Распределение температуры в начальный момент перфузии. Цветовая шкала отражает температурный градиент от максимальной (красный, соответствует начальной температуре органа) до минимальной (синий, соответствует температуре охлаждающей жидкости) в градусах Цельсия. Представленное распределение де-
Температура, C°
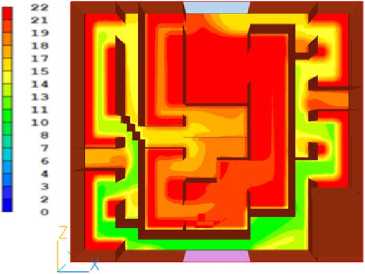
Рисунок 5. Распределение температуры в печени через 20 секунд после начала охлаждения. Цветовая шкала отражает температурный градиент в градусах Цельсия
Figure 5. Temperature distribution in the liver 20 seconds after the start of cooling. The color scale reflects the temperature gradient in degrees Celsius. Primary cooling zones near the perfusion fluid inlet are noticeable
монстрирует исходное состояние теплового поля печени перед началом активного охлаждения и служит отправной точкой для анализа динамики процесса гипотермической перфузии
Figure 4. Temperature distribution at the initial moment of perfusion. The color scale reflects the temperature gradient from maximum (red, corresponding to the initial temperature of the organ) to minimum (blue, corresponding to the temperature of the cooling fluid) in degrees Celsius. The presented distribution demonstrates the initial state of the liver's thermal field before active cooling begins and serves as a starting point for analyzing the dynamics of the hypothermic perfusion process
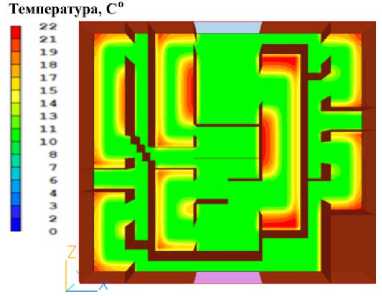
Рисунок 6. Распределение температуры в печени через 80 секунд после начала охлаждения. Цветовая шкала отражает температурный градиент в градусах Цельсия
Figure 6. Temperature distribution in the liver 80 seconds after the start of cooling. The color scale reflects the temperature gradient in degrees Celsius. Primary cooling zones near the perfusion fluid inlet are noticeable
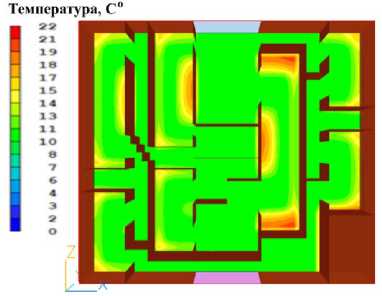
Рисунок 7. Распределение температуры в печени через 180 секунд после начала охлаждения. Цветовая шкала отражает температурный градиент в градусах Цельсия
Figure 7. Temperature distribution in the liver 180 seconds after the start of cooling. The color scale reflects the temperature gradient in degrees Celsius. Primary cooling zones near the perfusion fluid inlet are noticeable
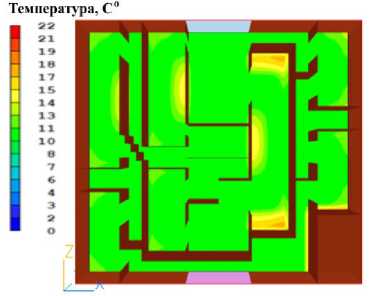
Рисунок 8. Распределение температуры в печени через 320 секунд после начала охлаждения. Цветовая шкала отражает температурный градиент в градусах Цельсия
Figure 8. Temperature distribution in the liver 320 seconds after the start of cooling. The color scale reflects the temperature gradient in degrees Celsius. Primary cooling zones near the perfusion fluid inlet are noticeable
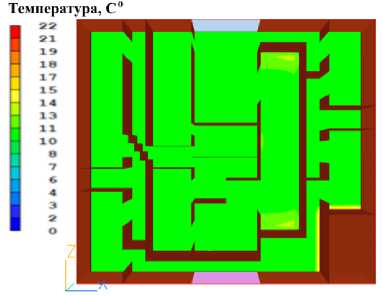
Рисунок 9. Распределение температуры в печени через 720 секунд после начала охлаждения. Цветовая шкала отражает температурный градиент в градусах Цельсия
Figure 9. Temperature distribution in the liver 720 seconds after the start of cooling. The color scale reflects the temperature gradient in degrees Celsius. Primary cooling zones near the perfusion fluid inlet are noticeable
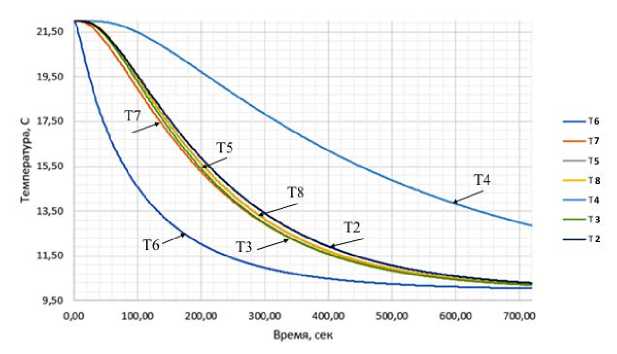
Рисунок 10. Изменение температуры в различных сегментах печени с течением времени. График демонстрирует динамику охлаждения отдельных сегментов печени (обозначены различными цветами) на протяжении всего процесса перфузии. Наблюдается выраженная неравномерность скорости снижения температуры: сегменты, расположенные ближе к входу охлаждающей жидкости, достигают целевой температуры значительно быстрее удаленных участков. Максимальный температурный градиент между сегментами наблюдается в интервале 100-300 секунд от начала охлаждения
Figure 10. Temperature changes in different liver segments over time. The graph demonstrates the cooling dynamics of individual liver segments (indicated by different colors) throughout the entire perfusion process. There is a pronounced unevenness in the rate of temperature decrease: segments located closer to the cooling fluid inlet reach the target temperature significantly faster than distant areas. The maximum temperature gradient between segments is observed in the interval of 100-300 seconds from the start of cooling
Как видно из графика и рисунков распределения температуры, быстрее всего охлаждаются сегменты 6 и 3, далее почти с одинаковой скоростью охлаждаются сегменты 7, 2, 5 и 8. Медленнее охлаждается сегмент 4. Полное охлаждение происходит за 720 секунд.
Выводы
Правильное охлаждение донорской печени позволяет существенно замедлить метаболизм органа и тем самым продлить время хранения до последующей трансплантации. Чем дольше время консервации, тем большему количеству больных, нуждающихся в трансплантации, может быть оказана необходимая врачебная помощь. В силу этого математическое моделирование теплофизики охлаждения печени как целого органа играют важную роль. Необходимо отметить, что моделирование охлаждения печени - весьма непростая задача, труд- ность которой определяется сложным строением органа и характером течения охлаждающей жидкости. Понимая это, авторы разработали модель, в которой на данном этапе учтены только основные особенности процесса охлаждения. Однако даже в этой простой постановке задачи с помощью модели удалось установить, что стандартная методика охлаждения печени не обеспечивает его равномерности: скорость охлаждения различных областей оказалась разной. Это создаёт риск температурного градиента внутри органа, что может способствовать неравномерному ишемическому повреждению различных участков ткани. Полученные результаты подчеркивают необходимость совершенствования методик охлаждения, включая адаптацию параметров подачи охлаждающей жидкости для обеспечения более равномерного распределения температуры в донорском органе.


