Матричная минерализация уролитов
Бесплатный доступ
Рассматривается один из возможных вариантов матричной минерализации, реализуемый в уролитах. Формирование минеральных агрегатов представляется как следствие защитной реакции иммунной системы организма в ответ на микробиальное и (или) химическое (С2О42-, N5H4C4O3) воздействие на ткани мочевых органов.
Уролиты, уролитиаз, матрица, ингибиторы
Короткий адрес: https://sciup.org/149128532
IDR: 149128532
Текст научной статьи Матричная минерализация уролитов
Проблемой уролитиаза в последние десятилетия занимались исследователи самых различных областей наук. Однако до настоящего времени нет убедительной модели формирования уролитов в мочевыводящих путях. Считается, что на процесс минералообразования влияет множество причин, но при этом воздействие конкретных факторов может способствовать камнеобразованию у одних людей, а у других - нет. Если главную роль в камнеобразовании играют не сами почки, а другие органы или организм в целом, то почему лишь изредка наблюдается двустороннее образование камней, а удаление камня не всегда приводит к рецидиву? Так, со гласно исследованиям С. А. Возиано-ва и его соавторов, повторное камне-образование наблюдается в 20-25 % случаев [2], а в работе М. С. Пармара (2004) отмечается, что если камень в почке сформировался, то вероятность образования второго конкремента в течение пяти-семи лет составляет около 50 % [10].
В первой половине 19-го века происхождение уролитиаза связывали с веществом, отделяющимся в почках из крови вследствие болезни всего организма, а не только почек. До начала 20-го столетия были введены понятия о защитных коллоидах и атипической кристаллизации солей мочи. В настоящее время существует множе ство теорий, объясняющих механизм формирования уролитов. Сторонники одной из таких теорий утверждают, что в основе образования камней лежит нарушение коллоидного состояния урины, приводящее к патологической кристаллизации солей. Из другой теории следует, что основой камня служит белоксодержащее скелетное вещество - матрица, в которой формируются кристаллы [1]. Была также предпринята попытка создания теоретической модели формирования уролитов в зависимости от их минерального состава. Определяющая роль в генезисе мочевых камней приписывается жизнедеятельности грибковой микрофлоры [3].

Целью данной работы является детализация одного из звеньев в цепи патогенного минералообразования при уролитиазе, основанная на анализе литературных данных и результатах экспериментальных работ.
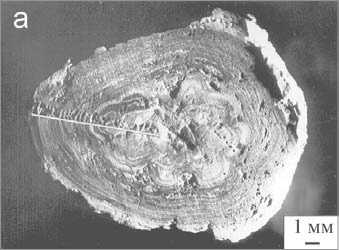
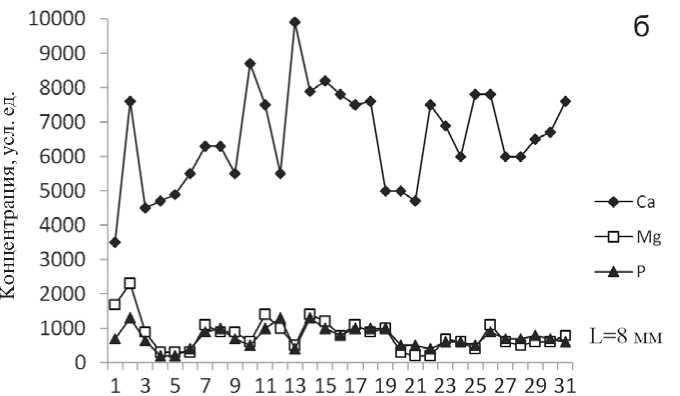
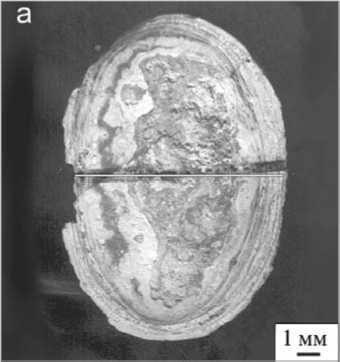
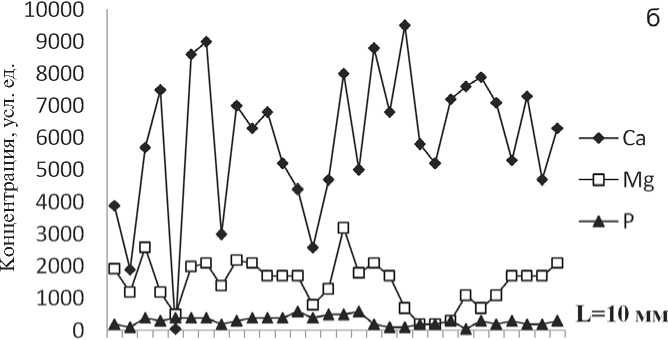
Изучение пространственного распределения элементов и микропримесей было проведено на лазерном микроанализаторе LMA-1 [3]. Чувствительность лазерного микроанализа на различные элементы составляла 10 ' —10 4 %. Сканирование аншлифов показало, что Са и Mg в объеме оксалатсодержащих и мочекислых камней зонального строения имеют относительно равномерное распределение. Фосфатные камни, состоящие из карбонатсодержащего апатита-(СаОН), напротив, характеризуются выраженной неоднородностью в распределении этих элементов. Например, в апатитсодержащих образцах проанализировано около 30 точек по профилю от периферии до центра. Расстояние между точками, где фиксируется лазерный луч, составляло от 0.1 до 0.6 мм (рис. 1, а, б; 2 а, б). По данным лазерного микроанализа было также выявлено, что кривая распределения магния в струвит-
содержащем камне мономинерально-го состава не имеет максимумов. Спектр концентрационной характеристики фосфора данного уролита сильно отличается по интенсивности спектральной линии от кривых распределения этого элемента в апатитсодержащих уролитах.
Проведенные нами исследования выявили тонкие различия в составе и распределении элементов по профилям камней, которые способствовали интерпретации данных с точки зрения генезиса уролитов и условий их образования. Эти различия наводят на мысль о том, что в секретируемых протеинах будущей матрицы оксалатных и мочекислых камней Са-содер-жащие сайты уже изначально могли быть укомплектованы кальцием, а органическая составляющая карбонатсодержащего апатита-(СаОН) содержит фосфорилированные остатки аминокислот.
В последние десятилетия пристальное внимание уделялось биохи
мическим аспектам уролитиаза, а именно изучению активности в моче различных протеолитических ферментов, а также их активаторов и ингибиторов [5—9]. Исследования органической составляющей показали, что основой матрицы уролитов являются, как правило, ингибиторы минерализации, вырабатываемые почечным уротелием. В работе Ф. Этмани с соавторами отмечается, что состав белка матрицы камнеобразователей и кристаллов, полученных экспериментальным путем из урины, имеют одинаковый набор ингибиторов. Альбумин, уропонтин (остеопонтин) и родственные протромбину белки содержатся во всех типах уролитов, но в кальциофосфатных образованиях преобладает гликопротеин Тамм-Хорсфалла (уромодулин) [8]. Перечисленные соединения являются кальцийсвязывающими белками.
Эпителиальные клетки почек (уротелий) синтезируют уропонтин — фосфорилированный и нефосфорили-
Рис. 1. Апатитсодержащий уролит с включениями уэвеллита (а); кривые распределения Са, Mg и Рот периферии до его центра (б) [3]
13 5 7 9 1113 15 17 19 2123 25 27 29
Рис. 2. Апатитсодержащий уролит с включениями струвита и уэвеллита (а); кривые распределения Са, Mg и Р по профилю (б) [3]

рованный сиалопротеин, один из адгезивных кальцийсвязывающих белков. Богатый аспарагиновой и глутаминовой кислотами гликопротеин (молекулярная масса 44 кДа) включает аминокислотный остаток фосфосерина и 12 остатков фосфотреонина.
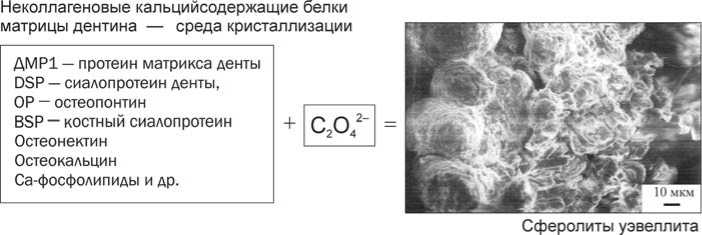
Рис. 3. Схема трансформации фосфорилированных Са-содержащих протеинов в мат рице дентина
Уропонтин в ситуациях, связанных с иммунной реакцией, исполняет роль цитокина и влияет на развитие местных защитных реакций в тканях с участием различных типов клеток крови, эндотелия, соединительной ткани и эпителиев. Он не вырабатывается постоянно, а синтезируется в ответ на повреждение тканей. Тамм-Хорсфалл-гли-копротеин (уромодулин) секретируется канальцевым эпителием и является ингибитором кристаллизации. Он полимеризуется при повышении концентрации электролитов и снижении рН урины. Нефрокалъцин (bicunin) свободный вырабатывается в печени и синтезируется в почках. Белок ингибирует адгезию кристаллов. Тромбины, фрагменты F1 и F2 (родственные протромбину белки) синтезируются в печени и клетками канальцевого эпителия. а1-Микроглобулин — сывороточный белок — в зоне воспаления способствует фибриллогенезу. IaI — ин-тер-а-ингибитор , бикунинсодержа-щий белок, включает в свою структуру две тяжелые цепочки H1 (65 kDa), H2 (70 kDa) и легкую, известную как бикунин (30 kDa) [7]. Алъбумин является сывороточным белком. Маннансвязы-вающий лектин — кальцийсвязываю-щий белок — секретируют макрофаги.
Для выявления молекулярной природы взаимодействия органических и минеральных компонентов в биоминералах были проведены эксперименты: фрагменты дентина зубов человека подвергались воздействию биогенной и абиогенной щавелевой кислоты. Средой кристаллизации для зарождения и роста новообразованных минералов послужили неколлагеновые белки матрицы дентина (рис. 3). Было установлено, что структурная и фазовая трансформации микроглобу-лярных агрегатов биоапатита сопровождались дефосфорилированием фи-зиогенного минерала и формированием уэвеллита или уэдделлита на его поверхности, которые морфологически не отличались от кристаллических образований оксалата кальция в структуре уролитов (рис. 4) [4].
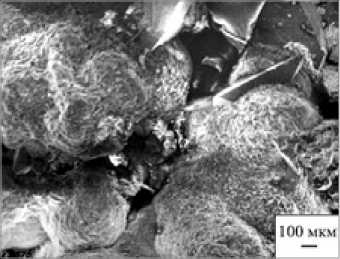
Рис. 4. Сферолиты уэвеллита в уролите
По результатам экспериментов можно предположить, что микробиота, ионы С 2 О 4 2— или мочевая кислота в мочевыводящей системе преобразуют ингибиторы минерализации в биоми-неральные образования. Воздействие бактериальных ферментов на кальций-связывающие фосфорилированные сиалопротеины (цитокины, ингибиторы минерализации), в частности уропонтин или уромодулин, способствует образованию карбонатсодержащего апатита-(СаОН) и струвита.
Таким образом, можно сказать, что среда кристаллизации, состоящая из кальцийсвязывающих сиалопротеинов, вырабатываемых уротелием в результате защитной реакции, одновременно служит и матрицей уролитов. Следовательно, причиной кристаллизации биоминералов в мочевых путях является сбой в системе регуляции местных защитных реакций, обусловленный микробиальными и (или) химическими (С2О42—, N5H4 C4O3) воздействиями.
Исследования проводились при поддержке грантов по Программе фундаментальных исследований Президиума РАН № 09-П-5-1026 и РФФИ №11-05-00620-а
Список литературы Матричная минерализация уролитов
- Вайнберг З. C. Камни почек. М.: Медицина, 1971. 198 c.
- Возiанов О. Ф., Павлова Л. П., Дзюрак В. С. та iн. Епiдемiологiя сечокам'яної хвороби як базис до її профiлактики та органiзацiя медичної допомоги// Працi VIII Пленуму асоцiацiї урологiв України. Киев, 1998. С. 3-7.
- Каткова В. И. Мочевые камни. Сыктывкар: Коми НЦ УрО РАН, 1996. 87 с.
- Каткова В. И. Биоминералогия стоматолитов. Екатеринбург УрО РАН, 2006. 111 с.
- Короткова О. В. Тамм-Хорсфалл протеин как маркёр поражения почек у больных пожилого и старческого возраста с небольничными пневмониями: Автореф. дис.... канд. мед. наук. М., 2008.
- Прахин Е. И., Реушев М. Ю., Бороздун С. В., Эверт Л. С. Оксалатно-кальциевый нефролитиаз в детском возрасте // Педиатрия, 2004. № 2. С. 67-70.
- Caroline j. Dawson, Phulwinder K. Grover, Jerry Kanellos et al. Inter-α-inhibitor in calcium stones // Clinical Science, 1998. V. 95. Р. 187-193.
- Fouad Atmani, Patricia A, Glenton, Saeed R. Khan. Identification of proteins extracted from calcium oxalate and calcium phosphate crystals induced in the urine of healthy and stone forming subjects // Urol. Res., 1998. 26. P. 201-207.
- Fouad Atmani. Characterization of urinary bikunin and its role in urolithiasis // Reviews in Biology and Biotechnology, 2001.Vol.1. No 2. Р. 17-20.
- Parmar M. S. Kidney stones. BMJ, 2004. 328: Р. 1420-1444.


