Механизмы активации филграстимом процессов восстановления гранулоцитарного ростка гемопоэза у больных раком молочной железы в условиях химиотерапии по схеме доксорубицин/доцетаксел
Автор: Хричкова Татьяна Юрьевна, Гольдберг Виктор Евгеньевич, Попова Наталья Олеговна, Симолина Елена Ивановна, Белевич Юлия Викторовна, Жданов Вадим Вадимович, Мирошниченко Лариса Аркадьевна, Удут Елена Владимировна, Симанина Елена Владиславовна
Журнал: Сибирский онкологический журнал @siboncoj
Рубрика: Лабораторные и экспериментальные исследования
Статья в выпуске: 6 (72), 2015 года.
Бесплатный доступ
Исследованы стимулирующие эффекты препарата гранулоцитарного колониестимулирующего фактора (филграстима) в отношении гранулоцитарного ростка гемопоэза. В исследование включены 77 больных раком молочной железы III-IV стадий, которым проводилась химиотерапия по схеме доксорубицин/доцетаксел. В перерывах между курсами химиотерапии 30 пациенткам назначался филграстим. Препарат вводился подкожно в дозе 300 мкг, двукратно на 8-й и 12-й дни от последнего введения доцетаксела. Показатели системы крови оценивали на протяжении 3 курсов химиотерапии. Показано, что под действием филграстима происходит активация костномозгового гранулоцитопоэза, подавленного цитостатиками. Эффект реализируется на уровне коммитированных предшественников, морфологически дифференцируемых элементов костного мозга и периферической крови, что является следствием стимуляции пролиферативной активности кроветворных клеток-предшественников гранулоцитопоэза под действием гуморальных факторов, выделяемых клетками микроокружения, а также, в значительной степени, ускорением созревания указанных клеток.
Рак молочной железы, химиотерапия, гранулоцитопоэз, доцетаксел, филграстим
Короткий адрес: https://sciup.org/14056598
IDR: 14056598 | УДК: 618.19-006.6-08:
Текст научной статьи Механизмы активации филграстимом процессов восстановления гранулоцитарного ростка гемопоэза у больных раком молочной железы в условиях химиотерапии по схеме доксорубицин/доцетаксел
Схемы химиотерапии, включающие антраци-клины и таксаны, часто используются для лечения больных раком молочной железы (РМЖ) III–IV стадий [3, 11, 12]. При этом эффективность сочетания доцетаксела с доксорубицином в качестве I линии химиотерапии составляет 55–94 %, в качестве II линии – 36–59 %, и демонстрирует наиболее высокие показатели выживаемости [3, 8]. Однако частым осложнением при использовании как доцетаксела, так и доксорубицина является угнетение костномозгового кроветворения, в большей степени гранулоцитарного ростка, что проявляется развитием лейкопении с преимущественным снижением в периферической крови количества нейтрофильных гранулоцитов. Нейтропения III–IV степени развивается у 85–100 %, фебрильная нейтропения – у 30–40 % больных, получавших цитостатическую терапию данными препаратами [9].
В тех ситуациях, когда необходимо быстро увеличить количество гранулоцитов в крови, используют преимущественно препараты гранулоцитарного колониестимулирующего фактора (Г-КСФ), в
частности филграстим [5, 10, 13]. Вместе с тем становятся известными новые эффекты Г-КСФ в отношении кроветворения, которые требуют дальнейшего изучения механизмов действия этих препаратов. Кроме того, в большом количестве экспериментальных работ показано, что реализация гемостимулирующих эффектов Г-КСФ на фоне различных режимов цитостатической терапии происходит через воздействие на совершенно разные звенья регуляции системы крови [4, 6, 7].
Целью исследования явилась оценка эффективности филграстима в качестве корректора нарушений, возникающих в системе крови у больных раком молочной железы III–IV стадий в процессе химиотерапии по схеме доксорубицин/доцетаксел, и изучение механизмов, лежащих в основе гемостимулирующего эффекта препарата.
Материал и методы
Было обследовано 77 больных с морфологически верифицированным раком молочной железы III–IV стадий. Все пациентки получали химиотерапию (ХТ) по схеме, включающей внутривенное введение
50 мг/м2 доксорубицина (адриабластин, Фармация и Апджон С.п.А., Италия) в 1-й день и 75 мг/м2 доцетаксела (таксотер, Авентис Фарма, С.А., Франция) – во 2-й день. Длительность цикла составляла два дня, интервал между курсами – 3 нед. Из представленной группы больных 30 пациенток в перерывах между курсами ХТ получали филграстим подкожно в дозе 300 мкг, который вводился на 8-й и 12-й дни от последнего введения доцетаксела.
Показатели системы крови оценивали на протяжении 3 курсов химиотерапии. Капиллярную кровь для исследования забирали до и после каждого цикла цитостатического лечения. Проведение стернальных пункций осуществляли до начала лечения, а также после I и II курсов химиотерапии. Определение показателей периферической крови (лейкоциты, гемограмма) и дифференциальный подсчет миелограмм в стернальном пунктате производили стандартными гематологическими методами [4].
Клонирование клеток-предшественников гранулоцитопоэза (КОЕ-Г) из неприлипающих кариоцитов костного мозга и периферической крови больных, выделенных на градиенте плотности Histopaque-1077 (Sigma, США) (концентрация клеток 2,0×105 мл), осуществляли в полувязкой питательной среде на основе метилцеллюлозы. Интенсивность дифференцировки гемопоэтических предшественников определяли по величине индекса созревания (соотношение колоний к кластерам). Пролиферативную активность КОЕ изучали методом клеточного самоубийства с использованием гидроксимочевины. Колониестимулирующую (КСА) активность супернатантов от прилипающей и неприлипающей фракций костного мозга тестировали микрометодом в 96-луночных планшетах, КСА выражали количеством выросших гранулоцито-макрофагальных колоний (на 105 миелокариоцитов) [2, 4]. Протокол исследования одобрен этическим комитетом Томского НИИ онкологии.
Статистическую обработку полученных данных проводили методом вариационной статистики с использованием t-критерия Стьюдента.
Результаты и обсуждение
Химиотерапия больных раком молочной железы приводила к статистически значимому снижению количества лейкоцитов после завершения 1, 2 и 3-го курсов. Со стороны показателей периферической крови гемостимулирующий эффект препарата Г-КСФ проявлялся в выраженном увеличении общего количества лейкоцитов на всех этапах исследования, причем не только за счет сегментоядерных нейтрофилов, но и за счет лимфоцитов, моноцитов и палочкоядерных форм нейтрофильных лейкоцитов (рис. 1А, Б).
Картина периферической крови пациентов в целом соответствовала изменениям со стороны ми-
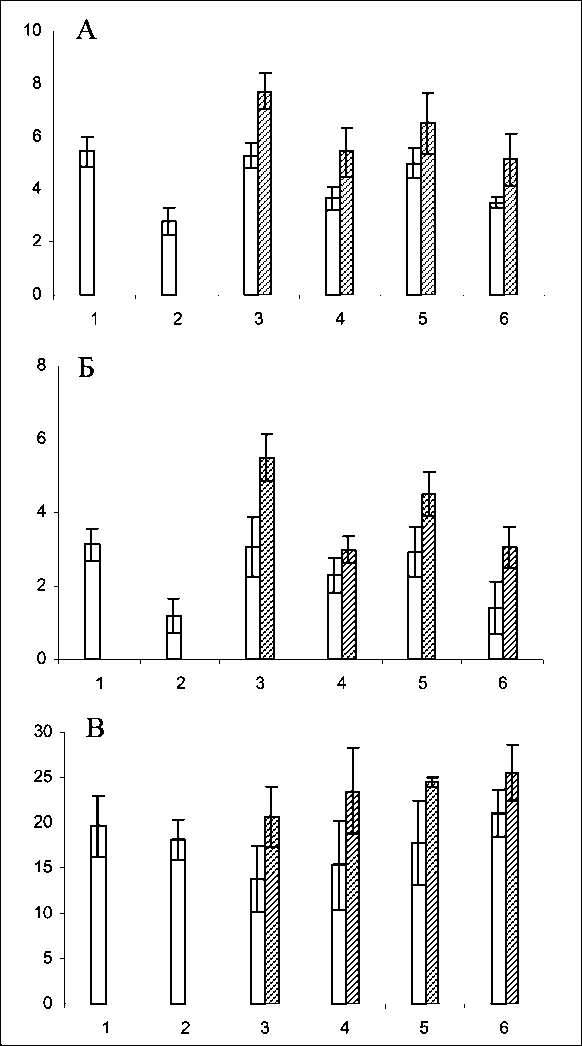
Рис. 1. Изменения общего количества лейкоцитов (А); содержания сегментоядерных нейтрофилов (Б) в периферической крови и уровня КСА (В) в сыворотке крови больных РМЖ в процессе химиотерапии с использованием доксорубицина и доцетаксела (прозрачные столбики), либо их комбинации с филграстимом (заштрихованные столбики). По оси абсцисс – сроки исследования (1 – до лечения, 2 – после первого курса, 3 – перед вторым курсом, 4 – после второго курса, 5 – перед третьим курсом, 6 – после третьего курса), по оси ординат – значения показателя; доверительные интервалы при р<0,05
елоидного ростка кроветворения. Применение филграстима в комбинации с режимом доксорубицин/ доцетаксел вызывало значительное возрастание количества зрелых нейтрофильных гранулоцитов на всех этапах (в 1,1–1,2 раза) и достоверный рост числа активно пролиферирующих морфологически идентифицируемых элементов гранулоцитарного ростка гемопоэза перед 2-м курсом химиотерапии (в 1,14 раза) по сравнению с контрольной группой больных (рис. 2А, Б). Данный факт позволяет говорить о том, что введение цитокина приводит к выраженной активации не только процессов дифференцировки, но и пролиферации в отделе морфологически дифференцируемых элементов нейтрофильного ростка кроветворения.
Как известно, состояние костномозгового кроветворения во многом зависит от функциональной активности пула кроветворных клеток-предшественников, способных давать начало определенному числу зрелых специализированных клеток крови [1, 2]. Нами установлено, что число КОЕ-Г в костном мозге больных РМЖ при лечении по схеме доксорубицин/доцетаксел достоверно возрастало лишь перед вторым курсом ХТ – на 47,1 %. Введение филграстима демонстрировало значительно больший рост числа гранулоцитарных клеток-предшественников в костном мозге больных. Этот показатель в основной группе больных перед вторым курсом ХТ был на 114 % выше, перед третьим курсом ХТ – на 156,6 %, чем у пациентов, получавших химиотерапию без введения гемостимулятора (рис. 2В). Поскольку количественное состояние пула любых незрелых клеток определяется интенсивностью пролиферации и дифференцировки составляющих его элементов, мы обратили особое внимание на изучение этих процессов в отделе прекурсоров грануломоноци-топоэза [1].
Вызванное цитостатическим лечением снижение пролиферативной активности гранулоцитарномакрофагальных предшественников в последний срок исследования полностью нивелировалось под влиянием препарата Г-КСФ. Более того, он вызывал повышение содержания в костном мозге
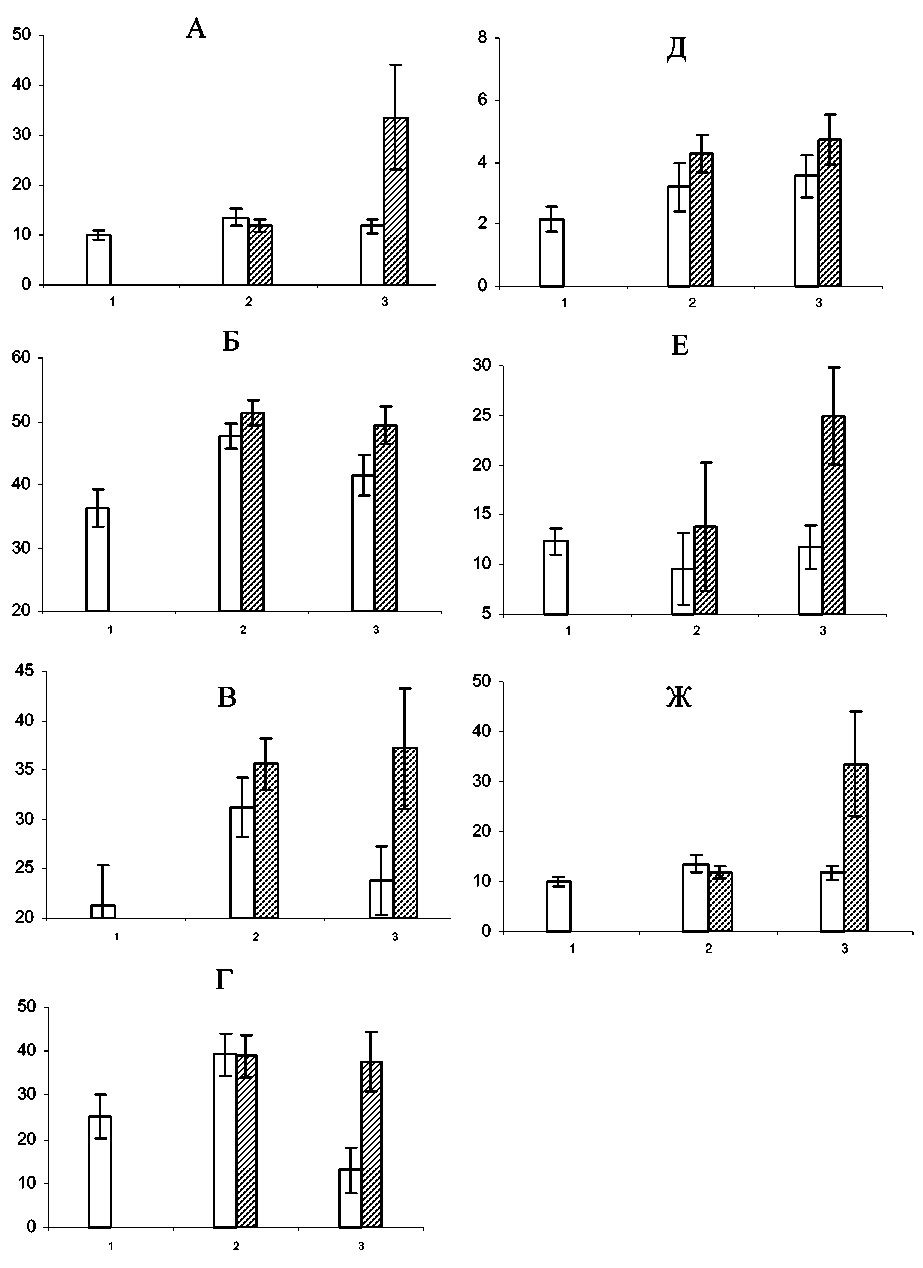
Рис. 2. Изменения содержания незрелых (А) и зрелых форм нейтрофильных гранулоцитов (Б), количество КОЕ-Г (В), доля КОЕ-Г в S-фазе митотического цикла (Г), интенсивность созревания КОЕ-Г (Д), уровень КСА в супернатантах от адгезирующих (Е) и неадгезирующих (Ж) миелокариоцитов в костном мозге больных РМЖ в процессе химиотерапии с использованием доксорубицина и доцетаксела (прозрачные столбики), либо их комбинации с филграстимом (заштрихованные столбики).
По оси абсцисс – сроки исследования
(1 – до лечения, 2 – перед вторым курсом, 3 – перед третьим курсом), по оси ординат – значения показателя; доверительные интервалы при р<0,05
больных данной группы КОЕ-ГМ, находящихся в S-фазе митотического цикла, до 288,8 % от уровня данного показателя в группе без филграстима. Одновременно с этим в группе пациенток, которым вводили филграстим на фоне таксан-содержащей схемы химиотерапии, как и в группе без стимулятора, наблюдалось ускорение созревания КОЕ-ГМ. Однако интенсивность этого процесса значительно возрастала как перед вторым (в 1,34 раза), так и перед третьим (в 1,33 раза) курсами ХТ по сравнению с контрольной группой (рис. 2Г, Д).
Традиционное мнение о том, что гемостимулирующее действие Г-КСФ обусловлено непосредственным его эффектом в отношении кроветворных клеток, не исключает возможности изменения под его влиянием функции добавочных клеток, формирующих микросреду в гемопоэтической ткани. В связи с этим нами были исследованы уровни КСА супернатантов костномозговых нуклеаров в процессе химиотерапии. Введение препарата Г-КСФ больным РМЖ, леченным по схеме доксорубицин/доцетаксел, вызывало достоверный рост уровня КСА от прилипающих и неприлипающих миелокариоцитов к началу третьего курса ХТ (рис. 2Е, Ж).
Назначение филграстима в перерывах между курсами ХТ вызывало значимое повышение КСА
Список литературы Механизмы активации филграстимом процессов восстановления гранулоцитарного ростка гемопоэза у больных раком молочной железы в условиях химиотерапии по схеме доксорубицин/доцетаксел
- Гольдберг Е.Д., Дыгай А.М., Жданов В.В. Роль гемопоэзиндуцирующего микроокружения в регуляции кроветворения при цитостатических миелосупрессиях. Томск: STT, 1999. 128 с.
- Дыгай А.М., Артамонов А.В., Бекарев А.А., Верещагин Е.И., Жданов В.В., Зюзьков Г.Н., Удут Е.В., Хричкова Т.Ю., Симанина Е.В., Ставрова Л.А., Мирошниченко Л.А., Чайковский А.В., Мадонов П.Г. Гемостимулирующие эффекты иммобилизированной гиалуронидазы и механизмы их развития при цитостатической миелосупрессии//Бюллетень экспериментальной биологии и медицины. 2010. Т. 149, № 5. С. 528-531.
- Манзюк Л.В., Артамонова Е.В. Таксотер в химиотерапии рака молочной железы//Русский медицинский журнал (Онкология). 2006. Т. 14, № 24. С. 1753-1757.
- Мирошниченко Л.А., Жданов В.В., Зюзьков Г.Н., Симанина Е.В., Ставрова Л.А., Удут Е.В., Хричкова Т.Ю., Минакова М.Ю., Гольдберг В.Е., Дыгай А.М. Механизмы гемостимулирующих эффектов гранулоцитарного КСФипантогематогена в условиях цитостатической миелосупрессии//Бюллетень экспериментальной биологии и медицины. 2010. Т. 150, № 12. С. 645-649.
- Anderlini P., Champlin R.E. Biologic and molecular effects of granulocyte colony-stimulating factor in normal individuals: recent findings and current challenges//Blood. 2008. Vol. 111 (4). P. 1767-1772.
- Barrios L., Poletti O.H. Effects of filgrastim on granulopoietic cells of mice pretreated with methotrexate//Biocell. 2005. Vol. 29 (1). P. 7-14.
- Dygai A.M., Zhdanov V.V., Miroshnichenko L.A., Zyuz’kov G.N., Udut E.V., Simanina E.V., Stavrova L.A., Khrichkova T.Y., Agafonov V.I. Comparison of specific activity of granulocytopoiesis stimulators after treatment with cytostatics with different mechanisms of action//Bull. Exp. Biol. Med. 2013. Vol. 155 (5). P. 631-635.
- Herceg D., Vrbanec D. The role of taxanes in breast cancer chemotherapy: what’s new 15 years after?//Lijec. Vjesn. 2009. Vol. 131 (5-6). P. 133-141.
- Ishikawa T., Shimizu S., Momiyama N. Ichikawa Y, Shimada H. Advanced in breast cancer chemotherapy//Nippon Rinsho. 2006. Vol. 64. P. 529-535.
- Lyman G.H., Reiner M., Morrow P.K., Crawford J. The effect of filgrastim or pegfilgrastim on survival outcomes of patients with cancer receiving myelosuppressive chemotherapy//Ann. Oncol. 2015. Vol. 26 (7). P. 1452-1458 DOI: 10.1093/annonc/mdv174
- Nabholtz J.M., Riva A. Taxane/anthracycline combinations: setting a new standard in breast cancer?//Oncologist. 2001. Vol. 6. Suppl. 3. P. 5-12.
- Pronzato P. New therapeutic options for chemotherapy-resistant metastatic breast cancer: the epothilones//Drugs. 2008. Vol. 68 (2). P. 139-146.
- Uddin S., Russell P., Farrell M., Davy B., Taylor J., Agrawal S.G. Use of biosimilar filgrastim compared with lenograstim in autologous haematopoietic stem-cell transplant and in sibling allogeneic transplant//Ther. Adv. Hematol. 2015. Vol. 6 (2). P. 53-60 DOI: 10.1177/2040620714565962


