Механизмы центральной организации уровня общей неспецифической реактивности организма
Автор: Мулик А.б, Гуров Д.Ю., Шурыгин А.Я., Мулик Ю.а, Постнова М.В., Назаров Н.о
Журнал: Природные системы и ресурсы @ns-jvolsu
Рубрика: Биология и биотехнология
Статья в выпуске: 1 (1), 2011 года.
Бесплатный доступ
В статье изложены морфологические, биохимические и биофизические характеристики головного мозга в зависимости от уровня общей неспецифической реактивности организма. Полученные результаты комплексно отражают специфику морфофункциональной организации центральной нервной системы, обеспечивающую индивидуализацию гомеостаза организма.
Уровень общей неспецифической реактивности организма, нейроны, кора головного мозга, антиоксидантная активность, биоэлектрическая активность мозга
Короткий адрес: https://sciup.org/14967325
IDR: 14967325 | УДК: 612.82
Текст научной статьи Механизмы центральной организации уровня общей неспецифической реактивности организма
Общие принципы взаимосвязей различных функций организма основаны на фундаментальных положениях общей теории систем и представлений о биологическом объекте как системе. Открытие системных закономерностей в деятельности живых организмов связано с именем П.К. Анохина, который впервые констатировал, что системы живых организмов не просто упорядочивают входящие в них отдельные элементы, но и объединяют их для осуществления отдельных, жизненно важных функций организма [1]. В целом организме взаимодействие функциональных систем стро-
ится на основе принципов иерархии, муль-типараметрического их взаимосоединения, последовательного взаимодействия и сис-темогенеза [12]. Любая функциональная система имеет принципиально однотипную организацию, универсальные центральные и периферические механизмы реализации. Одинаковая организация различных функциональных систем говорит об их изоморфизме. Одни и те же нервные клетки, особенно корковых отделов мозга, через различные синаптические образования могут участвовать в работе различных функциональных систем [15]. Тем самым объясняется индивидуальная общность степени проявлений активности и реактивности различных систем организма.
Обеспечение функционального единства всех систем организма неизбежно предполагает согласование средних уровней их активности. Это подтверждается особенностями деятельности центральной нервной системы (далее – ЦНС). Получаемые любым анализатором из ретикулярной формации сенсорно-неспецифические влияния являются генерализованными, а воздействие на тот или иной сенсорный вход так или иначе изменяет активность всех анализаторов.
Предпринятый поиск принципов организации единства выраженности функциональной активности всех систем организма привел к разработке интегративного критерия индивидуального гомеостаза – уровня общей неспецифической реактивности организма (УОНРО). В ранее выполненных исследованиях выявлена роль УОНРО в формировании компонентов нейрогуморального, иммунного, психофизиологического и соматического статуса организма [2; 10; 11]. При этом остается неразрешенным вопрос центральной организации УОНРО, что требует комплексного исследования ЦНС на уровне структурных особенностей нейронов, биоэлектрической активности и биохимических характеристик головного мозга.
В качестве объекта исследования, прежде всего, была задействована кора головного мозга. Как известно, кора является образованием, интегрирующим функции организма, обеспечивающие его нормальную жизнедеятельность. В коре находятся сенсорные системы (анализаторы) мозга, осуществляющие функцию восприятия раздражителей окружающей среды, за счет чего формируется поведение, начиная от безусловных рефлексов и вплоть до реализации сложнорефлекторной деятельности, регуляции сна и бодрствования, двигательной деятельности, происходит структуризация потребностей [4].
В настоящее время хорошо разработаны морфологические методы исследования нейронов, биофизические методы анализа биоэлектрических потенциалов ЦНС, биохимические методы оценки процессов метаболизма в головном мозге.
Предпринятые исследования были направлены на изучение специфики организации центральных механизмов гомеостаза организ- ма в зависимости от УОНРО. Работа осуществлялась в два этапа. На первом этапе выполнялись морфологические и биохимические исследования головного мозга на лабораторных животных, как в состоянии покоя, так и в условиях стрессорной нагрузки. На втором этапе проводились электроэнцефалографические исследования на людях.
Для реализации первого этапа использовались 32 белых крысы обоего пола, живой массой 220–300 г. Животные содержались в условиях естественного освещения группами в стандартных клетках Т-3. Кормление проводилось по типовому рациону согласно приказу МЗ № 1179 от 10.10 1983 г. при свободном доступе к воде. Температура воздуха в помещении вивария поддерживалась в пределах 18-22 ° С, относительная влажность – 50–60 %. В качестве показателя УОНРО использовался порог болевой чувствительности (ПБЧ). Для оценки ПБЧ применяли метод обеспечения электрораздражения подошвенной поверхности конечностей через стандартный электролит (0,005 М раствор хлорида натрия) при свободном размещении животных на контактирующей поверхности электропола. Основой электропола являлась стеклотекстолитовая пластина 30 х 50 см с поперечно закрепленными на ней медными шинами шириной 3 мм и интервалом 1,5 мм. Напряжение подавали между соседними токопроводящими шинами через лабораторный автотрансформатор и плавно повышали реостатом от 17 вольт и выше до возникновения реакции устранения конечностей от поверхности электропола. В момент возникновения данной реакции фиксировали напряжение электротока, принимая его за ПБЧ. При этом минимальному ПБЧ (17,5–20,4 вольт) соответствует высокий УОНРО, среднему (20,5–23,4 вольт) – средний УОНРО, максимальному ПБЧ (23,5– 26,4 вольт) – низкий УОНРО [9].
Эвтаназию животных производили одномоментно, путем декапитации. Вскрывали череп, извлекали головной мозг, отделяя его от спинного мозга на уровне выхода первой пары шейных нервов.
Для морфологического исследования материал помещали в 10 %-й раствор нейт- рального формалина. Препарат головного мозга рассекали двумя фронтальными разрезами с помощью острой бритвы на три блока. От момента извлечения головного мозга до погружения образца в фиксатор происходило не более 2 минут. После фиксации в формалине в течение 48 часов образцы тканей обезвоживали и заливали в парафин. С парафиновых блоков готовили срезы толщиной 4–6 мкм. Окрашивали гематоксилином и эозином [6; 14].
Площади ядер нейронов определяли во всех восьми цитоархитектонических областях коры головного мозга: затылочной ( О ), височной ( Т ), передней теменной ( РА ), собственно теменной ( Р ), задней лобной ( FP ), собственно лобной ( F ), островковой ( I ) и лимбической ( L ). Морфостереометрическое исследование нейронных образований коры головного мозга с определением объемной плотности ядер нейронов, объема ядер нейронов, удельной площади поверхности ядер нейронов, количества ядер нейронов в единице объема проводилось на микроскопе с использованием компьютерного анализатора изображений и программы «ВидеоТест-Морфо».
Для биохимического исследования материал гемогенизировали с 10 %-м раствором трихлоруксусной кислоты. Производили оценку активности ключевых ферментов антиоксидантной защиты – супероксиддисму-тазы (СОД), каталазы (КАТ) и определяли содержание малонового диальдегида (МДА) общепринятыми методами биохимического анализа [5].
Для реализации второго этапа было задействовано 28 человек 18–30-летнего возраста, распределенных в группы с учетом УОНРО. В качестве показателя УОНРО использовался ПБЧ. Для оценки ПБЧ у человека использовали анальгезиметр «Ugo Basile» (Италия), регистрирующий величину ноцицептивной реактивности путем автоматического измерения времени наступления рефлекторного устранения кисти от светового луча, оказывающего стабильное температурное воздействие пороговой силы на середину тыльной поверхности дисталь- ной фаланги среднего пальца. Время в секундах, необходимое для устранения кисти от светового луча, принималось равным величине ПБЧ. Определение ПБЧ производилось в состоянии покоя, при полном соматическом и психологическом равновесии [8]. Запись электроэнцефалограммы (ЭЭГ) осуществляли посредством совмещенного с компьютером (Pentium IV) 21-канального электроэнцефалографа-анализатора «Энце-фалан-131-03» фирмы «Медиком МТД» (Россия). Исследования производили в максимально затемненной комнате монополярно, по международной схеме «10–20», в положении сидя, в состоянии спокойного бодрствования при открытых и закрытых глазах, а также при фото- и фоностимуляции с частотой предъявления стимула в 3, 5, 10, 15 и 27 Гц. Референтные электроды крепились к мочкам ушей. Предварительная обработка ЭЭГ проводилась с использованием программного обеспечения, входящего в комплект поставки комплекса. В качестве показателей биоэлектрической активности мозга использовали ЭЭГ-проявления альфа- и бета-ритма.
Статистическую обработку данных проводили с помощью пакета программ Microsoft Excel XP, программ Biostatistics 4.03 и Origin Pro 7.0 с использованием критерия Стьюдента [3; 7].
Результаты исследования структурных характеристик нейронов коры головного мозга представлены в таблице (см. табл. 1).
Полученные данные свидетельствуют о наличии четких взаимосвязей исследуемых показателей и УОНРО, где у животных с низким УОНРО площади ядер нейронов коры головного мозга превышают таковые у особей с высоким УОНРО. При этом по большинству сравнений во втором, третьем, пятом, шестом и седьмом слоях наблюдаются достоверные различия исследуемого показателя между группами наблюдения.
Параллельное исследование осуществлялось на животных, подвергшихся хроническому психоэмоциональному стрессу, который моделировали путем 2-часовой иммобилизации через день в течение трех недель.
Таблица 1
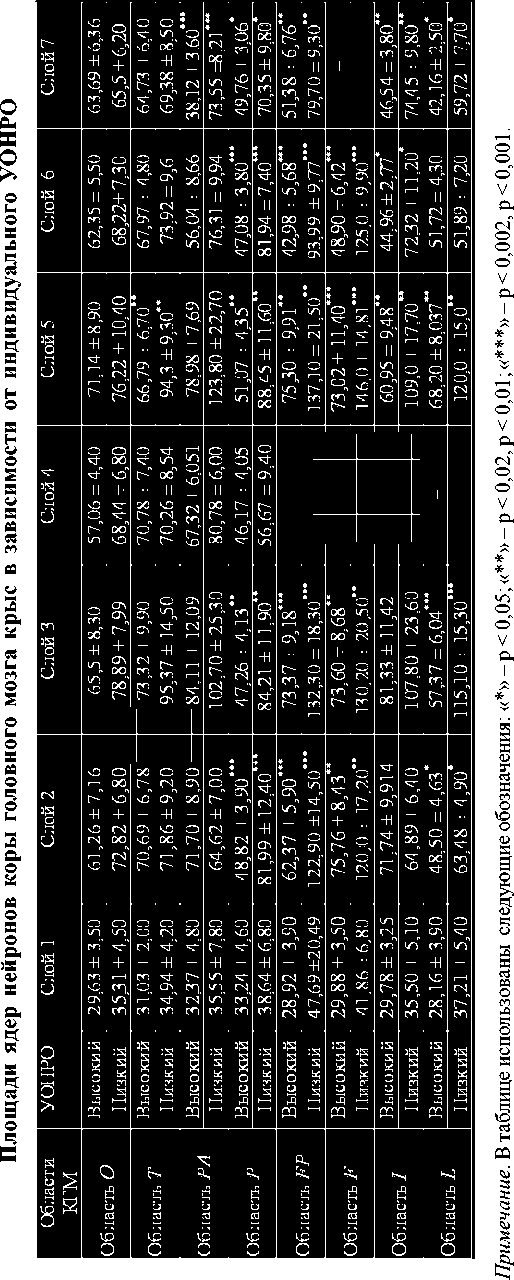
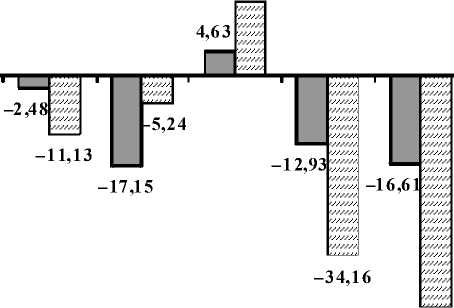
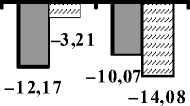
Фиксирование препаратов мозга и изготовление срезов осуществляли аналогично предыдущему опыту. Площадь ядер коры головного мозга у животных, подвергшихся стрессу, определяли, как и у интактных особей, в восьми цитоархитектони-ческих областях коры. Результаты изменения площадей ядер нейронов представлены на рисунке 1.
Полученные данные свидетельствуют о снижении площади ядер нейронов у животных как с высоким, так и с низким УОНРО в большинстве областей коры головного мозга, за исключением собственно теменной области, в которой зафиксировано увеличение значений анализируемого показателя.
На срезах, окрашенных по Нисслю, определяли степень поражения нейронов [13]. Производился подсчет нейронов коры, которые разделили на четыре группы: 1) нейроны нормальные, неизмененные (НН); 2) слабоиз-мененные нейроны (СН) с сохранением ядра, но со структурными или тинкториальными изменениями компонентов цитоплазмы (острое набухание, гиперхроматоз, хроматолиз, центральная тинкториальная ацидофилия); 3) грубо измененные нейроны (ГН) (сморщивание,
«тяжелое изменение», гомогенизирующее изменение нейронов, клетки-тени); 4) нейроны отсутствующие (ОН).
Степень поражения нейронов вычисляли по формуле:
СП = (2ОН + 2ГН + СН) X 100/2(ГН + + ОН + СН + НН) и выражали в процентах, согласно рекомендаций А.И. Чубинидзе [13].
Выделяли 4 степени поражения: легкая (менее 20 %), средняя (20–50 %), тяжелая (более 50 %), сплошной некроз.
Степень поражения нейронов коры головного мозга отражена в таблице 2.
Представленные данные свидетельствуют об отсутствии дистрофических изменений в нейронах коры головного мозга у животных с низким УОНРО по критерию А.И. Чубинид-зе (степень поражения нейронов менее 20 %). При этом у животных с высоким УОНРО дистрофические изменения нейронов коры головного мозга носят системный характер, охватывая переднюю теменную, заднюю лобную, собственно лобную, островковую и лимбическую области.
Результаты биохимического анализа тканей головного мозга белых крыс представлены в таблице 3.
кв. мкм
-10
-20
-30
-40

–8,36
13,79
–44,08
-50
O T PA P FP F I L
Высокий УОНРО
Низкий УОНРО
Рис. 1. Изменения среднеарифметических значений площадей ядер нейронов коры головного мозга крыс после стрессорного воздействия в зависимости от УОНРО
Таблица 2
Степень поражения коры головного мозга крыс после стрессорного воздействия в зависимости от УОНРО
|
Области КГМ |
УОНРО |
Слой 1 |
Слой 2 |
Слой 3 |
Слой 4 |
Слой 5 |
Слой 6 |
Слой 7 |
|
Область О |
Высокий |
2,6 |
2,9 |
4,67 |
2,7 |
4,44 |
3,6 |
2,41 |
|
Низкий |
1,4 |
3,2 |
1,32 |
1,25 |
2,04 |
1,8 |
1,59 |
|
|
Область Т |
Высокий |
1,25 |
2,03 |
3,1 |
0,8 |
4,9 |
0,7 |
1,15 |
|
Низкий |
1,35 |
0,89 |
1,5 |
1,6 |
0,9 |
0,7 |
0,77 |
|
|
Область РА |
Высокий |
32,5* |
58,5* |
57,0* |
55,0* |
66,0* |
23,0* |
18,3 |
|
Низкий |
1,32 |
2,86 |
3,3 |
2,0 |
3,8 |
4,2 |
2,91 |
|
|
Область Р |
Высокий |
7,6 |
6,4 |
13,2 |
7,39 |
16,2 |
3,2 |
2,31 |
|
Низкий |
0 |
4,5 |
5,4 |
7,35 |
2,05 |
1,6 |
1,92 |
|
|
Область FP |
Высокий |
56,0* |
53,4* |
52,0* |
– |
61,0* |
40,0* |
38,1* |
|
Низкий |
4,55 |
9,7 |
10,0 |
– |
2,1 |
10,0 |
9,2 |
|
|
Область F |
Высокий |
1,9 |
52,0* |
69,0* |
– |
69,5* |
37,0* |
– |
|
Низкий |
2,1 |
11,0 |
13,0 |
– |
11,0 |
8,3 |
– |
|
|
Область I |
Высокий |
9,09 |
26,6* |
30,0* |
– |
20,0* |
15,0 |
12,2 |
|
Низкий |
1,5 |
1,2 |
1,4 |
– |
2,1 |
2,2 |
1,3 |
|
|
Область L |
Высокий |
13,0 |
30,0* |
33,6* |
– |
32,8* |
14,0 |
12,1 |
|
Низкий |
0 |
4,7 |
7,43 |
– |
8,09 |
6,3 |
0 |
Примечание. Знаком «*» обозначается наличие дистрофических изменений (20 % и больше).
Таблица 3
Выраженность биохимических показателей антиоксидантной активности тканей головного мозга у интактных и стрессированных белых крыс с различным УОНРО
|
УОНРО |
Содержание МДА (нмоль/г ткани) |
Активность КАТ (мКат/л) |
Активность СОД (ед. активности/мг белка) |
|||
|
Фон |
Стресс |
Фон |
Стресс |
Фон |
Стресс |
|
|
Высокий |
60,7 ± 10,17 |
94,3 ±2,16 |
495,5 ± 20,50 |
585,2 ± 24,50 |
7,05 ± 0,395 |
5,81 ± 0,250 |
|
Средний |
62,4 ± 3,81 |
87,4 ± 8,84 |
441,3 ± 15,30 |
536,8 ± 21,20 |
6,41 ± 0,563 |
6,22 ± 0,533 |
|
Низкий |
42,8 ± 7,10 |
91,0 ± 10,25 |
184,5 ± 14,20 |
250,5 ± 12,30 |
6,52 ± 0,260 |
5,56 ± 0,211 |
Статистический анализ полученных данных выявил достоверное (р < 0,05) изменение величин исследуемых показателей при стрес-сировании животных, за исключением показателя активности СОД в группе крыс со средним УОНРО. Существующие различия фоновых величин исследуемых показателей, между группами УОНРО, обладают более выраженной спецификой. Так, по содержанию МДА различия между группами с высоким и средним УОНРО не достигают достоверных значений, различия между группами с высоким и низким УОНРО, а также группами со средним и низким УОНРО обладают достоверностью с p < 0,001. Активность СОД также характеризуется максимальной выраженностью в группе с высоким УОНРО. При этом достоверность различий между группами с высоким и низким УОНРО достигает р < 0,01, различия между группами со средним и низким УОН-РО недостоверны.
Результаты исследования биоэлектрической активности мозга представлены стандарт- ными показателями ЭЭГ. Определены фоновые величины индексов альфа- и бета-активности у индивидов с различным УОНРО (рис. 2).
Установлено, что у индивидов с высоким УОНРО индекс бета-активности составляет 70,2 ± 3,54 %, а у индивидов с низким УОНРО – 52,1 ± 3,84 %, различия достоверны (р < 0,002). В группе с низким УОНРО на фоне слабо выраженной бета-активности индекс альфа-активности в состоянии покоя достоверно выше, чем у индивидов с высоким УОНРО – 80,2 ± 5,24 % и 63,1 ± 2,12 % соответственно (р < 0,01).
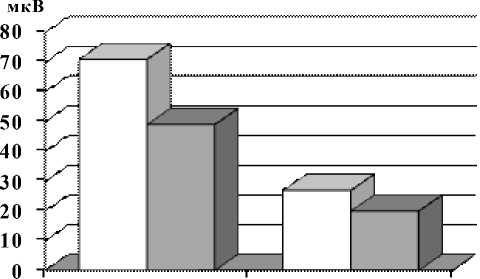
Результаты анализа выраженности амплитуд альфа- и бета-активности в экспериментальных группах представлены на рисунке 3. Установлено, что амплитуда альфа-активности в группе с высоким УОНРО составила 69,8 ± 3,54 мкВ, а в группе с низким УОНРО – 51,6 ± 3,84 мкВ, что выводит их различия на уровень достоверности с p < 0,002. Амплитуда бета-активности для высокого УОНРО составила 29,8 ± 2,25 мкВ, а для низкого – 22,6 ± 2,30 мкВ, что соответствует уровню различий с р < 0,05.
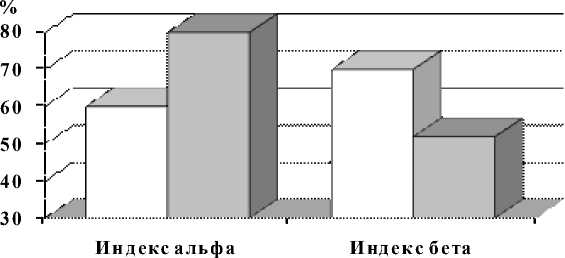
Рис. 2. Зависимость выраженности индексов альфа- и бета-активности от УОНРО
-
□Высокий УОНРО
-
□Низкий УОНРО
□Высокий
УОНРО
□Низкий УОНРО
Амплитуда альфа-активности
Амплитуда бета-активности
Рис. 3. Зависимость амплитуд альфа- и бета-активности от УОНРО
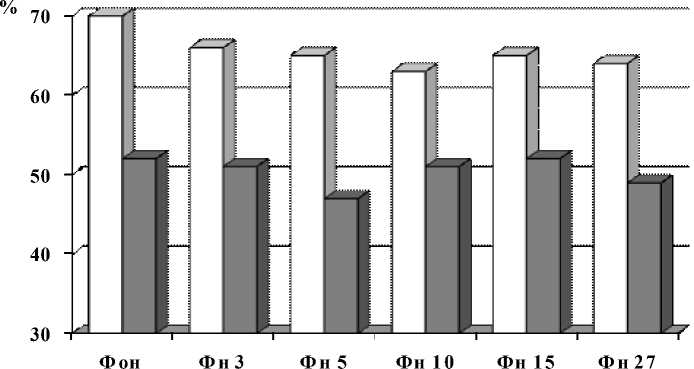
Определен характер изменений индекса бета-активности при фото- и фоности- муляции в группах с высоким и низким УОНРО (рис. 4, 5).
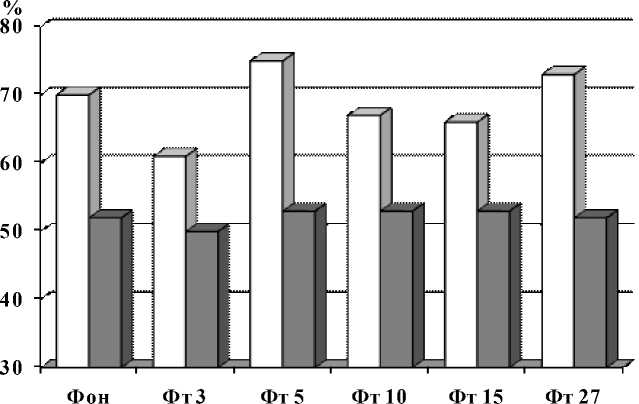
Рис. 4. Индексы бета-активности у индивидов с различным УОНРО при фотостимуляции
-
□Высокий УОНРО
-
□Низкий УОНРО
DВысокий УОНРО
□Низкий УОНРО
Рис. 5. Индексы бета-активности у индивидов с различным УОНРО при фоностимуляции
Было выявлено, что в группе с высоким УОНРО индекс бета-активности как в состоянии покоя, так и при фоно- и фотостимуляции с различной частотой раздражителя (3, 5, 10, 15 и 27 Гц) выше, чем в группе с низким УОНРО.
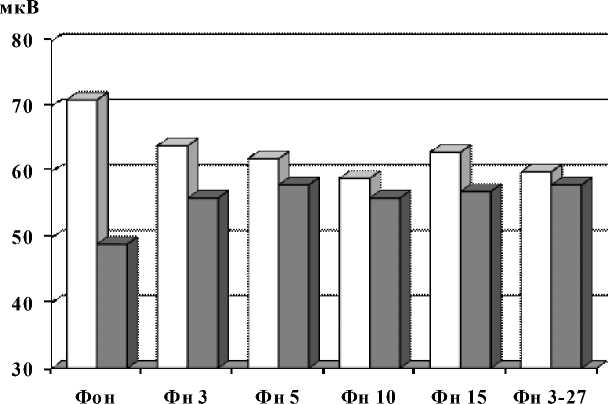
Кроме того, определена специфика проявления амплитуд альфа-активности у лиц с различным УОНРО при фото- и фоностимуляции (рис. 6; 7). При фотостимуляции достоверное снижение анализируемого показателя выявлено только в группе с высоким УОН-РО по всем режимам фотостимуляции относительно фона (69,8 ± 3,54). Средняя арифметическая и соответствующий разброс по сумме всех вариантов фотостимуляции составили 49,2 ± 4,37 мкВ, что выводит дос- товерность различий с фоновой величиной на p < 0,05 (рис. 6).
При фоностимуляции (рис. 7) суммарное снижение амплитуды альфа-активности относительно фона у индивидов с высоким УОНРО достигло 61,1 ± 2,32 мкВ, что соответствует достоверности различий с фоновой величиной p < 0,05.
Наряду с анализом выраженности основных ритмов ЭЭГ была изучена амплитуда альфа-активности в затылочной области у индивидов с различным УОНРО при функциональной пробе «открытые – закрытые глаза», что позволило выявить характерологическое проявление альфа-активности в данном режиме наблюдений (рис. 8).
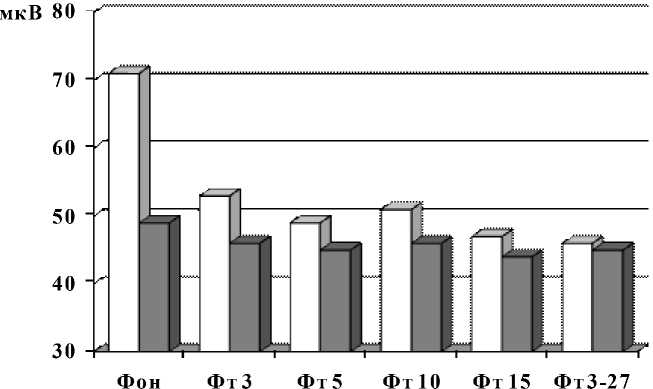
Рис. 6. Амплитуда альфа-активности у индивидов с различным УОНРО при фотостимуляции
-
□ Высокий УОНРО
-
■ Низкий УОНРО
□ Высокий УОНРО
□ Низкий УОНРО
Рис. 7. Амплитуда альфа-активности у индивидов с различным УОНРО при фоностимуляции
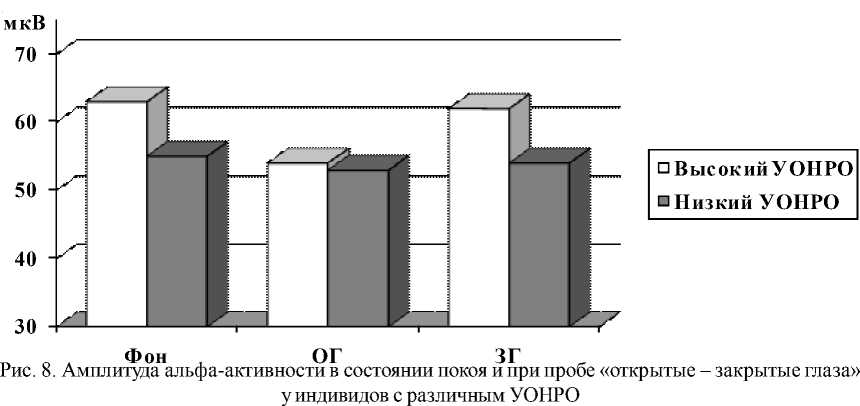
В состоянии покоя с закрытыми глазами у испытуемых с высоким УОНРО наблюдается достоверное (p < 0,05) преобладание амплитуды альфа-активности относительно индивидов с низким УОНРО (63,2 ± 3,30 мкВ и 55,1 ± 0,50 мкВ соответственно). При открытии глаз у индивидов (как с высоким, так и с низким УОНРО) наблюдалось подавление альфа-активности. Более значимое угнетение амплитуды альфа-ритма наблюдалось в группе с высоким УОНРО. В первые секунды после открытия глаз у индивидов с высоким УОНРО по сравнению с фоном происходит достоверное (p < 0,05) снижение амплитуды альфа-активности (от 63,2 ± 3,30 мкВ до 54,4 ± 1,40 мкВ); в группе с низким УОНРО существенных изменений не наблюдается (от 55,1 ± 0,50 мкВ до 53,1 ± 0,60 мкВ). После закрытия глаз у лиц с высоким УОНРО альфа-ритм восстанавливается полностью либо с увеличением амплитуды альфа активности (от 54,4 ± 1,40 мкВ до 63,2 ± 3,30 мкВ), что характерно для лабильной нервной системы. У индивидов с низким УОНРО альфа-ритм восстанавливался не полностью или не восстанавливался вообще и в среднем характеризовался изменениями от 53,1 ± 0,60 мкВ до 54,2 ± 0,50 мкВ.
В результате анализа ЭЭГ-показателей было определено, что индивиды с высоким УОНРО характеризуются повышенной бета-активностью, независимо от ее локализации; низким индексом альфа-активности; нерегулярной частотой альфа-активности; высокой реактивностью при пробах «открытые – закрытые глаза» и фото- и фоностимуляции. Ин- дивиды с низким УОНРО характеризуются высоким индексом альфа-активности в затылочной области на фоне слабо выраженной бета-активности; достаточно стабильной частотой альфа-активности как в состоянии покоя, так и при фото- и фоностимуляции. При пробах «открытые – закрытые глаза», а также при фото- и фоностимуляции амплитуда альфа-активности относительно фона изменяется несущественно.
Обобщая результаты выполненных исследований, следует выделить ряд принципиальных позиций.
Во-первых, выявлены различия в структуре нейронов коры головного мозга у крыс в зависимости от УОНРО, заключающиеся в относительном преобладании площади ядер нейронов у особей с низким УОНРО. Стрес-сирование вызывает легкое изменение нейронов у животных с низким УОНРО, на фоне выраженных структурных поражений нейронов коры головного мозга у представителей высокого УОНРО.
Во-вторых, полученные данные биохимического анализа тканей мозга свидетельствуют о наличии зависимости выраженности показателей антиоксидантной активности от УОНРО. При этом максимальными значениями активности КАТ и СОД обладают животные с высоким, а минимальным содержанием МДА – с низким УОНРО. Представленные результаты позволяют констатировать, что с увеличением УОНРО активируются процессы перекисного окисления липидов в головном мозге. Выявленные особенности предопределяют прямую взаимосвязь интенсивности метаболизма и УОНРО.
В-третьих, ЭЭГ-исследования определяют наличие повышенной подвижности и неуравновешенности нервных процессов, поведенческой активности, повышенной психической возбудимости индивидов с высоким УОНРО и выраженную стабильность функционирования ЦНС у испытуемых, обладающих низким УОНРО.
Таким образом, выявлена специфика организации центральных механизмов формирования уровня общей неспецифической реактивности, обеспечивающего индивидуализацию гомеостаза организма.
Список литературы Механизмы центральной организации уровня общей неспецифической реактивности организма
- Анохин, П. К. Узловые вопросы теории функциональной системы/П. К. Анохин. -М.: Наука, 1980. -196 с.
- Вариабельность адаптационных резервов организма человека в зависимости от уровня общей неспецифической реактивности/М. В. Постнова, Ю. А. Мулик, В. В. Новочадов, А. Б. Мулик//Российский медико-биологический вестник им. академика И.П. Павлова. -2010. -№ 3. -С. 25-31.
- Гланц, С. Медико-биологическая статистика: пер. с англ./С. Гланц. -М.: Практика, 1998. -459 с.
- Данилова, Н. Н. Физиология высшей нервной деятельности: учебник/Н. Н. Данилова, А. Л. Крылова. -М.: Учеб. лит., 1997. -432 с.
- Камышников, В. С. Справочник по клинико-биохимическим исследованиям и лабораторной диагностике/В. С. Камышников. -3-е изд. -М.: МЕДпресс-информ, 2009. -896 с.
- Коржевский, Д. Э. Основы гистологической техники/Д. Э. Коржевский, А. В. Гиляров. -СПб.: СпецЛит, 2010. -95 с.
- Лакин, Г. Ф. Биометрия: учеб. пособие для биол. спец. вузов./Г. Ф. Лакин. -4-е изд., перераб. и доп. -М.: Высш. шк., 1990. -352 с.
- Мулик, А. Б. Оптимизация медико-биологического эксперимента in vivo/А. Б. Мулик. -Волгоград: Изд-во ВИЭСП, 2003. -212 с.
- Мулик, А. Б. Уровень общей неспецифической реактивности организма: разработка, оценка, практическое применение/А. Б. Мулик. -Волгоград: Изд-во ВолГУ, 2001. -144 с.
- Мулик, А. Б. Уровень общей неспецифической реактивности организма человека/А. Б. Мулик, М. В. Постнова, Ю. А. Мулик. -Волгоград: Волгогр. науч. изд-во, 2009. -224 с.
- Постнова, М. В. Соматотипические корреляты уровня общей неспецифической реактивности организма/М. В. Постнова, Ю. А. Мулик, А. Б. Мулик//Валеология. -2009. -№ 2. -С. 25-32.
- Судаков, К. В. Физиология. Основы и функциональные системы: курс лекций/К. В. Судаков. -М.: Медицина, 2000. -784 с.
- Чубинидзе, А. И. К методике гистологического (морфологического) определения степени поражения центральной нервной системы/А. И. Чубинидзе//Архив патологии. -1972. -№ 11. -С. 77-78.
- Шубич, М. Г. Экономный метод дифференциального гистохимического анализа полисахаридов/М. Г. Шубич, Ж. К. Лопунова, Г. М. Могильная//Архив анатомии. -1966. -№ 1. -С. 71-74.
- Dickenson, A. The inhibitory effects of thalamic stimulation on the spinal transmission of nociceptive information in therat/A. Dickenson//Pain. -1983. -Vol. 17. -P. 213-224.


