Механизмы дезактивации цеолита H-ZSM-5 в процессе каталитической трансформации метанола в углеводороды
Автор: Бровко Роман Викторович, Мушинский Лев Сергеевич, Долуда Валентин Юрьевич
Журнал: Бюллетень науки и практики @bulletennauki
Рубрика: Химические науки
Статья в выпуске: 11 т.6, 2020 года.
Бесплатный доступ
Дезактивация цеолитов в процессе трансформации метанола в углеводороды представляет собой сложный химический процесс, включающий в себя обратимую и необратимую деградацию активных центров. Необратимая дезактивация катализатора связана с деградацией активных центров при длительном функционировании последних в условиях высокотемпературного воздействия водяного пара, одного из основных продуктов реакции. Образование отложений углерода на поверхности катализатора является основной причиной обратимой дезактивации. Образование углерода может происходить как в полостях каналов цеолитов, что обычно приводит к изменению селективности процесса по легким углеводородам, так и в местах соединения каналов, что приводит к блокировке пор и уменьшению активности катализатора. Кроме того, осаждение углерода может произойти непосредственно на активном центре цеолита, что также снижает активность катализатора. Исследование скорости дезактивации синтезированных каталитических систем от времени производилась в трубчатой реакторной установке непрерывного действия, состоящей из реактора получения диметилового эфира и реактора трансформации диметилового эфира в углеводороды. Определение кинетических закономерностей процесса дезактивации цеолита H-ZSM-5 позволяет адекватно описать реальное протекание процесса каталитической трансформации метанола в углеводороды. В результате решения дифференциальных уравнений дезактивации катализатора численными методами получены значения констант и энергий активаций. На основе значений предэкспоненциальных множителей и энергий активации была определена оптимальная область условий проведения процесса каталитической трансформации метанола в углеводороды, обеспечивающая минимальную скорость дезактивации катализатора, Pобщ = 1 атм., W (метанола) = 2,3 кг (метанола) / (кг (кат) × ч), t=330-360 °C, что коррелирует с результатами литературных данных по трансформации метанола на цеолите типа H-ZSM-5.
Метанол, трансформация, катализатор, цеолит
Короткий адрес: https://sciup.org/14117680
IDR: 14117680 | УДК: 544.47 | DOI: 10.33619/2414-2948/60/03
Текст научной статьи Механизмы дезактивации цеолита H-ZSM-5 в процессе каталитической трансформации метанола в углеводороды
Бюллетень науки и практики / Bulletin of Science and Practice
Дезактивация цеолитов в процессе трансформации метанола в углеводороды является одной из наиболее острых проблем этого способа получения углеводородов. Дезактивацию катализатора можно разделить на а) необратимую дезактивацию цеолита, связанную с деградацией активных центров цеолита в процессе трансформации метанола в углеводороды, б) обратимую дезактивацию углеводородов, обусловленную отложением углерода на поверхности катализатора в процессе трансформации метанола в углеводороды.
-
а) Необратимая дезактивация
Необратимая дезактивация катализатора связана с деградацией активных центров при длительном функционировании последних в условиях высокотемпературного воздействия водяного пара, одного из основных продуктов реакции, что в свою очередь приводит к вымыванию кремния и алюминия [1–4] с поверхности цеолита, в результате чего изменяется количество и сила кислотных центров [5]. Кроме того, одним из возможных gentq дезактивации цеолита может являться образование карбидов кремния и алюминия не активных в процессе трансформации метанола в углеводороды. В обоих случаях происходит уменьшение числа и силы активных центров [5].
-
б) Обратимая дезактивация.
Образование отложений углерода на поверхности катализатора является основной причиной обратимой дезактивации цеолитов [6–7]. Образование углерода может происходить как в полостях каналов цеолитов, что обычно приводит к изменению селективности процесса по легким углеводородам, так и в местах соединения каналов, что приводит к блокировке пор и уменьшению активности катализатора [8–9]. Кроме того, осаждение углерода может произойти непосредственно на активном центре цеолита, что также снижает активность катализатора [9–11].
Учет дезактивации катализатора в кинетических моделях представляет собой достаточно сложную задачу, связанную с отсутствием учета механизма дезактивации.
Так в работе [12], для учета дезактивации катализатора, был введен коэффициент β на который помножается скорость реакций для исходного катализатора (1).
r i = riop (1)
где r i — действительная скорость процесса, r i0 — скорость процесса для исходного катализатора, β — коэффициент дезактивации катализатора.
В свою очередь коэффициент дезактивации может быть разделен на две составляющие α и ƒ. Коэффициент α — является коэффициентом необратимой дезактивации катализатора, которая связана с деградацией активных центров в основном потерей алюминия в процессе каталитической трансформации метанола. Коэффициент ƒ — является коэффициентом обратимой дезактивации катализатора, которая связана с образованием отложений углерода в порах катализатора. При этом активность науглероженного катализатора может быть восстановлена путем его отжига в токе кислорода или воздуха (2).
в = of (2)
где β — коэффициент дезактивации катализатора, α — коэффициент необратимой дезактивации катализатора, ƒ — коэффициентом обратимой дезактивации катализатора
Для коэффициента необратимой дезактивации было выведено уравнение зависимости его изменения от температуры (3).
—
— = -КаОе RTam;m > 1 dt аи где d~ — изменение коэффициента необратимой дезактивации от времени, Еа кажущаяся энергия необратимой дезактивации катализатора, Ка0 — предэкспоненциальный множитель, R — газовая постоянная, T — температура протекания процесса, m — порядок реакции необратимой дезактивации катализатора.
Потеря активности в связи с образованием слоя углерода на поверхности катализатора может быть выражена Формулой 4.
df
4 =-К$п;п>1 dt где ^— — изменение коэффициента обратимой дезактивации от времени, Кг — dt j константа скорости образования углерода на поверхности катализатора, β — коэффициент дезактивации катализатора, n — порядок реакции образования углерода на поверхности катализатора.
Объединяя уравнения для обратимой и необратимой дезактивации катализатора получаем уравнение для определения общей скорости дезактивации катализатора (5).
d$
^ = I(-«fP ” -icrp)
где a — коэффициентом необратимой дезактивации катализатора, К$ — константа скорости образования углерода на поверхности катализатора, Ка — константа необратимой дезактивации цеолита, m — порядок реакции необратимой дезактивации катализатора.
Представленные способы учета дезактивации являются частными и не учитывают механизм протекания дезактивации, в связи с чем, разработка более точных моделей дезактивации является актуальной задачей.
Материал и методы исследования
В экспериментах использовался цеолит типа H-ZSM-5 (HKC, Hong-Kong) в натриевой форме. Для перевода цеолита в кислотную форму 20 г цеолита помещались в 250 мл 1М раствора NH 4 Cl и перемешивались в течение 4 часов, после чего проводилось центрифугирование при 4000 об/мин в течение 15 минут. Осадок промывался три раза дистиллированной водой и сушился при 105 °С и кальцинировали при 700 °С в течение 6 часов. Исследование скорости дезактивации синтезированных каталитических систем производилась в трубчатой реакторной установке непрерывного действия, состоящей реактора получения диметилового эфира и реактора трансформации диметилового эфира в углеводороды. В реакторе трансформации метанола в диметиловый эфир помещалось 10,2 г оксида алюминия в качестве катализатора, в реактор синтеза углеводородов помещалось 6,3 г исследуемых катализаторов. Реакторы догревались до 320–370 °С Скорость подачи диметилового эфира (ДМЭ) поддерживалась на уровне 0,1–4,2 г (ДМЭ) / (г (Кат)×ч). Анализ продуктов реакции проводили методом газовой хроматографии с использованием газового хроматографа Кристалл-2000 (Россия, Хроматэк), оснащенного пламенно ионизационным детектором и детектором по теплопроводности. Количество образующихся жидких углеводородов также определялось гравиметрическим методом.
Результаты и обсуждение
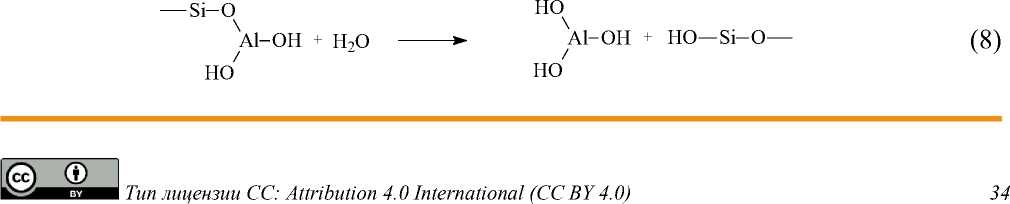
Деградация Бренстедовских кислотных центров при паровой обработке может быть выражена Фрмулами 6–8, где первые две стадии могут считаться обратимыми. При этом кальцинирование катализатора приводит к дегидратации поверхности катализатора, в связи с чем происходит практически полное восстановление его активности.
Si O O Si \ /
|
Al O |
+ H 2 O |
Si O Al OH + HO Si O / Si O |
(6) |
||
|
i |
|||||
|
Si O |
) Al OH + / > |
Si O \ |
HO Si O |
(7) |
|
|
Si O |
H2O |
Al OH + / HO |
|||
Последняя стадия дезактивации приводит к необратимому гидролизу активного центра катализатора и образованию аморфного гидроксида алюминия, который вымывается в процессе реакции или образует отдельную фазу оксида алюминия при прокаливании. В любом случае при последовательном протекании всех трех стадий ступенчатого гидролиза активного центра происходит полное разрушение активного центра и как следствие уменьшение активности катализатора.
Обратимая дезактивация является результатом адсорбции тяжелых полиароматических соединений на поверхности активного центра или в канале цеолита, что в первом случае является причиной потери активности только одного активного центра, а во втором случае может стать причиной потери активности целой группы активных центров (Рисунок).
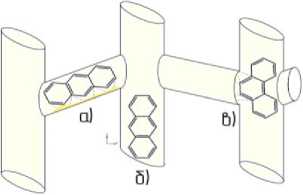
Рисунок. Адсорбция антрацена и фенантрена в каналах цеолита Н-ZSM-5 а) адсорбция в синусоидальных каналах, б) адсорбция в прямых каналах, в) адсорбция на местах стыка прямых и синусоидальных каналов.
На основании приведенного выше химизма можно записать схему паровой дезактивации активных центров цеолита (9–11).
[Ац]+Н20^ [Ац]хН20(9)
[Лц]хН20 +H2Oe [Ац]х2Н2О(10)
[Ац]х2Н2О +H2O^ [Ац]хЗН2О(11)
где [Ац] — доля поверхности, занимаемая свободными активными центрами; [Лц] х Н 2 О — доля поверхности, занимаемая моногидратированными активными центрами; [Ац] х 2Н 2 О — доля поверхности, занимаемая дигидратированными активными центрами; [Ац] х ЗН 2 О — доля поверхности, занимаемая тригидратированными активными центрами;
А схема дезактивации каталитических центров в результате адсорбции тяжелых ароматических соединение может быть выражена Формулой 12.
[Ац]+С14+ ~[Ац] х С (12)
где [Ац] — доля поверхности, занимаемая свободными активными центрами; [Ац] х С — доля поверхности, занимаемая активными центрами с адсорбированными полиаромтическими соединениями.
сс) ® |
С учетом равновесного характера реакций 9–10, скорость дезактивации цеолита по данному пути может быть записана системой уравнений 13–14.
d(Au)
Л=~ = -0Ац(к1Р(Н2О) + k4p(C14+)
^(^ ц ) полн. _ - кзК1К2рН2о(1 - 0Ацх2Н2о - 0Ацхзн2о - 0Ацхс ) (14)
dt = 1 + К1р(Н2О)
где 0Ац — доля поверхности, занимаемая свободными активными центрами; k i , k 2 , к з , k 4 — константа скорости реакции (9–12), 1/с; K 1 , K 2 — константа равновесия реакции (9–10); р(Н2О) — давление водяных паров в реакции, атм; p(C14+) — давление паров полиароматических соединений, атм.
Которые с учетом уравнения Аррениуса можно выразить уравнениями 15–16.
(4ц ) о —1акт —такт 14+
^t = - 0 Ац(к1е RT Р (Н2О) + к4к4е RT Р (С ))
-
d(A ц ) полн.
dt 0 о9
Е Закт £ 1 £ 2
кое RT К °Р RT K 2° e ят р3Н2 о (1-0 Ацх2Н 2 О -в Ацхзн 2 О
-
& Ацхс )
£ 0
1 + К0е~^гр(Н2^)
где k0 1 — предэкспоненциальный множитель константы скорости реакции (9), 1/(атм с), k0 2 — предэкспоненциальный множитель константы скорости реакции (10), 1/(атм с), k0 3 — предэкспоненциальный множитель константы скорости реакции (11), 1/(атм с), k0 4 — предэкспоненциальный множитель константы скорости реакции (11), 1/(атм с), К-° — предэкспоненциальный множитель константы адсорбции воды по реакции 9, кг (Кат) / кг (H 2 O), К — предэкспоненциальный множитель константы адсорбции воды по реакции 10, кг (Кат) / кг (H 2 O), Е 1 — энергия активации процесса адсорбции воды по реакции 9, кДж/(кг К), Е 2 — энергия активации процесса адсорбции воды по реакции 10, кДж/(атм К), Е закт — энергия активации процесса (11), кДж/(кг К),
Формулы 15–16 были решены численными методами в среде Matlab с использованием метода Левенберга-Марквардта, полученные значения констант и энергий активаций приведены в Таблице.
На основе полученных значений предэкспоненциальных множителей и энергий активации была определена оптимальная область условий проведения процесса каталитической трансформации метанола в углеводороды P общ =1 атм, W (Метанола) = 2,3 кг (Метанола) / (кг (Кат)×ч), t=330–360 °C, обеспечивающая минимальную дезактивацию катализатора, что коррелирует с результатами литературных данных по трансформации метанола на цеолита типа H-ZSM-5 [11–12].
Таблица.
ЗНАЧЕНИЯ ПРЕДЭКСПОНЕНЦИАЛЬНЫХ МНОЖИТЕЛЕЙ И ЭНЕРГИЙ АКТИВАЦИИ ПРОЦЕССА ДЕЗАКТИВАЦИИ ЦЕОЛИТА H-ZSM-5 ВО ВРЕМЯ КАТАЛИТИЧЕСКОЙ
ТРАНСФОРМАЦИИ МЕТАНОЛА В УГЛЕВОДОРОДЫ
|
Константы |
Единицы измерения |
Значение |
σ 95% |
|
k01 |
1/с |
24597 |
1230 |
|
k02 |
1/с |
18942 |
950 |
|
k03 |
1/с |
11312 |
550 |
|
k04 |
1/с |
15472 |
770 |
|
E 1акт |
кДж/(кг К) |
23 |
1 |
|
E 2акт |
кДж/(кг К) |
18 |
1 |
|
E 3акт |
кДж/(кг К) |
25 |
1 |
|
E 4акт |
кДж/(кг К) |
73 |
4 |
|
£ 1° |
кДж/(кг К) |
13 |
1 |
|
^ 2 |
кДж/(атм К) |
15 |
1 |
|
£ ° |
кДж/(атм К) |
12 |
1 |
|
« 1° |
кг(Кат)/кг(Н 2 O) |
3259 |
163 |
|
К ? |
кг(Кат)/кг(Н 2 O) |
3195 |
160 |
Заключение
Дезактивация цеолитов в процессе трансформации метанола в углеводороды представляет собой сложный химический процесс, включающий в себя обратимую и необратимую деградацию активных центров в результате образования углеродных отложений и взаимодействие активных центров цеолита с перегретым водяным паром. Определение кинетических закономерностей процесса дезактивации цеолита H-ZSM-5 позволяет адекватно описать реальное протекание процесса каталитической трансформации метанола в углеводороды. В результате решения дифференциальных уравнений дезактивации катализатора численными методами получены значения констант и энергий активаций. На основе полученных значений предэкспоненциальных множителей и энергий активации была определена оптимальная область условий проведения процесса каталитической трансформации метанола в углеводороды P общ = 1 атм, W (Метанола) = 2,3 кг (Метанола) / (кг (Кат)×ч), t=330–360 °C обеспечивающая минимальную дезактивации катализатора, что коррелирует с результатами литературных данных по трансформации метанола на цеолита типа H-ZSM-5.
Исследование выполнено в рамках проекта РФФИ 20-08-00191.
Список литературы Механизмы дезактивации цеолита H-ZSM-5 в процессе каталитической трансформации метанола в углеводороды
- Asadi A. A., Alavi S. M., Royaee S. J., Bazmi M. Dependency of acidic and surficial characteristics of steamed Y zeolite on potentially effective synthesis parameters: screening, prioritizing and model development // Microporous and Mesoporous Materials. 2018. V. 259. P. 142-154. DOI: 10.1016/j.micromeso.2017.09.028
- Ji Y., Birmingham J., Deimund M. A., Brand S. K., Davis M. E. Steam-dealuminated, OSDA-free RHO and KFI-type zeolites as catalysts for the methanol-to-olefins reaction // Microporous and Mesoporous Materials. 2016. V. 232, 126-137. DOI: 10.1016/j.micromeso.2016.06.012
- Almutairi S. M. T., Mezari B., Pidko E. A., Magusin P. C. M. M., Hensen E. J. M. Influence of steaming on the acidity and the methanol conversion reaction of HZSM-5 zeolite // Journal of Catalysis. 2013. V. 307. P. 194-203. DOI: 10.1016/j.jcat.2013.07.021
- Wei Z., Chen L., Cao Q., Wen Z., Zhou Z., Xu Y., Zhu X. Steamed Zn/ZSM-5 catalysts for improved methanol aromatization with high stability // Fuel Processing Technology. 2017. V. 162. P. 66-77. DOI: 10.1016/j.fuproc.2017.03.026
- Wan Z., Li G. K., Wang C., Yang H., Zhang D. Relating coke formation and characteristics to deactivation of ZSM-5 zeolite in methanol to gasoline conversion // Applied Catalysis A: General. 2018. V. 549. P. 141-151. DOI: 10.1016/j.apcata.2017.09.035
- Aguayo A. T. et al. Deactivation by coke of a catalyst based on a SAPO-34 in the transformation of methanol into olefins // Journal of Chemical Technology & Biotechnology: International Research in Process, Environmental & Clean Technology. 1999. V. 74. №4. P. 315-321. :43.0.CO;2-G
- DOI: 10.1002/(SICI)1097-4660(199904)74
- Chen D., Moljord K., Holmen A. A methanol to olefins review: Diffusion, coke formation and deactivation on SAPO type catalysts // Microporous and mesoporous materials. 2012. V. 164. P. 239-250.
- DOI: 10.1016/j.micromeso.2012.06.046
- Froment G. F., Dehertog W. J. H., Marchi A. J. Zeolite catalysis in the conversion of methanol into olefins // Catalysis. n.d. P. 1-64.
- DOI: 10.1039/9781847553218-00001
- Beeckman J. W., Froment G. F. Catalyst deactivation by site coverage and pore blockage: Finite rate of growth of the carbonaceous deposit // Chemical Engineering Science. 1980. V. 35. №4. P. 805-815.
- DOI: 10.1016/0009-2509(80)85064-0
- Beeckman J. W., Froment G. F. Catalyst deactivation by active site coverage and pore blockage // Industrial & Engineering Chemistry Fundamentals. 1979. V. 18. №3. P. 245-256.
- DOI: 10.1021/i160071a009
- Derouane E. G. Factors Affecting The Deactivation Of Zeolites By Coking // Studies in Surface Science and Catalysis. 1985. P. 221-240.
- DOI: 10.1016/s0167-2991(09)60173-7
- Schipper P. H., Krambeck F. J. A reactor design simulation with reversible and irreversible catalyst deactivation // Chemical engineering science. 1986. V. 41. №4. P. 1013-1019.
- DOI: 10.1016/0009-2509(86)87187-1


