Механизмы холод-индуцированной вазоконстрикции в постинсультном периоде
Автор: Герасимова Людмила Ивановна, Берлогина Светлана Юрьевна
Журнал: Ученые записки Петрозаводского государственного университета @uchzap-petrsu
Рубрика: Медицинские науки
Статья в выпуске: 2 (115), 2011 года.
Бесплатный доступ
Острое нарушение мозгового кровообращения, холод-индуцированная вазоконстрикция, локальный холодовой тест, вариабельность ритма сердца, вызванный кожный вегетативный потенциал
Короткий адрес: https://sciup.org/14749860
IDR: 14749860
Текст статьи Механизмы холод-индуцированной вазоконстрикции в постинсультном периоде
Сохранение здоровья в неблагоприятных климатических условиях Европейского Севера, вызывающих значительное напряжение функций организма, представляет собой комплекс медицинских, социальных и экологических проблем. Среди факторов, действующих на организм человека в северных регионах, холод рассматривают как влияние, вызывающее наибольший дискомфорт [10], [15], [30]. Адаптация к холоду, направленная на сохранение и поддержание го-мойотермии, сопровождающаяся значительными изменениями нейрогуморальной регуляции и метаболизма, затрагивает практически все системы организма человека. Длительное воздействие низкой температуры окружающей среды приводит к общим нарушениям в организме в виде повышенной гемоконцентрации, склонности к развитию артериального тромбоза и увеличивает риск гипотермии [24], [31]. Считается, что для молодых здоровых людей указанные механизмы редко представляют опасность, однако в более старшей возрастной группе они служат предпосылкой к развитию и прогрессированию ряда заболеваний именно в холодный период года, а также серьезно увеличивают риск смерти от нарушений кровообращения [24], в том числе от инсультов [12], [25], [27].
Высокая частота заболеваний системы кровообращения на Севере во многом обусловлена ее активным участием в адаптационных реакциях организма при длительном действии холодного климата, регуляторное звено которых составляет увеличение адренореактивности тканей [13]. Поэтому функциональное состояние сердечно-сосудистой системы является одним из ключевых звеньев реактивности организма в условиях холодного климата.
Напряжение регуляторных систем организма, связанное с адаптацией к Северу, проявляется склонностью к сосудистым реакциям вазоспастического характера [3], [4], [28], что составляет патогенетическую основу проявлений большого спектра так называемых «холод-ассо-циированных симптомов», включая феномен Рейно, или усиленную холод-индуцированную вазоконстрикцию, боли, нарушения чувствительности и изменения цвета открытых частей тела [5], [19], [20], [22], [26].
Начальный ангиоспазм как главное проявление феномена Рейно возникает в результате сложного взаимодействия трех основных факторов: изменения нервной регуляции тонуса сосудов, вазомоторной формы дисфункции эндотелия и свойств гладкомышечных элементов [21]. Значение нервной регуляции проявляется в повышении α 2 -адренореактивности сосудов кожи [18], [21], [23]. Помимо этого, возникновение первичного феномена Рейно связывают с постденервационной гиперчувствительностью гладкомышечных элементов сосудов к циркулирующим адреналину и норадреналину [14].
Ранее нами было выявлено повышение частоты холод-ассоциированных симптомов, в том числе феномена Рейно, и другие признаки высокой чувствительности к холоду у пациентов, перенесших острые нарушения мозгового кровообращения (ОНМК) [6]. Учитывая данные многочисленных эпидемиологических исследований по увеличению частоты инсультов в северных регионах Российской Федерации [8] и в холодное время года [12], [25], [27], [29], а также сходство некоторых механизмов развития холод-индуцированных сосудистых реакций и нарушений мозгового кровообращения, целью прове-
денного исследования было изучение особенностей холод-индуцированных реакций кистей рук у пациентов, перенесших ОНМК, а также особенностей вегетативной регуляции холод-инду-цированной вазоконстрикции.
МЕТОДИКА ИССЛЕДОВАНИЯ
В исследовании приняли участие 50 человек (18 мужчин, 32 женщины). Исследуемая группа пациентов, перенесших ОНМК по ишемическому типу, включала 35 человек, прошедших лечение в отделении ОНМК Республиканской больницы им. В. А. Баранова. Диагноз ОНМК верифицирован с помощью компьютерной томографии мозга при поступлении в стационар. Референтную группу составили 15 практически здоровых лиц. Исследованные группы были идентичны по возрасту (средний возраст 55,7 ± 1,01 года) и антропометрическим показателям (средний рост 166,03 ± 1,63 см, средняя масса тела 75,65 ± 2,23 кг, индекс массы тела 27,62 ± 0,80).
Разделение на подгруппы ОНМК произведено на основании МКБ-10 по продолжительности сохранения неврологической симптоматики: транзиторная ишемическая атака (ТИА, n = 10), завершившийся инсульт с малым неврологическим дефицитом (микроинсульт, МИ, n = 16), завершившийся инсульт с грубым неврологическим дефицитом (инсульт, И, n = 9). Оценка неврологического статуса, включая уровень сознания, очаговую неврологическую симптоматику в форме двигательного дефицита, чувствительных, речевых, зрительных, атактических нарушений, высших корковых функций, проведена по шкале инсульта национального института здоровья NIHSS [32] при поступлении в стационар и на 21-е сутки от развития заболевания. Для оценки степени нарушения жизнедеятельности на 28-е сутки от момента развития заболевания использована модифицированная шкала Рэнкина [33]. Характеристики исследованных групп ОНМК приведена в табл. 1.
|
Таблица 1 Характеристики неврологического статуса в группе ОНМК |
|||
|
Исследуемая группа ОНМК |
NIHSS при поступлении |
NIHSS на 21-е сутки |
Модифицированная шкала Рэнкина |
|
ТИА, n = 10 МИ, n = 16 И, n = 9 |
1,60 ± 0,95 3,44 ± 0,73 20,00 ± 1,61 |
0 0,50 ± 0,18 11,11 ± 0,90 |
0 0,31 ± 0,12 4,00 ± 0 |
Функциональные тесты выполнены в лаборатории при температуре воздуха 23,68 ± 0,92 °С после 30-минутной экспозиции. Локальный холодовый тест проведен путем погружения кисти одной руки в холодную воду с тающим льдом температурой 4,09 ± 1,33 °С на 3 мин с после- дующей термометрией кожи (Тк) в течение 15 мин с интервалом в 3 мин в симметричных точках обеих рук на уровне кисти, середины предплечья и локтя. В группе ОНМК холодовая проба проводилась дважды в разное время с охлаждением паретичной конечности и интактной конечности.
Для оценки вегетативной регуляции организма с помощью прибора «ВНС-спектр» («Нейрософт», Иваново) выполнен анализ временных и спектральных характеристик вариабельности ритма сердца (ВРС). Оценка параметров ВРС выполнена на 5-минутных стационарных отрезках записей ЭКГ в покое и при проведении дыхательной и ортостатической проб, отражающих реактивность автономной нервной системы [2], [9].
Временной анализ ВРС включал определение следующих показателей: RRNN, мс (средняя длительность интервалов R-R), R-R min и R-R max, мс (минимальное и максимальное значения R-R интервала), SDNN, мс (стандартное отклонение R-R-интервалов, указывает на суммарный эффект влияния на синусовый узел симпатического и парасимпатического отделов автономной нервной системы), RMSSD, мс (квадратный корень из среднего значения квадратов разностей величин последовательных R-R интервалов, отражающий активность парасимпатического звена вегетативной регуляции), pNN50, % (процент последовательных интервалов R-R, различие между которыми превышает 50 мс, отражающий влияния парасимпатического звена вегетативной регуляции), CV, % (коэффициент вариации показателя вариабельности ритма сердца). Анализ спектральных характеристик ВРС включал оценку TP, мс2 (общей спектральной мощности в диапазоне от 0,003 до 0,4 Гц, отражающей суммарную активность нейрогуморальных влияний на сердечный ритм), и компонентов спектра в абсолютных (мс2) и относительных (%) величинах в диапазоне очень низких частот (VLF), отображающих влияние надсегментарного уровня регуляции, тест центральных эрготропных и гуморально-метаболических факторов; низких частот (LF), связанных с колебаниями активности симпатического отдела вегетативной нервной системы, высоких частот (HF), соответствующих уровню активности парасимпатического звена регуляции. Проба с глубоким управляемым дыханием с частотой 6 мин-1 дополнительно включала определение индекса кардиореспираторной синхронизации (КРС), при анализе активной ортостатической пробы дополнительно определяли коэффициент К30/15, который характеризует реактивность парасимпатического отдела [9].
Исследование параметров вызванного кожного вегетативного потенциала (ВКВП) ладоней обеих рук проводилось при однократной зрительной стимуляции (серия из 5–7 стимулов длительностью 20 мс) [2]. Для оценки использовались следующие показатели ВКВП: L – латентный период, A1 – амплитуда первой фазы, S1 – длительность первой фазы, A2 – амплитуда второй фазы, S2А – длительность восходящей фазы, S2В – длительность нисходящей фазы.
Анализ результатов выполнен с использованием методов вариационной статистики [7]. Для сравнения совокупностей использованы непараметрические критерии оценки (критерий знаков, Колмогорова – Смирнова, Манна – Уитни). Влияние факторов оценивали с помощью дисперсионного анализа (ANOVA), непараметрического корреляционного анализа. Достоверными считали результаты при уровне значимости p менее 0,05. Статистическая обработка результатов выполнена программой «Statistica 5.0 for Windows».
РЕЗУЛЬТАТЫ ИССЛЕДОВАНИЯ И ОБСУЖДЕНИЕ
При исследовании температуры кожи рук во время проведения локального холодового теста были получены следующие результаты. В контрольной группе исходные значения Тк на кисти составляли 33,05 ± 0,53 °С, на предплечье – 32,65 ± 0,42 °С, в области локтя – 32,73 ± 0,42 °С. В группе ОНМК выявлены более низкие исходные значения Тк кистей по сравнению с контрольной группой, особенно в паретичной конечности в группе ИИ (31,00 ± 0,55 °С, p < 0,05) (см. рисунок).
После проведения локального холодового теста более глубокое снижение Тк наблюдалось в группе И в паретичной конечности во всех исследуемых точках. Изменения выявлены как при охлаждении соответствующей кисти, так и при проведении холодовой пробы на интактной конечности (p < 0,05). В период восстановления в контрольной группе изменения Тк происходили в пределах охлаждаемой конечности, что, по нашему мнению, свидетельствует о сохранности сегментарных механизмов управления сосудистым тонусом. В группе ОНМК в период восстановления в целом регистрировались более низкие значения Тк. Существенные отклонения Тк наблюдались в группе И в паретичной руке при проведении холодовой пробы на интактной конечности (p < 0,05). К концу исследования низ-
А Б
Т, С 36
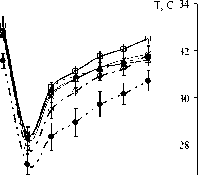
013691215 013691215Время, мин контроль ТИА МИ И - -* - МИ П —о -И И —• -И П
Температура кожи охлаждаемой (А) и контралатеральной (Б) кисти при выполнении локального холодового теста: ТИА – транзиторная ишемическая атака, МИ И, И И – пациенты с микроинсультом и инсультом, интактная конечность, МИ П, И П – пациенты с микроинсультом и инсультом, паретичная конечность. Достоверность отличий от контрольной группы
Таблица 2
Показатели временного анализа вариабельности сердечного ритма в покое
|
(данные п |
редставлены в формате Ме (25%; 75%)) |
|||
|
Параметр |
Контроль |
ТИА |
МИп |
МИл |
|
ЧСС, /мин |
66 (62; 71) |
64 (59; 68) |
67 (55; 70) |
64 (64; 68) |
|
NQRS |
325 (305; 352) |
295 (261; 319) |
277 (246; 345) |
318 (312; 332) |
|
RRMIN, мс |
800 (748; 840) |
795 (683; 828) |
865 (783; 983) |
835 (790; 855) **#+ |
|
RRMAX, мс |
995 (935; 1060) |
1125 (955; 1190) |
955 (912,5;1173) |
995 (940; 1040) |
|
RRNN, мс |
910 (849; 967) |
944 (878; 1031) |
901 (858; 1098) |
934 (887; 941) |
|
SDNN, мс |
31 (23; 36) |
42 (32; 53)* |
22 (19; 30) |
26 (16; 32) ***##++ |
|
RMSSD, мс |
19 (14; 22) |
30 (21; 39) |
12 (10,5; 20) |
15 (11; 19)*+ |
|
PNN50, % |
1,3 (0,1; 3,7) |
2,8 (1,1; 8,2)* |
0,3 (0,1; 1,7)# |
0,3 (0; 2,0)+ |
|
CV, % |
3,4 (2,4; 3,8) |
4,3 (3,4; 5,6)* |
2,5 (2,1; 3,0) |
2,6 (1,8; 3,7) ***##+++ |
|
КРС |
5,3 (4,3; 10,9) |
9,2 (6,3; 15,5) *** |
7,5 (6; 8,8)### |
11,8 (9,6; 15,7) ***+++ |
Примечание. МИп – группа пациентов с микроинсультом в правом каротидном бассейне, МИл – группа пациентов с микроинсультом в левом каротидном бассейне; достоверность отличий от контрольной группы: * – p < 0,05, ** – p < 0,01, *** – p < 0,001; от ТИА: # – p < 0,05, ## – p < 0,01, ### – p < 0,001; от МИп: + – p < 0,05, ++ – p < 0,01, +++ – p < 0,001.
Таблица 3
Показатели спектрального анализа вариабельности сердечного ритма в покое (данные представлены в формате Ме (25%; 75%))
|
Параметр |
Контроль |
ТИА |
МИ |
|
TP |
1112 (400; 1595) |
1651 (767; 5139)* |
865 (341; 260)#* |
|
VLF |
378 (222; 648) |
1099 (291;1379)** |
371 (199; 714)## |
|
LF |
180 (120; 430) |
348 (229; 1595)* |
153,5 (80; 290)# |
|
HF |
119 (69; 201) |
377 (185; 1965)* |
134 (55; 302) |
|
LFNORM |
63,9 (47,3; 80,9) |
46,5 (41,6; 68,4) |
57,5 (43; 62) |
|
HFNORM |
36,1 (19,1; 52,7) |
53,5 (31,6; 58,4) |
42,5 (38; 57) |
|
LF-HF |
1,77 (0,87; 4,23) |
0,87 (0,71; 2,16) |
1,36 (0,77; 1,62) |
|
% VLF |
48,4 (32,4; 59,4) |
44,2 (27,5; 60,9) |
56,2 (45,3; 67,1) |
|
% LF |
26,4 (12,9; 45,5) |
23,3 (18,5; 34,8) |
24,9 (18; 27) |
|
% HF |
15,3 (8,23; 31,3) |
22,8 (10,1; 40) |
18,7 (15; 25) |
Примечание. Достоверность отличий от контрольной группы: * – p < 0,05, ** – p < 0,01; от ТИА: # – p < 0,05, ## – p < 0,01.
Для группы МИ характерно снижение вариабельности сердечного ритма по сравнению с контрольной группой и группой ТИА (табл. 2). Выявлены различия временных показателей ВРС между пациентами с ишемическим инсультом в правом и левом каротидных бассейнах: прослеживаются достоверно более низкие показатели вариабельности (SDNN, RMSSD, CV) при локализации ишемического очага в правом каротидном бассейне по сравнению с левым, что согласуется с результатами исследования ВРС у пациентов в остром периоде ишемического инсульта [11], [17]. При спектральном анализе ВРС в группе МИ выявлены более низкие значения спектральной мощности (табл. 3). Эти данные коррелируют с изменениями в резидуальном периоде ишемического инсульта в вертебробазилярном и каротидном бассейнах, описанными в литературе [11], [17]. Помимо этого в группе МИ происходило снижение уровня вегетативных влияний: в структуре спектра определялась значительная доля VLF-компонента, что указывает на большой вклад в регуляцию гуморально-метаболических факторов и недостаток сегментарного звена автономной регуляции [9], [16], [17].
При проведении функциональных тестов с произвольной гипервентиляцией и во время ортостатической пробы в группах ОНМК также наблюдалось недостаточное участие сегментарных механизмов вегетативной регуляции сердечного ритма: сниженные показатели кардиореспиратор-ной синхронизации (p < 0,001), уменьшение параметра К30/15 (p < 0,01). Полученные нами результаты подтверждают дефицит автономной регуляции деятельности сердца и являются прогностически неблагопрятным признаком, свидетельствующим о неполноценности неспецифических адаптационных систем [16], [17].
При анализе ВКВП в группах ОНМК выявлено увеличение параметров ВКВП, характеризующих активность эрготропных центров (табл. 4). В группе МИ выявлены асимметричные изменения параметров ВКВП. Отмечены более высокие показатели амплитуды первой фазы ВКВП (А1) на интактной конечности, чем в контрольной группе (p < 0,001), и на паре-тичной конечно сти (p < 0,001). Также наблюдались более высокие значения амплитуды второй фазы ВКВП (А 2 ) по сравнению с контрольной группой (p < 0,01) и паретичной конечностью (p < 0,05). Полученные результаты свидетельствуют о сохранно сти вегетативной регуляции на интактной конечности у пациентов с МИ, в то время как в паретичной конечности наблюдаются низкие значения обеих фаз ВКВП, что может расцениваться как автономная дисфункция, возникшая вследствие ишемического инсульта.
Таблица 4
Параметры ВКВП у пациентов с разными формами ОНМК
|
Группы |
Контроль |
ТИА |
МИ И |
МИ П |
|
L,с |
1,42±0,05 |
1,42±0,05 |
1,33±0,07 |
1,39±0,06 |
|
A 1 ,мВ |
1,13±0,17 |
1,04±0,11 |
2,04±0,18***### |
1,03±0,15□□□ |
|
S 1 ,с |
1,25±0,12 |
1,00±0,09 |
1,49±0,09## |
1,29±0,11 |
|
A 2 ,мВ |
1,61±0,18 |
2,75±0,41* |
3,33±0,52** |
2,03±0,37□ |
|
S2A,с |
2,40±0,40 |
1,94±0,16 |
3,39±0,47# |
2,79±0,47* |
|
S2B,с |
2,36±0,19 |
3,43±0,35** |
2,70±0,25# |
2,30±0,26## |
Примечание. ТИА – транзиторная ишемическая атака, МИ И – пациенты с микроинсультом, интактная конечность; МИ П – пациенты с микроинсультом, паретичная конечность; достоверность отличий от контрольной группы: * – p < 0,05, ** – p < 0,01, *** – p < 0,001; от ТИА: # – p < 0,05, ## – p < 0,01, ### – p < 0,001; от МИ инт. □ – p < 0,05; □□ – p < 0,01; □□□ – p < 0,001.
ЗАКЛЮЧЕНИЕ
Сопоставление результатов проведенного нами комплексного исследования позволяет сделать вывод о том, что усиленная холод-индуци-рованная вазоконстрикция у пациентов, перенесших ОНМК, реализуется с преимущественным участием гуморально-клеточных механизмов при недостатке нейрогенных факторов. Таким образом, выявление данного признака свидетельст- вует о перестройке системы вегетативной регуляции организма, предрасполагающей к возникновению нарушений мозгового кровообращения. Полученные экспериментальные данные соответствуют ранее сформулированной гипотезе о значении усиленной холод-инду-цированной вазоконстрикции в качестве доно-зологического признака при дезадаптации к холоду [4], [5].
Список литературы Механизмы холод-индуцированной вазоконстрикции в постинсультном периоде
- Бойцов С. А. Возрастные особенности изменения показателей вариабельности сердечного ритма у практически здоровых лиц//Вестник аритмологии. 2002. №. 26. С. 57-60.
- Вейн А. М. Вегетативные расстройства: клиника, диагностика, лечение. М.: ООО «Медицинское информационное агентство», 2003. 752 с.
- Герасимова Л. И. Влияние длительности проживания на Европейском Севере на частоту холод-ассоциированных симптомов//Вестник РУДН. 2000. № 3. С. 35-38.
- Герасимова Л. И. Усиленная холод-индуцированная вазоконстрикция (феномен Рейно) как признак аварийно-го регулирования функций организма при адаптации к холоду//Регионарное кровообращение и микроциркуляция. 2007. Т. 6. № 1. С. 40-42.
- Герасимова Л. И. Усиленная холод-индуцированная вазоконстрикция как донозологический признак при адаптации к условиям Севера//Ученые записки Петрозаводского государственного университета. Сер. «Естественные и технические науки». 2008. № 4 (96). С. 69-71.
- Герасимова Л. И., Берлогина С. Ю. Холод-индуцированная реактивность у пациентов с нарушениями мозгового кровообращения//Медицинский вестник Башкортостана. 2009. Т. 4. № 2. С. 32-33.
- Гланц С. Медико-биологическая статистика: Пер. с англ. М.: Практика, 1999. 459 с.
- Гусев Е. И., Скворцова В. И., Стаховская Л. В. Проблема инсульта в Российской Федерации: время активных совместных действий//Журнал неврологии и психиатрии. 2007. № 8. С. 4-10.
- Михайлов В. М. Вариабельность ритма сердца: опыт практического применения. Иваново, 2002. 288 с.
- Потапов А. И., Истомин А. В., Шушкова Т. С. и др. Гигиенические проблемы сохранения здоровья населения в экстремальных условиях Севера//Вестник Российской АМН. 2005. № 3. С. 19-23.
- Самохвалова Е. В., Гераскина Л.А., Фонякин А. В. Инфаркты мозга в каротидной системе и вариабельность сердечного ритма в зависимости от поражения островковой доли//Неврологический журнал. 2009. № 4. С. 10-15.
- Сахаров В. Ю., Пенина Г. О. Региональный регистр инсульта в Республике Коми -предварительная оценка//Bulletin of the International Scientific Surgical Association. 2008. Vol. 3. №. 2-3. С. 48-50.
- Степанова Г. К. Физическая работоспособность и ее связь с морфофункциональными характеристиками у различных этносов Якутии//Физиология человека. 2005. Т. 31. № 3. С. 124-130.
- Табеева Р. Т. Неврологические аспекты феномена Рейно//Consilium medicum. 2002. Т. 4. № 8. С. 433-442.
- Хаснулин В. И., Собакин А. К., Хаснулин П.В., Бойко Е. Р. Подходы к районированию территорий России по условиям дискомфортности окружающей среды для жизнедеятельности населения//Бюллетень СО РАМН. 2005. Т. 117. № 3. С. 106-111
- Хаспекова Н. Б. Диагностическая информативность мониторирования вариабельности ритма сердца//Вестник аритмологии. 2003. № 32. С. 15-23.
- Уточкина И. М., Шамуров Ю. С., Миронов В. А. Прогностическое значение автономной дизрегуляции сердца при церебральных инсультах//Бюллетень сибирской медицины. 2008. № 5. С. 188-192.
- Bailey S. R., Mitra S., Flavahan S., Flavahan N. A., Bailey S. R. Reactive oxygen species from smooth muscle mitochondria initiate cold-induced constriction of cutaneous arteries//Amer. J. Physiol. Heart. Circ. Physiol. 2005. Vol. 289. № 1. Р. H243-50.
- Block J. A., Sequeira W. Raynaud's phenomenon//Lancet. 2001. Vol. 357. P. 2042-2049.
- Campbell D. A., Kay S.P. What is cold intolerance?//J. Hand. Surg. (Br). 1998. Vol. 23. № 1. P. 3-5.
- Cooke J. P., Marshall J. M. Mechanis of Raynaud's disease//Vascular Medicine. 2005. Vol. 10. P. 293-307.
- Hassi J., Raatikka V. P., Huurre M. Health-check questionnaire for subjects exposed to cold//Int. J. Circumpolar Health. 2003. Vol. 62. № 4. P. 436-443.
- Kanagy N. L. Alpha(2)-adrenergic receptor signaling in hypertension//Clin. Sci. 2005. Vol. 109. № 5. P. 431-437.
- Keatinge W. R. Winter mortality and its causes//Int. J. Circumpolar Health. 2002. Vol. 61. P. 292-299.
- Makinen T. M., Hassi J. Health Problems in Cold Work//Industrial Health. 2009. Vol. 47. P. 207-220.
- Maricq H. R., Carpentier P. H., Wеinrich M.C. et al. Geographic variation in the prevalence of Raynaud's phenomenon: A 5 region comparison//J. Rheumatol. 1997. Vol. 24. P. 879-889.
- Matsumoto M., Ishikawa S., Kajii E. Cumulative Effects of Weather on Stroke Incidence: A Multi-Community Cohort Study in Japan//J. epidemiologi. 2010. № 1. P. 1-7.
- Maximov A. L., Koscheyev V. S. Thermal profile of the hands as an indicator of the human adaptation to extreme environments//VIII World congress International society for adaptive medicine. 2006. P. 25-26.
- Mc Arthur K., Dawson J., Walters M. What is it with the weather and stroke?//Expert Rev. Neurother. 2010. Vol. 10. № 3. Р. 243-249.
- Mc Geehin M. A., Mirabelli M. The potential impacts of climate variability and change on temperature-related morbidity and mortality in the Unated States//Environ Health Perspect. 2001. 109 (Suppl. 2). P. 185-189.
- Nayha S. Cold and the risk of cardiovascular diseases//Int. J. Circumpolar Health. 2002. 61. P. 373-380.
- Spilker J., Kongable G., Barch C. et al. Using the NIH Stroke Scale to assess stroke patients. The NINDS rt-PA Stroke Study Group//J. Neurosci Nurs. 1997. Vol. 29. № 6. P. 384-392.
- Van Swieten J. C., Koudstaal Р. J., Visser M.C. et al. Interobserver agreement for the assessment of handicap in stroke patients//Stroke. 1988. Vol. 19. P. 604-607.


