Механизмы иммунной защиты и перспективы создания ДНК-вакцин против африканской чумы свиней
Автор: Середа А.Д., Иматдинов А.Р., Дубровская О.А., Колбасов Д.В.
Журнал: Сельскохозяйственная биология @agrobiology
Рубрика: Обзоры, проблемы
Статья в выпуске: 6 т.52, 2017 года.
Бесплатный доступ
Возбудитель африканской чумы свиней (АЧС) - крупный оболочечный вирус семейства Asfarviridae, содержащий двухцепочечную линейную ДНК 170-190 тыс. п.н., кодирующую более 150 белков, большинство из которых вовлечены во взаимодействия вирус-хозяин (L.K. Dixon с соавт., 2004). Вирулентные изоляты вызывают контагиозную геморрагическую болезнь со 100 % смертностью домашних свиней ( Sus scrofa domesticus ) и диких кабанов ( Sus scrofa ). Контроль над заболеванием осложняется отсутствием средств специфической профилактики (R.J. Rowlands с соавт., 2008; D.A. Chapman с соавт., 2011; P. Rahimi с соавт., 2010). Попытки защитить свиней от АЧС традиционными экспериментальными живыми, инактивированными, субъединичными вакцинами оказались неудачными (S. Blome с соавт., 2014). Иммунная защита при АЧС реализуется за счет цитотоксических Т-лимфоцитов-киллеров (ЦТЛ) и эффекторов антителозависимой клеточной цитотоксичности (АЗКЦ) и действует против вирусных белков на поверхности зараженных моноцитов (макрофагов). Установлен синергизм этих эффекторов (А.Д. Середа, 2013). На основании данных о локализации, структуре и функциональных свойствах вирусных белков, полипептидной специфичности антител в сыворотке крови свиней после введения аттенуированных или вирулентных штаммов вируса АЧС (ASFV), последствиях иммунизации свиней выделенными из зараженных клеток или рекомбинантными белками, ДНК-конструкциями белки р30, р54 и CD2v рассматривают в качестве потенциально протективных (S.D. Kollnberger с соавт., 2002; M.G. Barderas с соавт., 2001; J.G. Neilan с соавт., 2004). Существенный недостаток кандидатных ДНК-вакцин - относительно слабая индукция иммунных реакций, особенно у крупных млекопитающих, что требует специальных подходов (J. Rajcani с соавт., 2005; M.A. Liu с соавт., 2006; L.H. van Drunen с соавт., 2004). Для нацеливания лимфоцитов, экспрессирующих рецепторы CD48 и CD58 для белка CD2 антигенпрезентирующих клеток (AПК) предложено использовать секреторную часть (s) сходного с ним белка ASFV HA (или СD2v) (A. Brossay с соавт., 2003; K. Crosby с соавт., 2004). Введение в ДНК-конструкцию гена sHA усиливало как гуморальный, так и клеточный ответ против слитых белков p30 и p54 (F. Ruiz-Gonzalvo с соавт., 1996). Продемонстрировано усиление гуморального ответа при связывании p30 и p54 с одной цепью антитела к инвариантному эпитопу молекулы главного комплекса гистосовместимости (ГКГС) II класса у свиней. Однако в ряде случаев это приводило к ускоренной гибели животных после заражения вирулентными штаммами. Для стимулирования специфического CD8+-Т-клеточного ответа использовали конструкцию рСМV-UbsHAPQ, кодирующую антигенные детерминанты p30, p54 и sHA, слитые с клеточным убиквитином (Ub). Иммунизация рСМV-UbsHAPQ не индуцировала гуморальный ответ, выявляемый инструментально, но обеспечивала частичную защиту против контрольного заражения вирусом АЧС (J.M. Argilaguet с соавт., 2011). Перспективность ДНК-конструкций была подтверждена экспериментами по иммунизации короткими фрагментами вирусного генома, слитыми с геном клеточного убиквитина (ДНК-биб-лиотека ASFVUblib) (A. Lacasta с соавт., 2014). В результате иммунизации ASFVUblib 60 % свиней выжили после заражения вирулентным штаммом вируса. По данным иммуноферментного анализа (ИФА) у всех иммунизированных ASFVUblib свиней до контрольного заражения специфические антитела к белкам ASFV не обнаружили. CD8+-Т-клетки были единственной из исследованных клеточных субпопуляций, в которой у выживших свиней с 5-х сут после иммунизации отмечали статистически значимый рост. После иммунизации рекомбинантным бакуловирусом BacMam-sHAPQ с конструкцией, кодирующующей полноразмерные иммунодоминантные белки p30 и p54, слитые с карбоксильным концом внеклеточного домена вирусного гемагглютинина sHA под контролем промотора позвоночных, при контрольном заражении вирулентным штаммом у 66 % свиней не было виремии и клинических признаков заболевания (J.M. Argilaguet с соавт., 2013). Таким образом, результаты исследований по разработке ДНК-вакцин против ASFV можно рассматривать как обнадеживающие, хотя механизмы иммунного ответа на заражение этим вирусом еще требуют выяснения.
Днк-вакцины, африканская чума свиней, протективные белки, антитела, цитотоксические т-лимфоциты
Короткий адрес: https://sciup.org/142213860
IDR: 142213860 | УДК: 636.4:619:616.636:578:[577.2.08+51-76 | DOI: 10.15389/agrobiology.2017.6.1069rus
Текст обзорной статьи Механизмы иммунной защиты и перспективы создания ДНК-вакцин против африканской чумы свиней
Возбудитель африканская чумы свиней (АЧС, ASF) — крупный оболочечный вирус (ASFV) семейства Asfarviridae, содержащий двухцепо-
Работа выполнена в рамках проекта Российского научного фонда «Создание кандидатной вакцины против африканской чумы свиней на основе химерных вирусов» (проект 16-16-00090).
чечную линейную ДНК 170-190 т.п.н., кодирующую более 150 белков, большинство из которых вовлечены во взаимодействия «вирус—хозяин» (1). Его вирулентные изоляты вызывают контагиозную геморрагическую болезнь со 100 % смертностью домашних свиней ( Sus scrofa domesticus ) и диких кабанов ( Sus scrofa ). В 2007 г. в Грузии зарегистрированы первые вспышки АЧС в кавказском регионе (2). Оттуда болезнь проникла в Армению, Азербайджан, Нагорный Карабах, Иран, Абхазию, Россию, далее Украину, Беларусь, страны Прибалтики и Польшу (3). Контроль над заболеванием осложняется отсутствием средств специфической профилактики. Описано применение вирусных препаратов, инактивированных ультрафиолетовым излучением, фреоном, ионными и неионными детергентами, β -пропи-олактоном и др.), экстрактов инфицированных культур клеток макрофагов легких, костного мозга, селезенки зараженных свиней; очищенных вирионов, фиксированных на эритроцитах быка, микобактериях, γ -глобулине, зараженных макрофагов, фиксированных глутаровым альдегидом, и др. (4-6). Все эти традиционно приготовленные препараты оказались неэффективными. В 1962-1963 годах при эпизоотии АЧС на Пиренейском полуострове масштабная вакцинация лабораторно аттенуированными штаммами ASFV в Португалии и Испании привела к росту числа неблагополучных по АЧС пунктов в 3-6 раз, гибели 10-50 % привитого поголовья и проявлению клинических признаков болезни в поствакцинальный и отдаленный периоды (7). Причинами таких осложнений могли быть недостаточная изученность аттенуированных штаммов или их антигенное несоответствие циркулирующему вирулентному вирусу, поскольку сообщалось о выделении на Пиренейском полуострове нескольких иммунологических типов ASFV (8). В СССР согласно принятой в 1970-е годы концепции были получены лабораторно аттенуированные штаммы и различные формы препаратов на их основе (так называемые живые вакцины) для временной защиты свиней от вируса АЧС I-V сероиммунотипов (9). К недостаткам живых вакцин следует отнести выраженное в разной степени носительство аттенуированного вируса, вероятность последующего частичного восстановления его вирулентности, развитие субклинической инфекции, иногда переходящей в хроническую форму, недостаточная протективность у животных с ослабленным иммунитетом, например супоросных свиноматок. Последующее заражение животных, которые были привиты аттенуированными штаммами, вирулентными штаммами ASFV гомологичных сероиммунотипов приводило, как правило, к пожизненному вирусоносительству у выживших свиней (9-11).
Эти результаты показывают, что в настоящее время для ликвидации болезни необходимы строгие ветеринарно-санитарные мероприятия, включающие тотальный убой свиней в очаге и первой угрожаемой зоне. Тем не менее, определенные надежды возлагаются на ДНК-вакцины. Мы рассмотрим иммунологические механизмы специфической защиты, потенциально протективные вирусоспецифические белки, подходы к конструированию ДНК-вакцин, несущих гены ASFV, и результаты исследования их иммуногенных и протективных свойств.
Иммунологические механизмы специфической защиты . Для разработки вакцин нового поколения важно знать механизмы формирования специфической защиты, значение и соотношение гуморального и клеточного иммунитета при АЧС. Вирусоспецифические антитела рассматриваются как необходимый компонент защиты при АЧС. Перенос сыворотки или молозива от реконвалесцентов интактным свиньям при их последующем заражении вирулентным изолятом может задержать проявление клинических симптомов, уменьшить виремию и увеличить процент 1070
выживших особей. Из животных, которые получали анти-ASFV иммуноглобулины (Ig), 85 % выжили после заражения вирулентным штаммом ASFV Е75, в то время как в контроле, где особи получали или Ig против псевдобешенства, или нормальные свиные Ig, или раствор фосфатного буфера, зафиксировали 100 % смертности. За исключением значительно отсроченной и слабовыраженной лихорадки, животные, получавшие анти-ASFV Ig, после заражения оставалась клинически здоровыми, у них отмечали 10000-кратное снижение средних и максимальных титров вируса в крови по сравнению с контрольной группой, в которой клинические признаки АЧС проявлялись уже с 4-х сут после заражения (12).
Отметим, что механизмы гуморального иммунного ответа уже длительное время остаются дискуссионными. В 1980-х годах превалировало мнение, что ASFV не индуцирует нейтрализующих антител (13), но в 1990-х годах на основании опубликованных результатов была выдвинута гипотеза, что вируснейтрализующие антитела важны при формировании защиты от АЧС (14). Сообщалось о специфичных вируснейтрализующих антителах к структурным белкам ASFV p30, p54 и p72 (15). Свиней 3-кратно иммунизировали белками ASFV р30 и р54, которые экспрессировались в клетках насекомых, зараженных рекомбинантными бакуловирусами со встроенными генами белков р30 или р54 (I группа — рекомбинантным белком р30, II — р54, III — комбинацией р30 и р54). Иммуноблоттинг подтвердил, что в сыворотках иммунизированных свиней присутствовали антитела, специфичные к введенным рекомбинантным белкам. Через 15 сут после последней иммунизации животных внутримышечно заражали высоковирулентным штаммом ASFV Е75 в дозе 102 ГАЕ50. В не иммунизированной группе на 56-е сут смертность достигла 100 %; на 5-10-е сут погибли животные, иммунизированные либо р30, либо р54 (развитие виремии у животных этих групп было схожим). При иммунизации комбинацией р30 и р54 течение болезни значительно различалось: 2 особи из 6 заболели через 3 сут после контрольных, но выжили после периода проявления симптомов; 3 свиньи заболели спустя 10 сут после особей из групп, иммунизированных каждым из белков раздельно, и пали на 21-27-е сут после заражения. У одного животного клинических признаков болезни и виремии не наблюдали. Из 3 выживших свиней только у одной в ПЦР на 46-е сут после иммунизации выявили геном ASFV, причем, только в верхнечелюстных лимфоузлах, в остальных пробах органов иммунной системы результаты анализа были отрицательными. Авторы связали частичный протективный эффект комбинации р30 и р54 со способностью этих белков индуцировать антитела, препятствующие связыванию или проникновению вирионов в клетки-мишени (16). Экспериментально и теоретически обоснована и противоположная гипотеза, согласно которой образование иммунных комплексов благоприятствует проникновению вируса в клетки-мишени — моноциты (макрофаги) за счет активации фагоцитоза. Упомянутые выше эффекты сывороточных антител in vivo были увязаны с механизмом АЗКЦ (17, 18).
Показано значение цитотоксических Т-лимфоцитов (ЦТЛ) в обеспечении вирусоспецифической защиты в ранние сроки после инфицирования ASFV (19, 20). Процент цитолиза макрофагов, инфицированных гомологичным изолятом, был выше, чем для гетерологичных изолятов, что свидетельствовало об иммунотипоспецифичности ЦТЛ (21). Критическая роль вирусоспецифических ЦТЛ в защите от АЧС наиболее наглядно доказана тем, что истощение моноклональными антителами in vivo CD8+-T-лимфоцитов аннулирует защитный иммунитет, сформированный после инокуляции аттенуированного штамма OUR/T88/3 (22).
Таким образом, иммунологическая защита при АЧС вероятнее всего обусловлена действием цитотоксических Т-лимфоцитов-киллеров и АЗКЦ против вирусных белков на поверхности зараженных моноцитов (макрофагов) (20, 23). Синергизм ЦТЛ и антител в АЗКЦ доказан экспериментами in vitro с использованием гомологичных культур клеток лейкоцитов крови, полученных до и на 6-е сут после введения высоких доз аттенуированного штамма вируса АЧС. Опосредованные антителами механизмы защиты превосходили ЦТЛ по способности ограничивать репродукцию ASFV (24). Это дает основания предполагать, что формирование вирусоспецифической защиты при АЧС обеспечивается не одним, а несколькими белками, из которых каждый индуцирует либо гуморальные, либо клеточные эффекторы иммунитета (25).
Потенциально протективные белки. Исходя из локализации, структуры и функций вирусиндуцированных белков, проявляемых в оболочке вирионов и плазматической мембране зараженных клеток, поли-пептидной специфичности антител в сыворотках крови свиней к вирусным белкам в ранний период после введения аттенуированных или вирулентных штаммов ASFV, последствий иммунизации свиней очищенными из зараженных клеток или рекомбинантными белками, ДНК-конструкциями, протеины р30, р54, р73 и CD2v ранее рассматривались как потенциально протективные (16, 17, 25-27).
Внутренняя мембрана вириона ASFV включает белки р12 (димер), р22, р54 и р30, внешняя, приобретаемой при почковании вирусной частицы через плазматическую мембрану, — р12, р24 и CD2v (28). Белки р12, р30 и р54 важны для прикреплении и проникновении ASFV в клетки-мишени. Полагают, что антитела к р54 блокируют связывание вирионов с клетками, тогда как антитела к р30 ингибируют их проникновение внутрь клеток (15, 16). По результатам радиоиммунопреципитации и иммуноблоттинга, р30, р54 и р72 охарактеризованы как высокоиммуногенные (индуцирующие антитела) (29-31). Инструментально регистрируемые иммунологические процессы, определяющие исход инфицирования свиней ASFV, происходят с 3-х по 10-е сут. При инокуляции высокими дозами аттенуированного штамма ФК-135 через 3-6 сут наблюдают АЗКЦ, с 4-х по 10-е сут — первичные ЦТЛ. Радиоиммунопреципитация уже на 3-6-е сут после введения аттенуированного, слабовирулентного или вирулентного штаммов ASFV животным выявляла в сыворотке крови антитела к полипептидам с молекулярными массами 30 и 36-39 кДа (соответственно р30 и негликозилированная форма р54) (17). Несколько менее чувствительные иммуноферментный анализ и иммуноблоттинг с использованием рекомбинантного р30 в качестве антигена обнаруживают антитела с 7-8-х сут после инфицирования различными по вирулентности штаммами ASFV (32-34).
В качестве потенциальных антигенов для ЦТЛ рассматривали p30, p73, мажорный гликопротеин ГП 110-140 (или CD2v, НА) (35). Индукцией ЦТЛ можно объяснить частичную защиту против ASFV, достигнутую после иммунизации экспрессированными в бакуловирусе рекомбинантными белками p30 и p54 (16), гемагглютинином sHA ASFV или серотипоспецифическим ГП 110-140 в липосомах (36).
У оболочечных вирусов, как правило, протективны гликопротеины, определяющие серотиповую специфичность. У ASFV серотиповой специфичностью обладает мажорный гликопротеин ГП 110-140 (35). На основании сходства физико-химических характеристик этому белку соответствует CD2v, кодируемый геном EP402R , который, как известно, непосредственно вовлечен в процесс гемадсорбции при инфицировании чувствительных 1072
клеток вирусом АЧС (37). В подтверждение этому установлено, что результаты генотипирования по локусу, кодирующему CD2v, соответствуют распределению изолятов и штаммов ASFV по сероиммунотипам (38). Предположительно этот белок может быть основным индуктором ЦТЛ. Критическая роль CD2v (ГП 110-140) в формировании протективного иммунитета при АЧС обоснована экспериментально. Четырехкратная иммунизация свиней очищенным ГП 110-140 в составе липосом защищала 67 % животных от гибели, но не от переболевания при последующем заражении вирулентным штаммом Ф-32 (36). Иммунизация рекомбинантным ба-куловирусом, несущим ген СD2v ASFV, защищала от последующего контрольного заражения вирулентным штаммом. Внутримышечное введение свиньям ДНК-конструкции, включающей гены р30, р54 и внеклеточного домена CD2v, предотвращала гибель до 67 % свиней, впоследствии зараженных вирулентным штаммом ASFV (39, 40).
Таким образом, большинство исследователей рассматривают в качестве необходимых для индукции иммунологической защиты при АЧС белки р30, р54 и CD2v.
ДНК-вакцины . Метод ДНК-иммунизации впервые был описан в 1990-х годах (41) и используется при разработке вакцин против рака, инфекционных и аутоиммунных заболеваний. Концептуально важно, что ДНК-вакцины потенциально безопасны для животных и вызывают не только гуморальный, но и клеточный иммунитет (рис.) (42, 43).
Вакцинный
Оптимизиро- препарат
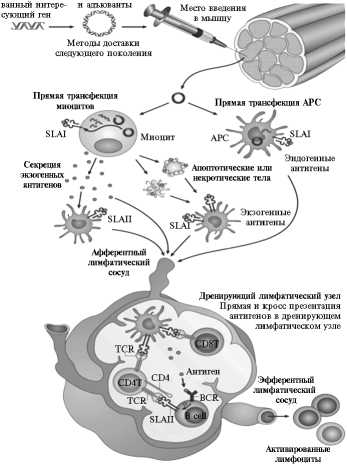
Индукция клеточного и гуморального иммунитета ДНК-вакцинами: SLAI и SLAII — свиные антигены гистосовместимости I и II классов; APC — антигенпрезентирующие клетки; TCR и ВCR — специфические рецепторы Т- и В-лимфоцитов для распознавания и связывания определенного антигена; B cell — B-лимфоциты; CD4T — Т-хелперы; CD8T — Т-супрессоры (цитотоксические Т-лимфоциты) (русифицировано по ссылке 42).
Существенный недостаток кан-дидатных ДНК-вакцин — относительно низкая индукция иммунных реакций, особенно у крупных млекопитающих. Для преодоления этой проблемы испытано несколько подходов (44-48).
Нацеливание (таргетинг). Нацеливание антигенов оказалось успешным во многих системах (46). Первые попытки индуцировать защитный иммунный ответ против ASFV с использованием ДНК-конструкции, кодиру- ющей p54 и p30 в виде химерного бел- ка PQ, оказались неудачными (49). Сходство между гемагглютенином ASFV HA (СD2v) и молекулой CD2 лейкоцитов (37, 50) позволило предположить наличие у него способности нацеливать лимфоциты, экспрессирующие рецепторы к CD2 (CD48 и CD58), на вирусные антигены в антигенпрезентирующих клетках (51, 52). Добавление sHA усиливало как гуморальный, так и клеточный ответ против PQ с оптимальным результатом после 3 внутримышечных инъекций. Усиление иммунного ответа на введение sHA также может быть связано с наличием в этой молекуле Т-хелперных клеточных эпитопов. Другая стратегия основана на нацелива- нии закодированных вирусных антигенов в места антигенной презентации (53, 54) с использованием вариабельных фрагментов одноцепочечных (ScFv) антител (55), которые специфически распознают клеточные антигены на поверхности антигенпрезентирующих клеток (56, 57). Эта стратегия показала себя эффективной в индукции иммунных ответов против множества различных антигенов как при иммунизации рекомбинантными субъединичными белками, так и при ДНК-вакцинации (58, 59).
Нацеливание рекомбинантных вирусных антигенов, слитых с одной цепью антитела, узнающего инвариантный эпитоп молекулы ГКГС II класса (APCH1), усиливает иммунный ответ на субъединичные вакцины у мышей и кроликов (59). Потенциал APCH1 продемонстрирован in vitro при трансфекции клеток Vero плазмидой pCMV-APCH1GFP, которая кодирует свиной ScFv, слитый с зеленым флуоресцентным белком (GFP). После трансфекции секретируемый клетками Vero слитый белок был способен специфически связываться со свиными макрофагами. Эффективность APCH1 в качестве генетического адъюванта in vivo подтвердилась при иммунизации свиней плазмидой рСМV-APCH1PQ, в которой ген APCH1 слит с химерной открытой рамкой считывания для PQ (26). ДНК-конструкции, кодирующие только PQ, вызывали образование антител в высоких титрах у мышей, но не у свиней, в то время как введение pCMV-APCH1PQ индуцировало у свиней как синтез специфичных к PQ антител, так и активность Т-хелперов, таргетированных на антиген гистосовместимости II класса, что указывало на адъювантный эффект молекулы APCH1. Однако эта кандидатная ДНК-вакцина в отличие от ранее описанной кан-дидатной субъединичной вакцины, основанной на тех же антигенах ASFV, не защищала свиней от последующего заражения ASFV (16, 26).
Убиквитинирование. Несмотря на инструментально зарегистрированный ответ на иммунизацию рСМV-sHAPQ, свиньи не были защищены от контрольного заражения (клинические признаки и кинетика виремии были неотличимы от таковых у контрольных животных). Отсутствие защиты совпало с индукцией специфических антител, которые не нейтрализовали ASFV in vitro (с ними ранее связывали защиту in vivo) (16). Этими данными подтвердилась неспособность кандидатных ДНК-вакцин индуцировать нейтрализующие антитела против p30 и p54, а не нейтрализующие антитела, как оказалось, могут даже усугубить течение инфекции (49).
Для того чтобы избежать нежелательной индукции антител и усилить специфические CD8+-Т-клеточных ответы, была разработана конструкция рСМV-UbsHAPQ, кодирующая антигенные детерминанты p30, p54 и sHA, слитые с клеточным убиквитином. Как и ожидалось, иммунизация рСМV-UbsHAPQ не индуцировала гуморальный ответ у свиней, но обеспечивала частичную защиту против контрольного заражения ASFV, подтверждая важность T-клеточного ответа в защите от этого вируса. Достигнутая защита не усиливалась увеличением кратности введения ДНК-вакцины, что, возможно, отражает отсутствие бустерного эффекта для Т-клеточного ответа, индуцируемого после первого введения. В частности, при 2-кратной иммунизации рСМV-UbsHAPQ выжили 2 из 6 свиней, при 4-кратной — только одна. Вероятно, бустеризация может иметь негативный эффект с точки зрения обеспечения защиты. По мнению авторов, 4-кратная иммунизация рСМV-UbsHAPQ могла привести к слабой индукции антител, не нейтрализующих вирус и обостряющих болезнь (49), что, в свою очередь, может подавлять защитное действие индуцированных CD8+-Т-клеток.
Иммунизация библиотеками экспрессии. Иммунизация с использованием библиотек экспрессии (ELI – expression library immunization) рас-1074
сматривается как перспективное направление при разработке средств защиты от особо опасных инфекций (60, 61). Для повышения иммуногенности можно создавать модифицированные ELI-вакцины с нацеливанием кодируемых антигенов на места индукции иммунных механизмов, либо с активизацией внутриклеточной деструкции и презентации этих антигенов (62, 63). Изучена протективность ASFVUblib — ДНК-библиотеки, представленной короткими фрагментами генома ASFV, объединенными с геном убиквитина в составе плазмиды pCMV-Ub для усиления индукции специфических ЦТЛ (64). Полученные 4029 клонов (всего 130 тыс. п.н.) охватывали около 76 % вирусного генома. Субоптимальная доза плазмиды при введении животным — 0,15 мкг, оптимальная — 600 мкг. После заражения вирулентным штаммом ASFV Е75 все контрольные свиньи (5 гол.) погибли до 10-х сут, тогда как из 5 особей, иммунизированных ASFVUblib, 3 выжили и 2 погибли на 10-е сут (позднее, чем начался падеж животных в контроле). В повторном опыте отмечали ту же степень защиты животных и подтвердили протективный потенциал ASFVUblib. Всего в двух экспериментах 6 из 10 иммунизированных свиней пережили летальное заражение ASFV. У выживших животных титров вируса в крови и носовых выделениях были ниже, чем у павших от АЧС ASFVUblib-иммунизированных и контрольных особей. У всех животных развивались типичные симптомы, включая лихорадку, но у выживших свиней клиническое состояние и температура приходили в норму на 11-12-е сут после заражения, а окончательное восстановление сопровождалось отсутствием виремии, начиная с 21-х сут. У таких особей вирус не обнаружили ни в одной из исследованных тканей, включая заглоточные лимфатические узлы, миндалины и селезенку, что подтверждалось отсутствием характерных для АЧС макро- и микроскопических поражений при посмертном обследовании. В ИФА ни у одной особи из иммунизированных ASFVUblib не выявили специфических антител к белкам ASFV до контрольного заражения, что подтверждало результаты, полученные с плазмидами, кодирующими убиквитинированные потенциально протективные белки (р30, р54, CD2v). У выживших свиней среди всех исследованных клеточных субпопуляций статистически значимый рост численности отмечался только у CD8+-Т-клеток, начиная с 5-х сут, что, по-видимому, подтверждает факт развития специфических CD8+-T-клеточ-ных ответов до контрольного заражения вирусом АЧС, а также подчеркивает их роль в защите от вируса АЧС. Отсутствие полной защиты не привело к появлению животных-носителей, поскольку у выживших особей титры вируса в крови, назальных жидкостях, лимфатических узлах, миндалинах и селезенке была ниже чувствительности теста, что минимизировало угрозу передачи ASFV восприимчивым реципиентам.
Вирусы BacMam. Для оптимизации индуцированных иммунных реакций были определены возможности вакцинации, основанной на использовании вирусов BacMam, которые представляют собой бакуловирусные векторы, кодирующие белки вирусов под контролем промоторов позвоночных, что обеспечивает высокую экспрессию трансгена в клетках млекопитающих (65-67). Несмотря на то, что для бакуловирусов хозяевами служат клетки членистоногих, вирусы BacMam также способны эффективно тран-сдуцировать клетки позвоночных, в которых исходные бакуловирусы к репликации не способны. Таким образом, BacMam по безопасности подходят для использования в качестве вакцинных векторов (68-73). Эффективность вакцинации BacMam была продемонстрирована на мелких лабораторных животных, установлена способность индуцировать гуморальные и клеточные реакции (68, 74-77).
При использовании рекомбинантного BacMam, кодирующего три белка ASFV изолята E75 под контролем специфического для позвоночных промотора рCMV (39) новый рекомбинантный бакуловирус (BacMam-sHAPQ) кодировал два полноразмерных иммунодоминантных белка р30 и р54, слитых с карбоксильным концом внеклеточного домена вирусного гемагглютинина (sHA; НА в позициях 21-204). До этого было продемонстрировано, что химерный белок (sHAPQ) индуцировал гуморальные и клеточные иммунные ответы у свиней при введении в виде ДНК (40).
Экспрессия химерного белка sHAPQ in vitro у млекопитающих доказана методом непрямой иммунофлуоресценции в клетках KOP/R, трансду-цированных с помощью BacMam-sHAPQ. Иммуногенность BacMam-sHAPQ определяли после 3-кратного введения 107 БОЕ с 15-суточным интервалом (в контроле — бакуловирус дикого типа). Затем всех животных инфицировали гомологичным изолятом Е75 в дозе 102 ГАЕ50. Все контрольные животные заболевали (с различными клиническими проявлениями АЧС с коротким пиком лихорадки (< 41,5 °С). На 10-е сут титры вируса в крови достигали максимума и медленно снижались до гибели к 17-м сут после инфицирования. У 4 из 6 иммунизированных BacMam-sHAPQ свиней виремии и клинических признаков заболевания не было (перед заражением ни у одного из этих животных вирусоспецифических антител не обнаружили). Более того, кинетика специфических гуморальных реакций после инфицирования ASFV была идентичной как у иммунизированных групп, так и в контроле. По мнению авторов, отсутствие индукции специфических антител не может быть следствием дефектов экспрессии белка или антигенной специфики слитого белка, поскольку индуцированный антиген (sHAPQ) вызвал активную гуморальную реакцию при иммунизации свиней канди-датной ДНК-вакциной (40). Неспособность BacMam-sHAPQ индуцировать специфические антитела не связана с исходной ошибкой стратегии BacMam, поскольку этот вектор успешно используется со многими другими антигенами (73, 74, 78). Одно из объяснений в том, что возможен какой-либо дефект в представлении антигенов В-клеткам in vivo, как это показано для других антигенов (79, 80). Индуцированные клеточные ответы оценивали с помощью IFNc-ELISPOT (49), для чего одноядерные клетки периферической крови (РВМС), выделенные через 15 сут после каждой иммунизации или 17 сут после заражения, стимулировали в течение 16 ч изолятом E75 (106 ГАЕ50/см3). Как и ожидалось, в контроле подобных ответов до заражения не было, а у 4 из 6 свиней, иммунизированных BacMam-sHAPQ, специфические Т-клеточные ответы проявились. Это полностью согласуется с данными, полученными при использовании аттенуированный штамм вируса АЧС, когда была установлена прямая корреляция между защитой и индукцией IFNc-секретирующих Т-клеток (11).
Следовательно, при вакцинации BacMam-sHAPQ защита свиней против сублетального гомологичного заражения ASFV возможна в отсутствие индукции антител. Кроме того, индуцированная защита и стимуляция Т-клеток прямо ассоциированы.
Стратегия разработки ДНК-вакцин при АЧС. В ветеринарии уже лицензированы препараты для ДНК-вакцинации лошадей против вируса Западного Нила и лососевых рыб против инфекционного геморрагического некроза (81). При иммунизации кандидатными ДНК-вакцинами обнаружены вируснейтрализующие антитела против бычьего герпесвируса-1, вирусов диареи крупного рогатого скота, чумы собак, классической чумы свиней, ящура, гепатита B у уток, инфекционной бурсальной болезни, инфекционного гемопоэтического некроза, японского энцефалита, ре-1076
продуктивного и респираторного синдрома свиней, псевдобешенства, бешенства, везикулярного стоматита и геморрагической септицемии (82, 83).
Если перспективы классических живых инактивированных субъединичных вакцин при АЧС понятны, то подходы к получению средств специфической защиты на основе ДНК-технологий еще необходимо выработать. При создании ДНК-вакцины против АЧС следует исходно определить цели и минимальные требования. Применение ДНК-вакцины целесообразно для временного сохранения поголовья на крупных свинокомплексах в очаге инфекции и первой угрожаемой зоне на период переработки продукции, а также в африканских странах, где заболевание энзоотично. Она также необходима в связи с тем, что нельзя полностью исключить вероятность появления опасных для человека или экономически значимых животных природных либо созданных вирулентных штаммов ASFV или подобных ему патогенов. По нашему мнению, ДНК-вакцина должна защищать от гибели, заболевания, виремии при заражении гомологичным вирулентным изолятом и от его приживления; не вызывать реакций в месте введения; при 1-2-кратном введении индуцировать защиту через 14-21 сут на срок до полугода; быть устойчивой при обычных условиях хранения и транспортировки. Эффективная ДНК-вакцина предполагает измеряемую in vitro индукцию как ЦТЛ, так и антител, участвующих в АЗКЦ и не выявляемых в ИФА-тесте или реакции нейтрализации, которые специфичны в отношении узкого спектра эпитопов протективных белков. При этом важно оптимальное соотношение индуцируемых клеточных и опосредованных антителами иммунологических механизмов защиты. С помощью ELI-библиотек, возможно, удастся определить протективно значимые эпитопы как для ЦТЛ, так и для АЗКЦ (60). Предстоит оптимизировать способы доставки ДНК-конструкций в иммунокомпетентные клетки, обеспечить нацеливание продуктов трансляции и иммунокомпетентных клеток на антигенпрезентирующие клетки, подобрать средства иммуностимуляции. Для этого можно использовать электропорацию (84), дополнительные стимулирующие молекулы, например синтетические олигодезоксинуклеотиды, содержащие немете-лированные CpG мотивы (85), или прайм-бустерную стратегию иммунизации (86, 87). В организме работа иммунной системы коррегируется мозгом и вегетативной нервной системой (88). Поэтому поиск средств и способов избирательного воздействия на отдельные субпопуляции клеток иммунной системы для реализации протективонго потенциала кандидатных ДНК-вакцин также представляется актуальным. Кроме того, придется учитывать новые молекулярные механизмы вирулентности и защиты патогенов от иммунитета хозяев, которые будут открыты при проведении исследований.
Итак, механизмы иммунного ответа на заражение ASFV и взаимодействия вирус-хозяин все еще требуют выяснения. Тем не менее, результаты исследований по разработке ДНК-вакцины против АЧС (эксперименты с ДНК-конструкцией, несущей ген sHA, с рСМV-UbsHAPQ, кодирующей антигенные детерминанты p30, p54 и sHA, слитые с клеточным убиквитином, ДНК-библиотека ASFVUblib, использовании рекомбинантного бакуловируса BacMam-sHAPQ) обнадеживают.
Список литературы Механизмы иммунной защиты и перспективы создания ДНК-вакцин против африканской чумы свиней
- Dixon L.K., Abrams C.C., Bowick G., Goatley L.C., Kay-Jackson P.C., Chapman D., Liverani E., Nix R., Silk R., Zhang F. African swine fever virus proteins involved in evading host defence systems. Vet. Immunol. Immunopathol., 2004, 100: 117-134 ( ) DOI: 10.1016/j.vetimm.2004.04.002
- Gogin A., Gerasimov V., Malogolovkin A., Kolbasov D. African swine fever in the North Caucasus region and the Russian Federation in years 2007-2012. Virus Res., 2013, 173(1): 198-203 ( ) DOI: 10.1016/j.virusres.2012.12.007
- Abrahantes J.C., Gogin A., Richardson J., Gervelmeyer A. Epidemiological analyses on African swine fever in the Baltic countries and Poland. EFSA Journal, 2017, 15(3): 4732 ( ) DOI: 10.2903/j.efsa.2017.4732
- Mebus C.A. African swine fever. Adv. Virus Res., 1988, 35: 251-269 ( ) DOI: 10.1016/S0065-3527(08)60714-9
- Blome S., Gabriel C., Beer M. Modern adjuvants do not enhance the efficacy of an inactivated African swine fever virus Vaccine preparation. Vaccine, 2014, 32: 3879-3882 ( ) DOI: 10.1016/j.vaccine.2014.05.051
- Коваленко Я.Р., Сидоров М.А., Бурба Л.Г. Африканская чума свиней. М, 1972.
- Petuska N. Quelques aspects morphogenesis des suites de la vaccination contre la PPA (virose L) an Portugal. Bull. Off. Int. Epiz., 1965, 63: 199-237.
- Vigário J.D., Terrinha A.M., Nunes J.F.M. Antigenic relatonships among strains of African swine fever virus. Arch. ges. Virusforschung, 1974; 45: 272-277 ( ) DOI: 10.1007/BF01249690
- Колбасов Д.В., Балышев В.М., Середа А.Д. Итоги разработки живых вакцин против африканской чумы свиней. Ветеринария, 2014, 8: 3-8.
- Boinas F.S., Hutchings G.H., Dixon L.K., Wilkinson P.J. Characterization of pathogenic and non-pathogenic African swine fever virus isolates from Ornithodoros erraticus inhabiting pig premises in Portugal. J. Gen. Virol., 2004, 85: 2177-2187 ( ) DOI: 10.1099/vir.0.80058-0
- King K., Chapman D., Argilaguet J.M., Fishbourne E., Hutet E., Cariolet R., Hutchings G., Oura C.A.L., Netherton C.L., Moffat K. Protection of European domestic pigs from virulent African isolates of African swine fever virus by experimental immunisation. Vaccine, 2011, 29: 4593-4600 ( ) DOI: 10.1016/j.vaccine.2011.04.052
- Onisk D.V., Borca M.V., Kutish G., Kramer E., Irusta P., Rock D.L. Passively transferred African swine fever virus antibodies protect swine against lethal infection. Virology, 1994, 198(1): 350-354 ( ) DOI: 10.1006/viro.1994.1040
- Viñuela E. African swine fever virus. Current Topics in Microbiology and Immunology, 1985, 116: 151-170 ( ) DOI: 10.1007/978-3-642-70280-8_8
- Escribano J.M., Galindo I., Alonso C. Antibody-mediated neutralization of African swine fever virus: myths and facts. Virus Res., 2013, 173: 101-109 ( ) DOI: 10.1016/j.virusres.2012.10.012
- Gomez-Puertas P., Rodriguez F., Oviedo J.M., Ramiro-Ibanez F., Ruiz-Go-nzalvo F., Alonso C., Escribano J.M. Neutralizing antibodies to different proteins of African swine fever virus inhibit both virus attachment and internalization. J. Virol., 1996, 70: 5689-5694.
- Gomez-Puertas P., Rodriguez F., Oviedo J.M., Brun A., Alonso C., Escribano J.M. The African Swine Fever Virus proteins p54 and p30 are involved in two distinct steps of virus attachment and both contribute to the antibody-mediated protective immune response. Virology, 1998, 243, 461-471 ( ) DOI: 10.1006/viro.1998.9068
- Середа А.Д., Соловкин С.Л., Фугина Л.Г., Макаров В.В. Иммунные реакции на вирус африканской чумы свиней. Вопросы вирусологии, 1992, 3: 168-170.
- Макаров В.В., Вишняков И.Ф., Коломыцев А.А., Середа А.Д. Сравнительный анализ показателей функциональной активности гуморального и клеточного иммунитета при вирусных инфекциях in vivo. Бюллетень экспериментальной биологии и медицины, 1995, 12: 599-602.
- Norley S.G., Wardley R.C. Cytotoxic lymphocytes induced by African swine fever infection. Res. Vet. Sci., 1984, 37: 255-257.
- Makarov V., Nedosekov V., Sereda A., Matvienko N. Immunological conception of African swine fever. Zoology and Ecology, 2016, 26(3): 236-243 ( ) DOI: 10.1080/21658005.2016.1182822
- Martins C.L.V., Lawman M.J.P., Scholl T., Mebus C.A., Lunney J.K. African swine fever virus specific porcine cytotoxic T cell activity. Arch. Virol., 1993, 129(1-4): 211-225 ( ) DOI: 10.1007/BF01316896
- Oura C.A.L., Denyer M.S., Takamatsu H., Parkhouse R.M.E. In vivo depletion of CD8+ T lymphocytes abrogates protective immunity to African swine fever virus. J. Gen. Virol., 2005, 86: 2445-2450 ( ) DOI: 10.1099/vir.0.81038-0
- Середа А.Д., Казакова А.С., Иматдинов А.Р., Колбасов Д.В. Гуморальные и клеточно-опосредованные механизмы иммунитета при африканской чуме свиней. Сельскохозяйственная биология, 2015, 50(6): 709-718. ( ) DOI: 10.15389/agrobiology.2015.6.709rus
- Середа А.Д. Моделирование in vitro защитных иммунных механизмов при африканской чуме свиней. Сельскохозяйственная биология, 2013, 4: 59-64 ( ) DOI: 10.15389/agrobiology.2013.4.59rus
- Kollnberger S.D., Gutierrez-Castañeda B., Foster-Cuevas M., Corteyn A., Parkhouses R.M.E. Identification of the principal serological immunodeterminants of African swine fever virus by screening a virus cDNA library with antibody. J. Gen. Virol., 2002, 83: 1331-1342 ( ) DOI: 10.1099/0022-1317-83-6-1331
- Barderas M.G., Rodriguez F., Gomez-Puertas P., Aviles M., Beitia F., Alonso C., Escribano J. M. Antigenic and immunogenic properties of a chimera of two immunodominant African swine fever virus proteins. Arch. Virol., 2001, 146: 1681-1691 ( ) DOI: 10.1007/s007050170056
- Neilan J.G., Zsak L., Lu Z., Burrage T.G., Kutish G.F., Rock D.L. Neutralizing antibodies to African swine fever virus proteins p30, p54, and p72 are not sufficient for antibody-mediated protection. Virology, 2004, 319: 337-342.
- Salas M.L., Andrés G. African swine fever virus morphogenesis. Virus Res., 2013, 173(1): 29-41 ( ) DOI: 10.1016/j.virusres.2012.09.016
- Pastor M.J., Laviada M.D., Sanchez-Vizcaino J.M., Escribano J.M. Detection of African swine fever virus antibodies by immunoblotting assay. Can. J. Vet. Res., 1989, 53(1): 105-107.
- Gallardo C., Blanco E., Rodríguez J.M., Carrascosa A.L., Sanchez-Vizcaino J.M. Antigenic properties and diagnostic potential of African swine fever virus protein pp62 expressed in insect cells. J. Clin. Microbiol., 2006, 44: 950-956 ( ) DOI: 10.1128/jcm.44.3.950-956.2006
- Andrés G., Simón-Mateo C., Viñuela E. Assembly of African swine fever virus: role of polyprotein pp220. J. Virol., 1997, 71: 2331-2341.
- Reis A.L., Parkhouse R.M., Penedos A.R., Martins C., Leitão A. Systematic analysis of longitudinal serological responses of pigs infected experimentally with African swine fever virus. J. Gen. Virol., 2007, 88: 2426-2434 ( ) DOI: 10.1099/vir.0.82857-0
- Kazakova A.S., Imatdinov I.R., Dubrovskaya O.A., Imatdinov A.R., Sidlik M.V., Balyshev V.M., Krasochko P.A., Sereda A.D. Recombinant protein p30 for serological diagnosis of African Swine Fever by immunoblotting assay. Transbound. Emerg. Dis., 2017, 64(5): 1479-1492 ( ) DOI: 10.1111/tbed.12539
- Giménez-Lirola L.G., Mur L., Rivera B., Mogler M., Sun Y., Lizano S., Goodell C., Harris D.L.H., Rowland R.R.R., Gallardo C., Sánchez-Vizcaíno J.M., Zimmerman J. Detection of African Swine Fever Virus antibodies in serum and oral fluid specimens using a recombinant protein 30 (p30) dual matrix indirect ELISA. PLoS ONE, 2016, 11(9): 1-14 ( ) DOI: 10.1371/journal.pone.0161230
- Середа А.Д., Анохина Е.Г., Макаров В.В. Гликопротеины вируса африканской чумы свиней. Вопросы вирусологии, 1994, 39(6): 278-281.
- Середа А.Д. Иммуногенные и протективные свойства гликопротеинов вируса африканской чумы свиней. Актуальные вопросы ветеринарной биологии, 2013, 4(20): 31-35.
- Borca M.V., Kutish G.F., Afonso C.L., Irusta P., Carrillo C., Brun A., Sussman M., Rock D.L. An African swine fever virus gene with similarity to the T-lymphocyte surface antigen CD2 mediates hemadsorption. Virology, 1994, 199: 463-468 ( ) DOI: 10.1006/viro.1994.1146
- Malogolovkin A., Burmakina G., Tulman E.R., Delhon G., Diel D.G., Salnikov N., Kutish G.F., Kolbasov D., Rock D.L. African swine fever virus CD2v and C-type lectin gene loci mediate serologic specificity. J. Gen. Virol., 2015, 96(4): 866-873 ( ) DOI: 10.1099/jgv.0.000024
- Argilaguet J.M., Pérez-Martín E., López S., Goethe M., Escribano J.M., Giesow K., Keil G.M., Rodríguez F. BacMam immunization partially protects pigs against sublethal challenge with African swine fever virus. Antiviral Res., 2013, 98(1): 61-65 ( ) DOI: 10.1016/j.antiviral.2013.02.005
- Argilaguet J.M., Pérez-Martín E., Nofrarías M., Gallardo C., Accensi F., Lacasta А., Mora M., Ballester M., Galindo-Cardiel I., López-Soria S., Escribano J.M., Reche P.A., Rodríguez F. DNA vaccination partially protects against African Swine Fever Virus lethal challenge in the absence of antibodies. PLoS ONE, 2012, 7(9): 1-11 ( ) DOI: 10.1371/journal.pone.0040942
- Jiao S., Williams P., Berg R.K., Hodgeman B.A., Liu L., Repetto G., Wolff J.A. Direct gene transfer into nonhuman primate myofibers in vivo. Hum. Gene Ther., 1992, 3: 21-33 ( ) DOI: 10.1089/hum.1992.3.1-21
- Kutzler M.A., Weiner D.B. DNA vaccines: ready for prime time? Nat. Rev. Genet., 2008, 9: 776-788 ( ) DOI: 10.1038/nrg2432
- Сюрин В.Н., Самуйленко А.Я., Соловьёв Б.В., Фомина Н.В. Вирусные болезни животных. М., 2001.
- Rajcani J., Mosko T., Rezuchova I. Current developments in viral DNA vaccines: shall they solve the unsolved? Rev. Med. Virol., 2005, 15(5): 303-325 ( ) DOI: 10.1002/rmv.467
- Liu M.A., Wahren B., Hedestam G.B.K. DNA vaccines: recent developments and future possibilities. Hum. Gene Ther., 2006, 17(11): 1051-1061 ( ) DOI: 10.1089/hum.2006.17.1051
- van Drunen L.H., Babiuk S.L., Babiuk L.A. Strategies for improved formulation and delivery of DNA vaccines to veterinary target species. Immunol. Rev., 2004, 199: 113-125 ( ) DOI: 10.1111/j.0105-2896.2004.00140.x
- Leifert J.A., Rodriguez-Carreno M.P., Rodriguez F., Whitton J.L. Targeting plasmid encoded proteins to the antigen presentation pathways. Immunol. Rev., 2004, 199(1): 40-53 ( ) DOI: 10.1111/j.0105-2896.2004.0135.x
- Рыбаков С.С., Грубый В.А. Подходы к созданию вакцины против африканской чумы свиней (обзор зарубежной литературы). Ветеринария, 2014, 3: 3-9.
- Argilaguet J.M., Perez-Martin E., Gallardo C., Salguero F.J., Borrego B., Lacasta A., Accensi F., Díaz I., Nofrarías M., Pujols J., Blanco E., Pérez-Filgueira M., Escribano J.M., Rodríguez F. Enhancing DNA immunization by targeting ASFV antigens to SLA-II bearing cells. Vaccine, 2011, 29(33): 5379-5385 ( ) DOI: 10.1016/j.vaccine.2011.05.084
- Rodriguez J.M., Yanez R.J., Almazan F., Vinuela E., Rodriguez J.F. African swine fever virus encodes a CD2 homolog responsible for the adhesion of erythrocytes to infected cells. J. Virol., 1993, 67(9): 5312-5320.
- Brossay A., Hube F., Moreau T., Bardos P., Watier H. Porcine CD58: cDNA cloning and molecular dissection of the porcine CD58-human CD2 interface. Biochem. Biophys. Res. Commun., 2003, 309: 992-998 ( ) DOI: 10.1016/j.bbrc.2003.08.099
- Crosby K., Yatko C., Dersimonian H., Pan L., Edge A.S. A novel monoclonal antibody inhibits the immune response of human cells against porcine cells: identification of a porcine antigen homologous to CD58. Transplantation, 2004, 77(8): 1288-1294.
- Ruffini P.A., Grodeland G., Fredriksen A.B., Bogen B. Human chemokine MIP1alpha increases efficiency of targeted DNA fusion Vaccines. Vaccine, 2010, 29(2): 191-199 ( ) DOI: 10.1016/j.vaccine.2010.10.057
- Nchinda G., Kuroiwa J., Oks M., Trumpfheller C., Park C.G., Huang Y., Hannaman D., Schlesinger S.J., Mizenina O., Nussenzweig M.C., Überla K., Steinman R.M. The efficacy of DNA vaccination is enhanced in mice by targeting the encoded protein to dendritic cells. J. Clin. Invest., 2008, 118: 1427-1436 ( ) DOI: 10.1172/jci34224
- Holliger P., Hudson P.J. Engineered antibody fragments and the rise of single domains. Nat. Biotechnol., 2005, 23(9): 1126-1136 ( ) DOI: 10.1038/nbt1142
- Demangel C., Zhou J., Choo A.B., Shoebridge G., Halliday G.M., Britton W.J. Single chain antibody fragments for the selective targeting of antigens to dendritic cells. Mol. Immunol., 2005, 42(8): 979-985 ( ) DOI: 10.1016/j.molimm.2004.09.034
- Grossmann C., Tenbusch M., Nchinda G., Temchura V., Nabi G., Stone G.W., Kornbluth R.S., Überla K. Enhancement of the priming efficacy of DNA vaccines encoding dendritic cell-targeted antigens by synergistic toll-like receptor ligands. BMC Immunol., 2009, 10: 43 ( ) DOI: 10.1186/1471-2172-10-43
- Ivanovska N., Tchorbanov A., Prechl J., Maximova V., Voynova E., Vassilev T.L. Immunization with a DNA chimeric molecule encoding a hemagglutinin peptide and a scFv CD21-specific antibody fragment induces long-lasting IgM and CTL responses to influenza virus. Vaccine, 2006, 24(11): 1830-1837 ( ) DOI: 10.1016/j.vaccine.2005.10.029
- Pereboev A.V., Asiedu C.K., Kawakami Y., Dong S.S., Blackwell J.L., Kashentseva E.A., Triozzi P.L., Aldrich W.A., Curiel D.T., Thomas J.M., Dmitriev I.P Coxsackie virus-adenovirus receptor genetically fused to anti-human CD40 scFv enhances adenoviral transduction of dendritic cells. Gene Ther., 2002, 9(17): 1189-1193 ( ) DOI: 10.1038/sj.gt.3301767
- Barry M.A., Howell D.P., Andersson H.A., Chen J.L., Singh R.A. Expression library immunization to discover and improve vaccine antigens. Immunol. Rev., 2004, 199: 68-83 ( ) DOI: 10.1111/j.0105-2896.2004.00143.x
- Talaat A.M., Stemke-Hale K. Expression library immunization: a road map for discovery of vaccines against infectious diseases. Infect. Immun., 2005, 73: 7089-7098 ( ) DOI: 10.1128/iai.73.11.7089-7098.2005
- Rodriguez F., Whitton J.L. Enhancing DNA immunization. Virology, 2000, 268(2): 233-238 ( ) DOI: 10.1006/viro.2000.0209
- Rodriguez F., An L.L., Harkins S., Zhang J., Yokoyama M., Widera G., Fuller J.T., Kincaid C., Campbell I.L., Whitton J.L. DNA immunization with minigenes: low frequency of memory cytotoxic T lymphocytes and inefficient antiviral protection are rectified by ubiquitination. J. Virol., 1998, 72(2): 5174-5181.
- Lacasta A., Ballester M., Monteguado P.L., Rodriguez J.M., Salas M.L., Accensi F., Pina-Pedrero S., Bensaid A., Argilaguet J., López-Soria S., Hutet E., Le Potier M.F., Rodríguez F. Expression library immunization can confer protection against African swine fever virus lethal challenge. J. Virol., 2014, 88(22): 13322-13332 ( ) DOI: 10/1128/jvi.01893-14
- Keil G.M., Klopfleisch C., Giesow K., Blohm U. Novel vectors for simultaneous high-level dual protein expression in vertebrate and insect cells by recombinant baculoviruses. J. Virol. Methods, 2009, 160: 132-137 ( ) DOI: 10.1016/j.jviromet.2009.05.001
- Kost T.A., Condreay J.P. Recombinant baculoviruses as mammalian cell gene delivery vectors. Trends Biotechnol., 2002, 20: 173-180 ( ) DOI: 10.1016/s0167-7799(01)01911-4
- O’Grady M., Batchelor R.H., Scheyhing K., Kemp C.W., Hanson G.T., Lakshmipathy U. BacMam-mediated gene delivery into multipotent mesenchymal stromal cells. Methods Mol. Biol., 2011, 698: 485-504 ( ) DOI: 10.1007/978-1-60761-999-4_34
- Brun A., Albina E., Barret T., Chapman D.A., Czub M., Dixon L.K., Keil G.M., Klonjkowski B., Le Potier M.F., Libeau G., Ortego J., Richardson J., Takamatsu H.H. Antigen delivery systems for veterinary Vaccine development viralvector based delivery systems. Vaccine, 2008, 26: 6508-6528 ( ) DOI: 10.1016/j.vaccine.2008.09.044
- Condreay J.P., Kost T.A. Baculovirus expression vectors for insect and mammalian cells. Curr. Drug Targets, 2007, 8(10): 1126-1131 ( ) DOI: 10.2174/138945007782151351
- Huser A., Hofmann C. Baculovirus vectors: novel mammalian cell gene delivery vehicles and their applications. Am. J. Pharmacogenomics, 2003, 3: 53-63 ( ) DOI: 10.2165/00129785-200303010-00007
- Koroleva N.N., Spirin P.V., Timokhova A.V., Rubtsov P.M., Kochetkov S.N., Prasolov V.S., Belzhelarskaia S.N. Baculovirus vectors for efficient gene delivery and expression in mammalian cells. Mol. Biol., 2010, 44(3): 541-550 ( ) DOI: 10.1134/s0026893310030180
- Kost T.A., Condreay J.P., Ames R.S., Rees S., Romanos M.A. Implementation of BacMam virus gene delivery technology in a drug discovery setting. Drug Discov. Today, 2007, 12: 396-403 ( ) DOI: 10.1016/j.drudis.2007.02.017
- Li Y., Ye J., Cao S., Xiao S., Zhao Q., Liu X., Jin M., Chen H. Immunization with pseudotype baculovirus expressing envelope protein of Japanese encephalitis virus elicits protective immunity in mice. J. Gene Med., 2009, 11(2): 150-159 () DOI: 10.1002/jgm.1282
- Bai B., Lu X., Meng J., Hu Q., Mao P., Lu B., Chen Z., Yuan Z., Wang H. Vaccination of mice with recombinant baculovirus expressing spike or nucleocapsid protein of SARS-like coronavirus generates humoral and cellular immune responses. Mol. Immunol., 2008, 45: 868-875 ( ) DOI: 10.1016/j.molimm.2007.08.010
- Tang X.C., Lu H.R., Ross T.M. Baculovirus-produced influenza virus-like particles in mammalian cells protect mice from lethal influenza challenge. Viral Immunol., 2011, 24(4): 311-319 ( ) DOI: 10.1089/vim.2011.0016
- Wang S., Fang L., Fan H., Jiang Y., Pan Y., Luo R., Zhao Q., Chen H., Xiao S. Construction and immunogenicity of pseudotype baculovirus expressing GP5 and M protein of porcine reproductive and respiratory syndrome virus. Vaccine, 2007, 25: 8220-8227 ( ) DOI: 10.1016/j.vaccine.2007.09.069
- Wu Q., Fang L., Wu X., Li B., Luo R., Yu Z., Jin M., Chen H., Xiao S. A pseudotype baculovirus-mediated vaccine confers protective immunity against lethal challenge with H5N1 avian influenza virus in mice and chickens. Mol. Immunol., 2009, 46: 2210-2217 ( ) DOI: 10.1016/j.molimm.2009.04.017
- Facciabene A., Aurisicchio L., La Monica N. Baculovirus vectors elicit antigen-specific immune responses in mice. J. Virol., 2004, 78: 8663-8672 ( ) DOI: 10.1128/JVI.78.16.8663-8672.2004
- Borrego B., Fernandez-Pacheco P., Ganges L., Domenech N., Fernandez-Borges N., Sobrino F., Rodríguez F. DNA Vaccines expressing B and T cell epitopes can protect mice from FMDV infection in the absence of specific humoral responses. Vaccine, 2006, 24: 3889-3899 ( ) DOI: 10.1016/j.vaccine.2006.02.028
- Ganges L., Barrera M., Núñez J.I., Blanco I., Frias M.T., Rodríguez F., Sobrino F. A DNA Vaccine expressing the E2 protein of classical swine fever virus elicits T cell responses that can prime for rapid antibody production and confer total protection upon viral challenge. Vaccine, 2005, 23: 3741-3752 ( ) DOI: 10.1016/j.vaccine.2005.01.153
- Wahren B., Liu M.A. DNA Vaccines: recent developments and the future. Vaccines, 2014, 2(4): 785-796 ( ) DOI: 10.3390/vaccines2040785
- Cantlon J.D., Gord P.W., Bowen R.A. Immune responses in mice, cattle and horses to a DNA vaccine for vesicular stomatitis. Vaccine, 2000, 18(22): 2368-2374 ( ) DOI: 10.1016/S0264-410x(00)00007-4
- Mateen I., Irshad S. A review on DNA Vaccines. Journal of Health Sciences, 2011, 1(1): 1-7 ( ) DOI: 10.5923/j.health.20110101.01
- van Drunen S.L.H., Lawman Z., Wilson D., Luxembourg A., Ellefsen B., van den Hurk J.V., Hannaman D. Electroporation enhances immune responses and protection induced by a bovine viral diarrhea virus DNA Vaccine in newborn calves with maternal antibodies. Vaccine, 2010, 28: 6445-6454 ( ) DOI: 10.1016/j.vaccine.2010.07.045
- Heegaard P.M., Dedieu L., Johnson N., Le Potier M.F., Mockey M., Mutinelli F., Vahlenkamp T., Vascellari M., Sørensen N.S. Adjuvants and delivery systems in veterinary vaccinology: current state and future developments. Arch. Virol., 2011, 156: 183-202 ( ) DOI: 10.1007/s00705-010-0863-1
- Dale C.J., Thomson S., De Rose R., Ranasinghe C., Medveczky C.J., Pamungkas J., Boyle D.B., Ramshaw I.A., Kent S.J. Prime-boost strategies in DNA vaccines. Methods Mol. Med., 2006, 127: 171-197 ( ) DOI: 10.1385/1-59745-168-1:171
- Radosevic K., Rodriguez A., Lemckert A., Goudsmit J. Heterologous prime-boost vaccinations for poverty-related diseases: advantages and future prospects. Expert Rev. Vaccines, 2009, 8(5): 577-592 ( ) DOI: 10.1586/erv.09.14
- Корнева Е.А. Иммунофизиология -истоки и современные аспекты развития. Аллергия, астма и клиническая иммунология, 2000, 8: 36-44.


