Механизмы нарушений функций печени и микробиоценоза толстой кишки при хронических вирусных гепатитах В и С и их пробиотическая коррекция
Автор: Соловьева Наталия Владиславовна
Журнал: Ученые записки Петрозаводского государственного университета @uchzap-petrsu
Рубрика: Медицинские науки
Статья в выпуске: 8 (145) т.1, 2014 года.
Бесплатный доступ
На основании проведенного комплекса биохимических и микробиологических исследований и корреляционного анализа установлено, что у больных хроническими гепатитами В (ХГВ) и С (ХГС) в механизмах нарушения функций печени, проявляющихся увеличением энзиматической активности (высокое содержание аспартатаминотрансферазы (АСТ), аланинаминотрансферазы (АЛТ), гамма-глутамилтрансферазы (ГГТ)), нарушениями обмена билирубина (высокое содержание общего и прямого), белка (низкое содержание альбумина у больных ХГС), важную роль играют дисбиотические сдвиги микробного гомеостаза толстой кишки с низким содержанием бифидо- и лактобактерий, высокой частотой встречаемости грибов рода Кандида, что подтверждается уменьшением количества и силы взаимосвязей между активностью ферментов, отсутствием корреляций между микроорганизмами при ХГВ, изменением их взаимосвязей с ферментами и показателями обменных процессов и свидетельствует о рассогласовании детоксицирующей и метаболической функций печени и микробиоценоза толстой кишки. После проведения курса терапии с применением пробиотических препаратов отмечается оптимизация микрофлоры толстой кишки с увеличением численности бифидо- и лактобактерий, уменьшением содержания грибов рода Кандида, а также активация их функций, что способствует увеличению функциональной способности печени и приводит к снижению активности ферментов (АСТ, ГГТ), содержания общего и прямого билирубина у больных ХГВ и ХГС, повышению - альбуминов при ХГС. Отражением этих изменений является восстановление корреляционных взаимосвязей микроорганизмов с активностью ферментов и параметрами обменных процессов.
Печень, вирусы гепатитов в и с, дисбактериоз
Короткий адрес: https://sciup.org/14750787
IDR: 14750787 | УДК: 616.36-002.2:
Текст научной статьи Механизмы нарушений функций печени и микробиоценоза толстой кишки при хронических вирусных гепатитах В и С и их пробиотическая коррекция
Вирусы гепатита В и С являются одними из основных этиологических факторов, приводящих к развитию хронических заболеваний печени (ХЗП), при этом отмечается рост количества лиц молодого возраста, инфицированных ими и страдающих ХЗП [8], [13].
Отмечено, что при ХГВ и ХГС имеют место выраженные дисбиотические нарушения микрофлоры кишечника [21]. Сниженная детоксикационная функция микрофлоры при дисбиозе кишечника увеличивает нагрузку на ферментные системы печени, что способствует возникновению в ней метаболических и структурных изменений [14]. В то же время нарушения процессов синтеза и экскреции компонентов желчи при ХЗП могут привести к нарушению микробиоценоза кишечника [10], [17].
Современные подходы к противодействию патологическим изменениям при дисбиозе кишечника состоят в восстановлении и стимуляции облигатной флоры посредством применения пробиотических препаратов, которые оказывают положительное действие на физиологические функции организма путем оптимизации его микроэкологического статуса [3], [4], [9]. Однако
механизмы минимизации нарушенных функций печени при применении пробиотических препаратов практически не изучены.
Целью работы явилось обоснование роли микрофлоры кишечника в механизмах повреждения печени при вирусных ее поражениях и применения пробиотических препаратов для оптимизации нарушенных функций кишечника и печени.
МАТЕРИАЛ И МЕТОДЫ ИССЛЕДОВАНИЯ
Обследовано 104 больных хроническими вирусными гепатитами (53,8 % мужчин и 46,2 % женщин), средний возраст 42,2 ± 1,9 года, из них ХГВ – 43 чел. (41,3 %) – I группа и ХГС – 35 чел. (33,6 %) – II группа с умеренной и слабовыражен-ной степенью активности. Достоверных различий в биохимических и микробиологических анализах по половому признаку обнаружено не было, в связи с чем в дальнейшем были сформированы группы больных ХГВ и ХГС без учета различий по полу. В соответствии с лечебными мероприятиями больные были разделены на подгруппы: пациенты в подгруппах I-а (53,4 % от больных ХГВ), II-а (51,4 % от больных ХГС) получали лечение по стандартной схеме, принятой в инфекционной практике, включавшей гепатопро- текторы, витамины группы В; больным подгрупп I-б (46,6 % от больных ХГВ), II-б (48,6 % от больных ХГС) помимо основного курса лечения проводилась коррекция дисбиоза толстого кишечника препаратами пробиотического действия «Альгибиф» и «Альгилак». Контрольную группу составили 26 практически здоровых мужчин. По возрастному составу указанные группы между собой достоверно не различались.
Обследование осуществлялось: в 1-е сут. госпитализации в инфекционное отделение областной клинической больницы г. Архангельска до начала лечения и после завершения курса терапии на 15–16-е сут. (к среднему времени снижения активности процесса) с повторным взятием фекалий через 2 сут. после окончания курса. Обследование контрольной группы проводилось однократно.
Проведено биохимическое исследование сыворотки крови с определением ферментативной активности АСТ, АЛТ, ГГТ, щелочной фосфатазы (ЩФ), содержания общего и прямого билирубина, показателей белкового и липидного обмена – общего белка, альбуминов, креатинина, мочевины, общего холестерина (ОХ), липопротеидов низкой (ЛПНП) и высокой плотности (ЛПВП), триглицеридов (ТГ), электролитов – калия, натрия, хлоридов.
Кишечную микрофлору изучали в соответствии с методическими рекомендациями МЗ РФ [7]. Количественное содержание основных представителей нормальной микрофлоры толстой кишки выражали в lg КОЕ/г. Частоту обнаружения представителей нормальной микрофлоры толстой кишки определяли в процентах. Степень нарушений нормальной микрофлоры кишечника оценивали по ОСТ 91500.11.0004–2003 [12].
Статистическая обработка полученных результатов, оценка распределения показателей, сравнительный анализ выборок проведен с помощью компьютерного пакета прикладных программ SPSS 15.0.
РЕЗУЛЬТАТЫ И ИХ ОБСУЖДЕНИЕ
В основе патогенеза ХГВ и ХГС лежат им-муноопосредованное воспаление и повреждение гепатоцитов, для ХГС имеет значение также прямой цитопатический эффект вируса [15], [20]. В патогенезе вирусных гепатитов значительная роль принадлежит цитокинам, которые образуются в связи с активацией клеток Купфера эндотоксинами, поступающими из кишечника [6]. Эндотоксины, появляющиеся при увеличении пропорции потенциально патогенных грамот-рицательных бактерий, повреждают клеточные мембраны, нарушают ионный транспорт, инициируют образование свободных радикалов, вызывают фрагментацию нуклеиновых кислот, инициирующих апоптоз, стимулируют продукцию провоспалительных цитокинов (ФНО-α, ИЛ-1,
ИЛ-6, ИЛ-8) клетками Купфера [16]. Это, в свою очередь, усугубляет ухудшение детоксикационной функции печени, нарушения обмена холестерина, желчных кислот, синтеза белка [5], [18].
Микрофлора толстой кишки также участвует в различных видах обмена. Так, лакто- и бифидобактерии синтезируют аминокислоты, белки, витамины группы В, никотиновую и фолиевую кислоту, клостридии, принимают участие в обмене билирубина. Липазы энтерококков и клостридий катализируют гидролиз водорастворимых эфиров жирных кислот, ТГ [2]. Поэтому изменение состава и функций микрофлоры толстой кишки может усугублять структурные и функциональные нарушения в печени.
В проведенном нами ранее исследовании [19] было показано, что наличие дисбиоза толстой кишки с преобладанием тяжелых степеней имело место у 86,1 % больных ХГВ и 91,8 % больных ХГС.
Анализ микробиоценоза толстой кишки выявил снижение численности бифидобактерий на 11,2 % (p = 0,03) у больных ХГВ, лактобактерий – на 17,9 % (p = 0,04) при ХГВ и на 18,3 % (p = 0,04) при ХГС по сравнению с контрольной группой. Достоверно ниже – в 2 раза (р < 0,001) – была частота встречаемости энтерококков при ХГВ и в 3,6 раза (p < 0,001) – при ХГС, но выше – грибов рода Кандида – в 1,4 раза (p = 0,004) в обоих случаях. У всех больных высевались клостридии, которые отсутствовали у здоровых лиц.
Изменения кишечного микробиоценоза наблюдались на фоне повышения активности ферментов: АСТ – в 2 раза (р < 0,001) при ХГВ и в 1,5 раза (р = 0,008) при ХГС; АЛТ в 3 раза (р < 0,001) у больных ХГВ, в 2,5 раза (р < 0,001) у больных ХГС; активность ГГТ также была выше в 2,2 раза (р < 0,001) у больных ХГВ и в 2,4 раза (р < 0,001) при ХГС по сравнению с контрольной группой.
У пациентов обеих обследуемых групп наблюдались явления холестаза. Так, содержание общего билирубина по сравнению с контрольной группой было выше у больных ХГВ в 2 раза (р < 0,001), у пациентов с ХГС – в 1,67 раза; прямого билирубина – в 2,5 раза (р < 0,001) и в 2 раза (р < 0,01) соответственно. Содержание альбуминов по сравнению с контрольной группой было ниже на 8,7 % (р = 0,04) у пациентов с ХГС.
Для установления роли микроорганизмов толстой кишки в механизмах нарушения функций печени при вирусных ее поражениях мы провели анализ корреляционных взаимосвязей функций печени и микробиоценоза толстой кишки. На основании литературных данных, результатов собственных исследований и анализа корреляционных связей нами сформулированы механизмы поражений печени при вирусных ее поражениях с учетом микробиологической составляющей толстой кишки.
У здоровых лиц (рис. 1) корреляционный анализ продемонстрировал наличие сильных внут-
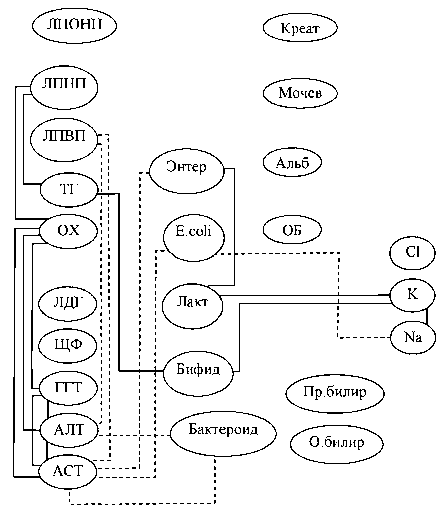
Рис. 1. Корреляционные взаимосвязи биохимических и микробиологических показателей у лиц контрольной группы: сплошная линия – прямая корреляционная взаимосвязь, пунктирная линия – обратная корреляционная взаимосвязь рисистемных связей активности ферментов, показателей липидного обмена, указывающих на достаточную детоксикационную и метаболическую функции печени. Были выявлены корреляции энзимологических показателей крови: АСТ с АЛТ (τ = 0,73, при p < 0,001), ГГТ с АСТ и АЛТ (τ = 0,54, при p = 0,005; τ = 0,61, при p = 0,004); параметров липидного обмена: ЛПНП с ОХ (τ = 0,94, при p < 0,001); ЛПНП с ТГ (τ = 0,85, при p < 0,001).
Наблюдались сильные положительные корреляционные взаимосвязи между лактобактериями и энтерококками (τ = 0,94, при p < 0,005), иллюстрирующие физиологически адекватное функционирование системы микробного гомеостаза.
Отмечены немногочисленные корреляции биохимических и микробиологических показателей, что может указывать на относительно неза- висимое и адекватное функционирование печени и микробиоценоза толстой кишки. Однако наличие взаимосвязей микроорганизмов с активностью ферментов и параметрами липидного обмена свидетельствует о сопряженном функционировании систем детоксикации печени и микрофлоры толстой кишки: энтерококков с АСТ (τ = –0,42, при p = 0,01), кишечной палочки с АСТ (τ = –0,37, при p = 0,01), бактероидов с АСТ и АЛТ (τ = –0,63, при p = 0,01; τ = –0,62, при p = 0,01 соответственно); бифидобактерий с ТГ (τ = 0,56, при p = 0,05).
В целом проведенный корреляционный анализ у здоровых лиц показал адекватную степень внутрисистемного сопряжения ферментативных систем, метаболических функций печени и микробного гомеостаза.
На высоте обострения ХГВ и ХГС было отмечено изменение внутрисистемных корреляций по сравнению со здоровыми лицами (рис. 2). Так, наблюдалось уменьшение численности и силы внутрисистемных корреляционных зависимостей между активностью ферментов: АСТ и АЛТ (τ = 0,33, р = 0,04) при ХГВ и АСТ с АЛТ (τ = 0,51, р = 0,006) при ХГС. При этом у больных ХГС регистрировалось появление значимых корреляционных взаимосвязей показателей белкового обмена: содержание альбуминов обнаружило корреляции с общим белком (τ = 0,85, р < 0,001), что может свидетельствовать о напряжении белково-синтетической функции печени.
Отмечено отсутствие взаимосвязей между микроорганизмами у больных ХГВ, в то время как при ХГС обнаружены новые корреляции бактероидов с клостридиями и лактозонегативными кишечными палочками (τ = 0,55, при p = 0,06; τ = 0,94, при p < 0,001 соответственно).
Отличительной особенностью у больных с ХЗП от контрольной группы явилось появление корреляций микроорганизмов с показателями белкового обмена. При ХГВ обнаружены
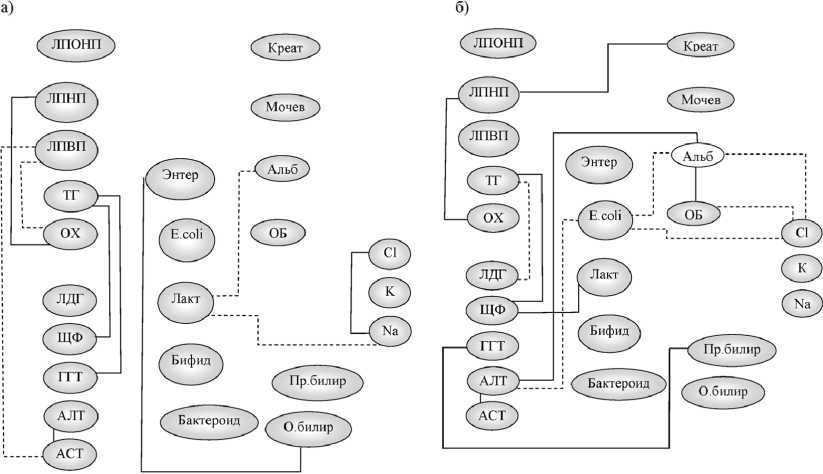
Рис. 2. Корреляционные взаимосвязи биохимических и микробиологических показателей у больных хроническими гепатитами В и С в 1-е сутки: а) ХГВ; б) ХГС. Сплошная линия – прямая корреляционная взаимосвязь, пунктирная линия – обратная корреляционная взаимосвязь
корреляции между низким содержанием лактобактерий и альбуминами (τ = –0,39, при p < 0,05); у больных ХГС – численности кишечной палочки с низким содержанием альбуминов (τ = –0,47, при p < 0,05).
У больных обследуемых групп появились корреляционные взаимосвязи микроорганизмов с показателями обмена билирубина: при ХГВ – количества энтерококков с содержанием общего билирубина (τ = 0,34, при p = 0,04); при ХГС – численности клостридий с содержанием прямого билирубина (τ = 0,70, при p < 0,001).
У больных ХГВ отсутствовали корреляции облигатных представителей микрофлоры с активностью ферментов. При ХГС имела место иная картина: содержание кишечной палочки обнаружило сильную отрицательную связь с активностью АЛТ (τ = –0,81, p < 0,001), что свидетельствует о включении данных микроорганизмов, наряду с печенью, в процессы детоксикации.
Следовательно, при действии вирусов гепатитов В и С наблюдается изменение взаимодействия детоксицирующей и метаболической функций печени и микрофлоры толстой кишки.
После проведения курса терапии наблюдалось статистически значимое изменение ферментативной активности сыворотки крови у больных, получавших пробиотики. Так, активность АСТ снизилась в 1,2 раза (р = 0,03) у пациентов ХГВ I-б подгруппы, в 2,3 раза (р < 0,001) – у больных ХГС II-б подгруппы по сравнению с 1-ми сут., тогда как в I-а, II-а подгруппах снижение активности фермента было меньшим. Статистически значимое снижение АЛТ в 1,5 раза (р < 0,05) имело место только у больных ХГС во II-б подгруппе. Нами отмечено более выраженное уменьшение активности ГГТ у больных после лечения с применением пробиотиков. При ХГВ снижение ГГТ отмечалось в I-б подгруппе в 1,8 раза (р = 0,04), тогда как у больных I-а подгруппы – в 1,3 раза (р = 0,03); при ХГС во II-б подгруппе данный показатель снизился в 1,7 раза (р < 0,01).
Было установлено уменьшение проявлений синдрома холестаза. Так, у пациентов ХГВ в I-б подгруппе содержание общего билирубина снизилось в 1,7 раза (р < 0,001) по сравнению с 1-ми сут., в то время как в I-а – только в 1,3 раза (р = 0,02). Снижение содержания прямого билирубина было более интенсивным в I-б подгруппе в 2,4 раза (р = 0,001) и большим по сравнению с I-а подгруппой в 1,8 раза (р = 0,001). У пациентов ХГС во II-б подгруппе содержание общего билирубина снизилось в 2 раза (р < 0,001), прямого билирубина – в 2,5 раза (р < 0,01). У больных ХГС II-б подгруппы также имело место увеличение содержания альбуминов (р < 0,05) сыворотки крови.
У пациентов, получавших лечение с применением препаратов с пробиотическим действием, отмечалось значительное увеличение содержания облигатных микроорганизмов толстой кишки.
Так, содержание бифидобактерий увеличилось на 22,5 % (р = 0,01) при ХГВ в I-б подгруппе, при ХГС во II-б подгруппе еще более значимо – на 24,7 % (р = 0,003) по сравнению с 1-ми сут. Численность лактобактерий возросла у больных ХГВ в I-б подгруппе на 27,9 % (р = 0,03).
Включение пробиотиков в комплекс лечения больных ХГВ и ХГС способствовало снижению частоты встречаемости грибов рода Кандида в 4,5 раза (р = 0,03) при ХГВ в I–б подгруппе и в 4,1 раза (p = 0,04) при ХГС во II-б подгруппе. Отмечено уменьшение частоты встречаемости клостридий в 1,3 раза (p = 0,02) и в 1,2 раза (p = 0,03) соответственно. При традиционной терапии значимого повышения содержания облигатных представителей микрофлоры и снижения условно-патогенных микроорганизмов (УПМ) выявлено не было.
После проведения общепринятой терапии изменилась структура корреляционных связей по сравнению с исходным состоянием (рис. 3). Установлено усиление корреляционных связей между активностью ферментов у больных ХГВ: в I-а подгруппе активности АСТ – с ЛДГ (τ = 0,75; при p < 0,001), ГГТ – с АСТ (τ = 0,61; при p = 0,004). При этом не наблюдалось взаимосвязей между микроорганизмами, как и в 1-е сут., однако численность энтерококков обнаружила корреляции с альбуминами (τ = –0,62, при p = 0,004); бифидобактерий – с содержанием ОХ (τ = –0,58, при p = 0,05).
У пациентов ХГС II-а подгруппы исчезли корреляции микроорганизмов с параметрами белкового обмена, но появились взаимосвязи энтерококков с АСТ (τ = 0,81, при p < 0,001) и ГГТ (τ = 0,93, при p < 0,001).
Наличие корреляционных связей облигатных микроорганизмов с показателями липидного и белкового обмена у больных ХГВ с ферментами у больных ХГС может указывать на включение представителей микрофлоры в процессы метаболизма и детоксикации, однако изменение их полярности по сравнению с 1-ми сут. свидетельствует о недостаточной их функции.
Отсутствие статистически значимого снижения активности ферментов и повышения содержания облигатных представителей микрофлоры толстой кишки свидетельствует о том, что стандартная терапия не в полной мере способствует активации нарушенных функций.
После пробиотической коррекции (рис. 4) имели место корреляционные взаимосвязи облигатных представителей микрофлоры с активностью ферментов: численности кишечной палочки – с активностью АСТ (τ = –0,52, при p = 0,008), энтерококков – с ЩФ (τ = –0,69, при p < 0,002) у больных ХГВ I-б подгруппы; бактероидов – с активностью АСТ (τ = –0,57, при p = 0,008) у больных ХГС II-б подгруппы. Выявлены корреляции облигатных микроорганизмов
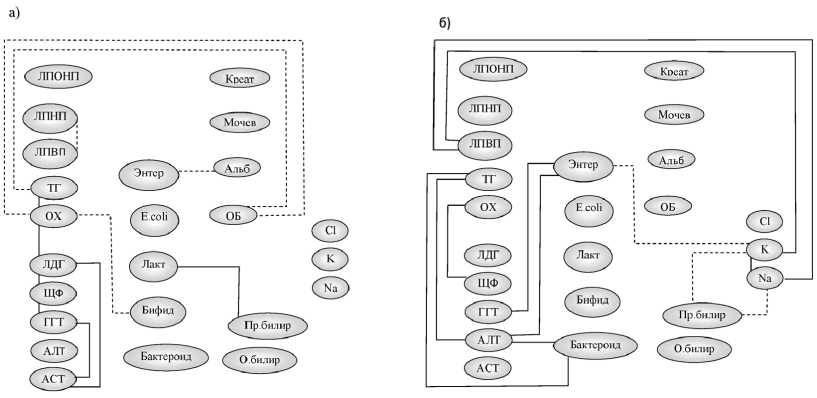
Рис. 3. Корреляционные взаимосвязи биохимических и микробиологических показателей у больных хроническими гепатитами B и С после традиционного лечения: а) I-а подгруппа; б) II-a подгруппа. Сплошная линия – прямая корреляционная взаимосвязь, пунктирная линия – обратная корреляционная взаимосвязь
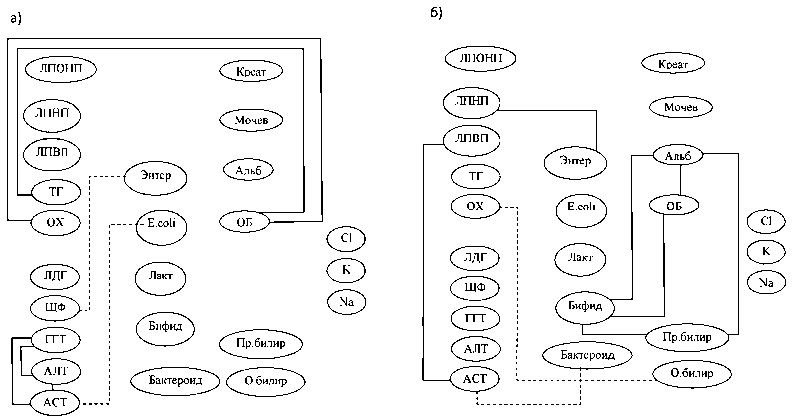
Рис. 4. Корреляционные взаимосвязи биохимических и микробиологических показателей у больных хроническими гепатитами В и C после лечения с пробиотиками: а) I-б подгруппа; б) II-б подгруппа. Сплошная линия – прямая корреляционная взаимосвязь, пунктирная линия – обратная корреляционная взаимосвязь
с показателями белкового (бифидобактерии – альбумины, τ = 0,84, при p = 0,05), пигментного (бифидобактерии – прямой билирубин, τ = 0,71, при p = 0,002), липидного видов обмена (энтерококки – ЛПНП, τ = 0,79, при p = 0,001) у пациентов ХГС II-б подгруппы. Наблюдалось сопряжение функций печени и микробиоценоза толстой кишки, что подтверждалось приближением характера взаимосвязей микроорганизмов с активностью ферментов, параметрами метаболических процессов к тому, что имело место в контроле.
Вышеуказанные изменения позволяют считать, что напряжение метаболической и детоксикационной функций печени после проведения биокоррекции уменьшилось в значительно большей степени, чем при традиционной терапии. Следовательно, механизм действия микроорганизмов, входящих в состав пробиотиков, заключается в повышении колонизационной резистен- тности за счет стимуляции роста собственных бифидо- и лактобактерий (статистически значимое увеличение содержания бифидобактерий у больных ХГВ и ХГС; лактобактерий у больных ХГВ), снижения содержания УПМ (частоты встречаемости грибов рода Кандида и клостридий).
Имеются указания на то, что увеличение численности облигатных микроорганизмов и уменьшение УПМ сопровождается усилением иммуномодулирующей и метаболической роли микрофлоры, уменьшением цитокин-опосредо-ванного и токсического влияния на печень [1]. Активация функций микроорганизмов толстой кишки способствует минимизации нарушенных функций печени [11].
В нашем исследовании оптимизация функций печени связана с уменьшением эндотоксемии на фоне снижения содержания УПМ, участием микрофлоры в иммунных, обменных процессах, что доказывается снижением активности ферментов (АСТ, ГГТ), маркеров холестаза (общего и прямого билирубина) у больных ХГВ и ХГС, повышением содержания альбуминов у больных ХГС.
ЗАКЛЮЧЕНИЕ
Таким образом, в механизмах нарушения гомеостаза при ХГВ и ХГС играют роль изменения функций печени и микробиоценоза толстой кишки, выражающиеся в увеличении энзиматической активности, повышении содержания общего и прямого билирубина, низком содержании альбуминов при ХГС, которые сопровождаются дисбиотичес-кими сдвигами микробного гомеостаза (низким содержанием бифидо- и лактобактерий, высокой частотой встречаемости грибов рода Кандида, клостридий), ослаблением корреляционных связей между активностью ферментов у пациентов обеих групп, отсутствием их между микроорганизмами у больных ХГВ; появлением новых корреляционных зависимостей между двумя системами: содержания микроорганизмов – с показателями белкового обмена, но отсутствия их с ферментами.
На фоне назначения пробиотиков отмечается оптимизация микробиоценоза толстой кишки (повышение численности бифидобактерий, лактобактерий, снижение содержания грибов рода Кандида, клостридий). Включение микроорганизмов в процессы детоксикации и метаболизма способствует минимизации нарушенных функций печени (снижение активности АСТ и ГГТ при ХГВ и ХГС, АЛТ – у больных ХГС, снижение уровня общего и прямого билирубина при ХГВ и ХГС, повышение содержания альбуминов у больных ХГС), что подтверждается восстановлением корреляционных взаимосвязей представителей микрофлоры толстой кишки с активностью ферментов и показателями обменных процессов.
Solov’eva N. V., Northern State Medical University (Arkhangelsk, Russian Federation)
MECHANISMS OF LIVER FUNCTIONS AND LARGE INTESTINE MICROBIOCENOSIS DISORDERS IN CHRONIC B AND C VIRAL HEPATITIS AND THEIR PROBIOTIC CORRECTION


